肺移植術后皮疽諾卡菌感染1例
江文洋 王博 汪巍 朱鐵源 康敢軍 耿慶 林慧慶
諾卡菌是常見于土壤、植被、水源等環境中的病原體,可通過傷口、呼吸道等途徑傳播,最常感染肺部。肺移植術后皮疽諾卡菌感染罕見,國內尚無報道。我們報道1例肺移植患者術后皮疽諾卡菌感染從出現到診治轉歸的全過程。
臨床資料
患者男性,57歲,因“活動后呼吸困難9年,進行性加重9個月”入院,既往從事煤炭工人工作,有吸煙、飲酒史,高血壓病史。初步診斷:塵肺,高血壓。2017年9月29日在全麻下行右單肺移植術(圖1),2周后康復出院,接受三聯抗排斥治療:他克莫司、嗎替麥考酚酯、強的松。2017年11月23日因“活動后胸悶、喘氣10天”入院,無發熱、咳嗽等不適。查血:WBC 6.78×109/L,N 60.8%,ALT 108U/L,AST 53U/L,Urea 11.11 mmol/L,Cr 89μmol/L。抗排斥藥物濃度:FK506 10.2 ng/mL,MPA AUC 32.08 mg·h/L。不吸氧時動脈血氣:pH 7.45,SaO289%,PaO254 mmHg,PaCO239 mmHg。肺功能:FEV1絕對值1.12 L,相對值42%。纖維支氣管鏡:左側各葉段支氣管扭曲變形,較多膿性分泌物,予以吸引送痰培養;右側支氣管吻合口肉芽形成并狹窄。痰培養:未見特異性致病菌。胸部CT可見右側移植肺上葉外帶近胸膜下斑片狀感染灶。使用頭孢哌酮鈉舒巴坦鈉3.0g,每8 h 1次靜脈注射,以及吸氧、化痰、霧化吸入、解痙等對癥支持治療,7天后胸悶、喘氣癥狀緩解,右肺感染灶消失(圖2)。同時,胸部CT可見左下肺基底段高密度小結節形成,直徑約0.4 cm(圖3A)。加用鹽酸莫西沙星0.4 g,每日1次靜脈注射,治療7天,胸部CT可見左下肺結節增大,直徑約1.3 cm(圖3B)。患者為免疫抑制狀態、常規抗菌治療效果不佳,考慮真菌感染不除外,停用嗎替麥考酚酯、調整他克莫司用量,使FK506濃度降低為8.0 ng/mL以恢復部分免疫功能,并加用伏立康唑200 mg,每日2次口服,治療8天,胸部CT可見左下肺病變進行性增大,直徑約3.4 cm(圖3C)。于CT引導下行經皮肺穿刺送檢,細胞學涂片可見大量中性粒細胞,少許纖毛柱狀上皮細胞,巨噬細胞,組織細胞;組織病理學HE染色可見肺泡間隔增寬,間質纖維結締組織增生伴大量中性粒細胞浸潤,部分區域組織壞死伴上皮樣細胞聚集,考慮為炎癥性病變;IHC染色:CD68(散在+),CD163(散在+),PKC(上皮+),Ki-67(散在+),特殊染色PAS(-);組織病原菌培養:皮疽諾卡菌。診斷明確為皮疽諾卡菌感染,更改抗菌藥物為甲氧芐啶-磺胺異甲噁唑(TriMethoPrim/SulfaMethoXazole,TMP/SMX)960mg,每日2次口服,聯合利奈唑胺600mg,每12 h 1次靜脈注射,治療16天后胸部CT可見左下肺病變有所吸收(圖3D)。繼續該方案治療8天后,胸部CT可見左下肺病變明顯吸收(圖3E)。予辦理出院并更改利奈唑胺為口服,出院后因患者不能耐受口服利奈唑胺,故采用單藥TMP/SMX口服繼續治療總共3個月,胸部CT可見左下肺病變幾乎完全吸收(圖3F),停用TMP/SMX。2021年6月29日隨訪,未見病變復發。
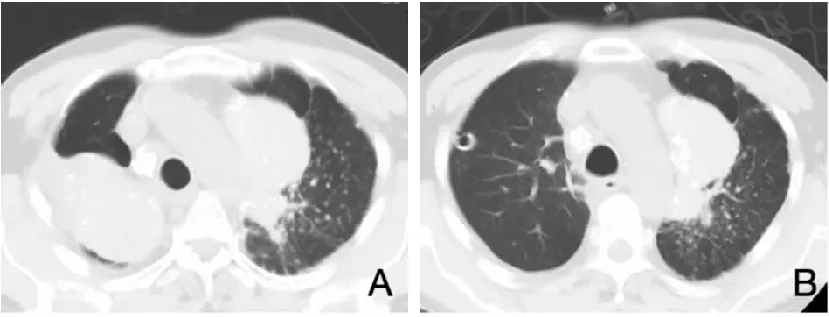
圖1 A:2017年9月28日術前胸部CT,可見雙肺高密度腫塊形成,伴散在小結節;B:2017年10月3日術后胸部CT,可見右側移植肺紋理清晰,無感染表現,壁層胸膜下可見引流管影
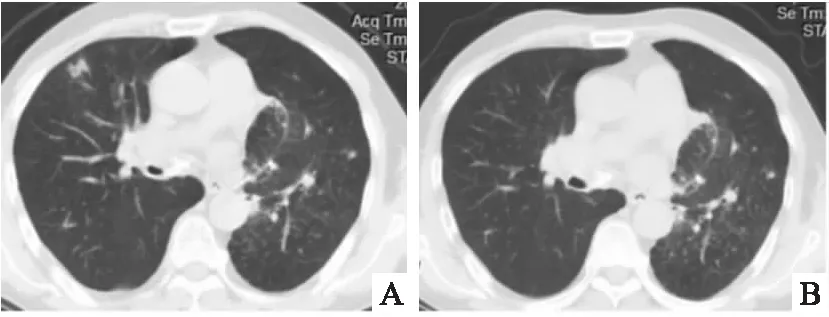
圖2 A:2017年11月23日胸部CT可見右側移植肺上葉外帶近胸膜下斑片狀感染灶;B:2017年11月30日胸部CT可見該感染灶經過治療后消失

圖3 胸部CT可見皮疽諾卡菌感染從出現到轉歸的全過程,病灶從小結節逐漸增大形成腫塊,治療后逐步縮小,最終病灶吸收。A:2017年11月30日;B:2017年12月7日;C:2017年12月15日;D:2018年1月4日;E:2018年1月12日;F:2018年3月19日
討 論
諾卡菌是一種需氧革蘭氏陽性、過氧化氫酶陽性、部分抗酸的絲狀分支細菌,隸屬于放線菌目。1888年,獸醫Edmond Nocard首次在牛瘟病例中描述,并以其名字進行命名,定義為諾卡菌屬。目前,已鑒定出皮疽諾卡、膿腫諾卡、巴西諾卡、泰國諾卡等種。環境中諾卡菌無處不在,主要感染肺,還可引起皮膚和軟組織感染、腦膿腫、血流感染或其他器官感染,通常發生在免疫功能低下的患者,如接受了實體器官移植的受者,或因其他原因接受免疫抑制藥物治療的患者[1]。本例患者肺部皮疽諾卡菌感染最初的CT表現,出現在住院治療期間,考慮院內感染可能性大,由于同期未發現類似感染者,無法判斷是來自醫院環境,還是其他患者或醫務人員的人傳人感染。
已有文獻[2-6]報道,肺移植受者諾卡菌感染的發生率約為0.98%~3.4%,比其他實體器官移植更高,其中皮疽諾卡菌最常見,占25%~41.18%。中位發病時間在肺移植術后9.4~14.3個月,也有術后34.1個月的較長中位時間的報道。諾卡菌肺部感染的癥狀是非特異性的,如咳嗽、呼吸困難、疲勞等,咯血罕見,胸部CT可見肺部局灶性實變、結節、腫塊或空洞,無明顯的區域或解剖分布,也可出現播散表現[1-3]。Husain等[4]認為諾卡菌似乎傾向于發生在單肺移植患者的原生肺,約占75%。由于癥狀和影像學表現的非特異性,且常規染色劑通常無法明確感染種類,確診需要依靠微生物培養[7]。本例感染發生在術后2個月,明顯短于文獻報道,可能由于患者術后短期內因病返院治療期間出現了機會性感染,因此比自然發病時間更短。本例感染患者無癥狀,為胸部CT評估治療療效時偶然發現原生肺局灶性、實性病灶,細胞學、組織病理學均考慮感染性病灶,但無法確診致病菌,最終通過組織病原菌培養確診,治療期間未發生播散。
按照加拿大多倫多肺移植小組發布的肺移植患者管理策略,肺移植術后常規使用TMP/SMX 480mg,每周一、三、五口服,可以有效預防卡氏肺孢子蟲肺炎。同時,TMP/SMX也是治療諾卡菌的有效藥物,文獻[2-3, 8-9]報道,諾卡菌對TMP/SMX、利奈唑胺、阿米卡星的敏感性幾乎100%。然而,術后常規使用TMP/SMX對諾卡菌感染的預防作用尚存爭議。Goodlet等[2]對586例肺移植患者進行分析,發現診斷諾卡菌感染前12周使用TMP/SMX是獨立的保護性因素;但多數研究者認為預防性使用TMP/SMX并不能降低諾卡菌感染的發生率,如Husain等[4]報道的10例感染中,6例已經預防性使用了TMP/SMX,Poonyagariyagorn等[5]報道的11例感染中,7例也預防性使用了TMP/SMX,Khan等[6]報道的4例感染中,全部都使用了TMP/SMX預防。這可能由于TMP/SMX對諾卡菌治療時藥物的劑量和使用頻率較預防時用藥更大、更頻繁,導致TMP/SMX治療時敏感,而預防時可能并無效果。目前,我院肺移植中心所在區域卡氏肺孢子蟲不是常見的感染病原,結合實際情況,我中心術后并未常規使用TMP/SMX,隨訪中也未發現肺卡氏肺孢子蟲感染病例[10]。本例患者最初采用經驗性抗感染治療,效果不佳,病變進展,在確診后,采取TMP/SMX口服聯合利奈唑胺靜脈注射治療,出院后單藥TMP/SMX口服共3個月,取得了良好的效果,病灶吸收,近期隨訪未見復發。諾卡菌病死率約為18%~30%,其中皮疽諾卡菌病死率更高[2, 4-5],因此,及時進行病原菌培養確診,并使用TMP/SMX、利奈唑胺等敏感藥物,有望改善肺移植術后皮疽諾卡菌感染患者的預后。

