熱處理及轉(zhuǎn)谷氨酰胺酶對(duì)糖基化燕麥蛋白凝膠性質(zhì)的影響
許英一,馬鑫蕊,王 宇,徐艷霞,林 巍,王 彪,王德香
(1.齊齊哈爾大學(xué)食品與生物工程學(xué)院,黑龍江 齊齊哈爾 161006;2.黑龍江省農(nóng)業(yè)科學(xué)院畜牧獸醫(yī)分院,黑龍江 齊齊哈爾 161005)
在谷物類食品中,燕麥蛋白質(zhì)含量居首位(11.19%~19.85%)。其蛋白組成中氨基酸均衡且配比合理,其中球蛋白占總蛋白質(zhì)含量的70%~80%,主要由12S、7S和3S蛋白組成,因燕麥蛋白溶解性等功能性質(zhì)較差,限制了其在食品加工領(lǐng)域中的應(yīng)用。對(duì)蛋白進(jìn)行糖基化、膠凝化等改性處理,將改性蛋白作為添加劑應(yīng)用于食品配方中是一種極具潛力的方法。通過糖基化改性,產(chǎn)物的溶解性、乳化性、凝膠性以及抗氧化活性等功能性質(zhì)均有不同程度的提高。凝膠性質(zhì)是蛋白質(zhì)作為食品添加劑十分重要的功能特性,蛋白質(zhì)凝膠具有黏彈性,可包裹水、脂質(zhì)、風(fēng)味物質(zhì)等食品成分,為新型食品的研發(fā)提供了很好的物質(zhì)基礎(chǔ)。國(guó)內(nèi)外對(duì)植物蛋白凝膠機(jī)理的研究主要集中在大豆蛋白上,其他植物蛋白的研究相對(duì)較少。劉建壘研究發(fā)現(xiàn)燕麥蛋白在溫度低于90 ℃時(shí)不能形成凝膠,隨著溫度升高,其破裂力、硬度減小,而黏附性增大。李琳琳以燕麥球蛋白為原料,制備燕麥球蛋白酸性、堿性和中性凝膠,由凝膠的水分弛豫和流變學(xué)特性可知,加熱溫度和球蛋白濃度越高,pH值越小,加熱時(shí)間越長(zhǎng)越有利于燕麥球蛋白凝膠的形成,其凝膠彈性及凝膠網(wǎng)絡(luò)穩(wěn)定性越好。轉(zhuǎn)谷氨酰胺酶(transglutaminase,TG)在參與催化蛋白交聯(lián)反應(yīng)時(shí),將酶肽鏈上谷氨酰殘基的γ-酰基,與賴氨酸上的ε-氨基、伯氨基和水發(fā)生交聯(lián),從而提高蛋白制品破斷力、硬度、持水力等。尚未有采用糖基化分別結(jié)合加熱與TG兩種處理方法進(jìn)行復(fù)合改性燕麥蛋白的凝膠性質(zhì)的報(bào)道。為了將改性蛋白作為添加劑更好地應(yīng)用于食品工業(yè)中,本研究對(duì)燕麥蛋白及其糖基化產(chǎn)物分別進(jìn)行熱處理和TG改性,測(cè)定改性蛋白凝膠的結(jié)構(gòu)和凝膠性質(zhì),探究糖基化改性結(jié)合熱處理或TG改性對(duì)燕麥蛋白凝膠性質(zhì)的影響。以期為燕麥蛋白的開發(fā)及應(yīng)用提供一定理論依據(jù)。
1 材料與方法
1.1 材料與試劑
燕麥 黑龍江省農(nóng)業(yè)科學(xué)院畜牧獸醫(yī)分院實(shí)驗(yàn)基地;透析膜(再生纖維素膜,截留分子質(zhì)量1 kDa)生工生物工程(上海)股份有限公司;乳糖 天津市凱通化學(xué)試劑有限公司;TG(酶比活力100 U/g) 江蘇一鳴有限公司;鄰苯二甲醛 上海阿拉丁生化科技股份有限公司;8-苯胺-1-萘磺酸(8-amino-1-naphthalene sulfonoc acid,ANS) 上海麥克林生化有限公司;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)標(biāo)準(zhǔn)蛋白、辣根過氧化物酶 生工生物工程(上海)股份有限公司;其他試劑均為國(guó)產(chǎn)分析純。
1.2 儀器與設(shè)備
BSA124S型電子天平 賽多利斯科學(xué)儀器(北京)有限公司;WK-600A型粉碎機(jī) 上海新諾儀器設(shè)備有限公司;SHA-C型恒溫水浴振蕩器 金壇市天竟實(shí)驗(yàn)儀器廠;PC/PLCLD-53型真空冷凍干燥機(jī) 美國(guó)Millrock公司;TDL-5A型臺(tái)式離心機(jī) 上海安亭科學(xué)儀器廠;DF-11型集熱式磁力加熱攪拌器 山東東易日盛儀器有限公司;PB-10型pH計(jì) 北京賽多利斯儀器有限公司;TMS-PRO質(zhì)構(gòu)儀 北京盈盛恒泰科技有限責(zé)任公司;Spectrum One型傅里葉變換紅外(Fourier transform infrared,F(xiàn)TIR)光譜儀 美國(guó)Perkin Elmer公司;TU-1901型紫外-可見分光光度計(jì) 北京普析通用儀器有限責(zé)任公司;EnSpire多功能酶標(biāo)儀 珀金埃爾默企業(yè)管理(上海)有限公司;DYCZ-24DN迷你雙垂直電泳儀北京市六一儀器廠;S-3400N掃描電子顯微鏡(scanning electron microscope,SEM) 日本日立公司。
1.3 方法
1.3.1 燕麥蛋白及乳糖糖基化產(chǎn)物的制備
1.3.1.1 燕麥蛋白的制備
參考張蓓的方法略作修改。燕麥籽粒磨粉過篩,正己烷脫脂。將脫脂后的燕麥粉以料水比1∶8(g/mL)配制溶液,用1 mol/L NaOH溶液調(diào)pH值為10,在50 ℃水浴振蕩2 h,10 000 r/min離心10 min。將上清液用1 mol/L HCl溶液調(diào)pH值至4.2,靜置30 min,10 000 r/min離心10 min得沉淀。水洗沉淀2 次,調(diào)pH值至7.0,冷凍干燥,得到燕麥蛋白,其蛋白質(zhì)質(zhì)量分?jǐn)?shù)為78.81%。
1.3.1.2 乳糖糖基化燕麥蛋白(lactose glycosylated oat protein,LGOP)的制備
參考Zhu Dan等的方法略作修改,根據(jù)本課題組前期實(shí)驗(yàn)得到LGOP制備的最優(yōu)工藝為:準(zhǔn)確稱取燕麥蛋白20 g,將其分散于1 000 mL 0.2 mol/L磷酸鹽緩沖溶液(pH 9)中,于35 ℃磁力攪拌1 h使蛋白完全分散。按照乳糖∶蛋白=2∶1(m/m)加入乳糖,于35 ℃磁力攪拌3 h。置于95 ℃的水浴中加熱反應(yīng)80 min,冰浴冷卻至室溫。4 ℃透析24 h除去未反應(yīng)的乳糖,冷凍干燥后得到LGOP。
1.3.2 燕麥蛋白及LGOP熱誘導(dǎo)凝膠的制備
取25 mL一定質(zhì)量分?jǐn)?shù)的燕麥蛋白及LGOP溶液置于50 mL小燒杯內(nèi),調(diào)節(jié)至一定pH值。磁力攪拌1 h,在某一溫度下水浴加熱一定時(shí)間后,冰浴急速冷卻至室溫。取出置于4 ℃冰箱中下靜置過夜(12 h),分別得到燕麥蛋白熱誘導(dǎo)凝膠(heat induced gel of oat protein,HIGOP)和LGOP熱誘導(dǎo)凝膠(heat induced gel of LGOP,HIGLGOP),測(cè)定其凝膠強(qiáng)度。
1.3.3 HIGOP制備的最優(yōu)工藝
根據(jù)本課題組前期實(shí)驗(yàn),得到HIGOP制備的最優(yōu)工藝:蛋白質(zhì)量分?jǐn)?shù)8%;pH 10;反應(yīng)溫度100 ℃;反應(yīng)時(shí)間2.5 h。
1.3.4 HIGLGOP制備的正交試驗(yàn)優(yōu)化
在單因素試驗(yàn)的基礎(chǔ)上,選取蛋白質(zhì)量分?jǐn)?shù)、pH值、反應(yīng)時(shí)間、反應(yīng)溫度為考察因素,以凝膠強(qiáng)度為評(píng)價(jià)指標(biāo),采用4因素3水平的正交試驗(yàn)優(yōu)化HIGLGOP制備工藝條件。
1.3.5 燕麥蛋白及LGOP TG誘導(dǎo)凝膠的制備
取25 mL一定質(zhì)量分?jǐn)?shù)的燕麥蛋白及LGOP溶液置于50 mL小燒杯內(nèi),磁力攪拌1 h使蛋白質(zhì)充分溶解,調(diào)節(jié)至一定pH值。加入一定量TG,在某一溫度水浴振蕩一定時(shí)間后,90 ℃下使酶滅活10 min,冰浴急速冷卻至室溫。取出置于4 ℃冰箱中靜置過夜(12 h),分別得到燕麥蛋白酶誘導(dǎo)凝膠(oat protease induced gel,OPIG)和LGOP酶誘導(dǎo)凝膠(lactose glycosylated oat protease induced gel,LGOPIG),測(cè)定其凝膠強(qiáng)度。
1.3.6 OPIG制備的最優(yōu)工藝
根據(jù)本課題組前期實(shí)驗(yàn),得到OPIG制備的最優(yōu)工藝:蛋白質(zhì)量分?jǐn)?shù)10%;酶添加量50 U/g;pH 7;反應(yīng)溫度55 ℃;反應(yīng)時(shí)間3 h。
1.3.7 LGOPIG制備的正交試驗(yàn)優(yōu)化
在單因素試驗(yàn)的基礎(chǔ)上,選取蛋白質(zhì)量分?jǐn)?shù)、酶添加量、pH值、反應(yīng)時(shí)間、反應(yīng)溫度為考察因素,以凝膠強(qiáng)度為評(píng)價(jià)指標(biāo),采用5因素4水平的正交試驗(yàn)優(yōu)化LGOPIG制備的工藝條件。
1.3.8 質(zhì)構(gòu)性質(zhì)測(cè)定
參考Zhang Qi等方法并進(jìn)行改動(dòng)。將4 種燕麥蛋白凝膠樣品分別切割成圓柱形(35 mm×30 mm)放置于25 ℃平衡30 min。采用質(zhì)構(gòu)儀對(duì)樣品進(jìn)行質(zhì)地剖面分析,測(cè)定其彈性、硬度和膠黏性。蛋白凝膠強(qiáng)度定義為穿透凝膠所需的最大破斷力(g)。參數(shù)設(shè)置:測(cè)前速率5.0 mm/s;測(cè)試速率5.0 mm/s;測(cè)試后速率5.0 mm/s;觸發(fā)力0.2 N;穿透距離10 mm;壓縮比50%。
1.3.9 持水性測(cè)定
采用離心法,分別取2.0 g 4 種燕麥蛋白凝膠樣品置于離心管中,于4 ℃、10 000×g離心15 min。記錄離心前離心管總質(zhì)量(m)、離心后離心管總質(zhì)量(m)及空離心管質(zhì)量(m),計(jì)算凝膠持水性:

1.3.10 表面疏水性(H)測(cè)定
采用ANS熒光探針法并進(jìn)行改動(dòng)。用磷酸鹽緩沖液(0.01 mol/L、pH 7)分別將4 種燕麥蛋白凝膠樣品配制質(zhì)量濃度為0.012 5、0.025、0.05、0.1、0.2、0.4 mg/mL的燕麥蛋白凝膠,加入20 μL 8 mmol/L ANS熒光探針,漩渦混合。室溫下避光反應(yīng)15 min,在激發(fā)波長(zhǎng)390 nm,發(fā)射波長(zhǎng)470 nm,狹縫5 nm的條件下測(cè)定蛋白與ANS結(jié)合物的相對(duì)熒光強(qiáng)度,以燕麥蛋白凝膠濃度為橫坐標(biāo),相對(duì)熒光強(qiáng)度為縱坐標(biāo)作圖,線性回歸曲線的初始斜率即為H0。
1.3.11 SDS-PAGE測(cè)定
根據(jù)馮芳等的方法,略有改動(dòng)。采用15%分離膠、5%濃縮膠進(jìn)行垂直夾板電泳。用碳酸鹽緩沖溶液(0.02 mol/L、pH 7)配制燕麥蛋白凝膠的質(zhì)量濃度為2 mg/mL,上樣量10 μL。樣品在分離膠時(shí)恒壓80 V,樣品在濃縮膠時(shí)恒壓120 V,當(dāng)指示劑前沿距電泳槽膠底0.5 cm時(shí),關(guān)閉電源停止電泳。取下凝膠后分別用考馬斯亮藍(lán)R-250和Schiff試劑進(jìn)行蛋白質(zhì)和糖蛋白染色。
1.3.12 熒光光譜測(cè)定
用0.01 mol/L pH 7.6磷酸鹽緩沖溶液配制質(zhì)量濃度為0.4 mg/mL的燕麥蛋白凝膠樣品,采用多功能酶標(biāo)儀進(jìn)行內(nèi)源熒光光譜分析。為降低酪氨酸殘基干擾,激發(fā)波長(zhǎng)290 nm,掃描發(fā)射光譜范圍為300~400 nm,激發(fā)和發(fā)射狹縫寬度均為5 nm。
1.3.13 FTIR測(cè)定
分別稱取2 mg的燕麥蛋白凝膠樣品,加入0.2 g溴化鉀,研磨均勻,壓成均一透明的薄片。用FTIR儀測(cè)定波數(shù)為4 000~400 cm的紅外光譜,分辨率4 cm,波數(shù)精度0.01 cm,掃描次數(shù)32 次,環(huán)境溫度25 ℃。
1.3.14 微觀結(jié)構(gòu)的測(cè)定
分別將4 種燕麥蛋白凝膠切成方形并冷凍干燥。參考賈子璇等的方法,樣品經(jīng)噴金處理后,用SEM測(cè)定其微觀結(jié)構(gòu),電壓10 kV,4 種燕麥蛋白凝膠的放大倍數(shù)分別為HIGOP 10 000 倍、HIGLGOP 10 000 倍、OPIG 200 倍、LGOPIG 10 000 倍。
1.4 數(shù)據(jù)處理
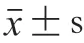
2 結(jié)果與分析
2.1 HIGLGOP的工藝優(yōu)化分析
由表1可知,各因素對(duì)HIGLGOP凝膠強(qiáng)度的影響大小為:蛋白質(zhì)量分?jǐn)?shù)>pH值>反應(yīng)時(shí)間>反應(yīng)溫度。由表2可知,蛋白質(zhì)量分?jǐn)?shù)和pH值對(duì)HIGLGOP凝膠強(qiáng)度的影響顯著(P<0.05),而反應(yīng)時(shí)間和反應(yīng)溫度對(duì)凝膠強(qiáng)度無顯著影響。結(jié)合表1和表3得到最優(yōu)組合為ABCD,即蛋白質(zhì)量分?jǐn)?shù)8%、pH 10、反應(yīng)時(shí)間2 h、反應(yīng)溫度95 ℃,通過最優(yōu)組合進(jìn)行實(shí)驗(yàn),得到HIGLGOP凝膠強(qiáng)度為(186.13±1.97)g,高于表1中9 個(gè)正交試驗(yàn)的結(jié)果。后續(xù)實(shí)驗(yàn)在此最優(yōu)條件組合下進(jìn)行。

表1 HIGLGOP制備條件的正交試驗(yàn)設(shè)計(jì)及結(jié)果Table 1 Orthogonal array design and results for optimization of preparation conditions of HIGLGOP

表2 HIGLGOP制備條件的方差分析結(jié)果Table 2 Analysis of variance for the effect of four variables on gel strength of HIGLGOP

表3 HIGLGOP制備條件的4因素多重比較結(jié)果Table 3 Multiple comparison of four variables
2.2 LGOPIG的工藝優(yōu)化分析
由表4可知,各因素對(duì)凝膠強(qiáng)度的影響大小為:酶添加量>蛋白質(zhì)量分?jǐn)?shù)>pH值>反應(yīng)時(shí)間>反應(yīng)溫度。由表5可知,酶添加量對(duì)凝膠強(qiáng)度的影響顯著(P<0.05),而蛋白質(zhì)量分?jǐn)?shù)、pH值、反應(yīng)時(shí)間和反應(yīng)溫度對(duì)其無顯著影響;結(jié)合表4和表6得到最優(yōu)組合為ABCDE,即蛋白質(zhì)量分?jǐn)?shù)8%、酶添加量40 U/g、pH 6.5、反應(yīng)時(shí)間2.0 h、反應(yīng)溫度55 ℃,通過最優(yōu)組合進(jìn)行實(shí)驗(yàn),得到凝膠強(qiáng)度為(159.64±1.83) g,高于表4中16 個(gè)正交試驗(yàn)的結(jié)果。后續(xù)實(shí)驗(yàn)在最優(yōu)組合下進(jìn)行。

表4 LGOPIG制備條件的正交試驗(yàn)設(shè)計(jì)及結(jié)果Table 4 Orthogonal design and results for the optimization of preparation conditions of LGOPIG

表5 LGOPIG制備條件的方差分析結(jié)果Table 5 Analysis of variance results for the effect of five variables on gel strength of LGOPIG
2.3 燕麥蛋白凝膠質(zhì)構(gòu)性質(zhì)分析
由圖1可以看出,與HIGOP相比,其他3 種燕麥蛋白凝膠的彈性和硬度均顯著提高(P<0.05);4 種燕麥蛋白凝膠中,LGOPIG的質(zhì)構(gòu)性質(zhì)最好。與HIGOP相比,LGOPIG的彈性、硬度和膠黏性分別提高了7.27%、9.49%和13.01%。LGOPIG的彈性和膠黏性顯著高于HIGLGOP(P<0.05);LGOPIG的質(zhì)構(gòu)特性顯著高于OPIG(P<0.05)。這與杜洪振等的研究結(jié)果一致。添加TG可以提高蛋白凝膠的彈性、硬度和膠黏性,這可能是由于蛋白帶凈電荷,加入TG后與蛋白發(fā)生交聯(lián),降低了蛋白質(zhì)分子之間的靜電斥力。此外,在加熱過程中蛋白質(zhì)內(nèi)部的非極性多肽會(huì)暴露出來,從而增強(qiáng)了臨近多肽非極性片段的疏水相互作用,進(jìn)而形成結(jié)構(gòu)更加致密的凝膠網(wǎng)絡(luò)。糖基化蛋白由于引入許多親水羥基,易形成分子間氫鍵,因此更易形成穩(wěn)定的三維網(wǎng)絡(luò)凝膠,其凝膠的質(zhì)構(gòu)性質(zhì)提高。

表6 LGOPIG制備條件的5因素多重比較結(jié)果Table 6 Multiple comparison of five variables for the preparation of LGOPIG

圖1 4 種燕麥蛋白凝膠的質(zhì)構(gòu)性質(zhì)Fig. 1 Texture properties of four oat protein gels
2.4 燕麥蛋白凝膠持水性分析
由圖2可以看出,4 種燕麥蛋白凝膠中,LGOPIG的持水性最好。與HIGOP相比,其他3 種燕麥蛋白凝膠的持水性都顯著提高(P<0.05),HIGLGOP、OPIG、LGOPIG的持水性分別提高了14.21%、4.86%、22.22%。兩種酶誘導(dǎo)蛋白凝膠(OPIG、LGOPIG)的持水性分別高于兩種熱誘導(dǎo)蛋白凝膠(HIGOP、HIGLGOP);兩種糖基化改性蛋白凝膠(HIGLGOP、LGOPIG)的持水性分別高于兩種未糖基化改性蛋白凝膠(HIGOP、OPIG)。這可能是由于肽鏈中谷氨酰胺殘基的γ-羧酰胺基和賴氨酸殘基的ε-氨基分別作為酰基的供體和受體,使燕麥蛋白形成分子內(nèi)及分子間的ε-(γ-谷氨酰)賴氨酸異肽鍵,使蛋白質(zhì)分子交聯(lián),形成更多水的結(jié)合位點(diǎn),留住更多的水分,從而使得TG改性后燕麥蛋白的持水性顯著提高,這與于殿宇等的研究結(jié)果一致。葛俠研究發(fā)現(xiàn)大豆分離蛋白糖基化后形成的凝膠強(qiáng)度和持水性明顯高于沒有糖基化處理的樣品,這與本研究結(jié)果一致,這是由于親水性糖基的導(dǎo)入能夠提高蛋白質(zhì)的持水能力。

圖2 4 種燕麥蛋白凝膠的持水性Fig. 2 Water-holding capacity of four oat protein gels
2.5 燕麥蛋白凝膠表面疏水性分析
由圖3可以看出,兩種酶誘導(dǎo)蛋白凝膠(OPIG、LGOPIG)的H分別高于兩種熱誘導(dǎo)蛋白凝膠(HIGOP、HIGLGOP);兩種糖基化改性蛋白凝膠(HIGLGOP、LGOPIG)的H分別低于兩種未糖基化改性蛋白凝膠(HIGOP、OPIG)。有可能是H由蛋白質(zhì)的表面殘基暴露的程度所決定。暴露于分子表面的疏水性殘基越多,H越強(qiáng)。燕麥蛋白經(jīng)TG催化后,蛋白結(jié)構(gòu)發(fā)生了改變,多肽鏈展開,疏水區(qū)域從分子內(nèi)部基團(tuán)暴露出來,使H升高,這與臧學(xué)麗等的結(jié)論一致。糖基化改性蛋白凝膠的H低于未糖基化改性蛋白凝膠,表明糖基化會(huì)阻礙熱處理過程中蛋白質(zhì)的變性,從而減少疏水殘基的暴露,這與趙城彬等的研究結(jié)果一致。

圖3 4 種燕麥蛋白凝膠的表面疏水性Fig. 3 Surface hydrophobicity of four oat protein gels
2.6 燕麥蛋白凝膠的SDS-PAGE分析
由圖4可以看出,與熱誘導(dǎo)蛋白凝膠(HIGOP、HIGLGOP)相比,TG交聯(lián)后的蛋白凝膠(OPIG、LGOPIG)在分離膠頂端有大量大分子質(zhì)量的蛋白交聯(lián)產(chǎn)物,且其31.0、21.0 kDa處的顏色相對(duì)熱誘導(dǎo)蛋白凝膠明顯變淺,同時(shí)還有大分子質(zhì)量的蛋白堆積在槽內(nèi)無法向下遷移,不能進(jìn)入凝膠(箭頭處)。結(jié)果表明,TG引起燕麥蛋白發(fā)生分子間或分子內(nèi)交聯(lián)而形成大分子質(zhì)量的交聯(lián)產(chǎn)物,這和Zhao Qiang等的研究結(jié)果一致。因此,TG可促進(jìn)燕麥蛋白發(fā)生分子內(nèi)或者分子間的交聯(lián),形成大分子質(zhì)量的聚合物。全越研究了TG對(duì)燕麥麩皮球蛋白的結(jié)構(gòu)修飾,得出酶促糖基化球蛋白的亞基帶比糖交聯(lián)球蛋白明顯,這直接證實(shí)TG催化氨基糖連接到球蛋白分子中。

圖4 4 種燕麥蛋白凝膠的SDS-PAGE圖Fig. 4 SDS-PAGE patterns of four oat protein gels
2.7 燕麥蛋白凝膠熒光光譜分析
由圖5可知,兩種酶誘導(dǎo)蛋白凝膠(OPIG、LGOPIG)的熒光強(qiáng)度分別高于兩種熱誘導(dǎo)蛋白凝膠(HIGOP、HIGLGOP);兩種糖基化改性蛋白凝膠(HIGLGOP、LGOPIG)的熒光強(qiáng)度分別高于兩種未糖基化改性蛋白凝膠(HIGOP、OPIG)。HIGOP、HIGLGOP、OPIG、LGOPIG的最大熒光發(fā)射波長(zhǎng)分別為358、355、349、353 nm,說明TG交聯(lián)后的蛋白最大熒光發(fā)射波長(zhǎng)減小,發(fā)生了藍(lán)移。酶誘導(dǎo)蛋白凝膠的熒光強(qiáng)度高于熱誘導(dǎo)凝膠,原因?yàn)門G使得燕麥蛋白交聯(lián),引起蛋白結(jié)構(gòu)發(fā)生變化,色氨酸、酪氨酸等發(fā)色氨基酸暴露,引起熒光強(qiáng)度增大。這與丁欣悅的研究結(jié)果一致。糖基化改性蛋白凝膠的熒光強(qiáng)度高于未糖基化改性蛋白凝膠是因?yàn)楹辛u基結(jié)構(gòu)的糖與蛋白進(jìn)行共價(jià)交聯(lián)反應(yīng),使整個(gè)體系的親水性增強(qiáng),改性后的樣品在水相中更容易分散,進(jìn)而提高蛋白的熒光強(qiáng)度。朱小燕采用TG分別對(duì)米渣蛋白和糖基化后的米渣蛋白進(jìn)行交聯(lián),發(fā)現(xiàn)交聯(lián)后的蛋白熒光強(qiáng)度有明顯上升,且最大熒光發(fā)射波長(zhǎng)同樣發(fā)生了藍(lán)移的現(xiàn)象。

圖5 4 種燕麥蛋白凝膠的熒光光譜圖Fig. 5 Fluorescence spectra of four oat protein gels
2.8 燕麥蛋白凝膠的FTIR分析
如圖6所示,與未糖基化改性燕麥蛋白凝膠(HIGOP、OPIG)相比,糖基化蛋白凝膠(HIGLGOP、LGOPIG)在3 200~3 700 cm范圍內(nèi)吸收峰變寬,證明燕麥蛋白與乳糖共價(jià)結(jié)合之后,復(fù)合物的羥基數(shù)量增加,引起C—OH的伸縮振動(dòng)。在酰胺I帶區(qū)域(1 600~1 700 cm)中,吸收導(dǎo)致C=O鍵的拉伸振動(dòng),因此被認(rèn)為是用于研究蛋白質(zhì)結(jié)構(gòu)變化最敏感的區(qū)域。由圖6可知,經(jīng)TG改性處理后的蛋白,其波形均向高波數(shù)偏移約1~2 cm。這說明在TG影響下,蛋白結(jié)構(gòu)不穩(wěn)定,氫鍵作用變?nèi)酰沟肅=O化學(xué)鍵的鍵長(zhǎng)減小,而化學(xué)鍵的伸縮振動(dòng)與鍵長(zhǎng)的平方根呈反比,由于鍵長(zhǎng)減小使伸縮振動(dòng)頻率增加,因此導(dǎo)致波數(shù)增加。Wang Pei等通過FTIR測(cè)定分析得出,酶的添加改變了蛋白質(zhì)之間的相互作用,形成更穩(wěn)固的結(jié)構(gòu)。

圖6 4 種燕麥蛋白凝膠的FTIR光譜圖Fig. 6 FTIR spectra of four oat protein gels
2.9 燕麥蛋白凝膠微觀結(jié)構(gòu)分析

圖7 4 種燕麥蛋白凝膠的SEM圖Fig. 7 SEM images of four oat protein gels
從圖7可以看出,與未糖基化的燕麥蛋白凝膠(圖7A和C)相比,LGOP凝膠(圖7B和D)的表面結(jié)構(gòu)變得更加疏松和多孔。這可能是糖基化反應(yīng)形成了不均勻結(jié)構(gòu),使蛋白結(jié)構(gòu)改變,導(dǎo)致燕麥蛋白凝膠的功能性質(zhì)發(fā)生變化。與未經(jīng)TG交聯(lián)的燕麥蛋白(圖7A和B)相比,經(jīng)TG交聯(lián)的燕麥蛋白凝膠(圖7C和D)中的蛋白大小發(fā)生了很大的變化且凝膠空間中孔徑減少。這說明TG能夠降低蛋白質(zhì)分子間的無序聚集形成更加有序的結(jié)構(gòu)。Han Minyi等研究表明,TG誘導(dǎo)使得豬肉肌原蛋白凝膠中的小塊狀結(jié)構(gòu)減少,大塊狀結(jié)構(gòu)逐漸增多,這與本實(shí)驗(yàn)結(jié)果基本一致。王逢秋節(jié)等研究表明,由于TG的加入,MgCl-TG豆腐的凝膠網(wǎng)狀結(jié)構(gòu)較鹽鹵冷榨豆粉豆腐得到了明顯的改善,包裹更多的冷榨豆粉纖維顆粒,將隨機(jī)聚集的凝膠網(wǎng)絡(luò)轉(zhuǎn)變?yōu)榫哂羞B續(xù)性的蛋白網(wǎng)狀結(jié)構(gòu),使其更為致密。
3 結(jié) 論
采用熱處理及TG處理對(duì)燕麥蛋白及其糖基化產(chǎn)物進(jìn)行膠凝化改性,TG處理的蛋白凝膠的質(zhì)構(gòu)性質(zhì)、持水性、H均高于熱處理蛋白凝膠,糖基化改性燕麥蛋白凝膠的質(zhì)構(gòu)性質(zhì)、持水性均高于未糖基化改性的燕麥蛋白凝膠,而糖基化改性燕麥蛋白凝膠的H低于未糖基化改性的燕麥蛋白凝膠。結(jié)果說明TG與蛋白發(fā)生交聯(lián)降低了蛋白質(zhì)分子之間的靜電斥力,易形成結(jié)構(gòu)致密的凝膠網(wǎng)絡(luò),提高了蛋白凝膠的質(zhì)構(gòu)性、持水性及H;連接了許多親水羥基的糖基化蛋白易形成分子間氫鍵,提高了蛋白凝膠的質(zhì)構(gòu)性、持水性,降低了蛋白凝膠的H。
通過SDS-PAGE、熒光光譜、FTIR光譜和SEM分析,證明TG能夠改變蛋白質(zhì)之間的相互作用,形成更穩(wěn)固的三維網(wǎng)絡(luò)凝膠結(jié)構(gòu),且凝膠微觀結(jié)構(gòu)更加均勻致密。因此,可以認(rèn)為TG預(yù)處理比熱處理能夠有效地改善燕麥蛋白凝膠的性質(zhì)和微觀結(jié)構(gòu),可以為改善燕麥蛋白凝膠的性質(zhì)及其在食品工業(yè)的應(yīng)用提供新思路。
- 食品科學(xué)的其它文章
- 高效液相色譜-三重四極桿串聯(lián)質(zhì)譜法研究塑料接觸材料中酚類化合物向奶油中的遷移
- 基于混合氣凝膠負(fù)載銀納米粒子構(gòu)建電化學(xué)傳感器用于食品過氧化氫的測(cè)定
- 基于1T-WS2@AuNPs復(fù)合材料的白蕓豆酯酶電化學(xué)生物傳感器構(gòu)建及其殺螟硫磷檢測(cè)應(yīng)用
- 基于磁性介孔SiO2免電極修飾電化學(xué)適配體傳感器檢測(cè)啶蟲脒
- 高靈敏度磁熒光免疫層析試紙模式構(gòu)建及在嘔吐毒素檢測(cè)中的應(yīng)用
- 3 種工況下PBAT/PLA材料中抗氧劑168及其降解產(chǎn)物的遷移

