茶多酚處理方式對干貝脂質氧化穩定性和貨架期的影響
樊鳳嬌,謝宏凱,羅謝琪,方 勇
(南京財經大學食品科學與工程學院,江蘇省現代糧食流通與安全協同創新中心,江蘇 南京 210023)
我國扇貝資源十分豐富,年總產量超過170萬 t,是世界第一生產大國。扇貝水分含量高、內源酶活性強、易受微生物作用,極易腐敗變質,而干制可以有效延長扇貝的貨架期,同時賦予其獨特的色澤、質地、口感和風味。因此,干制品是扇貝重要的商品形式。干貝是扇貝閉殼肌的干制加工品,不僅色澤誘人、口感鮮香,而且富含以二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)為代表的n-3多不飽和脂肪酸(n-3 polyunsaturated fatty acids,n-3 PUFAs),是我國傳統“海八珍”之一,深受消費者青睞。然而,n-3 PUFAs在干貝貯藏中極易氧化,導致干貝營養價值和保健功能降低,感官品質劣化,安全風險增加。
為控制水產品在加工及貯藏中的脂質氧化,添加抗氧化劑是目前最直接有效的方法。抗氧化劑能夠準確抵達脂質氧化發生的位點,是其發揮高效抗氧化作用的前提。因此,抗氧化劑在食品基質中的物理空間分布對脂質氧化的影響已成為當前的研究熱點。茶多酚是一類源于茶葉的天然活性物質,具有優異的抗氧化能力,是我國水產品及其制品中準許添加使用的抗氧化劑。在本課題組前期研究中,對比了將茶多酚僅添加至閉殼肌表面與茶多酚同時添加至閉殼肌表面及組織內部對其干制過程中脂質氧化的影響,結果發現茶多酚同時添加至閉殼肌表面及組織內部可以更有效地抑制脂質氧化。然而,上述不同的茶多酚處理方式對干貝貯藏過程中的脂質氧化穩定性和貨架期的影響尚不清楚。
食品的貨架期是指其品質處于消費者可接受程度的貯藏時間段。隨著人們生活水平的提高和食品安全意識的提升,消費者越來越關注食品品質,而貨架期是消費者了解食品品質的重要依據。食品品質的變化通常與微生物作用和化學反應有關,因此在貨架期建模過程中,通常選擇與化學或微生物相關的代表性指標,如色澤、氣味、滋味等消費者可以判斷的感官指標,或是與感官指標同步變化的其他指標,如微生物、VC等,也可以是國家標準中明確規定的理化指標,如揮發性鹽基氮、酸值和過氧化值等。常見的貨架期預測方法有基于化學動力學、微生物生長動力學和溫度的方法,以及BP神經網絡方法和威布爾危險值分析法。對于干貝等低水分食品,微生物作用有限,化學反應是導致其品質劣變的根本原因,其中最主要的化學反應就是脂質氧化。因此,本實驗選用基于化學動力學的方法,分三步完成建模:1)確定加速貯藏溫度梯度,采集貯藏中監測指標變化數據,進行零級或一級動力學模型擬合處理,描述監測指標變化規律;2)建立Arrhenius方程,依據其中參數建立變溫條件下貨架期預測模型;3)依據初始和貨架期終點監測指標的值,預測食品貨架期。
因此,本研究將基于前期研究基礎,將經過不同茶多酚處理方式制備的干貝進行加速貯藏,通過測定干貝的耗氧量、初級氧化產物生成、次級氧化產物生成、自由基的強度和氧化底物損失規律探究不同茶多酚處理方式對干貝脂質氧化穩定性的影響,同時基于貨架期預測模型比較不同茶多酚處理方式對干貝貨架期的影響,以期為動物性海洋干制品的抗氧化提供理論支撐和方法指導。
1 材料與方法
1.1 材料與試劑
鮮活櫛孔扇貝購買于當地海鮮市場。
十一碳酸甘油三酯、1,1,3,3-四甲氧基丙烷、14%三氟化硼-甲醇溶液、37 種脂肪酸甲酯(fatty acid methyl esters,FAMEs)混標 上海阿拉丁生化科技股份有限公司;硫代巴比妥酸、硫代硫酸鈉、三氯乙酸、氯仿、甲醇 天津科密歐化學試劑有限公司;氯仿、正己烷(均為色譜級) 美國Spectrum公司;茶多酚 江西省富之源生物科技有限公司。
1.2 儀器與設備
A200電子順磁共振波譜儀 德國Bruker公司;7890B氣相色譜儀 美國Agilent公司;CF16RXII高速冷凍離心機 日本Hitachi公司;DGH-9030A電熱恒溫干燥箱 上海一恒科學儀器有限公司;LC-1.0真空冷凍干燥機 沈陽航天新陽速凍廠;OXITEST油脂氧化穩定性分析儀 意大利VELP公司。
1.3 方法
1.3.1 干貝的制備
鮮活櫛孔扇貝剝殼,去除內臟和裙邊,取出完整的閉殼肌。將6 kg閉殼肌在12 L的3%鹽水中煮制3 min,取出瀝干,隨機分為3 組。空白組干貝:閉殼肌不添加茶多酚,直接在-50 ℃冷凍干燥制備干貝;傳統添加組干貝:閉殼肌添加0.3%的茶多酚,攪拌均勻,立即在-50 ℃冷凍干燥制備干貝,此時茶多酚僅分布在干貝表面;改進添加組干貝:閉殼肌添加0.3%的茶多酚,攪拌均勻,4 ℃靜置3 h,茶多酚將擴散至閉殼肌組織內部,隨后在-50 ℃冷凍干燥制備干貝,此時茶多酚同時分布于干貝表面和組織內部。
1.3.2 干貝的加速貯藏
取空白組、傳統添加組和改進添加組干貝各200 g,分別置于65 ℃烘箱中,避光貯藏16 d,間隔4 d取樣1 次,取樣后立即保藏在-80 ℃冰箱中,待所有樣品采集結束后分別粉碎,繼續保藏在-80 ℃冰箱中用于測定干貝的脂質氧化穩定性;取空白組、傳統添加組和改進添加組干貝各100 g,分別置于45 ℃和55 ℃烘箱中,避光貯藏16 d,間隔4 d取樣1 次,取樣后立即保藏在-80 ℃冰箱中,待所有樣品采集結束后分別粉碎,繼續保藏在-0 ℃冰箱中用于預測干貝的貨架期。
1.3.3 干貝脂質的提取
依據Folch等的方法提取干貝脂質,將30 g干貝粉與30 mL去離子水混合,再加入100 mL氯仿-甲醇(2∶1,V/V)混合溶劑,充分混合后加入37.5 mL氯仿,攪拌提取1 h,7 800×g離心10 min,收集有機相層,減壓濃縮得總脂質,將其貯存于-80 ℃冰箱中備用。
1.3.4 干貝耗氧量的測定
依據Caruso等的方法通過OXITEST測定干貝耗氧量,儀器參數如下:樣品量3 g;初始氧氣壓力6 bar;溫度90 ℃。通過儀器內置的OXIsoft軟件自動計算氧化誘導時間。
1.3.5 干貝過氧化值的測定
依據GB 5009.227—2016《食品中過氧化值的測定》的滴定法測定干貝的過氧化值(peroxide value,PV)。取0.2 g脂質樣品于錐形瓶中,用30 mL三氯甲烷-冰乙酸混合液溶解,加入1 mL飽和碘化鉀,輕搖0.5 min后暗處放置3 min。隨后加入100 mL水,搖勻后加入1 mL淀粉指示劑,用0.02 mol/L的硫代硫酸鈉溶液滴定直至藍色消失為終點。同時進行空白實驗。PV結果以g/100 g表示。

式中:V為試樣消耗硫代硫酸鈉溶液體積/mL;V為空白實驗消耗硫代硫酸鈉溶液體積/mL;C為硫代硫酸鈉標準溶液濃度/(mol/L);m為脂質樣品的質量/g;100為換算系數;0.126 9為與1.00 mL硫代硫酸鈉標準滴定溶液(1 mol/L)相當碘的質量。
1.3.6 干貝硫代巴比妥酸(thiobarbituric acid reactive substances,TBARS)值的測定
依據Khan等的方法測定干貝的TBARS,將500 mg干貝粉、2 mL去離子水和2 mL三氯乙酸溶液(10 g/100 mL)混合,渦旋振蕩2 min,8 000×g離心5 min。取1 mL上清液與1 mL硫代巴比妥酸溶液(0.01 mol/L)混合,沸水浴加熱25 min,取混合液在波長532 nm處測定吸光度。TBARS值依據以1,1,3,3-四乙氧基丙烷制作的標準曲線計算得出。標準曲線的制作方法如下:稱取0.315 g的1,1,3,3-四乙氧基丙烷于1 000 mL容量瓶中,用去離子水定容,配制質量濃度為100 μg/mL的丙二醛儲備液。吸取1 mL的丙二醛儲備液于100 mL容量瓶中,用去離子水定容,配制質量濃度為1 μg/mL的丙二醛標準使用液。分別吸取0.10、0.20、0.50、1.0、2.5、5.0 mL的丙二醛標準使用液于10 mL容量瓶中,用去離子水定容,配制0.01、0.02、0.05、0.1、0.25、0.5 μg/mL的系列標準溶液,按照以上步驟與樣液同時進行衍生化處理并測定吸光度。
1.3.7 干貝自由基強度的測定
依據Nissen等的方法測定干貝的自由基強度,儀器參數如下:樣品量100 mg;微波功率5.32 mW;中心磁場強度3 453.00 G;掃描寬度100.00 G;調制頻率100.00 kHz;調制幅度1.00 G;轉換時間480 ms;時間常數5 242.88 ms。譜圖中第1個峰的高度計為干貝的自由基強度。
1.3.8 干貝脂肪酸的測定
依據Metcalfe等的方法制備FAMEs,取500 μL脂質的氯仿溶液(10 mg/mL)和200 μL十一碳酸甘油三酯的氯仿溶液(1 mg/mL)于10 mL圓底燒瓶中,氮氣濃縮除去氯仿溶劑,繼續加入2 mL氫氧化鈉-甲醇溶液(0.5 mol/L),80 ℃回流5 min,再加入2 mL三氟化硼-甲醇溶液(14%),繼續回流2 min。冷卻后加入1.5 mL色譜級正己烷萃取FAMEs,收集正己烷層,無水硫酸鈉除水,0.22 μm有機濾膜過濾,濾液用于氣相色譜檢測。
依據GB 5009.168—2016《食品中脂肪酸的測定》測定FAMEs。色譜條件:SP 2560毛細色譜柱(100 m×0.25 mm,0.2 μm);進樣體積1 μL;分流比5∶1;進樣口溫度270 ℃;載氣N;載氣流速1 mL/min。升溫程序如下:初始溫度100 ℃,保持13 min;以10 ℃/min速率升溫至180 ℃,保持6 min;以1 ℃/min速率升溫至215 ℃;以5 ℃/min速率升溫至230 ℃,保持12 min。依據37 種FAMEs保留時間定性分析樣品中的脂肪酸(fatty acids,FAs),依據式(2)計算EPA和DHA含量(以干基計):

式中:RF為響應因子;IS為內標/mg;M為脂質質量/mg;1.006 7為十一碳酸甘油三酯轉化成十一碳酸甲酯的轉換系數;c為脂質含量/(mg/g);F為EPA或DHA甲酯轉換為EPA或DHA的轉換系數,分別為0.955 7和0.959 0。
1.3.9 干貝貨架期的預測
將干貝加速貯藏過程中PV的變化數據進行一級動力學方程(3)擬合,獲得其動力學參數,建立Arrhenius方程(4),基于獲得的參數,進一步建立貨架期預測模型(5),用于預測干貝的貨架期。

式中:PV為貯藏時間t時干貝的PV;k為應速率常數;PV為依據擬合后一級動力學方程計算的貯藏前干貝的初始PV;E為活化能/(J/mol);R為摩爾氣體常數,為8.314 4 J/(mol·K);T為絕對溫度/K;k為指前因子;PV為干貝貯藏前的初始PV值;PV為GB 10136—2015《動物性水產制品》規定干貝的限量PV,為0.6 g/100 g脂質;SL為貨架期/d。
1.4 數據處理與統計
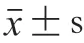
2 結果與分析
2.1 干貝加速貯藏過程中氧吸收的變化
頂空耗氧法是測定氧吸收的方法之一,該方法將待測樣品置于高壓氧氣和高溫條件下,通過實時監測氧氣壓力的變化計算氧氣的消耗速率,進而推導獲得氧化誘導時間。氧化誘導時間越長表明脂質氧化穩定性越高。如圖1所示,加速貯藏前,空白組、傳統添加組和改進添加組干貝的氧化誘導時間分別為(90.03±13.09)、(200.55±12.12)h和(241.03±8.03)h,傳統添加組和改進添加組干貝的氧化誘導時間分別是空白組干貝的2.23 倍和2.68 倍。可見,添加茶多酚可以顯著延長干貝的氧化誘導時間,增強干貝的氧化穩定性。隨著加速貯藏時間的延長,3 組干貝的氧化誘導時間逐漸縮短,說明干貝的氧化穩定性逐漸降低。在加速貯藏第8天,已無法測出空白組干貝的氧化誘導時間。在加速貯藏第16天,改進添加組干貝的氧化誘導時間為(50.05±6.10)h,是傳統添加組干貝氧化誘導時間((30.09±3.98)h)的1.66 倍。上述結果顯示,通過改進方式添加茶多酚比傳統方式更顯著地延長了干貝的氧化誘導時間,表明茶多酚同時處于干貝表面和組織內部比茶多酚僅處于干貝表面能更有效地提升干貝的氧化穩定性。

圖1 干貝加速貯藏過程中氧化誘導時間的變化Fig. 1 Changes in induction period of oxidation of dried scallop adductor muscle during accelerated storage
2.2 干貝加速貯藏過程中初級氧化產物變化

圖2 干貝加速貯藏過程中PV的變化Fig. 2 Changes in PV of dried scallop adductor muscle during accelerated storage
PV是測定脂質初級氧化產物的常用指標,可以反映脂質中總氫過氧化物的量。如圖2所示,加速貯藏前,空白組、傳統添加組和改進添加組干貝的PV無顯著差異,表明閉殼肌的前處理及干貝的制備過程未發生顯著氧化。隨著加速貯藏時間的延長,3 組干貝的PV顯著升高,表明干貝加速貯藏過程中不飽和脂質發生氧化,持續生成大量氫過氧化物,且其生成速率高于其降解速率。在整個65 ℃加速貯藏過程中,傳統添加組和改進添加組干貝的PV顯著低于空白組,說明茶多酚顯著抑制了氫過氧化物的形成,而改進添加組干貝具有最低的PV,表明改進添加方式具有最好的抗氧化效果。這是由于在抗氧化劑的改進添加過程中,茶多酚的擴散過程使其不僅分布于干貝的表面還分布于干貝組織內部,進而同時抑制干貝表面和組織內部脂質氧化,促使其發揮更全面的抗氧化作用,更有效地抑制了氫過氧化物的生成。
2.3 干貝加速貯藏過程中次級氧化產物的變化
脂質氧化過程中生成的初級氧化產物氫過氧化物不穩定,容易降解為醛、酮、醇、烴、揮發性有機酸和環氧化合物等各種次級氧化物產物。TBARS是檢測脂質次級氧化產物的常用指標,可以反映食品中丙二醛的量。如圖3所示,加速貯藏前,空白組、傳統添加組和改進添加組干貝具有相似的TBARS值,表明閉殼肌的前處理及干貝的制備過程未發生顯著性氧化。隨著加速貯藏時間的延長,3 組干貝TBARS值逐漸升高,加速貯藏16 d后,3 組干貝TBARS值分別比初始值增長了16.50、6.59 倍和3.51 倍,表明干貝加速貯藏過程中氫過氧化物不斷降解生成丙二醛。在整個65 ℃加速貯藏過程中,傳統添加組和改進添加組干貝的TBARS值顯著低于空白組的TBARS值,說明茶多酚顯著抑制了丙二醛的生成,而改進添加組干貝具有最低的TBARS值,說明茶多酚同時處于干貝組織表面和內部比其僅分布在干貝表面能更顯著地抑制丙二醛的產生。

圖3 干貝加速貯藏過程中TBARS值的變化Fig. 3 Changes in TBARS value of dried scallop adductor muscle during accelerated storage
2.4 干貝加速貯藏過程中自由基強度的變化
脂質氧化分為自動氧化、酶促氧化和光敏氧化3 種類型。在預處理過程中,閉殼肌已進行煮制處理,脂氧合酶已被鈍化。經過干制后,干貝的水分含量較低,僅約為5%,且加速貯藏溫度較高,進一步抑制了殘存脂氧合酶的活性,因此酶促氧化很難發生。此外,整個加速貯藏過程在避光條件下進行,難以發生光敏氧化。因此,自動氧化是本實驗中干貝的主要氧化類型。自動氧化是不飽和脂質和氧氣通過自由基的鏈式反應自發進行的化學過程,包含鏈引發、鏈傳遞和鏈終止3 個階段。因此,自由基水平是脂質氧化程度的重要評價指標。如圖4所示,加速貯藏前,空白組、傳統添加組和改進添加組干貝的自由基強度值無顯著差異,分別為0.81±0.11、0.79±0.15和0.82±0.09,說明閉殼肌的前處理及干貝的制備過程未發生顯著性自由基增殖過程。隨著加速貯藏時間的延長,3 組干貝的自由基強度值逐漸升高。在加速貯藏16 d后,3 組干貝的自由基強度值分別增加為9.03±0.25、5.50±0.31和4.32±0.18,分別比初始值增長了10.15、5.96 倍和4.27 倍,表明干貝發生自動氧化,生成了大量的脂質自由基。在加速貯藏16 d后,空白組干貝的自由基強度值分別是傳統添加組和改進添加組干貝的1.64 倍和2.09 倍,說明茶多酚阻斷了自由基的鏈式反應,抑制了自由基的生成。在此過程中,茶多酚含有的酚羥基提供氫原子,猝滅自由基,酚羥基自身轉變為醌。值得注意的是,改進添加組干貝的自由基強度值比傳統添加組干貝的自由基強度值更低。傳統添加方式使得茶多酚分布在干貝表面,只能抑制干貝表面組織氧化產生自由基,而改進添加方式中閉殼肌添加茶多酚并靜置后,部分茶多酚能夠擴散至組織內部,相比于茶多酚僅分布在干貝表面,此方式還能有效清除干貝組織內部的脂質自由基,由此導致2 種處理方式自由基含量的差異。

圖4 干貝加速貯藏過程中自由基強度的變化Fig. 4 Changes in free radical intensity of dried scallop adductor muscle during accelerated storage
2.5 干貝加速貯藏過程中氧化底物含量的變化
在脂質氧化過程中,氧氣并入不飽和脂質分子的雙鍵形成氫過氧化物,氫過氧化物不穩定,最終降解成為各種次級氧化產物,導致不飽和脂質含量的損失。因此,測定氧化底物的損失規律是評估脂質氧化最直接的方法。如圖5所示,加速貯藏前,空白組、傳統添加組和改進添加組干貝具有相似的EPA+DHA含量,分別為(9.05±0.22)、(9.02±0.11)、(9.03±0.15) mg/g,表明閉殼肌的前處理及干貝的制備過程未發生顯著性氧化底物損失。隨著加速貯藏時間的延長,3 組干貝的EPA+DHA含量逐漸減少。在加速貯藏16 d后,3 組干貝的EPA+DHA含量分別為(6.40±0.29)、(7.35±0.21)mg/g和(8.31±0.20)mg/g,分別損失了29.28%、18.51%和7.97%,說明EPA和DHA發生氧化和降解,轉變為氫過氧化物和醛、酮、醌等次級氧化產物,造成干貝中n-3 PUFAs類營養組分的損失,干貝營養價值降低。傳統添加組和改進添加組的干貝在整個加速貯藏過程中EPA+DHA含量損失比空白組干貝更少,說明茶多酚抑制了氧化底物的氧化損失。此外,改進添加組干貝的EPA+DHA含量損失比傳統添加組干貝更少,說明茶多酚擴散到干貝組織內部后可以更全面保護干貝含有的EPA+DHA等不飽和脂質成分,更大程度上保持了干貝的營養價值。

圖5 干貝加速貯藏過程中EPA+DHA含量的變化Fig. 5 Changes in EPA + DHA content of dried scallop adductor muscle during accelerated storage
2.6 干貝貨架期的預測
干貝屬于低水分食品,微生物活動受到抑制,是微生物穩定類食品,其品質劣變的主要原因是脂質氧化。GB 10136—2015《動物性水產制品》中明確規定了干貝等預制水產干制品的理化指標為PV,限量值為0.6 g/100 g脂質。因此,本實驗以PV為干貝品質的監測指標,測定了干貝在45、55 ℃和65 ℃加速貯藏環境中PV的變化數據。如圖6所示,在不同貯藏溫度環境中,空白組、傳統添加組和改進添加組干貝的PV隨著貯藏時間的延長而逐漸升高,說明3 組干貝中氫過氧化物的持續生成和積累。

圖6 干貝不同溫度加速貯藏過程中PV的變化Fig. 6 Changes in PV of dried scallop adductor muscle during accelerated storage at different temperatures
在食品加工與貯藏過程中,大多數與品質相關的指標參數均符合反應動力學規律。本課題組前期研究結果也證實,相比于零級動力學方程,干貝在加速貯藏過程中PV的變化數據更符合一級動力學方程。因此,本研究采用一級動力學模型對采集到的干貝PV變化數據進行擬合處理,分別獲得45、55 ℃和65 ℃條件下加速貯藏中干貝PV的一級動力學方程(表1)。根據一級動力學方程模型可知,空白組、傳統添加組和改進添加組干貝45、55 ℃和65 ℃條件下PV的變化速率。將上述貯藏溫度及對應的變化速率進行Arrhenius方程擬合,獲得空白組、傳統添加組和改進添加組干貝的Arrhenius方程,分別為lnk=-1 752/T+2.989 2、lnk=-2 576/T+5.162 5和lnk=-2 354/T+4.243 5,3 組干貝的E分別為14.57、21.42 kJ/mol和19.57 kJ/mol。

表1 干貝加速貯藏中PV動力學模型擬合Table 1 Kinetic models of PV in dried scallop adductor muscle during accelerated storage
進一步,基于從Arrhenius方程中獲得的E和k等參數分別建立空白組、傳統添加組和改進添加組干貝的貨架期預測模型。將干貝的初始值和GB 10136—2015《動物性水產制品》中規定的干貝PV限量值(0.6 g/100 g脂質)分別代入貨架期預測模型,計算獲得空白組、傳統添加組和改進添加組干貝在25 ℃下的預測貨架期分別為29.76、53.71 d和63.94 d(表2)。傳統添加方式,即茶多酚分布在干貝表面,能延長干貝貨架期23.95 d,而改進添加方式比傳統添加方式可以多延長干貝貨架期10.23 d。

表2 干貝貨架期預測模型及預測貨架期Table 2 Shelf life prediction models of dried scallop adductor muscle and its predicted shelf life
3 結 論
通過測定耗氧量、初級氧化產物生成、次級氧化產物生成、自由基強度和氧化底物損失評價了不同茶多酚處理方式對干貝加速貯藏過程中脂質氧化穩定性的影響,同時建立干貝貨架期預測模型,探究不同茶多酚處理方式對干貝預測貨架期的影響。結果表明,將茶多酚添加至干貝表面和組織內部的方式比僅將茶多酚添加至干貝表面更能有效地延長干貝的氧化誘導時間,降低其PV、TBARS值、自由基強度和EPA+DHA的含量損失,提升干貝的氧化穩定性。空白組、傳統添加組和改進添加組干貝的貨架期分別為29.76、53.71 d和63.94 d,將茶多酚同時添加至干貝表面和組織內部的改進添加方式比僅將茶多酚添加至干貝表面的傳統方式更能有效延長干貝的貨架期。本研究為動物性海洋干制品的高效抗氧化和營養品質保持提供了理論依據和方法指導。

