PINK1介導的線粒體自噬對大鼠骨髓內皮祖細胞衰老及其功能的影響
唐 蜜,石永芳,肖 珍,梁 梅,秦 臻
(貴州醫科大學基礎醫學院,貴州 貴陽 550025)
隨著人口老齡化速度加劇,冠心病、心梗等缺血性心血管疾病的發病率與死亡率逐年攀升,如何有效防治其發生發展具有重要的意義。近年來利用內皮祖細胞(endothelial progenitor cells,EPCs)介導的心血管治療已成為再生醫學研究的熱點[1-2]。EPCs作為主要定居于骨髓,具有游走特性并能自我更新,增殖分化為血管內皮的前體細胞,在缺血缺氧等病理生理的作用下,可隨著血液循環募集至缺血組織,修復損傷血管[3]。隨著研究的不斷深入,通過體外培養自體EPCs移植修復損傷內皮對缺血性心血管疾病的治療具有很好的應用前景[4]。但衰老機體的EPCs在體外培養時由于老化過快,難以維持增殖活性而無法發揮修復作用[5]。活性氧(reactive oxygen species,ROS)與細胞衰老密切相關,我們前期研究也發現,EPCs在體外培養時其衰老程度逐漸加重并伴有ROS水平的急劇上升[6]。線粒體作為產生ROS的主要場所,其功能失常被證實與衰老進展有關,而線粒體自噬可通過選擇性的清除衰老或受損的線粒體,調節線粒體質量,維持細胞穩態[7-8]。因此我們推測線粒體自噬與EPCs衰老之間可能存在某種聯系,本文從較為經典的PINK1介導的線粒體自噬通路入手,通過小干擾RNA技術敲減PINK1基因,以確定最佳敲減時間,并以此為據點選取不同時間點模擬衰老進程來觀察EPCs衰老與PINK1介導的線粒體自噬之間的關系,以期為EPCs衰老機制的研究提供一些思路。
1 材料與方法
1.1 材料
1.1.1實驗動物 健康SPF級SD大鼠20只,20月齡,雌雄各半,體質量(560~600)g;貴州醫科大學實驗動物中心提供,許可證號:SCXK(黔)2018-0001;光照12 h,環境:濕度50%~70%,溫度20 ℃~26 ℃,采用滅菌飲用水和標準鼠飼料喂養。
1.1.2主要試劑 M199培養液(2187131)、胎牛血清(2254375CP)、OPTI-MEM培養液(2177581)均購自Gibco公司;堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF,1210432-1)、血管內皮生長因子(vascular endothelial growth factor,VEGF,1107436)均購自PeproTech公司;大鼠骨髓淋巴細胞分離液(TBD2013LR)購自天津灝洋生物科技有限公司;PINK1、p16抗體(ab23707,ab51243)均購自英國Abcam公司;Parkin、p62、LC3抗體(2132S,39749S,4108S)均購自美國CST公司;磷酸鹽緩沖液購自Gibco公司;FITC 標記的荊豆凝集素1(FITC-UEA-1)購自美國Sigma 公司;Dil標記的乙酰化低密度脂蛋白(Dil-ac-LDL)購自廣州奕源生物科技有限公司;siRNA干擾序列及GP-transfect-Mate轉染試劑購自吉瑪基因公司;熒光定量PCR試劑盒購自Servicebio公司;活性氧檢測試劑盒與SA-β-半糖苷酶染色試劑盒均購自碧云天公司;CCK-8試劑盒購自absin公司;體外血管生成試劑盒購自Millipore公司;Transwell小室購自Corning公司。
1.1.3主要儀器 IX71熒光顯微鏡(日本Olympus公司);TS100倒置顯微鏡(日本Nikon公司);多功能酶標儀(美國Thermo Fisher公司);流式細胞儀(美國BD公司);實時熒光定量PCR儀(德國Eppendorf公司);冷凍離心機(美國Thermo Fisher公司);CO2培養箱(美國Thermo Fisher公司);透射電鏡(日本Hitachi公司)。
1.2 方法
1.2.1大鼠骨髓源EPCs的培養及鑒定 采用脫頸法將大鼠處死,剪下兩側大腿,浸入75%的酒精中消毒,無菌環境中分離雙側股骨與脛骨,無菌注射器抽取PBS沖洗髓腔,收集細胞懸液,并通過200目細胞篩進行過濾,按2 ∶1的體積比將重懸液緩慢加入骨髓淋巴細胞分離液中,兩者之間形成清晰界面。1 500 r·min-1離心20 min,收集白色絮狀物層,加入PBS吹打混勻,密度梯度離心法分離得到的骨髓單個核細胞,用PBS洗滌2次,每次10 min。獲得的細胞團塊用含10 μg·L-1的VEGF和bFGF、20%胎牛血清的M199全培養液進行重懸,接種于T25細胞培養瓶中,4 d后進行第一次換液,此后每3 d換液1次,記錄細胞生長特性;并繼續培養收集約10 d的細胞,采用雙染色法進行鑒定,PBS洗2次后,將細胞與Dil-ac-LDL于37 ℃孵育4 h,多聚甲醛固定20 min后,PBS洗3次,加入10 mg·L-1的 FITC-UEA-1于37 ℃孵育1 h,棄去后PBS洗3次,熒光顯微鏡下觀察。
1.2.2細胞分組及轉染 將EPCs計數后在6孔板中進行培養,同步化24 h后,將其隨機分為3組:空白組、NC siRNA組、PINK1 siRNA組,空白組正常培養,另外兩組分別予以NC siRNA及PINK1 siRNA進行轉染。當細胞密度達到60%~80%時,按照轉染試劑說明書進行操作,將含轉染試劑的培養基混合物滴加至RNA oligo培養基混合物中,輕輕混勻,室溫靜置20 min后,立即轉染。棄去原有培養基,PBS洗2次后每孔加入1.5 mL預熱的新鮮培養基,再將配好的轉染混合液加入其中,輕輕混勻,培養箱中孵育6 h后,換為全培養基,繼續培養至不同時間。
1.2.3qRT-PCR法檢測各組細胞中PINK1 mRNA的表達 將轉染24 h與48 h后的各組EPCs,分別進行收集,運用TRIzol法將各組細胞的總RNA提取后,依據逆轉錄說明書合成單鏈cDNA,并以cDNA為模版,參照PCR試劑盒說明書進行擴增,以GAPDH(138 bp)為內參上游引物序列為:5′-CTGGAGAAACCTGCCAAGTATG-3′,下游引物序列:5′-GGTGGAAGAATGGGAGTTGCT-3′,PINK1(113 bp)的上游引物序列為:5′-TGCAATGCCGCTGTGTATGA-3′,下游引物序列:5′-TCTGCTCCCTTTGAGAC-GAC-3′,反應條件:95 ℃預變性10 min后,95 ℃ 15 s,60 ℃ 30 s,擴增40個循環,采用 2- ΔΔCt法計算各組細胞中PINK1 mRNA表達水平。
1.2.4Western blot法檢測各組EPCs中PINK1蛋白表達水平 將轉染24 h、48 h后的各組細胞,棄去原培養液,預冷的PBS清洗2次,加入適量含PMSF的RIPA裂解液,使用細胞刮將細胞刮取后收集,12 000 r·min-1,4 ℃離心10 min,提取細胞總蛋白。根據BCA蛋白定量試劑盒的說明檢測總蛋白濃度,按比例將蛋白樣品與上樣緩沖液混勻。將蛋白樣品熱變性后加入制好的SDS-PAGE凝膠中進行電泳,轉膜。使用Quick Western封閉液將膜封閉15 min,用TBST液清洗PVDF膜每次10 min,共3次,再加入特異性的一抗(PINK1抗體、GAPDH抗體),4 ℃環境慢搖過夜。次日,用TBST液洗3次,每次10 min,再加入二抗,室溫下孵育2 h,TBST液洗3次,每次10 min。化學顯影液進行曝光,得到目的條帶顯影。再通過ImageJ軟件對各個條帶的灰度值進行比對分析。
1.2.5細胞衰老程度檢測 將轉染48、96 h的各組EPCs,依據SA-β-半乳糖苷酶染色試劑盒說明書操作。將原有細胞培養液棄去,PBS緩沖液洗3次,加入1 mL半乳糖苷酶染色固定液,室溫下靜置15 min,棄去固定液,用PBS緩沖液洗3次,每次3 min,加入1 mL染色工作液,置于37 ℃、無CO2培養箱孵育過夜。封口膜封住孔板防止液體蒸發,次日將染色工作液棄去,PBS洗滌后,于倒置顯微鏡下觀察,衰老細胞的胞質呈藍染,隨機選取5個視野進行拍照,最后根據細胞藍染數量計算出衰老細胞所占的百分比。
1.2.6細胞增殖能力檢測 將轉染48 h與96 h的各組EPCs計數后接種于96孔板中,每孔100 μL(5×103個),于培養箱中培養24 h后,每孔加10 μL的CCK-8溶液,培養箱中繼續孵育1~4 h,酶標檢測儀于波長450 nm處進行吸光值檢測。
1.2.7細胞遷移能力檢測 分別將轉染48 h與96 h的各組EPCs,用無血清培養基重懸,計數每孔300 μL細胞懸液(1×105個)加入Transwell小室的上室,下室加入M199全培養基700 μL。于37 ℃,CO2培養箱中培養24 h,將小室中的培養基棄去,PBS洗2次,再經多聚甲醛固定,結晶紫染色,拭去內室細胞,于顯微鏡下隨機選取5個視野進行觀察,計數遷移至下層的細胞,算出平均值。
1.2.8細胞成血管功能檢測 按照體外血管生成試劑盒操作說明,將10×稀釋液與ECMatfixTM膠液于4 ℃冰箱凍融,將900 μL ECM-atfixTM膠液與100 μL ECM 10×稀釋液置于冰上混勻,加入96孔板中,每孔50 μL,勿產生氣泡,培養箱中基質膠凝固1 h。將轉染48、96 h的各組細胞計數后以150 μL(1×104個)接種于膠上,于37 ℃培養箱孵育2~4 h后,鏡下隨機5個視野,觀察長度為寬度的4倍及以上的細胞,計數取其平均值。
1.2.9流式細胞儀檢測ROS水平 按1 ∶1 000用無血清培養基稀釋DCFH-DA,將轉染48 h與96 h的各組細胞,胰酶消化后收集細胞,棄去上清,每管中加入適量DCFH-DA稀釋液混勻,于培養箱中孵育20 min,每隔5 min顛倒混勻1次,使探針和細胞充分接觸。用無血清培養基洗滌細胞3次,以充分去除未進入細胞內的DCFH-DA,最后用PBS重懸細胞,于流式細胞儀進行檢測。
1.2.10Western blot法檢測線粒體自噬及衰老相關蛋白表達水平 將轉染48 h與96 h后的各組EPCs棄去原培養液,操作方法同1.2.4,電泳、轉膜、封閉。TBST液清洗PVDF膜每次10 min,共3次,再加入一抗(PINK1、Parkin、LC3、p62、p16抗體、GAPDH抗體),4 ℃環境慢搖過夜。次日用TBST液洗3次,每次10 min,再加入二抗,室溫下孵育2 h。TBST液洗3次,每次10 min,化學顯影液曝光,通過ImageJ軟件對各個條帶的灰度值進行比對分析。
1.2.11透射電鏡觀察線粒體自噬 將轉染48 h與96 h的各組細胞,胰酶消化后離心收集細胞,棄去上清,沿離心管壁加入預冷的2.5%戊二醛溶液,4 ℃固定12 h,PBS緩沖液洗3次,每次10 min,1%鋨酸4 ℃固定1 h后,PBS緩沖液洗3次,經乙醇及丙酮梯度脫水處理,再經過環氧樹脂浸透、包埋、聚合后,超薄切片機切片;采用醋酸鈾-檸檬酸鉛進行雙重染色,透射電鏡下進行觀察拍照。
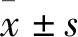
2 結果
2.1 大鼠骨髓EPCs的分離培養及鑒定大鼠骨髓源單個核細胞在分離之初呈小圓形,在培養液中呈懸浮狀態,培養5 d后貼壁細胞逐漸開始出現偽足樣突起,首尾相連呈條索樣分布;7 d后細胞出現集落生長并逐漸變為鋪路石樣(Fig 1A)。培養10 d左右,貼壁細胞經FITC-UEA-1和Dil-ac-LDL處理后,熒光顯微鏡下觀察,EPCs攝取Dil-ac-LDL呈紅色,結合FITC-UEA-1呈綠色,同時結合FITC-UEA-1與Dil-ac-LDL的細胞為正在分化的EPCs(Fig 1B)。
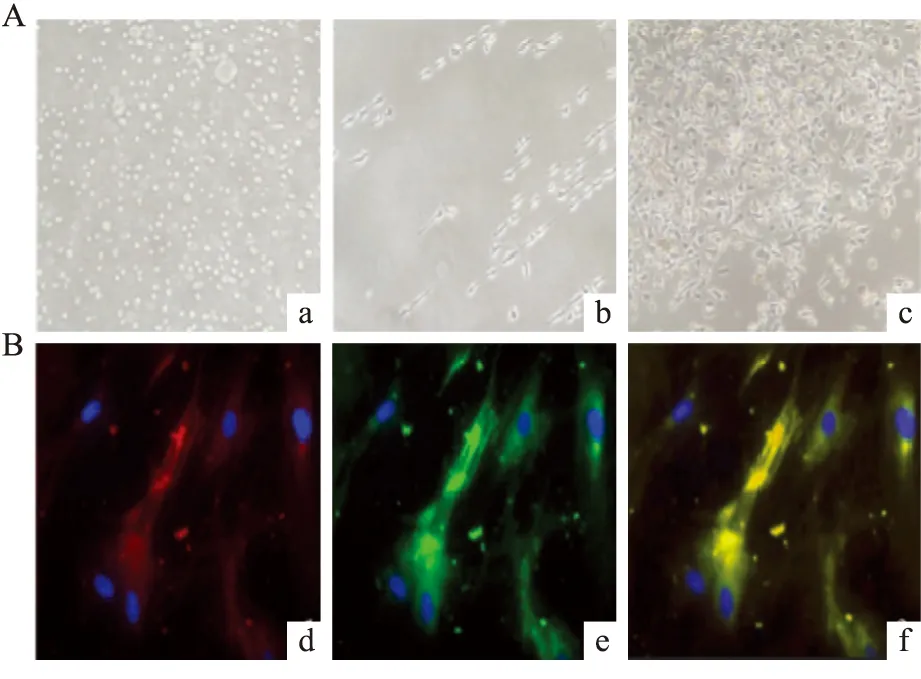
Fig 1 Cultivation and identification of EPCsA:a:At the beginning of separation of EPCs;b,c:The growth characteristics of day 5 and day 7 (100×);B:d:Adherent cells with Dil-ac-LDL were red;e:Cells binding FITC-UEA-1 were green;f:Double positive cells were differentiating EPCs (200×).
2.2 siRNA轉染細胞后PINK1 mRNA和蛋白的表達水平qRT-PCR和Western blot結果(Fig 2)顯示,在siRNA轉染24 h后,與空白組相比,PINK1 siRNA組細胞PINK1 mRNA表達水平明顯降低(P<0.01),PINK1蛋白表明無明顯變化;在轉染48 h后,與空白組相比,PINK1 siRNA組細胞PINK1 mRNA及蛋白表達水平均明顯降低(P<0.01),NC siRNA組則無明顯差異。
2.3 EPCs衰老程度的變化如Fig 3所示,在轉染48 h、96 h后,與空白組相比,PINK1 siRNA組藍染細胞數量增加,衰老陽性率明顯升高(P<0.01),p16蛋白表達水平也明顯上調(P<0.05),NC siRNA組無明顯變化;組內比較,與轉染48 h相比,轉染96 h后各組中的藍染細胞數量增加,衰老陽性率明顯升高(P<0.05),空白組與PINK1 siRNA組的p16蛋白表達水平也明顯上調(P<0.05)。
2.4 EPCs增殖能力的變化如Fig 4所示,在轉染48 h、96 h后,與空白組相比,PINK1 siRNA組的細胞增殖能力均明顯下降(P<0.01),NC siRNA組無明顯變化。組內比較,與轉染48 h相比,轉染96 h后各組細胞的增殖能力均明顯降低(P<0.05)。
2.5 EPCs遷移功能的變化如Fig 5所示,在轉染48 h、96 h后,與空白組相比,PINK1 siRNA組的細胞遷移能力均明顯下降(P<0.01),NC siRNA組無明顯變化。組內比較,與轉染48 h相比,轉染96 h后各組細胞的遷移能力均有所降低(P<0.05)。
2.6 EPCs成血管功能的變化如Fig 6所示,在轉染48 h、96 h后,與空白組相比,PINK1 siRNA組成血管功能均明顯下降(P<0.01),NC siRNA組無明顯變化。組內比較,與轉染48 h相比,轉染96 h后各組細胞的成血管功能均有所降低(P<0.05)。
2.7 各組細胞ROS水平的變化通過檢測DCFH-DA平均熒光強度來反映胞內ROS的水平。如Fig 7所示,在轉染48 h、96 h后,與空白組相比,PINK1 siRNA組細胞ROS水平均有所升高(P<0.01),NC siRNA組則無明顯變化。

Fig 2 The expression levels of PINK1 mRNA and protein in EPCs in various groups detected by qRT-PCR and Western blot n=3)A:PINK1 mRNA expression;B,C:PINK1 protein expression;a:control;b:NC siRNA;c:PINK1 siRNA.**P<0.01 vs control.
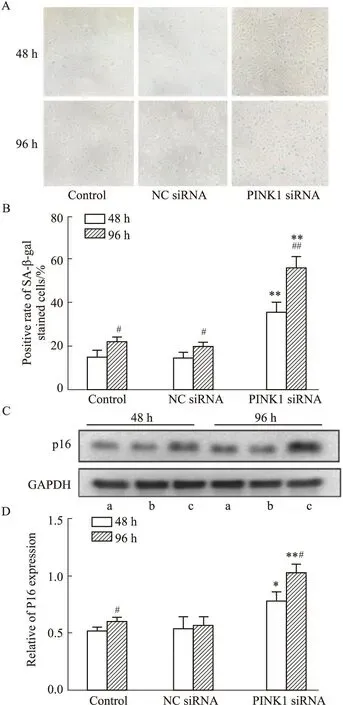
Fig 3 Cell senescence degree of EPCs obtained from various groups tested by SA-β-gal staining and Western blot n=3)A,B:At 48 h and 96 h after transfection,the blue-stained cells were senescent cells (×100) ;C,D:p16 protein expression;a:Control;b:NC siRNA;c:PINK1 siRNA.*P<0.05,**P<0.01 vs control;#P<0.05 ,##P<0.01 vs 48 h.
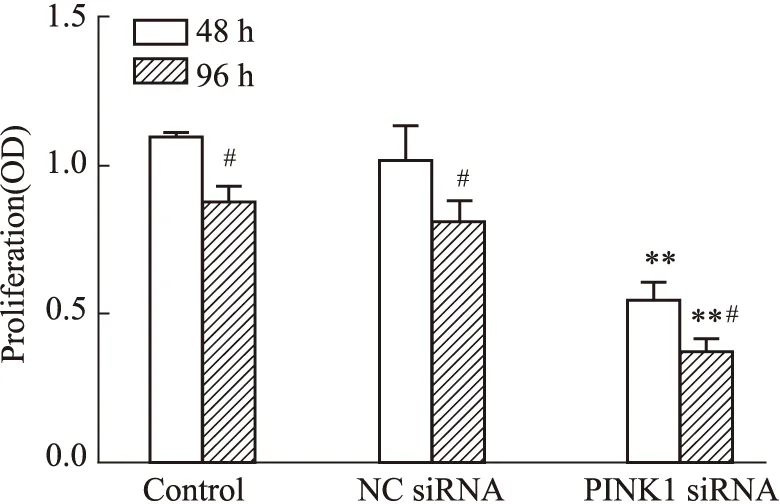
Fig 4 Proliferation of EPCs in various groups n=3)**P<0.01 vs control;#P<0.05 vs 48 h.
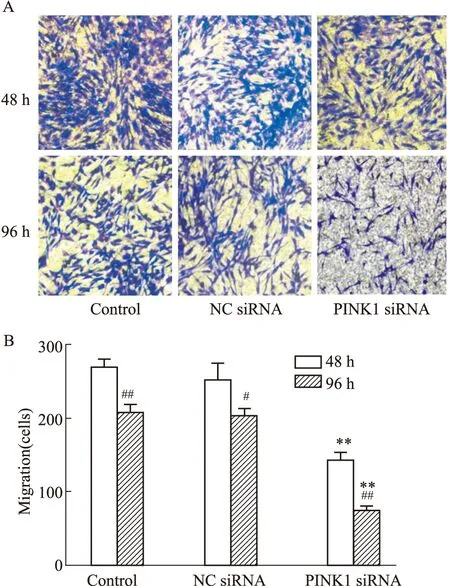
Fig 5 Migration of EPCs in various groups n=3)A,B:The number of cells stained with crystal violet represented the migration ability of cells (100×).**P<0.01 vs control;#P<0.05,##P<0.01 vs 48 h.
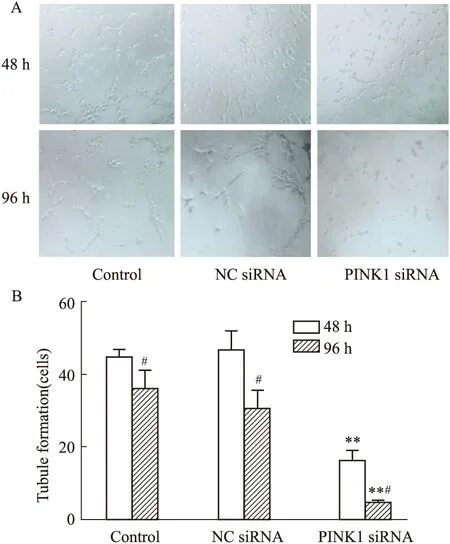
Fig 6 Tubule formation of EPCs in various groups n=3)A,B:The number of tubule formation of EPCs indicated its tubule function (100×) ;**P<0.01 vs control;#P<0.05 vs 48 h.
2.8 Western blot檢測線粒體自噬相關蛋白的表達在轉染48 h、96 h后,與空白組相比,PINK1 siRNA組細胞的PINK1、Parkin、LC3蛋白表達均明顯下調,而p62蛋白表達明顯上調(P<0.05),NC siRNA組無明顯差異(Fig 8)。
2.9 透射電鏡觀察細胞線粒體自噬情況轉染48 h后,各組腫脹變形的線粒體數量較少,轉染96 h后,各組線粒體明顯腫脹變形;各組均可觀察到典型的呈雙層膜結構的線粒體自噬體和被自噬小體包裹的受損線粒體,還出現了線粒體自噬體與溶酶體融合的現象,而PINK1 siRNA組的自噬體數量較空白組明顯減少(Fig 9)。
3 討論
大量研究表明,諸多危險因子造成的動脈內皮細胞功能失調和損傷是缺血性心血管疾病發生的始動環節[9]。動脈內皮細胞損傷可由周圍的內皮細胞增殖修復,但當其衰老時此種修復功能明顯減弱,成熟的內皮細胞屬于終末分化細胞,替代能力有限,而EPCs作為具有強大增殖能力的干細胞,可遷移至受損血管,修復損傷內皮和構建血管網絡,同時通過分泌細胞因子,重建血管[10]。因此,近年來利用體外培養的自體EPCs移植治療缺血性心血管疾病的細胞干預法已成為再生醫學的新策略之一。然而,缺血性心血管疾病多發生于老年患者,老年機體的EPCs在體外培養過程中會較快出現細胞增殖活力下降,分化停滯等衰老表現,這使其臨床應用受到極大限制[11-12]。

Fig 7 ROS levels of EPCs in various groups by flow cytometry n=3)A,B:Overlay map of fluorescence histogram and histogram of mean fluorescence intensity of various groups.**P<0.01 vs control.
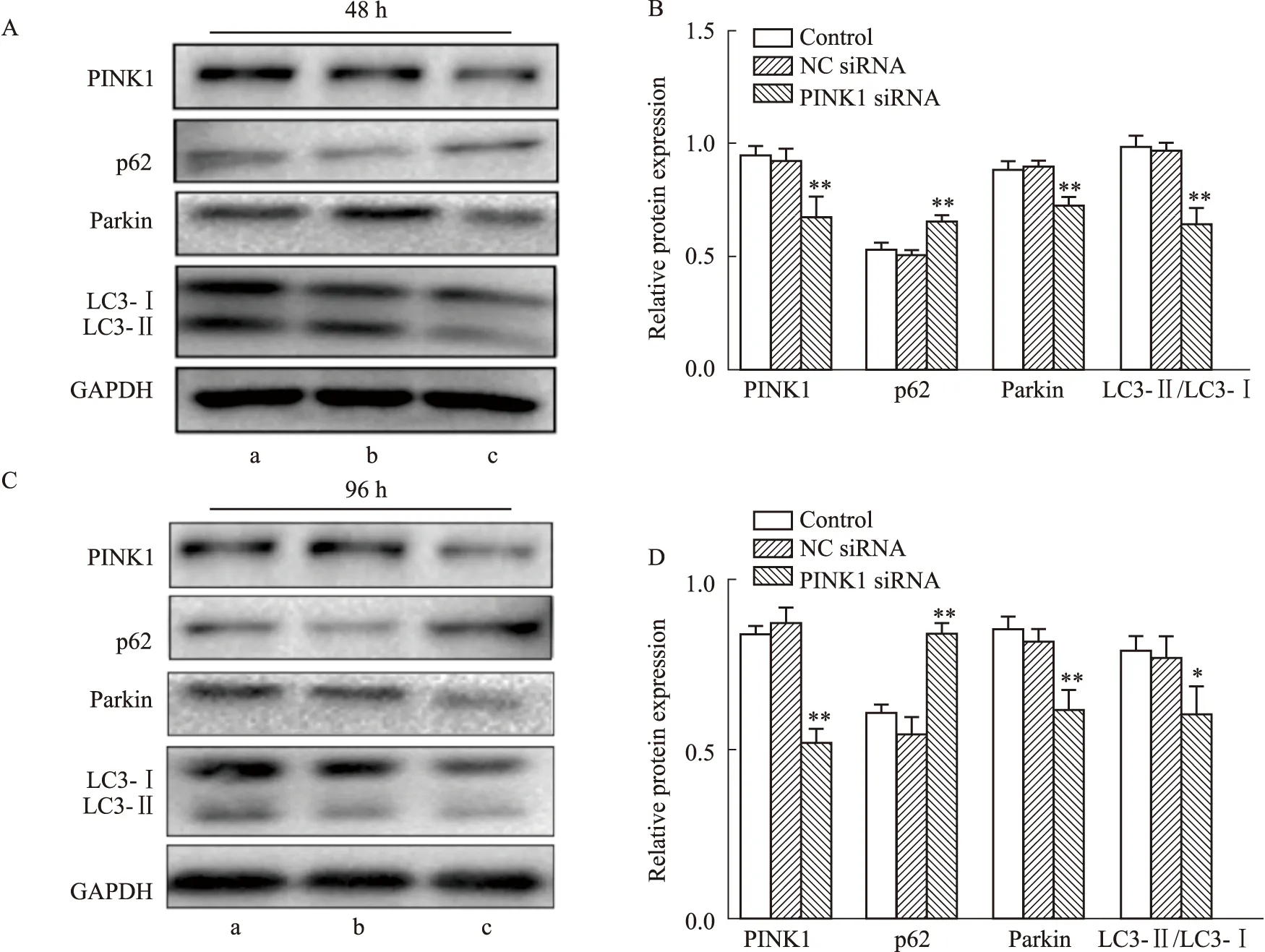
Fig 8 Mitophagic protein expression levels detected by Western blot n=3)A,B:The mitophagic protein levels in EPCs were detected by Western blot 48 h after transfection;C,D:The mitophagic protein levels in EPCs were detected by Western blot 96 h after transfection;a:control;b:NC siRNA;c:PINK1 siRNA.*P<0.05,**P<0.01 vs control.
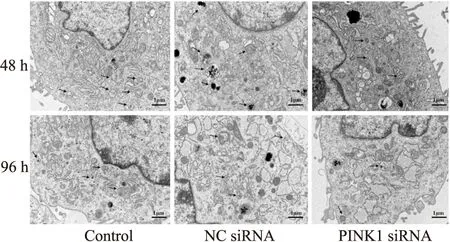
Fig 9 Autophagosomes and mitochondria in EPCs detected by TEMBlack arrows represented the characteristic double-membrane ultrastructural morphology of autophagic vacuoles (4 000×).
細胞衰老是指細胞的增殖活性轉變為不可逆的停滯狀態,無法發揮正常的細胞功能。自由基假說作為經典衰老假說之一,該假說認為細胞中自由基不斷產生誘發分子損傷積累是細胞衰老的主要潛在原因[13]。在我們前期研究中也發現,ROS水平在EPCs衰老進程中逐漸升高。而線粒體作為ROS產生的主要來源,其功能失常常被認為與衰老進程密切相關,這主要通過線粒體損傷→ROS更多的釋放→線粒體進一步損傷→細胞衰老這一惡性循環表現出來[14]。而線粒體自噬在維持線粒體功能穩態方面至關重要,線粒體自噬可選擇性的對受損及衰老的線粒體進行清除,減少ROS的過度積累,進而中斷惡性循環,來對抗細胞衰老[15]。目前存在多條信號分子通路來調節線粒體自噬,而PINK1介導的線粒體自噬是作為年齡相關疾病研究最為廣泛的經典線粒體自噬通路,PINK1是一種線粒體靶向的絲氨酸/蘇氨酸激酶,也是線粒體外膜蛋白,Parkin是胞質中的一種E3泛素-蛋白連接酶[16]。PINK1作為Parkin的上游,直接或間接通過磷酸化作用激活Parkin來啟動線粒體自噬,之后p62與受到Parkin泛素化的蛋白底物作用并結合至LC3上,受損線粒體與溶酶體融合為線粒體自噬溶酶體,從而清除受損線粒體,終止ROS的過度積累[17-18]。然而,線粒體自噬在EPCs衰老進程中的作用尚不清楚。
據此,我們首先采用小干擾RNA轉染細胞,多時間點觀察PINK1的敲減效率,檢測到PINK1 siRNA組在轉染后48 h時,其PINK1 mRNA和蛋白表達均出現明顯下調,這表明48 h時PINK1已被有效敲減。為通過時間差異模擬衰老進程,因此后續選擇兩個時間點(48 h和96 h)動態觀察了細胞衰老和功能的變化。半乳糖苷酶染色與衰老蛋白p16檢測結果顯示,轉染PINK1 siRNA后,其衰老程度加重;由于衰老細胞的功能遠不如正常細胞,因而推測EPCs的功能也會有所減弱,隨后通過CCK-8、Transwell和成血管實驗,表明PINK1 siRNA組EPCs在增殖、遷移、成血管功能方面均有所降低,同時流式細胞儀也檢測到胞內ROS水平升高。隨后,我們通過透射電鏡觀察到PINK1 siRNA組細胞線粒體發生明顯腫脹變形,自噬小體減少。LC3作為自噬過程中自噬泡形成的必要條件,主要由Ⅱ型LC3起主要作用,其錨定在自噬小體的膜上,通過與Ⅰ型LC3的比值可以衡量自噬活性。而p62作為評價自噬水平的常用標志,可以通過自噬降解自身,該蛋白積聚于胞質內表明自噬被抑制。通過Western blot檢測線粒體自噬相關蛋白發現轉染48 h與96 h后PINK1 siRNA組的PINK1、Parkin、LC3蛋白表達下調,而p62蛋白表達明顯上調。以上結果表明細胞的衰老,細胞功能的降低,內源性ROS的產生,可能是由于PINK1的下調導致的,進而推測PINK1對EPCs衰老具有延緩作用,而這種延緩作用可能是通過其介導的線粒體自噬來實現的。同時,我們還通過比較不同轉染時間各組細胞衰老和功能的變化,以證實EPCs在體外培養過程中隨時間的延長,細胞衰老程度愈漸加重,功能明顯減退。
綜上所述,PINK1介導的線粒體自噬參與調節了EPCs的衰老和功能且起到了保護作用。這提示是否可以通過誘導PINK1介導的線粒體自噬來干預EPCs的衰老進程。但是由于自噬的發生是一把雙刃劍,一方面自噬清除損傷的蛋白質和細胞器,可維持細胞的生存,而另一方面自噬過度反而會降低細胞的功能,誘發細胞的死亡;因此,如何通過把握自噬的“適度”原則來干預細胞衰老,還需進一步的深入研究。

