“DMH+煙酸”復(fù)合體系的無氰預(yù)鍍銀工藝及性能研究
李智勇,王春霞,鄒俊文,劉軍
(1.江西昌河航空工業(yè)有限公司,江西南昌 333002;2.南昌航空大學(xué)材料科學(xué)與工程學(xué)院,江西南昌 330063;3.重慶立道新材料科技有限公司,重慶 401332)
銀擁有優(yōu)良的導(dǎo)電、導(dǎo)熱等性能,在裝飾、光學(xué)、生物、電子元件等[1]方面均有廣泛應(yīng)用。大多數(shù)無氰鍍銀的研究及應(yīng)用實例表明,由于銅的標(biāo)準(zhǔn)電極電位比銀要負,與鍍銀液接觸時會發(fā)生化學(xué)置換反應(yīng),而置換銀層與銅基體間結(jié)合疏松,如置換銀層上再鍍銀,導(dǎo)致整個銀層出現(xiàn)脫皮、起泡等。一般都需要進行鍍前預(yù)處理后才能鍍銀。鍍前預(yù)處理主要有三種方式[2]:汞齊化、浸銀、預(yù)鍍銀。汞齊化工藝對環(huán)境會造成嚴重污染,目前已被浸銀或預(yù)鍍銀工藝代替;浸銀工藝存在鍍層不均勻、暴露基體、對前處理要求苛刻等問題;預(yù)鍍銀工藝具有較強的分散能力和覆蓋能力,在基體表面生成致密、結(jié)合力好的鍍層[3]。
目前,工業(yè)上通常采用氰化物預(yù)鍍銀工藝。氰化物劇毒,操作環(huán)境惡劣,需要無氰鍍銀工藝取代氰化物。1997年,Asakawa T[4]申請了乙內(nèi)酰脲無氰鍍銀專利。2009年,肖文濤[5]在DMH鍍銀工藝的基礎(chǔ)上,降低主鹽和絡(luò)合劑的含量,研究了DMH預(yù)鍍銀工藝。5,5-二甲基乙內(nèi)酰脲作為銀的配位劑,可以與銀離子形成穩(wěn)定配位化合物,提高銀鍍層性能,溶液的pH對絡(luò)合劑的穩(wěn)定性、絡(luò)合形態(tài)及其電沉積獲取的金屬薄鍍層的性能有著決定性作用[6]。
本文以DMH和煙酸復(fù)合體系的無氰預(yù)鍍銀為基礎(chǔ),分別在預(yù)鍍銀液pH為9、10、11的條件下,利用電化學(xué)測試分析pH對DMH-Ag絡(luò)合離子電沉積過程的影響,用電沉積法制備鍍銀層,研究pH對預(yù)鍍銀后鍍銀層結(jié)合力、抗變色性、微觀形貌的影響。研究結(jié)果對改進DMH預(yù)鍍銀體系和調(diào)控銀鍍層性能方面,具有重大意義。
1 實驗
1.1 基材
陽極材料為純銀板,尺寸為80 mm×80 mm×10 mm;陰極材料為紫銅片,尺寸為50 mm×50 mm×1 mm。
1.2 工藝流程
工藝流程為:采用400、600、800和1000目砂紙逐級打磨→去離子水洗→堿性除油→去離子水洗→酸洗→去離子水洗→活化→去離子水洗→超聲清洗→干燥→預(yù)鍍銀→去離子水洗→硫代硫酸鹽鍍銀→去離子水洗→干燥。
1.3 無氰預(yù)鍍銀的配方和工藝條件
預(yù)鍍銀液以AgNO3為主鹽,DMH和煙酸作為復(fù)合配位劑,碳酸鉀作為導(dǎo)電鹽。具體配方:AgNO35 g/L、DMH 80 g/L、煙酸30 g/L。工藝條件為:pH 9~11(用KOH溶液調(diào)整)、電流密度0.1 A/dm2、溫度20~30°C、時間1~2 min。
1.4 性能表征
利用RST-5200型電化學(xué)工作站測量電化學(xué)阻抗譜、開路電位-時間(E-t)曲線以及陰極極化曲線。采取三電極體系(工作電極為銅電極,工作面積為1.0 cm2,參比電極為飽和甘汞電極,對電極為鉑電極),工作液為“DMH+煙酸”體系預(yù)鍍銀液。根據(jù)ASTMD3359,將試樣進行附著力測試,再采用重慶奧特光學(xué)顯微鏡觀察鍍銀層的是否出現(xiàn)起皮、剝落等現(xiàn)象。根據(jù)HB5051—1993標(biāo)準(zhǔn)進行抗硫性測試:在1%硫化鈉溶液中,溫度控制在15~25℃,浸漬30 min;抗高溫性能測試:在200℃下保溫2 h,觀察鍍層變色情況。
2 結(jié)果與討論
2.1 預(yù)鍍銀液電化學(xué)性質(zhì)的研究
2.1.1E-t曲線
圖1(a)是銅電極在不同pH預(yù)鍍銀液中的開路電位隨時間變化關(guān)系。如圖1(a)所示,在pH=9預(yù)鍍銀液中,開路電位在-80 mV左右保持穩(wěn)定;在pH=10和pH=11的預(yù)鍍銀液中,開路電位在-180 mV左右保持穩(wěn)定。當(dāng)pH為9~11時,鍍液中DMH和煙酸與銀離子形成穩(wěn)定狀態(tài)的配合物,減小銅和銀的平衡電位差,抑制了銅電極發(fā)生置換銀反應(yīng),對提高鍍層結(jié)合力有決定性作用。
2.1.2 陰極極化曲線
對不同pH預(yù)鍍銀液進行線性掃描伏安測試,掃描速率為50 mV/s,結(jié)果如圖1(b)所示。在電位向負方向掃描時,極化電流在-1.0 V后才開始出現(xiàn)明顯增大,電極表面發(fā)生銀的電沉積反應(yīng)。隨著pH減小,DMH與銀離子配合物更加穩(wěn)定,銀絡(luò)合離子在電極上還原所需的活化能增大,沉積電位負移,晶核的形核速率增大[7-8],極化率dφ/dj增大,整體反應(yīng)的極化程度增大,陰極表面距離陽極遠端與近端的電流密度差值減小,使得各處的實際電流密度趨于均勻,預(yù)鍍液的分散能力和覆蓋能力提高。pH=9時最有利于得到更加細致、均勻平整的銀鍍層。
2.1.3 循環(huán)伏安曲線
分別取pH為9、10、11的預(yù)鍍銀液,利用電化學(xué)工作站在20 mV/s掃速下測試循環(huán)伏安曲線,結(jié)果如圖1(c)所示。由圖可知,在循環(huán)伏安曲線中,電位先由正向負掃描,從-0.1 V向陰極負向掃描時,這個區(qū)域電流很小,此時可以認為無明顯的陰極還原反應(yīng)發(fā)生。隨著電勢的負移,當(dāng)電位負向掃描到達-1.5 V時,陰極電流迅速向更負的方向增大,可以看到有一個明顯的陰極還原峰存在,此時對應(yīng)的是銀與DMH的配位化合物的還原反應(yīng)。反向掃描時,回掃電流曲線與陰極負向掃描時的電流曲線形成抗感應(yīng)性電流環(huán),說明此時沉積過程受傳質(zhì)過程控制。隨著溶液的pH增大,銀電沉積電位正移,不同pH條件下均出現(xiàn)抗感應(yīng)性電流環(huán),表明在不同pH下銀在銅電極表面存在過電位的成核過程[9]。
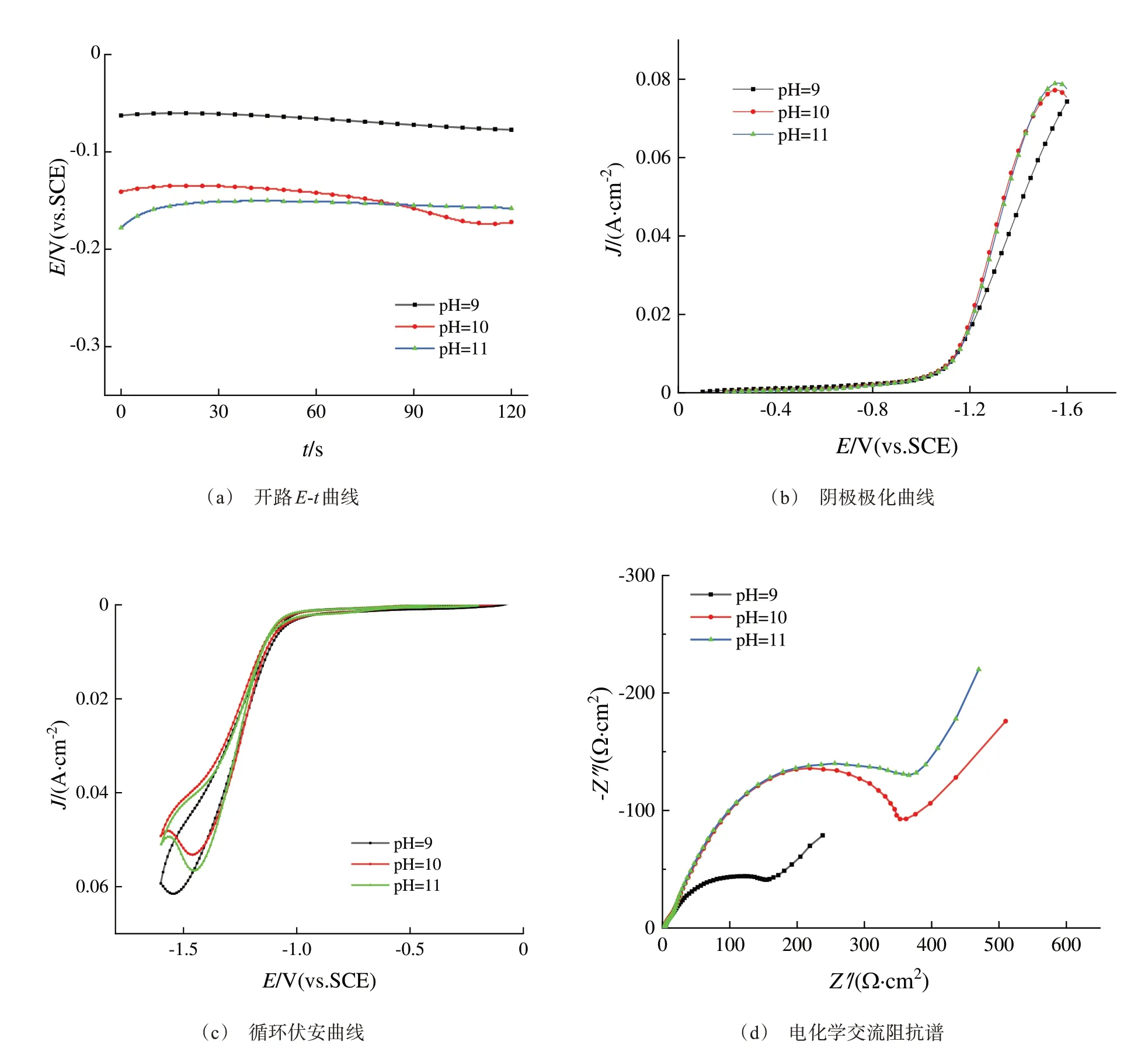
圖1 不同pH下預(yù)鍍銀液的電化學(xué)曲線Fig.1 Electrochemical curves of pre-silver plating solution at different pH
2.1.4 電化學(xué)阻抗譜
圖1(d)是不同pH的預(yù)鍍銀液中的交流阻抗譜。在高頻端的曲線都是一條半圓形狀的容抗弧,由法拉第電流引起的雙電層電容和電荷轉(zhuǎn)移引起的反應(yīng)電阻組成;在低頻端,曲線從半圓轉(zhuǎn)變成Warburg擴散阻抗的直線,則表現(xiàn)出液相擴散步驟控制的特征[10]。當(dāng)鍍液的pH發(fā)生變化時,陰極過程的控制步驟并不會發(fā)生改變,pH=9預(yù)鍍液體系的電荷轉(zhuǎn)移阻抗小于pH=10和pH=11的預(yù)鍍液體系的電荷轉(zhuǎn)移阻抗,從而增強了向陰極表面的離子傳輸,DMH與銀離子的配合物更容易吸附在電極表面的成核活性點上,激活銀絡(luò)合離子在電極表面發(fā)生成核反應(yīng),使銀離子在電極表面快速沉積形成致密的鍍層。
2.2 鍍層結(jié)合力的分析
銅基材在不同pH預(yù)鍍液中預(yù)鍍后,分別施鍍8~12 μm的銀鍍層,根據(jù)GB5270—2005劃線和劃格法進行附著力測試,如圖2所示。DMH和銀離子形成配合物的穩(wěn)定狀態(tài),銅電極在預(yù)鍍液中不發(fā)生置換反應(yīng)。預(yù)鍍時銀絡(luò)合離子吸附在陰極表面作為電結(jié)晶的形核質(zhì)點,提高形核率[11],銅基體在預(yù)鍍液中快速形成致密的銀層。pH為9~11時鍍層在格子邊緣基本沒有剝落,符合ASTMD3359標(biāo)準(zhǔn)。

圖2 不同pH下預(yù)鍍后鍍銀層經(jīng)附著力測試后的金相顯微圖Fig.2 Metallographic micrograph of silver coating after pre-silver plating at different pH after adhesion test
2.3 鍍層微觀形貌的分析
在不同pH條件下的預(yù)鍍液中預(yù)鍍銀后,分別在鍍銀液中施鍍40 min,獲取8~12 μm厚的銀鍍層,采用金相顯微鏡觀察表面微觀形貌,如圖3所示。不同pH條件下,預(yù)鍍銀后獲取的銀鍍層表面都呈現(xiàn)為凹凸不平的棱錐狀,pH不同時,銀的電結(jié)晶過程導(dǎo)致預(yù)鍍銀層的組織結(jié)構(gòu)不同,影響了鍍銀表面沉積初期的選擇性和沉積速率[12],從而獲得不同結(jié)構(gòu)的鍍銀層。pH過高還會引起析氫,影響銀沉積過程,導(dǎo)致鍍銀層表面變粗糙。pH=9預(yù)鍍液中,銀沉積層的晶粒比其他條件下銀沉積層更均勻、細致。

圖3 不同pH下預(yù)鍍后鍍銀層的表面形貌圖Fig.3 Surface morphology of silver coating after pre-plating at different pH
2.4 pH對鍍銀層抗變色性能的影響
在不同pH條件下進行預(yù)鍍銀后,分別在鍍銀液中施鍍40 min,獲取8~12 μm厚的銀鍍層,圖4是鍍銀層在200℃下烘烤2 h后的照片。圖5是鍍層在1 %的硫化鈉溶液中,常溫條件下浸漬30 min后的照片。在經(jīng)過高溫測試時,pH=9時預(yù)鍍銀后,鍍銀層表面基本沒有發(fā)生變色,pH=10和pH=11時鍍層表面局部變黃,這是因為在高溫的環(huán)境中,銅原子會通過擴散、滲透等方式到鍍銀層表面,導(dǎo)致銀層變黃。pH=9時,預(yù)鍍銀層更致密,分散性好,銀層孔隙率更低,有效地阻礙了銅原子向銀層表面擴散。

圖4 pH對鍍銀層抗高溫性能的影響Fig.4 Effect of pH on high temperature resistance of silver coating

圖5 pH對鍍銀層抗硫性能的影響Fig.5 Effect of pH on sulfur resistance of silver coating
對pH=9~11條件下預(yù)鍍銀后的鍍銀層進行抗硫測試;在1 %硫化鈉溶液中,浸漬30 min,均未發(fā)生變色,抗硫性能都滿足HB5051—1993的要求。說明預(yù)鍍銀后鍍層晶粒細小、結(jié)構(gòu)致密且非常穩(wěn)定,晶粒的緊密堆積可以有效隔絕腐蝕介質(zhì)和水分子在間隙處富集,阻礙了硫和銀的反應(yīng)[14]。
3 結(jié)論
(1)采用“DMH+煙酸”復(fù)合體系的無氰預(yù)鍍銀液,可使后續(xù)鍍銀層與銅基材具有良好的結(jié)合力和優(yōu)異的抗硫性。
(2)采用“DMH+煙酸”復(fù)合體系的無氰預(yù)鍍銀液,在pH為9~11時,銅電極在預(yù)鍍銀液中開路電位較為穩(wěn)定,其中pH為9時電位最正,穩(wěn)定性最好,鍍液陰極極化最強,分散性能最好。
(3)pH=9時,預(yù)鍍后的鍍銀層更加均勻細致,施鍍8~12 μm的銀鍍層在200℃下烘烤2 h,銀層不變色。

