PD-1 在預測卵巢癌患者預后中的作用
王洋 孫娜 鞠策
卵巢癌是臨床上女性常見的一種惡性腫瘤,對于女性的生命健康與心理健康造成嚴重影響[1]。當前,對卵巢癌常用的治療方法是手術治療,并在術后對患者進行經腹腔灌注化療,通過手術能夠將患者的病灶清除,在手術之后應用化療能夠清除患者術中擴散的腫瘤細胞,減少復發率,提高生存率。研究發現[2],卵巢癌免疫逃逸機制和患者的預后具有一定相關性,因此,免疫治療成為了卵巢癌的新型治療方法。目前多項研究發現,程序性死亡配體2(PD-L2)和程序性死亡配體1(PD-L1)與卵巢癌的發生、發展具有一定相關性,可以考慮作為卵巢癌的新治療靶點,但是對于程序性死亡受體在預測卵巢癌患者預后中的作用尚無明確定論[3]。因此,本研究選取本院2019 年1 月~2020 年1 月收治的70 例卵巢癌患者及70 例良性卵巢腫瘤患者作為研究對象,探討PD-1 在預測卵巢癌患者預后中的作用,具體報告如下。
1 資料與方法
1.1 一般資料 選取本院2019 年1 月~2020 年1 月收治的70 例卵巢癌患者作為研究對象,并作為惡性組。納入標準:所有患者經過病理學檢查確診為卵巢癌[4];對本研究知情并簽署同意書;治療方式為腫瘤細胞減滅術或根治手術,并在手術中取得腫瘤組織標本。排除標準:存在嚴重臟器功能障礙的患者;不能配合隨訪的患者;合并其他惡性腫瘤的患者。另選取70 例同期良性卵巢腫瘤患者作為良性組。惡性組患者年齡45~72 歲,平均年齡(55.25±4.55)歲;病程5 個月~2 年,平均病程(1.24±0.25)年。良性組患者年齡48~70 歲,平均年齡(56.22±3.51)歲;病程6 個月~3 年,平均病程(1.28±0.67)年。兩組患者的一般資料比較,差異無統計學意義(P>0.05),具有可比性。對惡性組患者進行1 年隨訪,根據預后結果分為死亡組(17 例)和存活組(53 例)。
1.2 方法 應用免疫組化檢測良性組患者良性上皮性卵巢腫瘤組織和惡性組患者上皮性卵巢癌組織的PD-1表達水平,具體方法為:主要應用免疫組織化學原理,利用化學標記顯示,從而分析不同組織中PD-1 的表達水平。并在顯微鏡下觀察良性組和惡性組卵巢組織切片染色情況,以400 倍視野,根據染色強度和染色陽性細胞進行綜合評分。染色強度評分:棕褐色為3 分,棕黃色為2 分,淡黃色為1 分,無色為0 分。陽性細胞數>75%為4 分,50%~75%為3 分,25%~49%為2 分,5%~24%為1 分,<5%為0 分。陽性細胞數與染色強度評分乘積為總積分,以此判定PD-1 蛋白陽性情況,其中9~12 分為強陽性(+++),5~8 分為陽性(++),2~4 分為弱陽性(+),0~1 分為陰性(-)。并收集兩組患者的性別、年齡等人口學資料和FIGO 分期、淋巴結轉移以及組織分化程度等病理學資料。
1.3 觀察指標 對比惡性組與良性組患者PD-1 蛋白陽性表達率,存活組與死亡組患者臨床特征;并采用Logistic 回歸分析卵巢癌預后的影響因素。
1.4 統計學方法 采用SPSS23.0 統計學軟件進行統計分析。計量資料以均數±標準差(±s)表示,采用t檢驗;計數資料以率(%)表示,采用χ2檢驗;采用Logistic 回歸分析卵巢癌預后的影響因素。P<0.05 表示差異具有統計學意義。
2 結果
2.1 惡性組與良性組患者PD-1 蛋白陽性表達率對比惡性組患者PD-1 蛋白陽性率62.86%明顯高于良性組的28.57%,差異具有統計學意義(P<0.05)。見表1。
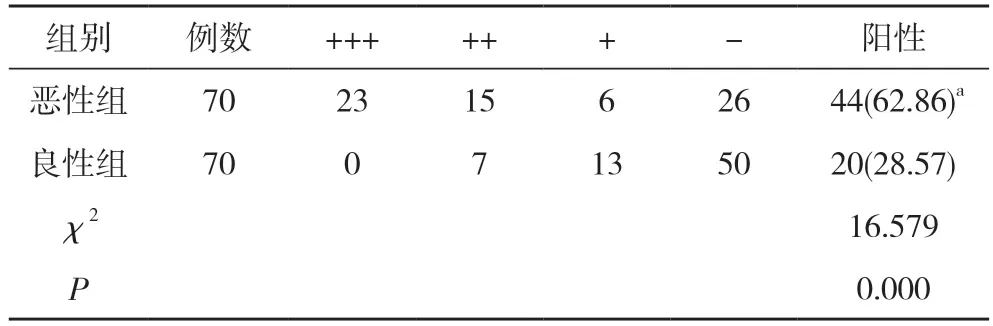
表1 惡性組與良性組患者PD-1 蛋白陽性表達率對比[n,n(%)]
2.2 存活組與死亡組患者臨床特征對比 存活組與死亡組患者年齡、絕經情況對比,差異無統計學意義(P>0.05);存活組與死亡組患者FIGO 分期、淋巴結轉移情況、組織分化程度、PD-1 表達情況對比,差異具有統計學意義(P<0.05)。見表2。
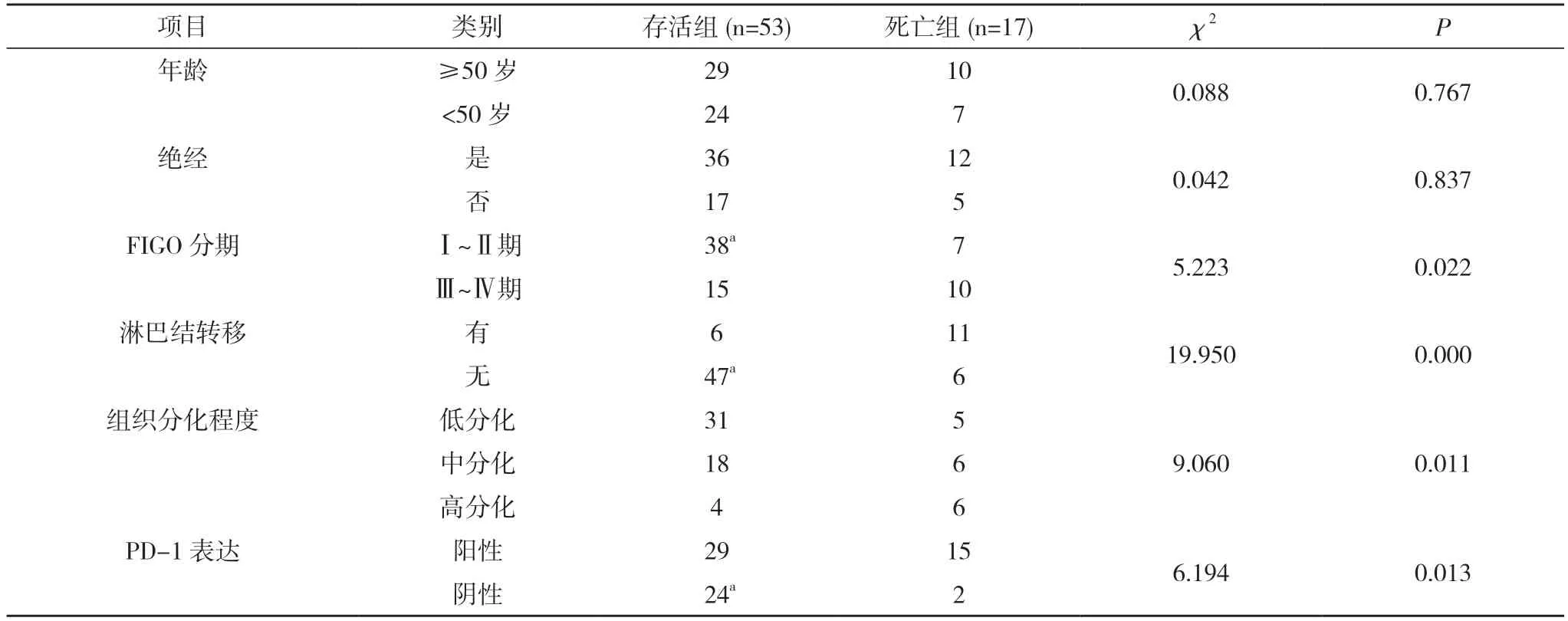
表2 存活組與死亡組患者臨床特征對比(n)
2.3 卵巢癌預后的多因素Logistic 回歸分析 對上述單因素分析中P<0.05 的指標進行賦值:FIGO 分期Ⅲ~Ⅳ期為1,Ⅰ~Ⅱ期為0;淋巴結轉移為1,未轉移為0;組織分化程度高分化為2,中分化為1,低分化為0;PD-1 表達陽性為1,陰性為0。Logistic 回歸分析結果顯示,淋巴結轉移情況與PD-1 表達情況為卵巢癌預后獨立危險因素(P<0.05)。見表3。
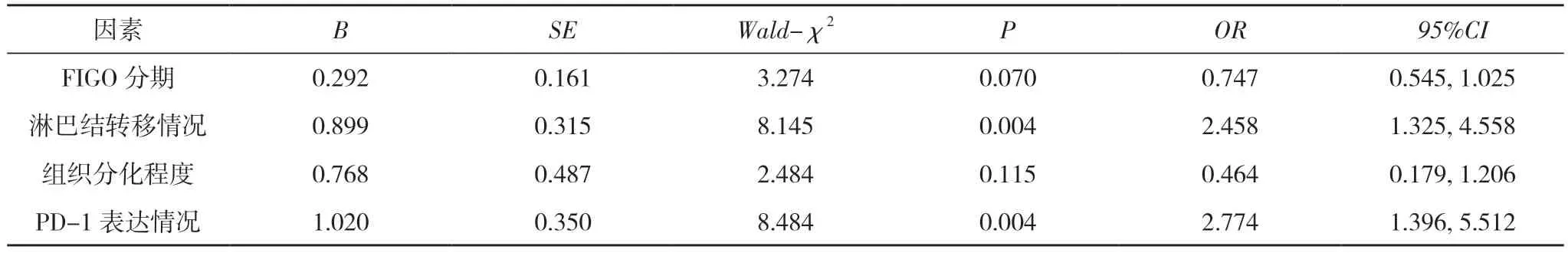
表3 卵巢癌預后的多因素Logistic 回歸分析
3 討論
卵巢癌患者隨著疾病的發展,待出現癥狀后可能已經處于晚期。雖然通過手術與化療等治療方案能夠提升患者遠期生存率,但是不能完全根治,因此改善卵巢癌預后的關鍵在于提升患者的早期檢出率與早期預后判斷[5]。因此,臨床上需要對卵巢癌進行穩健的診斷檢測,以確保對卵巢癌患者進行迅速、正確的治療。PD-1 又稱為分化簇279,在腫瘤領域引發廣泛關注。最初PD-1 是1992 年從藥物處理小鼠雜交瘤細胞與造血祖細胞中克隆出來的,主要參與細胞凋亡過程[6]。PD-1 在NK 細胞、單核細胞、B 細胞以及外周活化的T 細胞等多種免疫細胞中表達[7]。因此,本研究探討了PD-1 在預測卵巢癌患者預后中的作用,希望能夠為卵巢癌的診斷與靶向治療提供參考。
本研究結果表明,惡性組患者PD-1 蛋白陽性率62.86%明顯高于良性組的28.57%,差異具有統計學意義(P<0.05)。這是因為,當PD-1 與其配體PD-L1 結合時,免疫受體酪氨酸基的開關基序區域被磷酸化,激活細胞內信號通路,導致免疫細胞被激活,減少免疫細胞分泌抗體與細胞因子,甚至將免疫細胞消耗殆盡,形成免疫抑制。但是目前對卵巢癌中PD-1 表達的相關研究較少,有研究發現[8],PD-1 表達與腫瘤的分化程度、淋巴結節轉移具有密切關系;本研究結果顯示,存活組與死亡組患者年齡、絕經情況對比,差異無統計學意義(P>0.05);存活組與死亡組患者FIGO 分期、淋巴結轉移情況、組織分化程度、PD-1 表達情況對比,差異具有統計學意義(P<0.05)。由此證明,FIGO 分期、淋巴結轉移情況、組織分化程度、PD-1 表達情況可能與卵巢癌的預后有關。有研究發現[9],上皮卵巢癌組織中PD-1陽性表達率與淋巴結轉移和FIGO分期相關。本研究結果與其研究相似。由此表明,PD-1 與卵巢癌患者的生存期密切相關,主要是PD-L1 多在巨噬細胞、T 細胞和B 細胞上呈現多表達,與PD-1 結合后可促使免疫逃逸,促進T 細胞的增殖與分化,因此PD-1 陽性表達率越高,患者的生存期越長;Logistic 回歸分析結果顯示,淋巴結轉移情況與PD-1 表達情況為卵巢癌預后獨立危險因素(P<0.05)。有研究[10]使用Kaplan-Meier 法對卵巢癌患者進行分析研究,發現PD-1 陰性表達患者生存期更長,與本研究結果相符。因此證明,PD-1 與卵巢癌患者生存率具有明顯關系。PD-L1 在活化的巨噬細胞和T 細胞表面與PD-1 結合后出現免疫逃逸,PD-1 陽性的腫瘤細胞與T 細胞結合之后,抑制T 細胞增殖與分化,形成抗腫瘤效應[11-13]。
綜上所述,卵巢癌患者組織中PD-1表達明顯增高,且PD-1 表達與卵巢癌患者病理特征中的淋巴結轉移情況具有一定關系,而且是患者預后的獨立危險因素。

