一步法構建雞傳染性貧血病毒感染性克隆
陳俊成 , 袁 栩 , 馬子月 , 李曉齊 , 曹 紅 , 王永強 , 鄭世軍 , 高 麗
(中國農業大學動物醫學院農業農村部動物流行病學重點實驗室 , 北京 海淀 100193)
雞傳染性貧血(Chicken infectious anemia,CIA)是由雞傳染性貧血病毒(Chicken infectious anemia virus,CIAV)引起的一種禽免疫抑制病[1]。雛雞感染CIAV后胸腺細胞和骨髓中成紅細胞被破壞,造成嚴重的免疫抑制和貧血[2-3],這不僅會降低疫苗對雛雞的保護作用,導致雛雞死亡率增高,還會降低飼料轉化率以及肉雞的生產性能,對家禽產業產生巨大的經濟影響[4-5]。CIAV屬于指環病毒科 (Anelloviridae) 環病毒屬 (Gyrovirus),病毒基因組為環狀單鏈DNA,編碼3種病毒蛋白:VP1、VP2和VP3。VP1是唯一的結構蛋白,可結合病毒中的ssDNA[6]; VP2是一種雙特異性蛋白質磷酸酶,在病毒粒子組裝過程中主要起到腳手架蛋白的作用[7]; VP3又稱凋亡素,可誘導淋巴細胞與骨髓造血母細胞凋亡,最終導致雞出現貧血和免疫抑制[8]。
反向遺傳技術已廣泛應用于各種DNA病毒,該技術通過將DNA病毒的全長基因組克隆入質粒載體從而獲得感染性克隆,然后將感染性克隆轉染細胞拯救獲得重組病毒[9-10]。由于CIAV是環狀病毒,直接將全基因組DNA插入質粒后轉染細胞并不能得到重組病毒。目前多先通過分段獲得CIAV基因組,連接得到線性全長基因組后,繼而連接載體并通過酶切環化得到病毒環狀基因組[11]; 此外,還可在載體中加入重復的兩端CIAV基因組[12]。但上述方法需要進行多次酶切、連接、單克隆鑒定、測序等復雜程序,耗時較長。本試驗通過優化PCR反應條件,一次性擴增出CIAV全基因組,并通過引物設計使CIAV基因組兩端帶有與載體相同酶切位點的同源臂,使用同源重組技術將病毒基因組嵌合入載體中,提高了CIAV感染性克隆構建的效率,為進一步研究CIAV的致病機制和研發新型疫苗提供了試驗基礎。
1 材料與方法
1.1 毒株、菌株和質粒 CIAV Cux-1毒株,由北京市農林科學院畜牧獸醫研究所楊兵研究員饋贈;質粒pcDNA3.1,由本實驗室保存;雞淋巴瘤細胞MDCC-MSB1,購自美國菌種保藏中心(American Type Culture Collection,ATCC);大腸桿菌感受態菌株Trans-T1,購自北京擎科生物科技有限公司。
1.2 主要試劑 DNA 凝膠回收試劑盒和無內毒素質粒小提試劑盒,均購自廣州美基生物科技有限公司;病毒基因組DNA/RNA快速提取試劑盒,購自北京艾德萊生物科技有限公司;LATaq酶、限制性內切酶和Solution I連接酶,均購自日本 TaKaRa公司;2×Basic Assembly Mix(同源重組酶),購自北京全式金生物技術有限公司;瓊脂糖,購自北京盛旭百川生物科技有限公司;100×非必需氨基酸和胎牛血清,均購自美國 Gibco 公司;低熔點瓊脂,購自北京博奧拓達科技有限公司;核酸分子量標準(DNA Marker),購自北京中科瑞泰生物科技有限公司;核酸染料 Gold View、HRP標記山羊抗小鼠IgG、FITC 標記山羊抗鼠 IgG,均購自北京鼎國生物技術有限責任公司;CIAV VP2 3D7株單克隆抗體,由本實驗室制備。
1.3 主要儀器 電泳成套設備,北京東方瑞利科技有限公司;臺式電子天平,德國Sartorius公司;高壓蒸氣自動滅菌器,日本電氣公司;-80 ℃超低溫冰箱,美國Forma Scientific公司;低溫冷凍高速離心機,德國Eppendorf 公司;凝膠成像分析系統,美國Alpha公司;超凈工作臺,中國蘇州凈化設備廠;透射電子顯微鏡,日本Hitachi 公司;CO2培養箱,美國Thermo公司;倒置顯微鏡,中國重光公司;Bio-Rad電穿孔儀,美國伯樂公司。
1.4 試驗方法
1.4.1 DNA提取 將CIAV Cux-1株病毒接種MDCC-MSB1細胞,用含有2%胎牛血清的RPMI 1640培養基維持培養24 h,收取細胞與細胞上清并反復凍融3次,經3 000 g離心2 min后取上清,用病毒基因組DNA/RNA快速提取試劑盒提取DNA。
1.4.2 CIAV全長基因組的克隆 根據CIAV Cux-1株基因序列 (GenBank登錄號:M55918.1)及 pcDNA3.1質粒多克隆位點設計帶有同源臂和酶切位點的引物(表1),并由北京擎科生物科技有限公司合成。以病毒基因組DNA為模板,以CIAV-AflⅡ-F/R為引物,用LATaq酶進行PCR擴增。PCR反應體系:2×High Fidelity Master Mix 25 μL,模板 5 μL,上、下游引物各 2 μL,ddH2O 13.5 μL,DMSO 2.5 μL;PCR反應條件:98 ℃預變性2 min;98 ℃變性10 s,58 ℃退火15 s,72 ℃延伸30 s,共33個循環;72 ℃終延伸5 min。用DNA 凝膠回收試劑盒對PCR產物回收和純化。
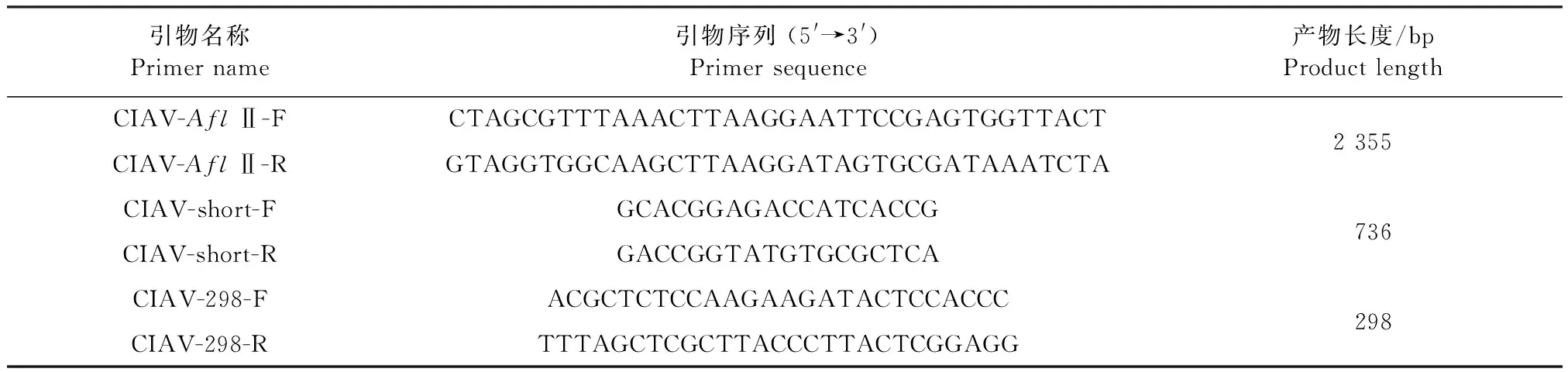
表1 病毒基因組擴增引物(基于Cux-1毒株)Table 1 Primers for viral genome amplification (based on Cux-1 strain)
1.4.3 嵌合CIAV Cux-1株全長基因組重組質粒的構建 用AflII內切酶酶切pcDNA3.1載體,回收純化酶切后產物。應用同源重組酶將病毒基因組DNA與線性化pcDNA3.1載體同源重組,從而將病毒基因組DNA全長嵌合入載體中。同源重組體系:2×Basic Assembly Mix 5 μL,目的基因 3.5 μL,線性化載體 1.5 μL;反應條件:50 ℃ 30 min,4 ℃保存。同源重組產物轉化感受態細胞Trans-T1,進一步通過菌落PCR篩選陽性克隆并進行測序鑒定,將測序正確的質粒命名為pcDNA3.1-Cux-1。
1.4.4 CIAV全長基因組的環化 對重組質粒pcDNA3.1-Cux-1 進行AflⅡ單酶切,酶切體系:AflⅡ限制性內切酶 1 μL,10×buffer 5 μL,重組質粒 2 μg,ddH2O補充至50 μL。得到線性化CIAV Cux-1株全基因組,其兩端攜帶有互補的黏性末端。酶切產物經回收和純化后,通過SolutionⅠ連接酶連接得到 CIAV Cux-1 環狀DNA。
1.4.5 重組病毒rCux-1的拯救 為區分重組病毒與親本病毒,將重組病毒命名為rCux-1。CIAV Cux-1環狀DNA電轉染 (220 V,10 ms)導入MDCC-MSB1細胞。轉染后細胞置于含10%胎牛血清、無抗生素的RPMI 1640培養基中,48 h后對細胞反復凍融3次,離心收獲上清液并通過0.45 μm濾器過濾,將濾液按1∶10接種MDCC-MSB1細胞進行連續傳代。
1.4.6 重組病毒rCux-1的鑒定
1.4.6.1 PCR鑒定 當病毒連續傳代至第3、4、5代時,通過病毒基因組DNA/RNA快速提取試劑盒提取病毒DNA,使用CIAV-298-F/R引物進行PCR擴增CIAVvp2保守區。
1.4.6.2 Western blot檢測VP2蛋白 當病毒連續傳代至第8代時,用RIPA裂解液裂解細胞收獲細胞總蛋白,經12% SDS-PAGE后轉印至PVDF膜,以CIAV VP2 3D7株單抗為一抗(1∶1 000),以HRP標記山羊抗小鼠IgG為二抗(1∶10 000);使用化學發光法進行曝光。
1.4.6.3 間接免疫熒光檢測VP2蛋白 當病毒連續傳代至第8代時,離心收集MDCC-MSB1細胞,并用0.01 mol/L PBS (pH 7.4)洗滌2次,每次1 min;以適量PBS重懸細胞,將細胞涂于載玻片,室溫干燥;用丙酮-乙醇(體積比為1∶1)4 ℃固定15 min;37 ℃、1% BSA封閉2 h;向細胞涂片滴加CIAV VP2 3D7株單抗稀釋液(1∶100),37 ℃孵育1 h;用PBS室溫洗滌3次,每次5 min;向細胞涂片滴加 FITC 標記山羊抗小鼠 IgG(1∶100),37 ℃孵育30 min;用PBS室溫洗滌3次,每次5 min;室溫干燥后在熒光顯微鏡下觀察。
1.4.7 重組病毒遺傳標志鑒定 將第9代病毒液根據病毒基因組DNA/RNA快速提取試劑盒說明書提取病毒DNA,通過CIAV-short-F/R引物進行PCR擴增,得到的產物進行AflⅡ酶切鑒定。
1.4.8 建立病毒拷貝數定量PCR(qPCR)標準曲線 計算包含CIAVvp2保守區的重組質粒摩爾濃度,以10倍濃度梯度稀釋的質粒作為模板,使用CIAV-298-F/R引物進行qPCR擴增,以Ct值對應質粒拷貝數作標準曲線。其公式為LogYCt=LogX+Ct×Log(1+E),其中YCt為第Ct個循環后擴增產物的量,X為原模板數,E為擴增效率,Ct為擴增循環數。
1.4.9 CIAV復制曲線的測定 將重組病毒與親本病毒按照感染復數(MOI)為1分別感染處于對數生長期的MDCC-MSB1細胞,在感染后的0、6、12、24 h 和48 h反復凍融裂解細胞,并離心收獲上清液,保存于-80 ℃。提取病毒DNA,進行qPCR擴增,通過1.4.8建立的標準曲線計算CIAV拷貝數,繪制病毒生長動力學曲線。qPCR反應體系:2×M5 HiPer SYBR Premix 10 μL,模板 2 μL,上游引物0.4 μL,下游引物0.4 μL,ddH2O 7.2 μL;qPCR反應條件:98 ℃預變性30 s;95 ℃變性10 s,60 ℃退火20 s,共40個循環;熔解曲線:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s;50 ℃降溫30 s。
1.5 CIAV感染性克隆構建流程 CIAV感染性克隆構建流程如圖1所示。
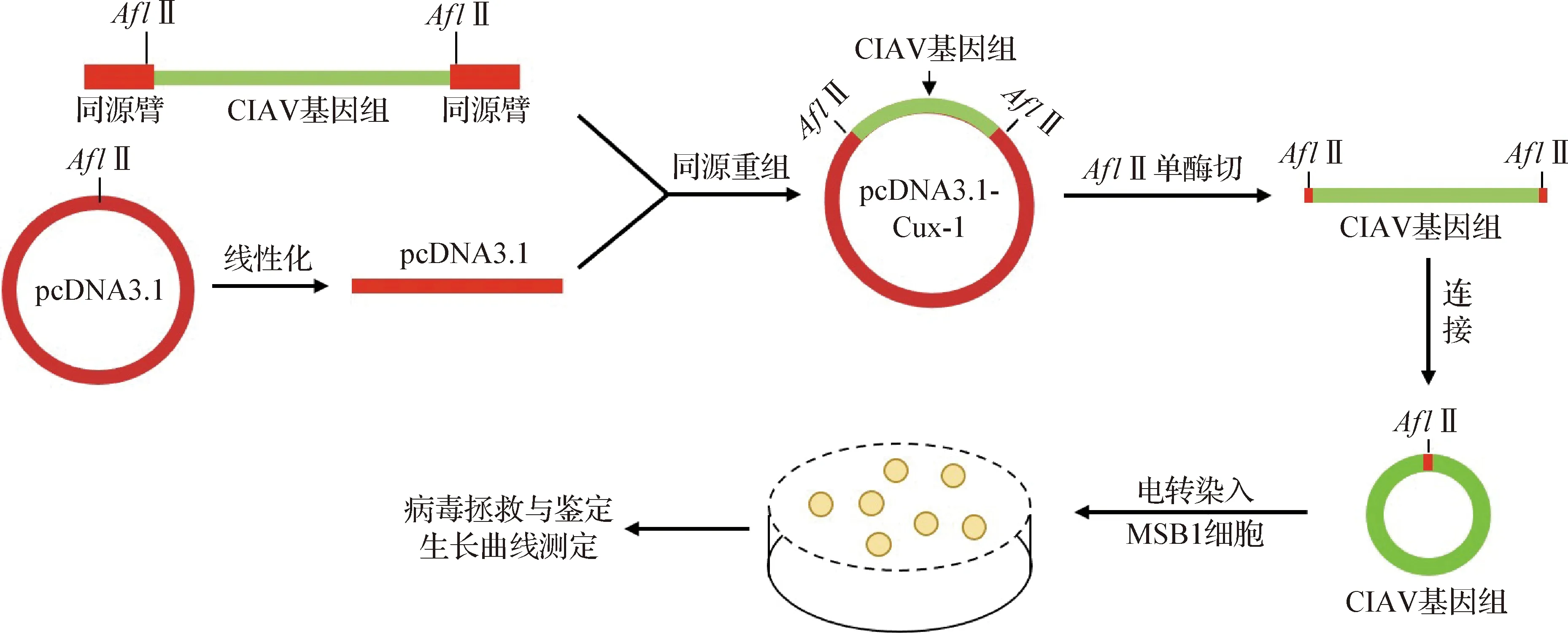
圖1 感染性克隆構建流程Fig.1 Flow chart of infectious clone construction
2 結果
2.1 CIAV全長基因組的克隆 以CIAV Cux-1毒株感染MDCC-MSB1后提取的DNA為模板,采用同源臂擴增引物CIAV-AflⅡ-F/R經PCR擴增獲得兩端帶有同源臂的CIAV基因組,片段大小為2 355 bp,與預期大小一致(圖2A)。
2.2 pcDNA3.1-Cux-1重組質粒的構建與鑒定 pcDNA3.1載體經AflⅡ限制性內切酶單酶切后線性化(圖2B),與帶有同源臂的CIAV基因組進行同源重組,轉化后挑取測序正確的質粒,命名為pcDNA3.1-Cux-1。測序結果顯示,除兩端帶AflII酶切位點外,質粒pcDNA3.1-Cux-1中插入的CIAV基因序列與親本病毒完全相同。
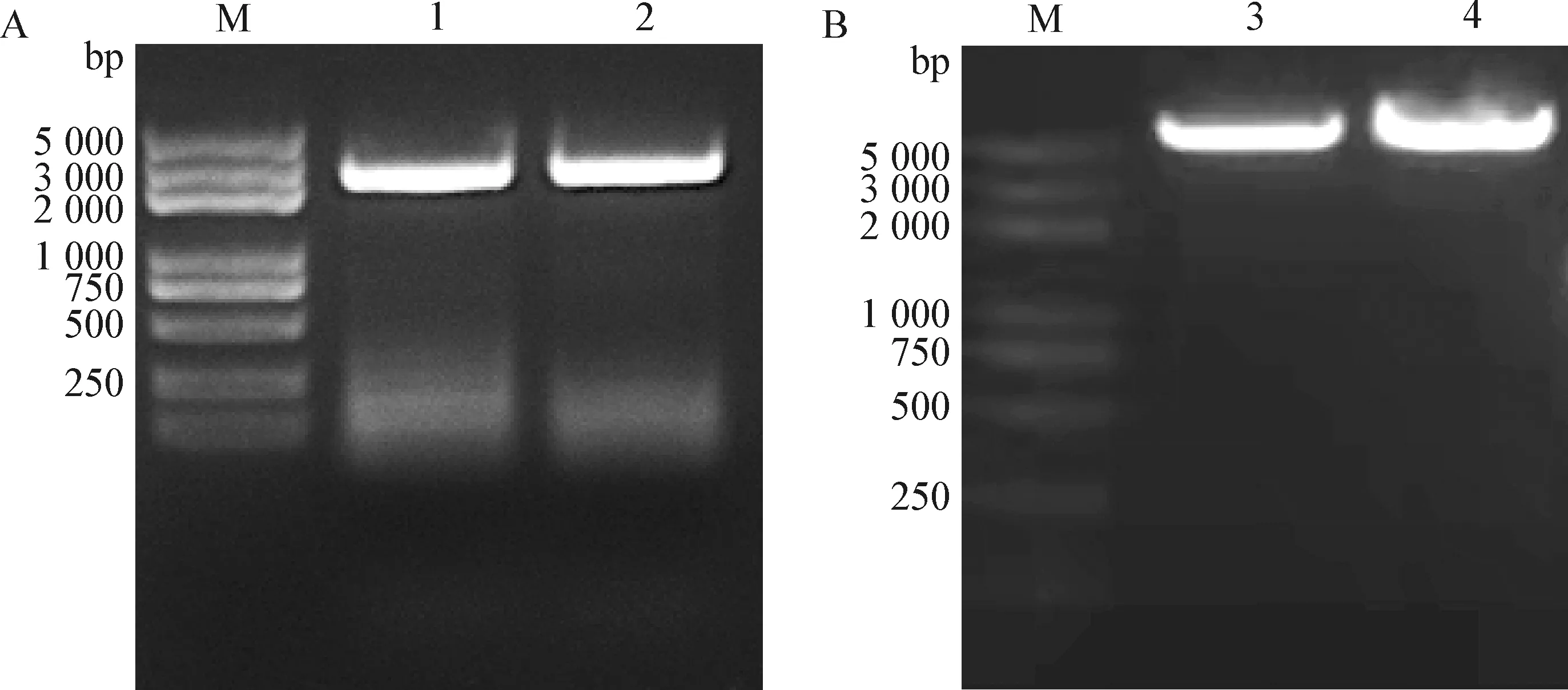
圖2 CIAV Cux-1全長基因組PCR擴增(A)與pcDNA3.1載體線性化(B)Fig.2 PCR amplification of CIAV Cux-1 full-length genome (A) and linearization of pcDNA3.1 vector (B)M:DNA標志物(DL2 000 plus); 1~2:Cux-1毒株樣品; 3~4:pcDNA3.1載體經Afl Ⅱ限制性內切酶酶切產物M:DL2 000 plus DNA Marker; 1-2:Cux-1 strain samples; 3-4:pcDNA3.1 vector digested by Afl Ⅱ restriction endonuclease
2.3 CIAV環狀全長基因組的構建 利用AflⅡ限制性核酸內切酶位點將CIAV全長基因組從pcDNA3.1-Cux-1質粒上切割下來,電泳條帶分別為2 350 bp和5 500 bp左右(圖3),與預期大小一致。回收并純化2 350 bp左右的條帶,通過Solution Ⅰ 連接酶將線性DNA環化,得到CIAV Cux-1環狀基因組。
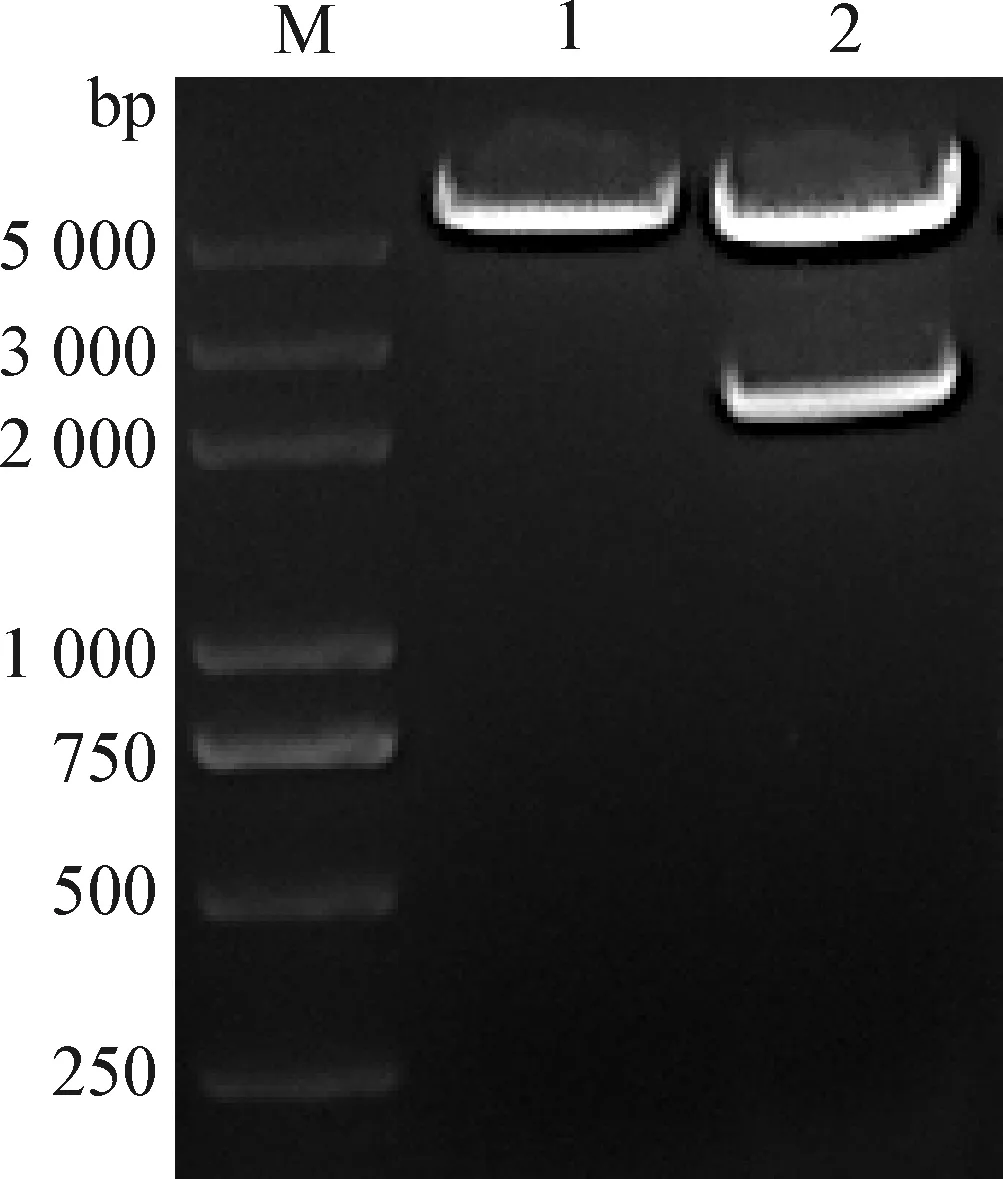
圖3 CIAV全長基因組的環化Fig.3 Cyclization of full-length CIAV genomeM:DNA標志物(DL2 000 plus); 1:質粒pcDNA3.1酶切后樣品; 2:質粒pcDNA3.1-Cux-1酶切后樣品M:DL2 000 plus DNA Marker; 1:Plasmid pcDNA3.1 samples after enzyme digestion; 2:Plasmid pcDNA3.1-Cux-1 samples after enzyme digestion
2.4 重組病毒rCux-1的鑒定 將CIAV Cux-1環狀基因組通過電轉染方式導入MDCC-MSB1細胞,并進行連續傳代。通過PCR檢測第3、4、5代細胞,結果如圖4所示,病毒DNA均能被檢測到,表明病毒可進行傳代。將rCux-1傳至第8代時,Western blot檢測結果顯示,CIAV感染MDCC-MSB1細胞24 h后,親本病毒和重組病毒均能檢測到VP2蛋白,而對照細胞無法檢測到VP2蛋白(圖5),表明重組病毒rCux-1能夠正常表達蛋白。同時應用間接免疫熒光檢測細胞內VP2蛋白,結果顯示,親本病毒和重組病毒均可檢測到特異性的綠色熒光,而對照細胞無法檢測到特異性的綠色熒光(圖6)。
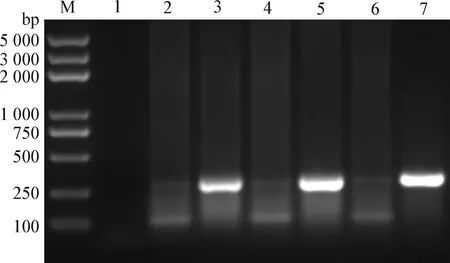
圖4 重組病毒的PCR鑒定Fig.4 PCR identification of the recombinant virusM:DNA標志物(DL2 000 plus); 1:空白對照; 2:陰性對照; 3:第3代重組病毒rCux-1; 4:陰性對照; 5:第4代重組病毒rCux-1; 6:陰性對照; 7:第5代重組病毒rCux-1M:DL2 000 plus DNA Marker; 1:Blank control; 2:Negative control; 3:3rd recombinant virus rCux-1; 4:Negative control; 5:4th recombinant virus rCux-1; 6:Negative control; 7:5th recombinant virus rCux-1

圖5 免疫印跡檢測病毒VP2蛋白Fig.5 Immunoblot detection of viral VP2 protein1:陰性對照; 2:親本病毒Cux-1; 3:重組病毒rCux-11:Negative control; 2:Parental virus Cux-1; 3:Recombinant virus rCux-1
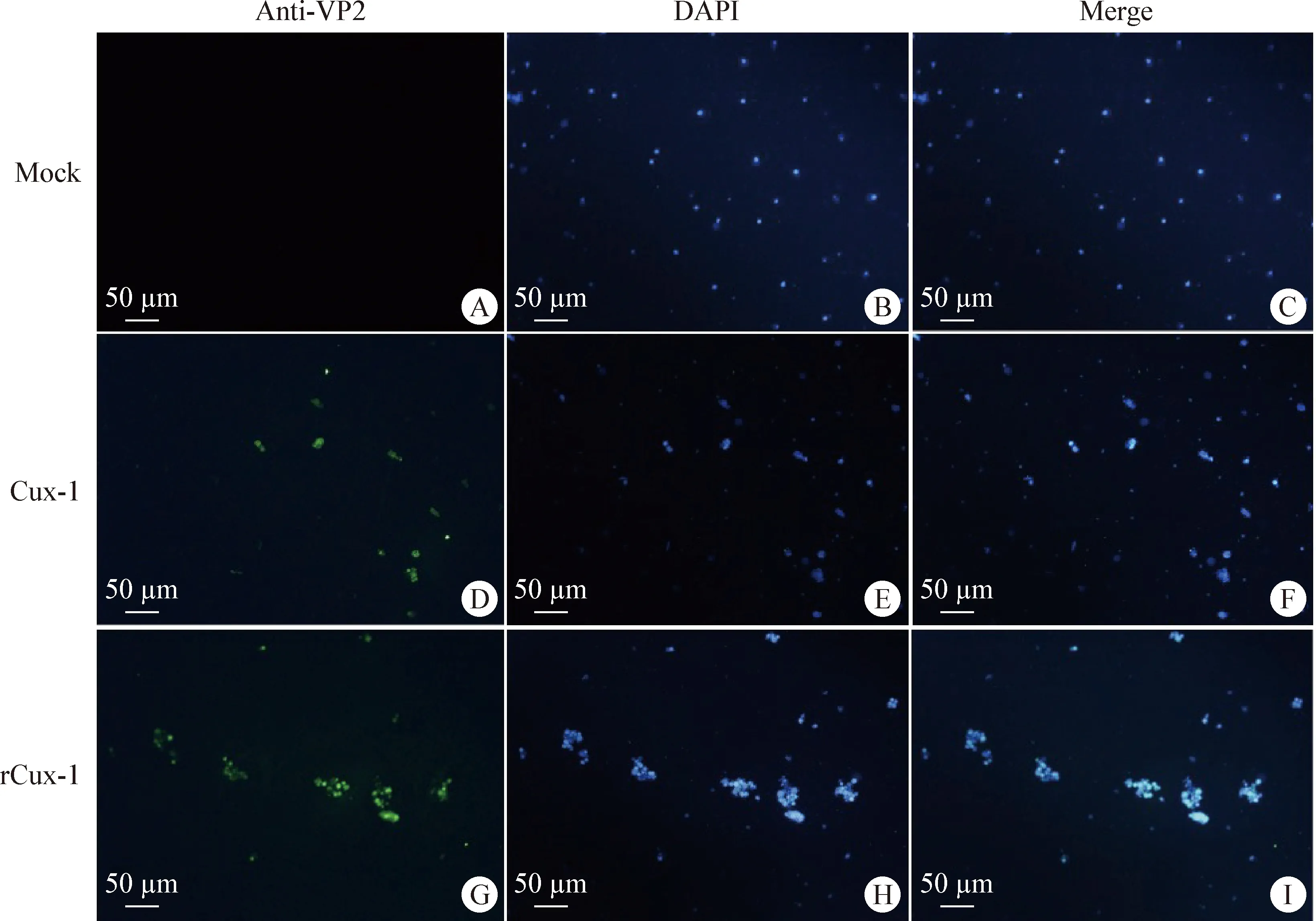
圖6 間接免疫熒光檢測細胞內VP2蛋白Fig.6 Indirect immunofluorescence detection of intracellular VP2 proteinA~C:陰性對照; D~F:親本病毒Cux-1; G~I:重組病毒rCux-1A-C:Negative control; D-F:Parental virus Cux-1; G-I:Recombinant virus rCux-1
2.5 重組病毒遺傳標志的鑒定 將rCux-1傳至第9代,應用PCR技術擴增帶有AflⅡ酶切位點遺傳標記的序列,電泳結果顯示,目的條帶大小為736 bp,與預期大小一致(圖7)。用限制性內切酶AflⅡ對目標序列進行單酶切,電泳結果顯示,親本毒株Cux-1 PCR產物未被切開,而重組毒株rCux-1 PCR產物切開后得到2條大小為360 bp左右的條帶(圖8),表明獲得的重組病毒rCux-1帶有特定遺傳標記,為感染性克隆構建所得重組病毒。
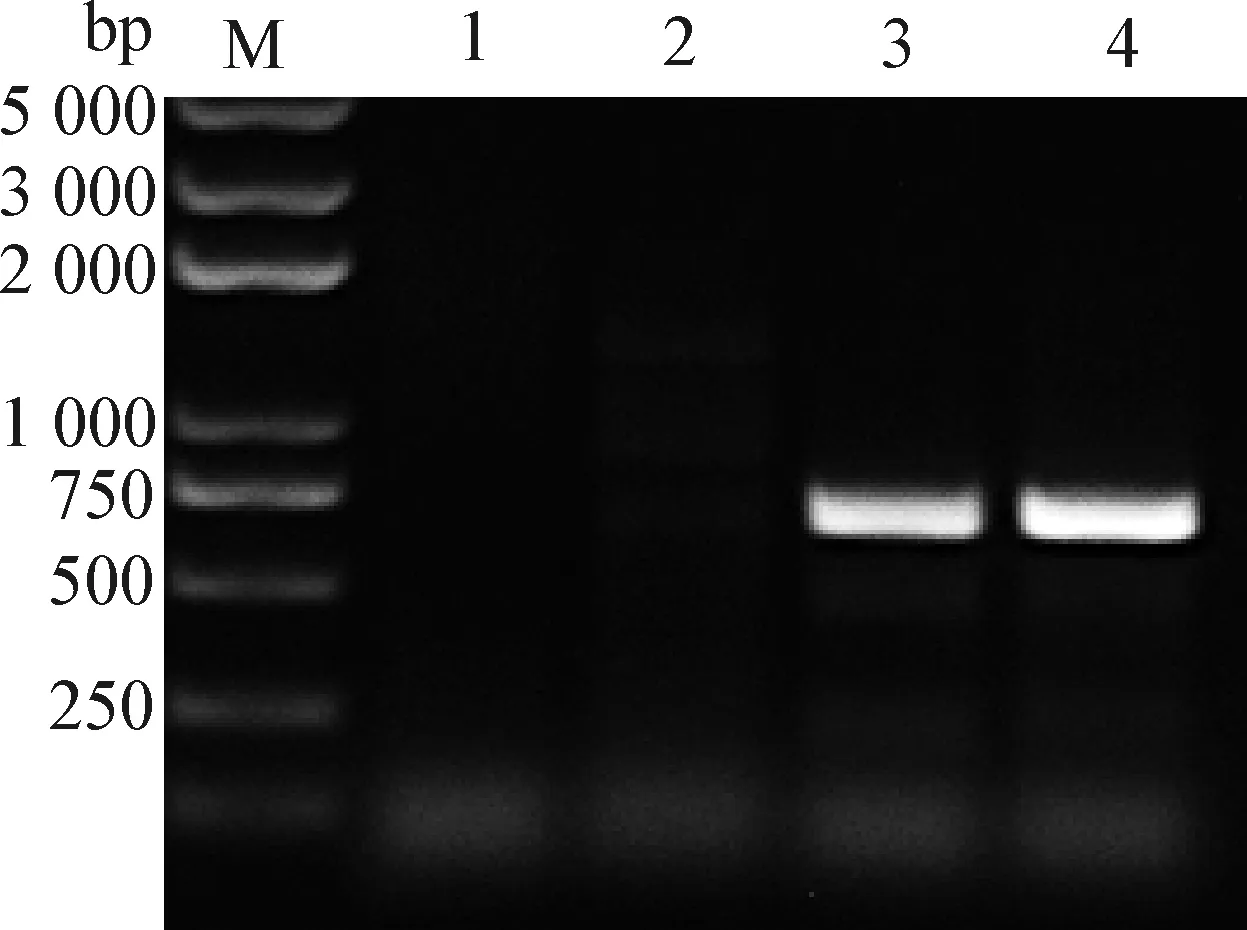
圖7 重組病毒的PCR鑒定Fig.7 PCR identification of the recombinant virusM:DNA標志物(DL2 000 plus); 1:空白對照; 2:陰性對照; 3:親本病毒Cux-1; 4:重組病毒rCux-1M:DL2 000 plus DNA Marker; 1:Blank control; 2:Negative control; 3:Parental virus Cux-1; 4:Recombinant virus rCux-1
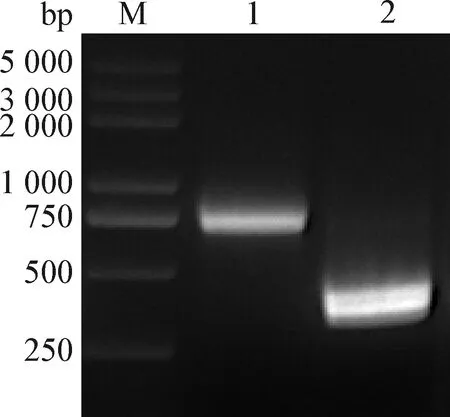
圖8 親本病毒和重組病毒PCR產物的酶切鑒定Fig.8 Identification of PCR products of the parental and recombinant virus by enzymatic digestionM:DNA標志物(DL2 000 plus); 1:親本病毒 PCR產物酶切后樣品; 2:重組病毒PCR產物酶切后樣品M:DL2 000 plus DNA Marker; 1:Sample of parental virus PCR product after enzymatic digestion; 2:Sample of recombinant virus PCR product after enzymatic digestion
2.6 病毒復制曲線分析 為比較重組病毒rCux-1與親本病毒的復制能力和增殖特性是否發生變化,將rCux-1傳至第9代后檢測病毒感染MDCC-MSB1細胞后不同時間點的病毒拷貝數并繪制病毒生長曲線,發現二者生長趨勢一致(圖9),表明重組病毒復制能力和增殖特性與親本Cux-1株基本相同,可用于后續研究。
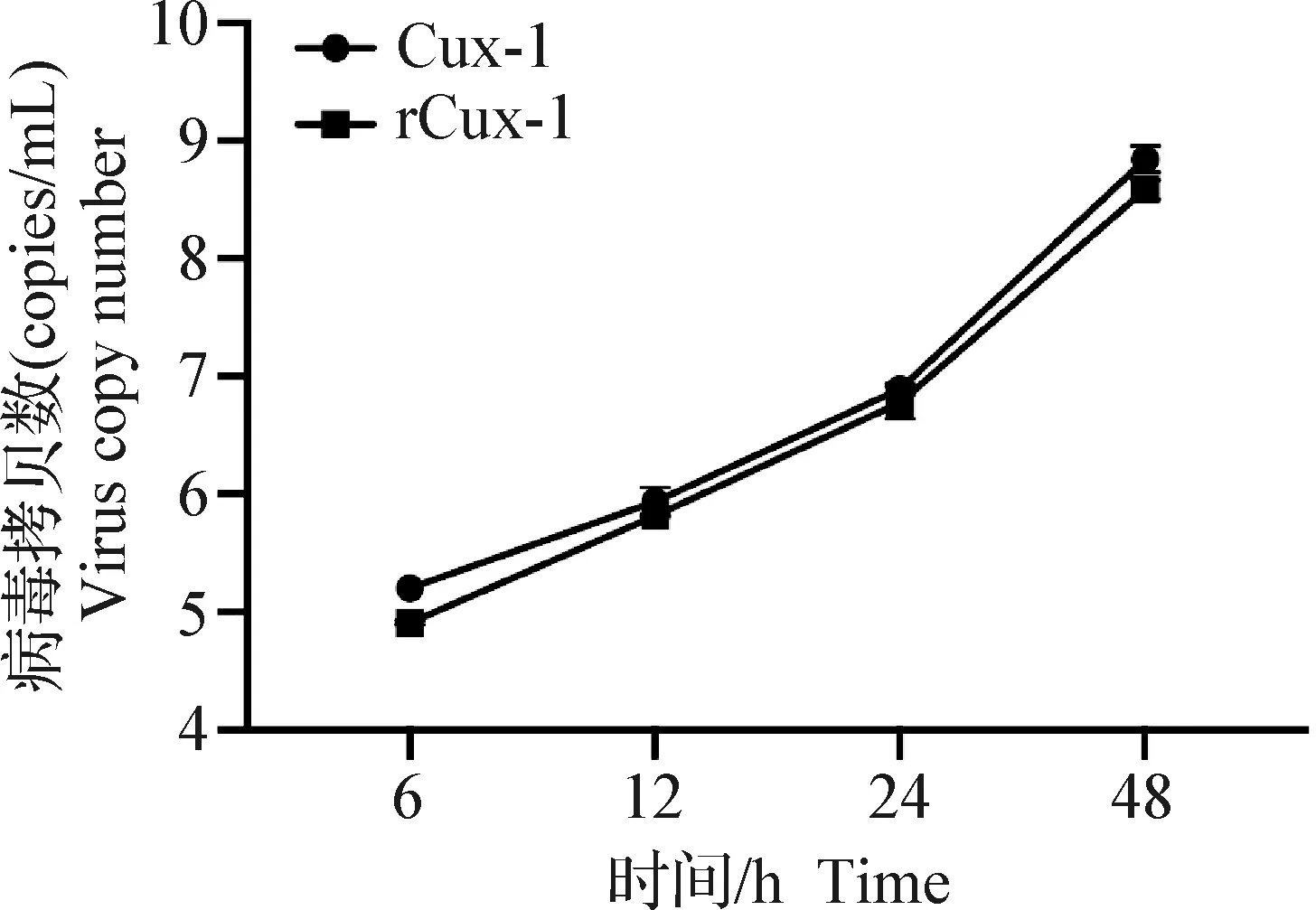
圖9 親本病毒Cux-1和重組病毒rCux-1的生長曲線Fig.9 Growth curves of parental virus Cux-1 and recombinant virus rCux-1
3 討論
CIAV是一種重要的禽類免疫抑制病病毒,該病毒于1979年由Yuasa等學者首次報道[3]。隨后發現CIAV在世界各地的家禽場中普遍存在,我國于1992年在黑龍江省首次分離到該病毒[13-15]。目前,CIAV在我國廣泛流行[15],嚴重危害養禽業發展,但目前尚沒有有效的疫苗防控該病,針對CIAV的減毒活疫苗免疫后誘導的抗體效價較低,僅能提供中等保護[16],因此深入研究CIAV致病機制對于制備新型的亞單位疫苗或DNA疫苗具有重要意義。
反向遺傳操作是病毒研究的重要方法,為深入研究病毒致病分子機制以及研制疫苗奠定了基礎[17]。為快速構建CIAV反向遺傳平臺,本試驗采用一步法擴增CIAV全基因組,在同源重組酶的作用下連接病毒基因和線性化的質粒,得到重組質粒。重組質粒中CIAV全基因組兩端的同源臂上具有相同的酶切位點,單酶切后可在體外使用T4 DNA連接酶將其環化,得到環狀的CIAV全基因組。
將環狀的CIAV基因組電轉染入MDCC-MSB1細胞中,盲傳3代后開始提取病毒DNA,連續檢測第3~5代病毒DNA,發現在連續傳代后仍能夠檢測到病毒,初步表明病毒拯救成功。本試驗在病毒傳至第8代時收取了細胞與蛋白,使用VP2單克隆抗體,分別通過間接免疫熒光和Western blot進行鑒定,發現均能檢測到VP2蛋白。為進一步探究重組病毒與親本病毒的復制能力和增殖特性,比較重組病毒第9代rCux-1與親本病毒第9代Cux-1的生長動力曲線,結果表明重組毒株與親本毒株增殖能力基本一致。最后,以第9代病毒的DNA為模板,通過PCR擴增其遺傳標記,經酶切鑒定為陽性,表明一步法構建CIAV感染性克隆平臺準確有效。
本試驗感染性克隆構建的關鍵在于得到病毒環狀DNA,CIAV基因組的長度較短(約2.3 kb),為共價閉合環狀單股負鏈DNA。相比于其他方式如分段擴增等[11-12],本試驗在高保真DNA聚合酶作用下一步得到病毒全基因組,縮短了構建時間,并且是非載體依賴的分子克隆,更易于轉染入細胞得到病毒。
綜上所述,本試驗成功構建了CIAV感染性克隆,為今后對CIAV進行致病機制研究提供了試驗基礎,也將為開展基因工程疫苗研究提供平臺。

