活性氧/c-Jun氨基末端激酶/核因子-κB信號分子通過調控凋亡參與牙周炎誘導肝損傷
曹牛奔 劉笑夢 鄧愉 劉歆嬋 辛雨 于維先,3,4
1.吉林大學口腔醫(yī)院牙周病科,長春 130021;2.吉林大學口腔醫(yī)院種植科,長春 130021;3.吉林大學口腔醫(yī)院老年口腔科,長春 130021;4.吉林省牙發(fā)育及頜骨重塑與再生重點實驗室,長春 130021
牙周炎是破壞牙周支持組織的細菌感染性疾病,我國第四次口腔健康流行病學調查結果顯示,約90%的成年人罹患牙周病,其中將近30%的成年人患有重度牙周炎[1]。重度牙周炎不僅危害局部口腔健康,而且與2型糖尿病、阿爾茨海默病和類風濕性關節(jié)炎等多種系統(tǒng)性疾病的發(fā)生和發(fā)展密切相關[2]。非酒精性脂肪性肝病(nonalcoholic fat‐ty liver disease,NAFLD)是最常見的慢性肝病之一,在全球范圍內患病率約為25.2%[3]。近期一項流行病學調查研究發(fā)現(xiàn),在1 226 例患有NAFLD的成人人群中,牙周探診深度(probing depth,PD)≥4 mm的比率顯著,且NAFLD的發(fā)病率隨牙周炎嚴重程度的增加而上升[4]。由此可見牙周炎與NAFLD關系密切,但其具體機制尚未明了。
氧化應激微環(huán)境是一系列慢性疾病的基礎[5],也是牙周炎和NAFLD 共同致病因素。活性氧(re‐active oxygen species,ROS)在氧化應激反應過程中發(fā)揮至關重要的作用,被認為是氧化應激反應的“馬達”[6]。研究[7]表明,ROS 作為絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor kappa-B,NFκB)的上游調節(jié)因子,參與調控該信號分子的表達。其中,c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)是MAPK 家族成員之一,介導對外界應激信號做出反應的基本生物過程,被認為是炎癥反應和先天免疫反應的重要調節(jié)因子[8]。當JNK 信號分子被多種細胞應激活動如氧化應激、遺傳毒性應激和滲透應激等激活后可促進炎癥介質的釋放,進而加劇胞內的炎癥反應和凋亡,最終造成組織損傷[9]。此外,NF-κB 作為JNK 的下游信號因子,在傳導細胞凋亡和炎癥信號中亦發(fā)揮了關鍵作用[10-11]。由于JNK/NF-κB 信號分子在多種細胞功能調節(jié)中發(fā)揮核心作用,因此當JNK/NFκB 信號分子被ROS 過度激活后可引發(fā)機體內環(huán)境紊亂。
目前針對NAFLD 的防治依舊缺乏有效的措施和特異性藥物,未來以牙周炎為靶點可能為NAFLD的防治提供一種新的策略。因此,深入探討牙周炎誘導NAFLD的相關機制,對于NAFLD的防治具有重要意義。綜上,本研究旨在探討ROS/JNK/NFκB信號分子在牙周炎誘導肝損傷中的作用。
1 材料和方法
1.1 材料和設備
Micro-CT系統(tǒng)(SCANCO公司,瑞士);油紅O 試劑盒(北京索萊寶科技有限公司);MitoSOX red 試劑(Thermo Fisher Science 公司,美國);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、丙二醛(malondial‐dehyde,MDA)、谷丙轉氨酶(alanine aminotrans‐ferase,ALT)和谷草轉氨酶(aspartate aminotrans‐ferase,AST)生化試劑盒(南京建成生物工程研究所);Hoechst 染液(Sigma 公司,美國);逆轉錄試劑盒(TaKaRa 公司,日本);引物由上海生工生物工程有限公司合成;抗體JNK、磷酸化c-Jun 氨基末端激酶(phosphorylation of c-Jun N-ter‐minal kinase,P-JNK)、NF-κB、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)(Cell Signaling Technolo‐gy 公司,美國);BCL2-Associated X 的蛋白質(BCL2-Associated X,Bax)、B 淋巴細胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)、β-肌動蛋白(β-ac‐tin)、二抗(Proteintech公司,美國);實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction,qRT-PCR)儀、石蠟切片機(Ther‐mo 公司,美國);實時熒光定量擴增儀(Agilent公司,美國);RIPA 裂解液、BCA 試劑盒、末端脫氧核苷酸轉移酶dUTP 缺口末端標記(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)試劑盒和電化學發(fā)光(electrochemilumi‐nescence,ECL)顯色液(上海碧云天生物技術有限公司);光學顯微鏡、熒光顯微鏡(Olympus 公司,日本);全自動化學發(fā)光凝膠成像顯影儀(北京君意東方電泳設備有限公司)。
1.2 方法
1.2.1 大鼠牙周炎模型的構建 12 只SPF 級雄性Wistar大鼠(6 周齡,200~220 g)隨機分為對照組和牙周炎組,每組各6只(購于吉林大學動物實驗中心)。牙周炎組大鼠在2%戊巴比妥鈉腹腔注射麻醉后,采用0.2 mm 正畸結扎絲在雙側上頜第一磨牙頸部結扎構建牙周炎模型。8周后檢查牙周臨床指標并處死,然后迅速采集上頜骨、肝臟和血液用于后續(xù)實驗[12]。動物實驗經(jīng)吉林大學基礎醫(yī)學院倫理委員會批準(批準編號:2021 年研審243號)。
1.2.2 牙周臨床指標檢查 探查各組大鼠上頜第一磨牙牙齦狀況,并記錄牙周臨床指標,具體如下。1)PD:用牙周探針在上頜第一磨牙頰腭側的近遠中及中央6 個位點進行探診,記錄PD 測量結果并取均值。2)牙齒動度(tooth mobility,TM):用鑷子檢查上頜第一磨牙TM 情況。評價標準為0:生理動度;1:僅頰腭向松動;2:頰腭及近遠中向松動;3:頰腭、近遠中向及垂直向均松動。3)出血指數(shù)(bleeding index,BI):將牙周探針輕探入齦溝或袋底,取出探針30 s 后,觀察有無出血及出血程度,以Mazza 出血指數(shù)為評價標準,0:牙齦健康,無炎癥和出血;1:牙齦輕度水腫,探診不出血;2:探診后有點狀出血;3:探診后出血沿齦緣擴展;4:探診后出血并溢出齦溝;5:自發(fā)性出血[13]。
1.2.3 Micro-CT 分析 采用Micro-CT 系統(tǒng)掃描上頜骨。Micro-CT 系統(tǒng)設置參數(shù)為70 kV、200 mA和300 ms 曝光時間(體素大小為10 μm×10 μm×10 μm),使用IPL軟件進行圖像處理并重建牙槽骨三維結構。Image J 軟件分析上頜第一磨牙近中、中央及遠中釉牙骨質界到牙槽嵴頂?shù)木嚯x并取平均值。
1.2.4 蘇木精-伊紅(hematoxylin-eosin,HE)染色 采集大鼠上頜骨及肝組織,上頜骨置于10%乙二胺四乙酸溶液中脫鈣后,制作石蠟切片;肝組織經(jīng)4%多聚甲醛溶液固定后制作石蠟切片。常規(guī)進行HE染色后鏡下觀察并拍照。
1.2.5 油紅O(oil red O)染色 采用油紅O 試劑盒對肝臟冰凍切片染色,以評估肝組織脂肪變性。4%多聚甲醛固定肝組織冰凍切片,沖洗后滴加油紅O 染液染色10 min,之后用60%異丙醇分化至間質清晰并流水沖洗,蘇木精復染5 min,沖洗后甘油明膠封片,最后在光學顯微鏡下觀察并拍照。采用Image-Pro Plus 6.0 軟件對圖像進行分析并計算肝臟脂肪光密度總和。
1.2.6 MitoSOX red 染色 4%多聚甲醛固定肝臟冰凍切片,沖洗后滴加MitoSOX red 試劑。在37 ℃黑暗環(huán)境中孵育30 min,Hoechst 染液對細胞核進行染色,最后在熒光顯微鏡下觀察并拍照。
1.2.7 肝功能和氧化應激指標的測定 采用商用生化試劑盒檢測血清中肝功指標AST 和ALT 及肝組織中氧化應激指標SOD、MDA 和GSH,實驗步驟按照說明書指示進行。
1.2.8 qRT-PCR 檢測 Trizol 試劑提取肝組織中總RNA,逆轉錄為cDNA 后采用SYBRPrime-Script-TM qRT-PCR Kit 試劑盒進行qRT-PCR 反應,檢測白細胞介素-6(interleukin-6,IL-6)、腫瘤壞死因子-α(tumor necrosis factorα-α,TNF-α)、NF-κB、Bax 和Bcl-2 mRNA 表達情況,引物序列見表1。采用2-ΔΔCt法計算基因相對表達量。

表1 基因序列Tab 1 Genetic sequence
1.2.9 Western blot 檢測 RIPA 裂解液提取新鮮肝組織總蛋白,BCA 試劑盒檢測蛋白濃度。10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離,濕轉法轉移到聚偏二氟乙烯膜上,5%脫脂牛奶室溫封閉1 h,TBST 洗滌后加入抗體JNK(1∶2 000)、
P-JNK(1∶2 000)、NF-κB(1∶2 000)、Caspase-3(1∶2 000)、Bax(1∶8 000)、Bcl-2(1∶2 000)、β-actin(1∶8 000)4 ℃孵育過夜,TBST 洗膜后與二抗(1∶8 000)室溫孵育1 h,最后使用ECL顯色并通過Image J軟件分析灰度值。
1.2.10 TUNEL 染色 根據(jù)TUNEL 試劑盒說明書對肝組織石蠟切片進行染色,Hoechst 染液對細胞核進行染色后,在熒光顯微鏡下觀察細胞并拍照。
1.3 統(tǒng)計學分析
利用GraphPad Prism 6.0軟件進行統(tǒng)計學分析,所有數(shù)據(jù)用xˉ±s來表示,組間比較采用t檢驗分析,P<0.05則認為差異具有統(tǒng)計學意義。
2 結果
2.1 成功構建牙周炎模型
肉眼觀察對照組牙齦呈粉紅色,形態(tài)菲薄,質地堅韌(圖1a);而牙周炎組牙齦充血紅腫,齦緣肥厚,質地松軟(圖1b)。牙周組織切片HE 染色結果顯示,與對照組相比,牙周炎組牙周組織上皮連續(xù)性破壞,固有層中有大量炎癥細胞浸潤,牙槽嵴吸收明顯(圖1c、d)。Micro-CT顯示牙周炎組牙槽骨骨質較對照組吸收明顯(圖1e、f),且釉牙骨質界到牙槽嵴頂?shù)木嚯x(1.06 mm±0.09 mm)明顯大于對照組(0.68 mm±0.02 mm)(t=3.934,P=0.017)。此外,牙周炎組牙周臨床指標PD、BI 和TM 值均明顯升高(表2)。以上結果表明,本研究成功構建牙周炎模型。

表2 大鼠牙周臨床指標Tab 2 Periodontal clinical indices of rats xˉ±s
2.2 肝大體照及組織病理學檢測結果
肉眼觀察牙周炎組肝臟較對照組體積增大,顏色變淺,邊緣圓鈍(圖2a、b)。肝組織HE 染色結果顯示,牙周炎組肝索排列紊亂,小葉內及匯管區(qū)可見炎癥細胞浸潤,肝細胞胞漿內可見白色脂肪空泡(圖2c~f)。油紅O 染色結果顯示,牙周炎組肝組織胞漿內紅色脂滴明顯多于對照組(圖3)。以上結果表明牙周炎可誘導肝組織發(fā)生結構改變。
2.3 MitoSOX red染色結果
線粒體是產(chǎn)生ROS 的主要場所,MitoSOX red試劑可靶向檢測ROS含量。MitoSOX red是一種線粒體超氧化物熒光染料,被超氧化物氧化后可呈現(xiàn)紅色熒光,從而評估ROS含量。實驗結果示,牙周炎組肝組織中紅色熒光強度較對照組明顯增強,表明牙周炎組肝組織中ROS含量升高(圖4)。
2.4 氧化應激標志物和肝功檢測結果
SOD 和GSH 是生物體內重要的抗氧化劑,MDA 是脂質過氧化的最終產(chǎn)物。AST 和ALT 是評價肝功能損傷的重要指標。結果顯示,與對照組相比,牙周炎組肝組織中SOD、GSH 含量顯著降低,MDA 含量升高。血清中AST、ALT 含量升高,差異具有統(tǒng)計學意義(P<0.05)。以上結果表明牙周炎可誘導肝組織中發(fā)生氧化應激反應且損害肝功能(表3)。
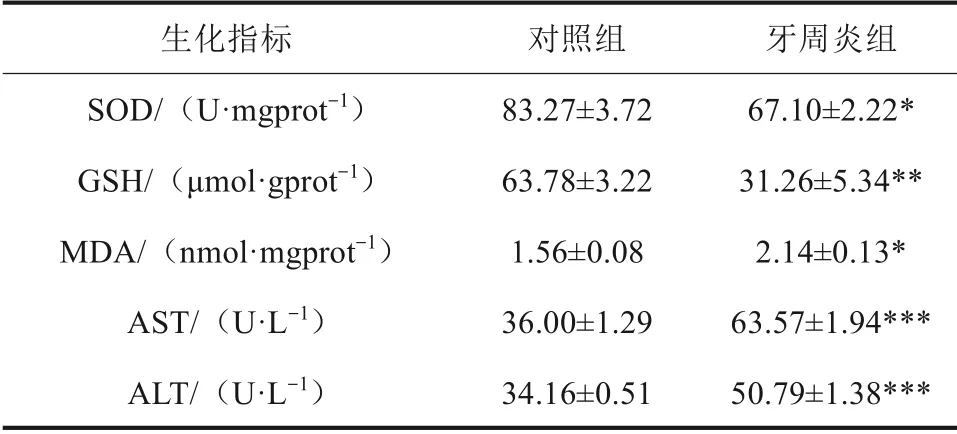
表3 生化指標檢測結果Tab 3 Biochemical index test results xˉ±s
2.5 qRT-PCR檢測結果
qRT-PCR 檢測肝組織中IL-6、TNF-α、Bax、NF-κB 和Bcl-2 mRNA 表達水平。結果顯示,與對照組相比,牙周炎組肝組織中IL-6、TNF-α、Bax和NF-κB mRNA 表達水平顯著升高,Bcl-2 mRNA表達水平顯著下降,差異具有統(tǒng)計學意義(P<0.05)。以上結果表明牙周炎組肝組織中炎癥介質和凋亡相關mRNA表達水平較對照組升高(圖5)。
2.6 Western blot檢測結果
提取肝組織總蛋白,Western blot 檢測肝組織中P-JNK/JNK、NF-κB、Caspase-3、Bax 和Bcl-2表達水平。與對照組相比,牙周炎組肝組織中PJNK/JNK、NF-κB、Caspase-3、Bax 表達水平明顯增高,Bcl-2 表達水平降低,Bax/Bcl-2 比值升高,差異具有統(tǒng)計學意義(P<0.05)。以上結果表明,與對照組相比,牙周炎組肝組織中JNK/NF-κB 信號分子被激活,且凋亡相關蛋白表達水平顯著升高(圖6)。
2.7 TUNEL染色結果
TUNEL 染色可將凋亡細胞呈現(xiàn)綠色熒光。結果顯示,牙周炎組肝組織中綠色熒光強度較對照組增強,表明牙周炎組肝組織中凋亡水平升高(圖7)。
3 討論
牙周炎和NAFLD 均為慢性炎癥性疾病,有共同的危險因素,兩者間相互作用,均表現(xiàn)為組織內部發(fā)生氧化應激反應,然而牙周炎誘發(fā)肝損傷的具體機制尚不清楚。因此,本研究以氧化應激為切入點,探討牙周炎誘導肝損傷的具體機制。
ROS 在機體內發(fā)揮“雙刃劍”作用:一方面ROS 本身具有殺菌抗菌能力,在生理狀態(tài)下可以幫助殺死入侵機體的病原菌。另一方面,當ROS被過度激活在體內大量積累會引起機體氧化-抗氧化失衡,導致機體內發(fā)生氧化應激反應,最終引起組織損傷[16]。Mohs 等[17]研究報道,ROS 的過度產(chǎn)生可導致脂質穩(wěn)態(tài)的破壞,從而導致肝細胞內脂質的過度積累。因此,氧化應激是NAFLD 發(fā)病和進展的重要因素之一。
流行病學調查結果發(fā)現(xiàn),牙周炎患者齦溝液、唾液和血清中氧化應激生物標志物水平較牙周健康者顯著升高[18]。而通過手術或非手術治療等方式對牙周炎進行干預可有效降低全身氧化應激生物標志物水平[19]。基于以上研究猜測牙周炎不僅能改變牙周局部氧化應激水平,也可影響全身氧化還原狀態(tài)。本研究根據(jù)肝組織病理學檢測結果以及肝功指標水平變化發(fā)現(xiàn)牙周炎可誘導肝臟發(fā)生結構改變和功能障礙,表明本研究成功構建大鼠牙周炎相關肝損傷模型。在此模型基礎上,通過MitoSOX red染色和檢測肝組織中氧化應激生物標志物水平進一步證實我們的猜想。結果顯示,牙周炎組肝組織中ROS 含量升高,且氧化應激生物標志物SOD 和GSH 水平降低,MDA 水平升高,表明牙周炎可誘導肝組織中發(fā)生氧化應激反應。
An 等[7]研究發(fā)現(xiàn),ROS 大量積累可觸發(fā)JNK/NF-κB 信號分子的激活,進而引起一系列細胞反應。前文所述,由于JNK/NF-κB 信號分子可參與多種信號的傳導,當該通路被過度激活時可導致內環(huán)境紊亂。本研究結果顯示,牙周炎組肝組織中JNK 蛋白磷酸化水平和NF-κB 基因及蛋白表達水平明顯較對照組升高,表明JNK/NF-κB 信號分子在牙周炎誘導肝損傷過程中可能發(fā)揮重要作用。因此,根據(jù)以上研究結果初步認為牙周炎可能通過誘導肝臟中ROS 大量積累,導致肝組織內發(fā)生氧化應激反應,進而激活JNK/NF-κB 信號分子,最終造成肝損傷。
細胞凋亡是機體的一種生理機制,在維持內環(huán)境穩(wěn)態(tài)過程中發(fā)揮關鍵作用[20]。然而,當機體受到氧化應激等信號刺激導致凋亡水平上升時,巨噬細胞無法清除過多的凋亡細胞,未清除的凋亡細胞可加劇體內炎癥反應[7]。Zhou 等[21]研究發(fā)現(xiàn),在NAFLD 進展中伴隨細胞凋亡水平增加。此外,Veskovic等[22]通過改善促凋亡和抗凋亡介質平衡可有效緩解肝臟炎癥和損傷。由此可見NAFLD發(fā)病機制與細胞凋亡水平改變密切相關。本研究通過探討JNK/NF-κB 信號分子對細胞凋亡的調控作用,進一步揭示牙周炎誘導肝損傷的具體機制。目前研究[23]發(fā)現(xiàn),JNK信號分子在細胞內源性和外源性凋亡途徑中發(fā)揮至關重要的作用。激活后的JNK 通過磷酸化14-3-3α 或14-3-3ζ 蛋白(bax 的胞質錨定蛋白)介導bax 活化并將其轉位到線粒體,進而誘導線粒體外膜滲透。線粒體外膜滲透可導致細胞色素C 和其他促凋亡蛋白從線粒體膜間空間釋放,觸發(fā)Caspase-9 級聯(lián)反應[24]。同時,JNK也可通過磷酸化Bim 和Bmf 蛋白,從而抑制Bcl-2及其同系物的抗凋亡活性,最終誘導細胞凋亡[20]。此外,NF-κB 作為一種重要的轉錄因子,通過傳導凋亡和炎癥信號參與細胞損傷過程[11]。本實驗結果顯示牙周炎組肝組織中凋亡細胞數(shù)量明顯增多,促凋亡介質Bax 和Caspase-3 表達水平顯著升高,抗凋亡介質Bcl-2 表達水平下降,且炎癥因子表達水平亦明顯上升。綜上,牙周炎可能通過誘導肝組織中發(fā)生氧化應激反應,激活JNK/NF-κB 信號分子,導致肝組織中細胞凋亡水平上升,促進炎癥介質大量釋放,最終引起肝損傷。
本研究存在一定的局限性,即未使用JNK/NFκB 信號分子的阻斷藥物觀察牙周炎誘導的肝損傷是否得到有效緩解。然而大量研究證實,通過抑制JNK/NF-κB 信號分子可有效減輕ROS 大量積累對組織和細胞造成的氧化損傷。Chen 等[25]研究發(fā)現(xiàn),在心肌缺血-再灌注期間,ROS 大量積累造成心肌細胞受損和功能障礙,而Zhou 等[26]通過體內應用阻斷藥物抑制JNK/NF-κB 信號通路可以有效減輕心肌組織功能障礙和免疫紊亂。由于氧化應激是缺血-再灌注損傷和牙周炎誘導的NAFLD 的共同致病因素之一,上述結果在為后續(xù)通過使用阻斷藥物抑制JNK/NF-κB 信號通路從而緩解牙周炎誘導的肝損傷的過程中提供強有力的理論支撐。
綜上所述,本研究發(fā)現(xiàn)ROS/JNK/NF-κB 信號分子可能在牙周炎誘導肝損傷過程中發(fā)揮了重要作用,未來可通過應用JNK 和NF-κB 的靶向藥物做進一步研究。期待以牙周炎為靶點為NAFLD 的防治提供新策略。
利益沖突聲明:作者聲明本文無利益沖突。

