基于網絡藥理學和分子對接探究三棱-莪術抗乳腺癌的作用機制
劉雪婷,孫小慧,朱建敏*,李林,李文悅
(1.山東中醫藥大學 a.中醫學院;b.第一臨床醫學院,山東 濟南 250013;2.山東中醫藥大學附屬醫院,山東 濟南 250014)
據國際癌癥研究機構統計,2020年女性乳腺癌已超過肺癌成為最常見的癌癥,新增病例約230萬例,占所有癌癥的11.7%[1]。目前治療方式以手術為主,根據分期和激素受體狀態,可能包括化療、放療、內分泌治療和靶向治療[2],這些治療在顯著提高生存率的同時也會產生長期的生理和心理后遺癥,嚴重影響生活質量。隨著中國傳統醫學的發展,中醫藥治療成為乳腺癌綜合治療的重要部分,具有扶正抗癌、調節體質、緩解因化療引起的不良反應、提高患者生活質量等作用。
乳腺癌屬于中國傳統醫學 “乳巖”“石癰”“奶巖”的范疇,氣滯血瘀貫穿乳巖發生發展的始末,氣為血之帥,血隨氣行,若肝氣不舒,則血行不暢,日久形成癥瘕積聚,治法當行氣活血化瘀[3]。中醫認為乳巖發生發展的重要病機之一為瘀血內阻[4],三棱-莪術是臨床上常用的活血化瘀藥對,三棱更善長破血,莪術行氣之力更強。現代研究表明,二者的共同抗癌機制是誘導腫瘤細胞凋亡、干擾腫瘤細胞周期、抗血管內皮生成、調控腫瘤微環境[5]。
莪術味辛、苦,性溫,歸肝、脾二經,首載于《藥性論》,有破氣行血、消積止痛之功,三棱性味及所治病證與莪術相似,始載于《本草拾遺》。現代植物化學研究表明,莪術的活性成分主要有姜黃素類、揮發油、莪術醇、多糖類[6],姜黃素類發揮活血化瘀作用[7],莪術油是莪術發揮抗腫瘤功效的主要成分,可用于乳腺癌的防治[8]。三棱總黃酮亦可抗腫瘤、抗栓。盡管三棱-莪術藥對抗乳腺癌療效在臨床中得到證實,但其具體的作用機制仍未明確。網絡藥理學將生物學、藥理學與傳統中藥相結合,構建有效活性成分-疾病-靶點-通路途徑網絡,與中醫學整體觀與辨證論治不謀而合[9]。因此,本研究運用網絡藥理學探究三棱-莪術藥對抗乳腺癌的有效活性成分及作用機制,為今后開展其臨床研究與應用提供理論參考。
1 材料和方法
1.1 藥物有效成分及作用靶點收集
運用中藥系統藥理學數據庫與分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)獲取三棱、莪術的活性成分,以口服生物利用度(oralbio-availability, OB)≥30%和類藥性(drug-likeness ,DL)≥0.18為標準,最終確定三棱、莪術有效活性成分。通過TCMSP數據庫查詢其有效活性成分相對應的靶蛋白,并利用Uniprot數據庫(https://www.uniprot.org/),物種選擇為Homo sapiens,剔除非人類、重復及不規范的靶點,將靶基因進行基因符號Gene Symbol標準化命名。
1.2 疾病相關靶點篩選
將“breast cancer”分別輸入GeneCards數據庫(https://www.genecards.org/)、OMIM數據庫(http://www.omim.org/)進行檢索,將兩個數據庫的篩選結果合并刪除重復項后獲得乳腺癌相關靶點,運用維恩圖將藥物靶點和乳腺癌的治療靶點取交集,獲得三棱-莪術藥對抗乳腺癌的靶點。
1.3 成分-疾病-靶點網絡構建
以藥物、有效活性成分、疾病、交集靶點為節點,通過Excel表格構建相應關系,導入到Cytoscape 3.7.2軟件中繪制中藥-成分-疾病-靶點網絡圖,運用Cytoscape 3.7.2軟件中的Network Analyzer插件進行拓撲分析,計算節點的度值(degree)、介度中心性(betweenness centrality, BC)和緊密中心性(closeness centrality,CC),設置閾值為BC值中位數和CC值中位數,按度值大小排序篩選關鍵活性成分。
1.4 蛋白質-蛋白質相互作用網絡的構建
將三棱-莪術抗乳腺癌的潛在作用靶點導入STRING數據庫(https://cn.string-db.org/),將所得數據以TSV格式導出到Excel表格中再導入Cytoscape 3.7.2軟件中構建靶點蛋白質-蛋白質相互作用(protein-protein intrraction,PPI)網絡圖,使用Cytoscape中MCODE插件進行分析篩選出前10個蛋白,作為三棱-莪術抗乳腺癌的核心靶點。
1.5 GO功能富集與KEGG通路分析
將交集靶點導入DAVID 6.8數據庫(https://david.ncifcrf.gov/),運用DAVID數據庫進行基因本體(gene ontology,GO)功能富集分析與京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。設置閾值P<0.01,排除非特異性GO功能及KEGG通路,依據P值大小篩選出與乳腺癌關聯度較大的條目,繪制氣泡圖。Cytoscape 3.7.2軟件中構建成分-靶點-通路網絡,綜合預測三棱-莪術與乳腺癌的生物學特性及調控通路。
1.6 分子對接驗證
選取PPI網絡中排名前3的關鍵靶點,與三棱-莪術藥對有效活性成分進行分子對接。從Pubchem數據庫(https://pubchem.ncbi.nlm.nih.gov/)中下載小分子配體的2D結構,使用chem3D軟件完成優化力學結構,在AutoDockTools中操作,檢測配體的root、選擇配體可旋轉的鍵,并導出pdbqt格式文件。從RCSB PDB數據庫(https://www.rcsb.org/)獲取靶點的最佳三維晶體結構文件,保存為pdb格式。經Pymol軟件進行去水、加氫后,利用AutoDock軟件計算電荷、添加原子類型,轉換為pdbqt格式,利用AutoDock Vina軟件計算靶點與活性成分之間的最低結合能并將分子對接驗證結果可視化。
2 結果
2.1 三棱-莪術有效成分及作用靶點
通過TCMSP數據庫,以OB≥30%,DL≥0.18作為篩選參數,初步得到8個活性成分。莪術有3個,三棱有5個,其中常春藤皂苷元(MOL000296)為二者共有成分,刪除重復數據后剩余活性成分7個。結合Unitprot數據庫確認并轉換,最終共得到73個藥效靶點。
2.2 乳腺癌靶點篩選
通過GeneCards、OMIM數據庫檢索合并去重后得到3 629個乳腺癌相關靶點。運用venny平臺將三棱-莪術藥效靶點與乳腺癌的治療靶點取交集,得到三棱-莪術藥對抗乳腺癌的靶點43個,如圖1所示。
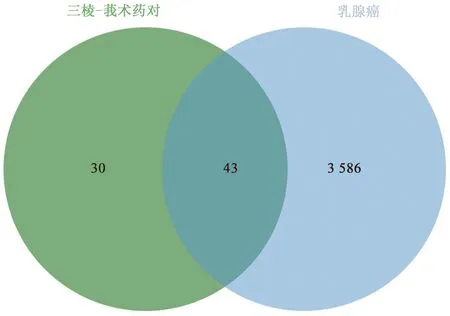
圖1 藥物靶點和疾病靶點維恩圖Fig.1 Venn diagram of the drug targets and disease targets
2.3 藥物-成分-疾病-靶點網絡構建
利用Cytoscape 3.7.2構建三棱-莪術的藥物-成分-疾病-靶點網絡,如圖2所示。該網絡共含有53個節點和118條邊,涉及7種活性成分和43個潛在靶點,以不同的顏色或形狀來表示。按度值排序,得到芒柄花黃素、β-谷甾醇、豆甾醇這3個成分可能是三棱-莪術抗乳腺癌的關鍵成分,從圖中可以看出同一成分對應多個靶點和多個成分對應同一靶點的關系,體現了三棱-莪術多成分、多靶點抗乳腺癌的作用特點。

注:黃色菱形節點代表疾病;藍色橢圓形節點代表藥物;粉色矩形節點代表成分;綠色橢圓形節點代表靶點。圖2 藥物-成分-疾病-靶點網絡圖Fig.2 The drug-ingredient-disease-target network map
2.4 PPI網絡構建及PPI網絡構建及核心靶點的篩選
利用Cytoscape 3.7.2繪制PPI網絡圖,共涉及41個節點,195條邊,如圖3所示。

注:圖中節點表示蛋白,度值用節點大小與顏色表示,邊表示功能相關性,邊的粗細反映作用強度(combine score)。圖3 PPI網絡圖Fig.3 Network diagram of PPI
使用Cytoscape中MCODE插件進行分析,篩選出排名前10的關鍵蛋白,分別是JUN、CASP3、PTGS2、ESR1、MPK14、PPARG、SIRT1、NOS3、TGFB1、NOS2,如圖4所示,這10個蛋白在整個網絡中起著關鍵作用,由此可見,JUN、CASP3、PTGS2為三棱-莪術抗乳腺癌的核心靶點。
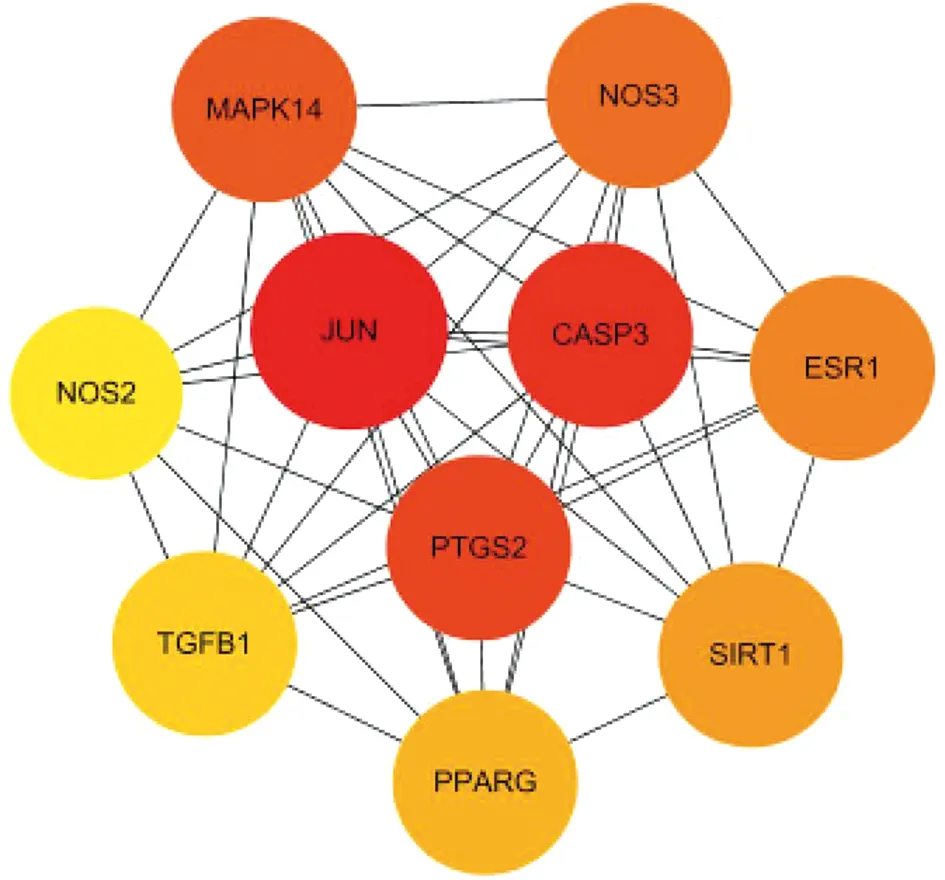
注:顏色由淺黃到深紅,顏色越深,表示蛋白的作用越強。圖4 PPI網絡關鍵節點Fig.4 The key nodes of the PPI network
2.5 GO和KEGG富集分析結果
通過DAVID 6.8數據庫對43個潛在靶點進行GO和KEGG分析,共獲得303條GO條目,包括214個生物過程、63個分子功能、26個細胞組分。如表1所示,生物過程主要是對雌二醇的反應、對藥物的反應、RNA聚合酶Ⅱ啟動子轉錄DNA模板正調控、RNA聚合酶Ⅱ啟動子起始轉錄、類固醇激素介導的信號通路、轉錄的正調控等;表2所示,分子功能主要是類固醇激素受體、酶結合、蛋白質結合、類固醇結合等;表3所示,細胞組分主要是膜筏、細胞質、核、核質、核染色質、線粒體、線粒體外膜等。KEGG富集通路如圖5所示,主要是VEGF信號通路、TNF信號通路、p53信號通路、催乳素信號通路、P13K-Akt信號通路、AMPK信號通路等。利用Cytoscape 3.7.2軟件繪制成分-靶點-通路網絡圖,見OSID附圖1。
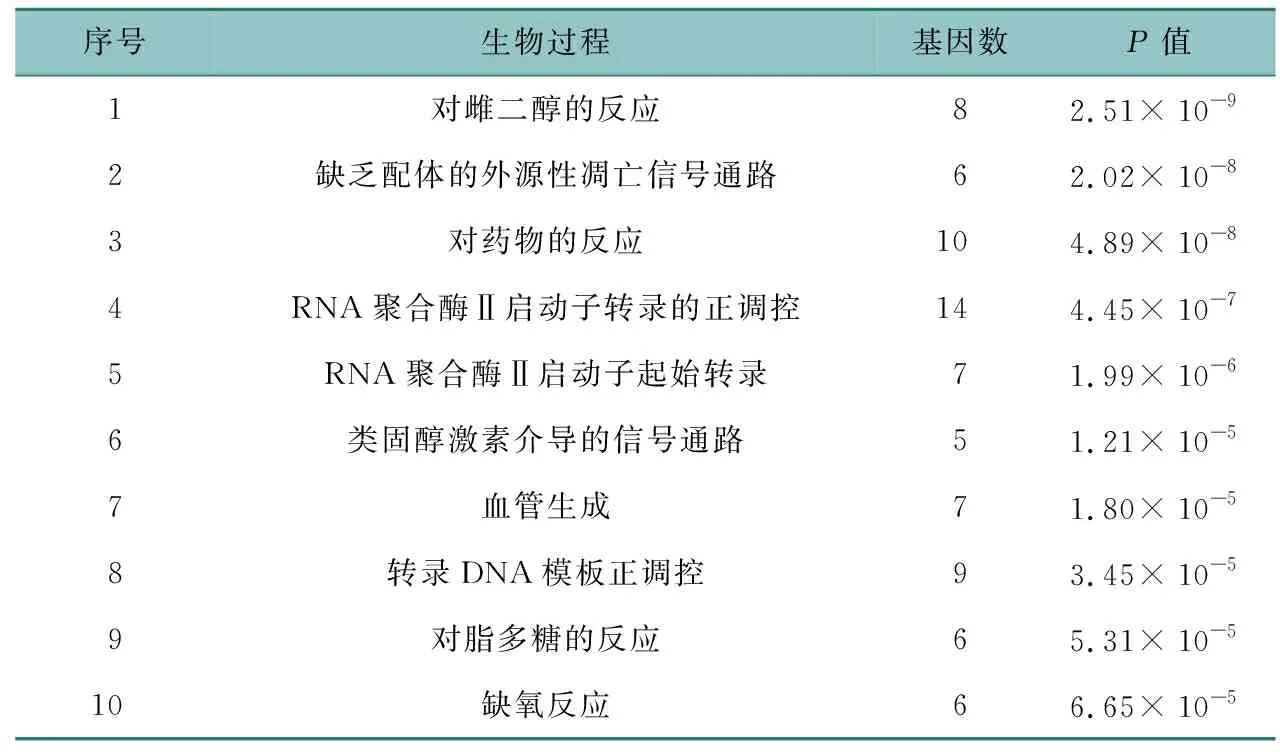
表1 三棱-莪術治療乳腺癌涉及的主要生物過程(前10位)

表2 三棱-莪術治療乳腺癌涉及的主要分子功能(前10位)
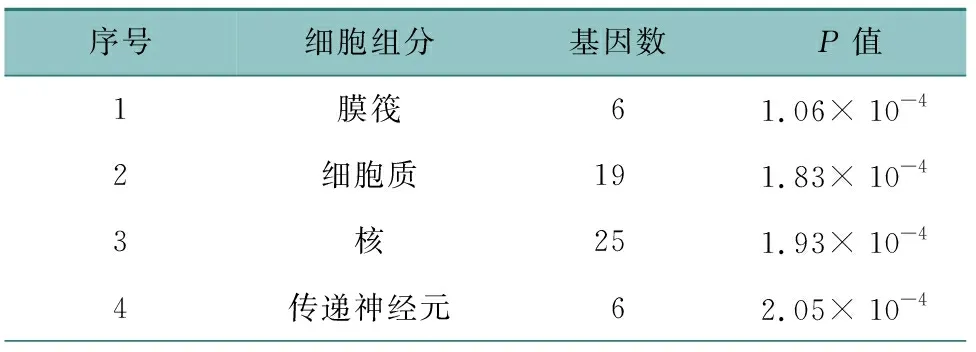
表3 三棱-莪術治療乳腺癌涉及的主要細胞組分(前10位)
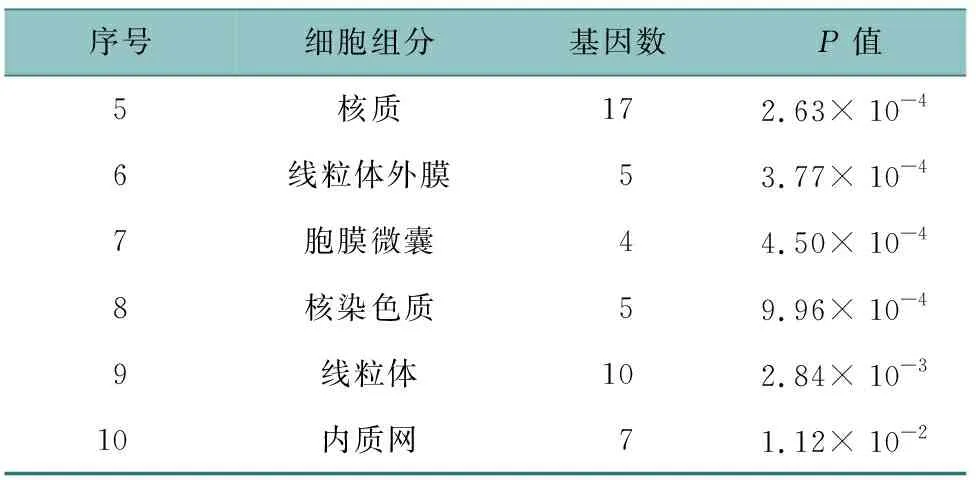
表3(續)

注: P值大小與顏色有關,顏色越紅,代表P值越小,可信度越高;富集條目數量與節點大小有關,節點越大,代表富集條目數量越多。圖5 KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis
2.6 分子對接結果
PPI網絡中排名前3的關鍵靶點JUN、CASP3、PTGS2與三棱-莪術藥對有效活性成分常春藤皂苷元、β-谷甾醇、芒柄花黃素、豆甾醇、反式軟骨酸進行分子對接驗證,結果如表4所示。

表4 有效活性成分與核心靶點的分子對接結果
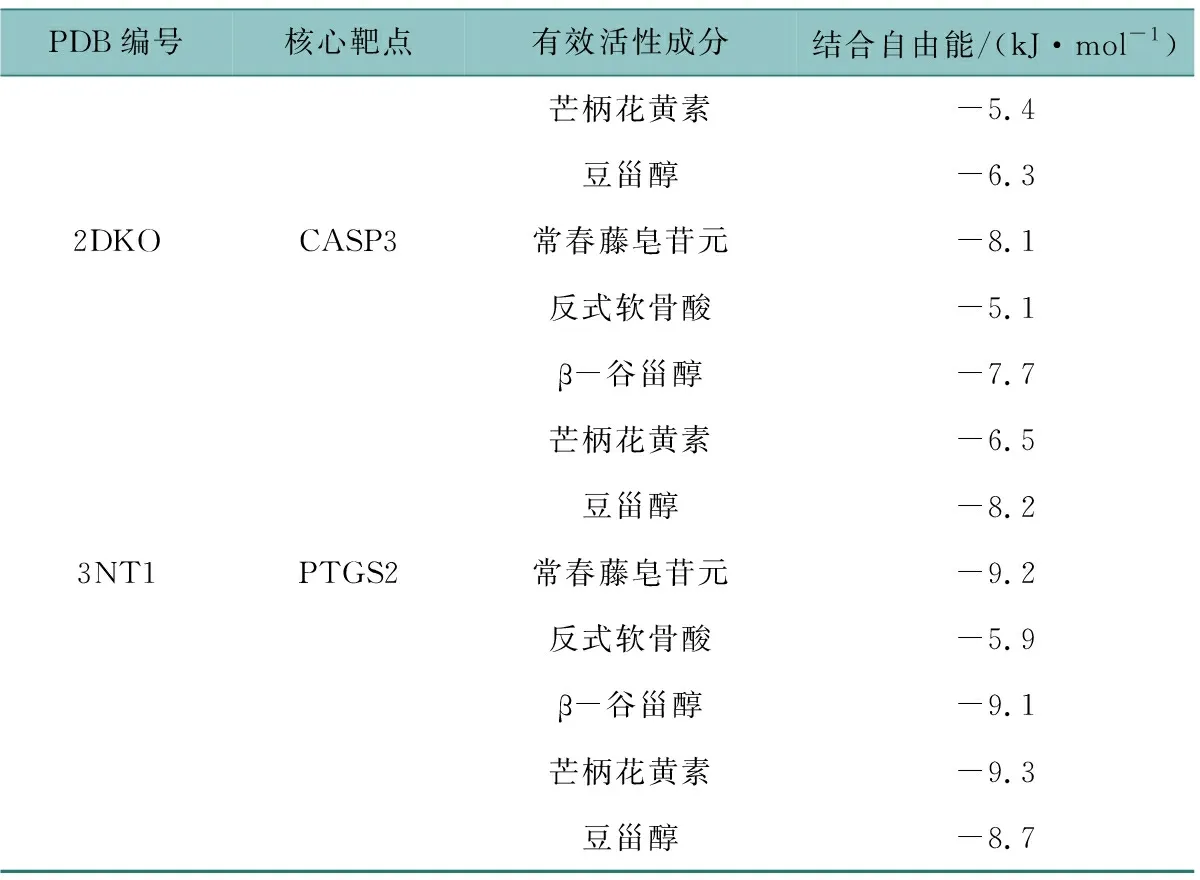
表4(續)
分子對接的分值用于評估藥物活性成分與核心靶點之間的結合活性,結合能<-4.25 kJ/mol表示小分子配體與蛋白受體之間有結合活性;結合能<-5.0 kJ/mol表明兩者之間有較好的結合活性;結合能<-7.0 kJ/mol則說明二者之間有很強烈的結合能力[10]。根據分子對接結合能最低值篩選出結合能力最優的前四組蛋白,即PTGS2與常春藤皂苷元、β-谷甾醇、芒柄花黃素、豆甾醇結合性最好,如圖6所示,常春藤皂苷元通過HIS-356、LYS-97、ASN-581、SER-579氨基酸殘基形成四條氫鍵,β-谷甾醇通過LYS-532、GLN-372氨基酸殘基形成兩條氫鍵,芒柄花黃素通過GLN-461、ASN-39氨基酸殘基形成兩條氫鍵,豆甾醇通過ARG-333形成一條氫鍵,均與PTGS2緊密結合。

圖6 有效活性成分與核心靶點蛋白的分子對接圖Fig.6 Molecular docking diagram of the effective active ingredients and core target proteins
3 討論
藥物-成分-疾病-靶點網絡圖顯示,三棱-莪術藥對的核心活性成分包括常春藤皂苷元、芒柄花黃素、β-谷甾醇、豆甾醇、反式軟骨酸。常春藤皂苷元(MOL000296)為二者共同成分,通過調節線粒體凋亡途徑誘導乳腺癌細胞凋亡,降低線粒體APAF-1和細胞色素C蛋白,上調caspase-3和caspase-9的活性[11]。β-谷甾醇可誘導腫瘤細胞凋亡,抑制PI3K-Akt信號通路,可用于治療乳腺癌、前列腺癌和冠狀動脈疾病[12]。豆甾醇與化療藥物協同抑制乳腺癌的增殖和轉移,有廣泛的抗癌作用[13]。芒柄花黃素通過抑制纖維細胞生長因子2(FGF2)的活性抑制腫瘤血管內皮生成,抑制乳腺癌細胞中CXCR4和HIF-1α的過度表達,抑制乳腺癌細胞的增殖并阻斷致癌信號通路[14]。賈紹華等[15]研究表明,芒柄花素通過激活JNK信號通路誘導人乳腺癌MCF-7細胞凋亡抑制乳腺癌細胞增殖。
通過PPI網絡圖可見JUN、CASP3、PTGS2、ESR1、MPK14等是三棱-莪術抗乳腺癌的關鍵靶點。絲裂原活化蛋白激酶(MAPK)級聯是一種復雜的信號通路,對于將細胞外刺激轉化為廣泛的細胞過程至關重要。c-Jun N-末端激酶(JNK)通路是參與細胞活動調節的三種具有良好特征的MAPK通路之一,調節細胞周期、細胞增殖和轉化生長[16]。Caspase家族是腫瘤細胞凋亡的起始者和執行者,首先Caspase起始因子被凋亡信號激活,接著下游的Caspase效應因子激活, Caspase-3被激活后通過破壞細胞的蛋白結構和功能水解細胞一系列底物,在細胞凋亡中起著重要作用,成為腫瘤治療的主要靶點[17]。PTGS2是血管生成環境的重要調節因子,通過提高血管內皮生長因子(VEGF)的表達來刺激腫瘤血管生成。近年來,PTGS2與癌癥之間的潛在關系已成為抗癌研究的熱點,并且已經證明PTGS2可能在腫瘤促進,特別是乳腺癌中發揮重要作用。PTGS2的高表達可促進腫瘤細胞增殖、血管生成、侵襲性、轉移,以及抑制凋亡和免疫監測[18]。雌激素受體-1(ESR1)基因編碼雌激素受體-α(ERα),在70%的乳腺癌中表達,ERα表達可通過影響雌激素代謝途徑調節乳腺癌風險,ESR1突變是ER陽性乳腺癌內分泌治療抵抗和轉移的原因,并對芳香化酶抑制劑產生耐藥性[19-21]。MAPK14編碼p38 MAPK的α亞單位,調節多種細胞因子的產生,MAPK14通過與TGF-β13的協同作用在乳腺癌細胞中誘導細胞遷移和上皮-間充質轉化(EMT)中起著至關重要的作用[22]。
GO富集分析結果顯示,三棱-莪術抗乳腺癌的關鍵靶點主要通過影響類固醇激素受體活性、轉錄因子活性、核激素受體結合等分子功能起作用。KEGG通路富集分析結果顯示核心通路有VEGF信號通路、TNF信號通路、p53信號通路、催乳素信號通路等,揭示三棱-莪術藥對可能是通過以上途徑調控乳腺癌的病理進程。血管內皮生長因子(VEGF)信號通路是血管生成的關鍵介質,對腫瘤的發生和轉移至關重要[23]。VEGF及其受體VEGFR1和VEGFR2通常在腫瘤中過度表達[24]。VEGFR2已被證明可調節血管內皮細胞增殖和遷移以及血管通透性。這些效應是通過各種信號通路的下游激活介導的,包括PI3K通路、MAPK細胞外信號調節激酶(ERK)通路等[25]。乳腺癌常伴有炎癥過程,產生腫瘤壞死因子-α(TNF-α),TNF-α屬于TNF超家族,由19種蛋白質組成,具有激活、分化、存活和細胞死亡等多種生物學功能。microRNA (miRNA)是一類重要的內源性非編碼小RNA(21-25個核苷酸長),可在轉錄后調節基因表達,特別是miRNA-23b和miRNA-27b與人類乳腺癌的預后不良相關,TNF-α通過AKT/NF-κB信號通路刺激兩種miRNA的表達[26]。TNF-α在激活其受體后通過一個復雜的調節網絡,可誘導癌細胞凋亡或壞死、細胞生長、侵襲或增殖,即TNF-α受體1和2(TNFR1/2),以激活NF-κB信號傳導途徑,亦可激活JNK、MAPKs、AKT信號通路[27]。p53是第一個被發現的腫瘤抑制基因,通過轉錄調控下游靶基因的表達,具有消除和抑制細胞增殖、防止異常細胞的生長的功能,從而影響腫瘤的發展[28]。催乳素(PRL)是一種蛋白質激素,由垂體前葉腺嗜酸細胞分泌,研究表明乳腺癌患者體內的血清催乳素水平會明顯升高,催乳素可以提高乳腺組織對致癌因素的敏感性[29]。PRL與PRLr結合可增加乳腺癌細胞(BCC)侵襲和惡性淋巴細胞增殖,并導致化療耐藥[30]。
本研究通過網絡藥理學分析預測了三棱-莪術藥對抗乳腺癌的有效活性成分、關鍵靶點及作用機制,闡明了三棱-莪術藥對通過常春藤皂苷元、芒柄花黃素、β-谷甾醇、豆甾醇等7個有效活性成分,作用于JUN、CASP3、PTGS2等核心靶點,干預VEGF、TNF、p53、催乳素等信號通路,影響類固醇激素受體活性、轉錄因子活性、核激素受體結合,從而調控乳腺癌的病理進程。分子對接技術提示該藥對的有效活性成分與乳腺癌的疾病靶點可產生較好的結合活性,其中PTGS2與常春藤皂苷元、芒柄花黃素、β-谷甾醇、豆甾醇之間的結合活性可能為三棱-莪術藥對抗乳腺癌的重要機制之一。三棱-莪術藥對可以通過多成分、多靶點、多通路的方式抗乳腺癌的病理進程,該研究能夠為乳腺癌的臨床防治提供一定的理論依據。

