DNA復(fù)制調(diào)控與腫瘤發(fā)生發(fā)展的研究進(jìn)展
王艷珍,陳 亮
(武漢大學(xué)生命科學(xué)學(xué)院,湖北 武漢 430072)
腫瘤是一種生長不受控制的組織,不同類型的腫瘤機(jī)理差異很大,但幾乎所有的腫瘤細(xì)胞都具有若干共同特征,包括持續(xù)增殖、防止細(xì)胞凋亡和基因組不穩(wěn)定等[1]。DNA復(fù)制調(diào)控異常和DNA損傷會造成復(fù)制壓(replication stress),是基因組不穩(wěn)定的來源,也是癌前細(xì)胞和癌細(xì)胞的重要特征[2]。相較于正常細(xì)胞,腫瘤細(xì)胞在DNA的復(fù)制過程中會出現(xiàn)復(fù)制起始(replication origin)紊亂、S期檢查點(checkpoint)異常、復(fù)制叉暫停(replication fork stalling)等現(xiàn)象[2],并具有增殖速度快、細(xì)胞周期短、復(fù)制潛力無限等特征。因此,靶向DNA復(fù)制調(diào)控抑制腫瘤細(xì)胞增殖成為近年來腫瘤治療的重要手段,多種相關(guān)小分子藥物已進(jìn)行臨床試驗并取得了較好的研究成果。作者在簡單介紹DNA復(fù)制及其調(diào)控機(jī)制的基礎(chǔ)上,闡述DNA復(fù)制調(diào)控在腫瘤發(fā)生發(fā)展中的重要作用,并對DNA復(fù)制調(diào)控在腫瘤治療新方法研究中的作用進(jìn)行探究,以期為腫瘤治療提供新方向。
1 DNA復(fù)制及其調(diào)控機(jī)制
完整且準(zhǔn)確的DNA復(fù)制過程是細(xì)胞增殖和維持基因組穩(wěn)定性的重要基礎(chǔ),任何延遲、阻礙或終止DNA復(fù)制的缺陷均會導(dǎo)致DNA復(fù)制異常。因此,DNA復(fù)制調(diào)控的每個階段都極為重要,其對防止遺傳改變的積累、維持細(xì)胞生存和組織健康具有重要意義。
1.1 DNA復(fù)制
基因組DNA復(fù)制分為起始、延伸與終止3個過程。DNA復(fù)制起始的基因組區(qū)域稱為復(fù)制起始位點,該區(qū)域能被特定蛋白質(zhì)識別并結(jié)合形成復(fù)制前復(fù)合物(pre-replication complex,pre-RC),即為復(fù)制起始的許可(replication origin licensing),其被激活后稱為復(fù)制起始的起火(replication origin firing)。在G1期,由復(fù)制起始識別復(fù)合物(origin recognition complex,ORC)亞基ORC1~6形成的復(fù)合體被招募組裝到復(fù)制起始位點,然后募集ATP酶和CDC6并與之結(jié)合,進(jìn)而將DNA復(fù)制因子CDT1加載到復(fù)制起始位點,進(jìn)一步共同募集微型染色體維持(MCM)復(fù)合物以形成pre-RC[3]。在G1期向S期轉(zhuǎn)變時,DDK和細(xì)胞周期蛋白依賴性激酶(cyclin-dependent kinases,CDKs)磷酸化多種復(fù)制因子MCM10、CDC45、treslin、GINS、TOPBP1和DNA聚合酶ε(pol ε)以促進(jìn)它們募集到復(fù)制起始位點上,并直接磷酸化MCM2~7復(fù)合物,形成CDC45·MCM2~7·GINS(CMG) 復(fù)合物,激活MCM復(fù)合物的解旋酶活性,從而完成pre-IC的形成[3-4]。進(jìn)入S期后,MCM復(fù)合物誘導(dǎo)其它復(fù)制激活相關(guān)蛋白質(zhì)如復(fù)制因子C(replication factor C,RFC)、增殖細(xì)胞核抗原(proliferating cell nuclear antigen,PCNA)、復(fù)制蛋白A(replication protein A,RPA)和其它DNA聚合酶的募集,將pre-IC轉(zhuǎn)化為2個含有復(fù)制體的復(fù)制叉,復(fù)制叉從激活的起點向相反方向移動完成復(fù)制起始位點的激活[3]。真核生物中參與DNA復(fù)制起始的因子列于表1。
復(fù)制起始激活后,MCM10和酸性核質(zhì)DNA結(jié)合蛋白1(acidic nucleoplasmic DNA-binding protein 1,AND-1)募集DNA聚合酶α引物酶(pol α primase),催化合成短的核糖核酸(RNA)引物,引導(dǎo)DNA合成;隨著CMG解旋酶向相反方向移動,2個復(fù)制叉與polα引物酶、pol δ、pol ε和PCNA結(jié)合以促進(jìn)DNA合成[5];最后,當(dāng)2個相鄰的復(fù)制叉從相反的方向相互接近時,拓?fù)洚悩?gòu)酶Ⅰ(topoisomerase Ⅰ,Topo Ⅰ)和TopoⅡ會相繼釋放扭轉(zhuǎn)壓力,復(fù)制叉之間的所有蛋白組織(包括核小體)被移除,當(dāng)最后一個岡崎片段的雙鏈DNA合成并連接后便完成DNA的復(fù)制終止[6]。
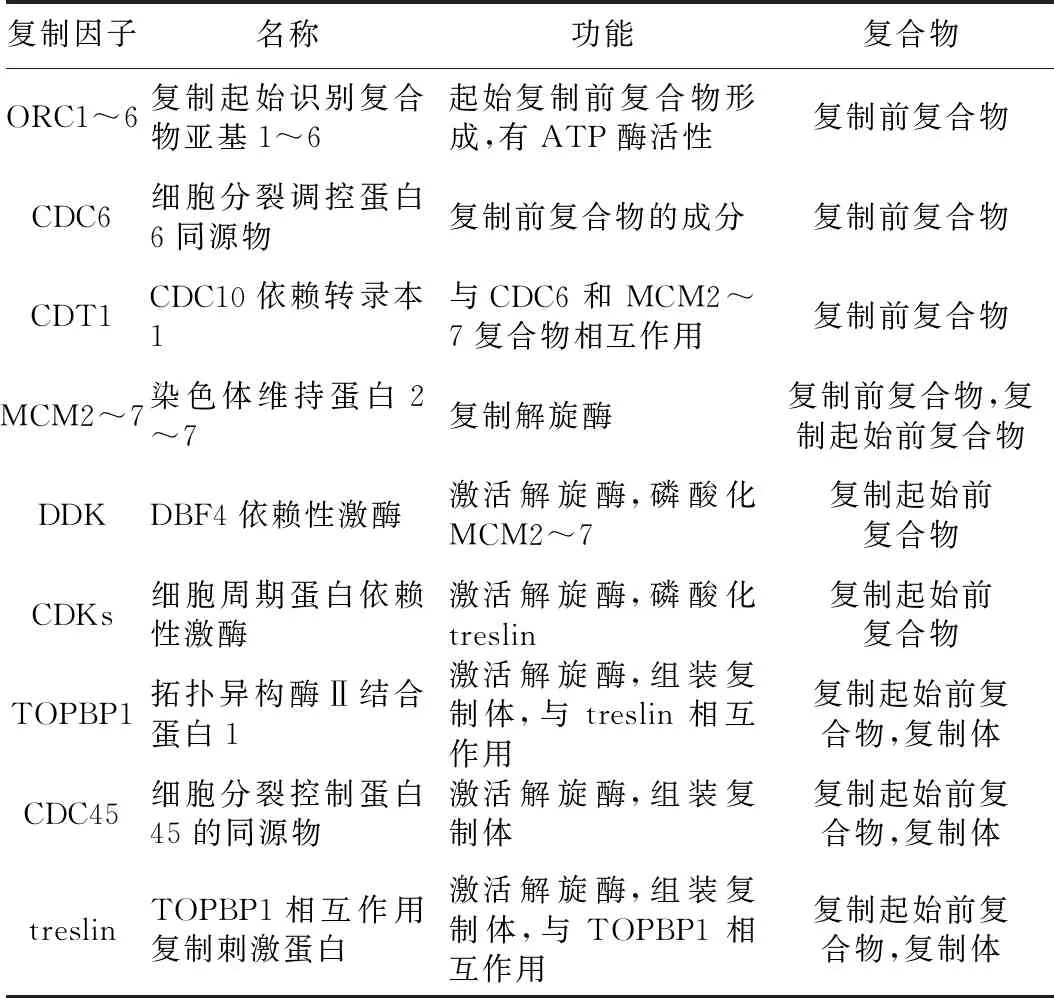
表1 真核生物中參與DNA復(fù)制起始的因子
1.2 DNA復(fù)制調(diào)控機(jī)制
DNA復(fù)制過程由眾多調(diào)控因子相互作用共同維持,包括細(xì)胞周期及其檢查點調(diào)控、DNA復(fù)制與轉(zhuǎn)錄協(xié)同調(diào)控、多聚ADP-核糖基化修飾機(jī)制等。
1.2.1 細(xì)胞周期及其檢查點調(diào)控
細(xì)胞周期蛋白(cyclin)、CDKs和CDK抑制因子(CDK inhibitors,CKIs)是參與細(xì)胞周期調(diào)控的主要因子。CDKs與不同周期表達(dá)的細(xì)胞周期蛋白相結(jié)合,其中CDK4是G1期重要分子,細(xì)胞周期蛋白D1能將其激活,導(dǎo)致細(xì)胞從G1期加速進(jìn)入S期。林宇靜等[7]發(fā)現(xiàn),在瘢痕癌中細(xì)胞周期蛋白D1和CDK4的表達(dá)量升高,導(dǎo)致細(xì)胞快速增殖,從而誘發(fā)癌癥。在G2晚期和M早期,細(xì)胞周期蛋白A與CDK1結(jié)合后使細(xì)胞向M期進(jìn)入。CKIs會抑制細(xì)胞周期蛋白與CDKs結(jié)合,導(dǎo)致細(xì)胞周期無法正常運行。因此,細(xì)胞周期蛋白、CDKs、CKIs之間的相互協(xié)調(diào)是保證細(xì)胞周期正常運行的關(guān)鍵。
細(xì)胞周期檢查點是監(jiān)測細(xì)胞周期主要事件的順序、完整性和保真度的機(jī)制。在檢測到DNA損傷后,毛細(xì)血管擴(kuò)張性共濟(jì)失調(diào)突變基因(ATM)和ATM/Rad3相關(guān)蛋白基因(ATR)可以將信號傳導(dǎo)至整個通路的核心——CHK1;ATR磷酸化激活CHK1,后者磷酸化CDC25,形成ATR-CHK1-CDC25通路,加速CDC25的泛素化降解,最終使細(xì)胞周期停滯[8];ATM亦可以通過磷酸化CHK1的Ser317位點激活整個信號通路[9]。在發(fā)生DNA雙鏈斷裂損傷(double-strand breaks,DSBs)時,ATM-CHK2-CDC25信號通路激活不同的細(xì)胞周期檢查點,對DNA損傷進(jìn)行修復(fù),使細(xì)胞周期進(jìn)程發(fā)生阻滯[10-11]。
1.2.2 DNA復(fù)制與轉(zhuǎn)錄協(xié)同調(diào)控
DNA的復(fù)制和轉(zhuǎn)錄都是細(xì)胞內(nèi)高頻的生物學(xué)過程,二者共用DNA模板,并且早期DNA復(fù)制和轉(zhuǎn)錄都發(fā)生在活性染色質(zhì)區(qū)域,可能導(dǎo)致轉(zhuǎn)錄-復(fù)制沖突(transcription-replication conflicts,TRCs),破壞基因組穩(wěn)定性和細(xì)胞活性,是癌細(xì)胞的標(biāo)志[2]。細(xì)胞如何調(diào)控轉(zhuǎn)錄-復(fù)制沖突仍是待闡明的生物學(xué)問題,清楚的是細(xì)胞依賴多種機(jī)制避免或解決沖突。
復(fù)制叉的移動方向和轉(zhuǎn)錄的延伸方向一致所造成的沖突稱為同向(co-directional,CD)的轉(zhuǎn)錄-復(fù)制沖突,反之稱為反向(head-on,HO) 的轉(zhuǎn)錄-復(fù)制沖突[12],其中,HO-TRCs對細(xì)胞危害更大,會造成染色體缺失、重組和細(xì)胞死亡[13]。為減少HO-TRCs,細(xì)菌基因組傾向于將一些必要且高頻轉(zhuǎn)錄的基因與復(fù)制同向進(jìn)行[14]。在哺乳動物細(xì)胞中,早期復(fù)制起始發(fā)生在開放的染色質(zhì)區(qū)域并且與轉(zhuǎn)錄延伸相互排斥,中頻轉(zhuǎn)錄的基因組區(qū)域通常與高復(fù)制起始頻率相關(guān),而在高頻轉(zhuǎn)錄的基因組區(qū)域中檢測到的復(fù)制起始事件非常少[13-14]。復(fù)制起始因子激活之前在染色質(zhì)上的重新分布是減少HO-TRCs的另一種機(jī)制,在果蠅中,MCM復(fù)合物的基因組分布受轉(zhuǎn)錄調(diào)控,在基因非轉(zhuǎn)錄區(qū)域富集,但在轉(zhuǎn)錄活躍區(qū)域減少[15]。RNA聚合酶Ⅱ促進(jìn)MCM復(fù)合物重新分配在非轉(zhuǎn)錄區(qū)域,避免轉(zhuǎn)錄區(qū)域早期DNA復(fù)制的起始[14]。Gros等[15]發(fā)現(xiàn),在酵母中, G1期加載在轉(zhuǎn)錄終止上的MCM復(fù)合物在終止位置突變后被RNA聚合酶重新定位到新轉(zhuǎn)錄區(qū)域之外。在S期,真核生物將基因組中復(fù)制區(qū)劃分出來,因此,DNA復(fù)制與轉(zhuǎn)錄協(xié)同調(diào)控機(jī)制發(fā)生在DNA復(fù)制過程的不同區(qū)域、不同時間[16]。
1.2.3 多聚ADP-核糖基化修飾機(jī)制
多聚ADP-核糖基化是由多聚ADP-核糖聚合酶(PARPs)催化和轉(zhuǎn)移的動態(tài)可逆翻譯后修飾。PARP1是PARPs家族主要成員,負(fù)責(zé)約90%多聚ADP-核糖基(poly-ADP-ribose,PAR)的修飾[17]。PARPs介導(dǎo)煙酰胺腺嘌呤二核苷酸(NAD+)中的ADP-核糖基(ADP-ribose,ADPR)以單個或多個形式與底物蛋白質(zhì)的特定氨基酸殘基發(fā)生共價連接反應(yīng)形成單ADP-核糖基化(mono ADP-ribosylation,MARylation)和多聚ADP-核糖基化(poly-ADP-ribosylation,PARylation)[18]。PAR修飾調(diào)控細(xì)胞內(nèi)多種生物學(xué)過程,包括復(fù)制、DNA修復(fù)、轉(zhuǎn)錄、代謝、應(yīng)激和免疫反應(yīng)等[19-20]。
研究報道,PARPs活性在復(fù)制叉處[21]和新復(fù)制的染色質(zhì)區(qū)域中[22]增強(qiáng)。PARP1與參與DNA復(fù)制的多種蛋白質(zhì)如pol α、pol δ、解旋酶、拓?fù)洚悩?gòu)酶和PCNA相互作用并刺激其活性[23-24],且這些蛋白很多被PAR修飾,表明PARP1可能作為傳感器調(diào)控復(fù)制叉進(jìn)程,或通過直接與復(fù)制蛋白結(jié)合催化其形成PAR來調(diào)控[23]。Hanzlikova等[24]發(fā)現(xiàn),S期DNA復(fù)制位點檢測到的PAR信號在未連接的岡崎片段產(chǎn)生,可能作為單鏈斷裂修復(fù)的“備用”機(jī)制,促進(jìn)岡崎片段連接。PARP1還可調(diào)控復(fù)制壓下DNA復(fù)制叉的延伸速率,抑制PARP1可反轉(zhuǎn)小分子藥物對復(fù)制叉進(jìn)程的抑制[25-26]。在未受干擾的細(xì)胞中,PARPs的抑制或敲除不僅導(dǎo)致復(fù)制叉延伸速率的加快,并檢測到復(fù)制起始之間的距離增大[27],進(jìn)一步驗證PAR修飾對復(fù)制叉和復(fù)制起始的調(diào)控作用。
另外,ADP-核糖基化活性也有助于PARP1修復(fù)DNA損傷和維持基因組穩(wěn)定性。作為DNA損傷應(yīng)答(DNA damage response,DDR)中的信號傳感器,PARP1與DNA單鏈斷裂 (single-stranded DNA breaks,SSBs)、DNA缺口或DSBs結(jié)合,發(fā)生結(jié)構(gòu)變化并激活其催化功能,在自身和鄰近蛋白進(jìn)行PAR修飾,促進(jìn)如X-線修復(fù)交叉互補(bǔ)基因1(X-ray repair cross complementing group1,XRCC1) 等DNA修復(fù)因子的募集,改變?nèi)旧|(zhì)結(jié)構(gòu)并促進(jìn)DNA損傷修復(fù)[28]。由于PAR修飾在多種DNA損傷中的修復(fù)作用,PARPs抑制劑的潛在抗腫瘤作用逐步被揭示并在臨床治療中被應(yīng)用。
2 DNA復(fù)制調(diào)控在腫瘤發(fā)生發(fā)展中的重要作用
2.1 腫瘤的特點與形成原因
人類腫瘤形成是一個多步發(fā)展的過程[29],受物理、化學(xué)、生物等因素誘導(dǎo)。基因組不穩(wěn)定性是驅(qū)動腫瘤發(fā)展并獲得基因突變和選擇性生長的重要因素[30]。例如某些環(huán)境化合物分子與DNA形成加合物,有可能造成特定腫瘤抑制基因或原癌基因突變和DNA復(fù)制壓,促使細(xì)胞癌化并持續(xù)增殖。
2.2 DNA復(fù)制在腫瘤發(fā)生發(fā)展中的重要作用
DNA復(fù)制異常體現(xiàn)在持續(xù)復(fù)制、復(fù)制叉停滯和崩潰、DNA損傷及DDR異常、檢查點和細(xì)胞周期失活、DNA損傷修復(fù)錯誤、復(fù)制重啟錯誤等。這些異常是推動腫瘤發(fā)展和基因組不穩(wěn)定的重要因素。腫瘤細(xì)胞具有無限的復(fù)制潛力,并規(guī)避復(fù)制異常缺陷。例如細(xì)胞周期調(diào)控機(jī)制在人類腫瘤中經(jīng)常失調(diào),導(dǎo)致腫瘤細(xì)胞周期蛋白的異常激活。研究[31]表明,失調(diào)的CDKs誘導(dǎo)非計劃性增殖和基因組不穩(wěn)定性,DNA損傷和有絲分裂檢查點的改變經(jīng)常導(dǎo)致CDKs活性增強(qiáng),從而驅(qū)動腫瘤細(xì)胞周期進(jìn)程。核心細(xì)胞周期機(jī)制內(nèi)的遺傳損傷導(dǎo)致其過度激活,在大多數(shù)腫瘤的發(fā)生發(fā)展中起著重要作用,并且腫瘤細(xì)胞中組成性有絲分裂信號傳導(dǎo)和對抗有絲分裂信號的缺陷反應(yīng)導(dǎo)致細(xì)胞惡性增殖[32-33]。
DNA損傷修復(fù)機(jī)制在腫瘤發(fā)生發(fā)展中也起著關(guān)鍵作用。鑒于腫瘤細(xì)胞形成多種DNA損傷及基因組不穩(wěn)定性,其生存更依賴DDR途徑。但與正常細(xì)胞不同的是,大多數(shù)腫瘤細(xì)胞會失去一個或多個DDR途徑或能力,從而導(dǎo)致對剩余途徑的更大依賴[34]。近年來,腫瘤的靶向治療被更多地應(yīng)用到臨床,更多靶向DNA復(fù)制的小分子藥物也被應(yīng)用到臨床。
3 DNA復(fù)制調(diào)控在腫瘤治療新方法研究中的作用
3.1 腫瘤的靶向治療
分子生物學(xué)和腫瘤生物學(xué)的進(jìn)步極大地改變了腫瘤治療方式,從傳統(tǒng)的手術(shù)、放療、化療到靶向治療、免疫治療和微創(chuàng)治療等,不斷涌現(xiàn)出新的治療方法。其中分子靶向治療是一種利用靶向特定致病分子的藥物進(jìn)行治療的手段,具有快速有效和便于推廣的優(yōu)勢。理想靶點的識別對于靶向療法的成功開發(fā)至關(guān)重要,腫瘤細(xì)胞特異性基因/蛋白是常見靶標(biāo)[35]。通過了解腫瘤特定分子靶點的生理學(xué)特征,可以確定抑制腫瘤發(fā)生發(fā)展的潛在分子策略。復(fù)制起始異常、DNA損傷、腫瘤特異性DNA修復(fù)缺陷等正常細(xì)胞的差異性特征,為腫瘤的分子靶向治療提供了新方向。
3.2 利用DNA復(fù)制起始開發(fā)腫瘤治療新方法
靶向DNA復(fù)制起始是腫瘤治療的重要方向。DNA復(fù)制起始蛋白常在腫瘤細(xì)胞中高表達(dá),而在非增殖正常細(xì)胞中不表達(dá)或低表達(dá)。因此,DNA復(fù)制起始蛋白可能成為腫瘤治療的潛在靶點,如靶向細(xì)胞分裂周期7(cell division cycle 7,CDC7)激酶[36-39]可有效且特異性殺傷腫瘤細(xì)胞,其作用機(jī)制為:在抑制CDC7后,正常細(xì)胞能夠利用細(xì)胞周期檢查點將細(xì)胞停滯在G1/S期交界處并暫停DNA復(fù)制,而腫瘤細(xì)胞由于缺失細(xì)胞周期檢查點依賴的基因,進(jìn)入S期后沒有足夠復(fù)制起始位點的激活而造成DNA復(fù)制異常,最終造成腫瘤細(xì)胞死亡。目前,多家生物制藥公司已啟動CDC7藥物開發(fā)計劃并進(jìn)入早期臨床試驗[40-41]。Feng等[42]運用靶向3個人類DNA復(fù)制起始基因hCdc6、hMcm2和hCdc45的反義寡核苷酸和siRNA分子,顯著降低靶基因產(chǎn)物的mRNA和蛋白質(zhì)水平,并阻止了DNA復(fù)制和細(xì)胞增殖,導(dǎo)致p53陽性和陰性腫瘤細(xì)胞凋亡,而不會導(dǎo)致正常細(xì)胞死亡。另有研究表明,抑制復(fù)制起始蛋白CDT1p活性的雙核蛋白片段可以抑制DNA復(fù)制和細(xì)胞增殖,并導(dǎo)致腫瘤細(xì)胞凋亡[43],siRNA對ORC6p(起始蛋白ORC的一個亞基)的基因沉默導(dǎo)致細(xì)胞周期失調(diào),包括有絲分裂阻滯和多核細(xì)胞出現(xiàn)[44],進(jìn)一步證明抑制復(fù)制起始蛋白活性的小分子是潛在的抗腫瘤藥物。
3.3 利用DNA復(fù)制應(yīng)激開發(fā)腫瘤治療新方法
DNA復(fù)制應(yīng)激是導(dǎo)致腫瘤基因組不穩(wěn)定的主要因素之一[45-46]。許多腫瘤抑制基因(tumor suppressor gene,TSG)的突變都會引發(fā)DNA復(fù)制應(yīng)激并激活A(yù)TR、CHK1和酪氨酸激酶WEE1等以確保復(fù)制叉的穩(wěn)定和修復(fù),并防止異常復(fù)制的基因組進(jìn)入有絲分裂M期[47-48]。因此,抑制DNA復(fù)制應(yīng)激和修復(fù)DNA損傷是提高腫瘤治療效果的途徑之一。
很多腫瘤細(xì)胞G1檢查點失調(diào),使其依賴于由ATR-CHK1通路調(diào)控的S/G2檢查點。除調(diào)節(jié)細(xì)胞周期檢查點外,ATR-CHK1在復(fù)制應(yīng)激時能夠保護(hù)細(xì)胞免受DNA損傷、穩(wěn)定停滯的復(fù)制叉、防止其崩潰和DSB形成、控制補(bǔ)償性起始位點的激活并促進(jìn)同源重組[49-50],這些特性使其成為治療干預(yù)的潛在目標(biāo)。目前,靶向ATR和CHK1的抑制劑已經(jīng)分別進(jìn)入臨床Ⅱ期和Ⅰ期。DNA復(fù)制應(yīng)激時CHK1還可以激活WEE1,使其抑制CDK1,從而將細(xì)胞阻滯在G2/M過渡期,靶向WEE1的抑制劑AZD1775也已進(jìn)入臨床Ⅱ期[45]。此外,更多在DNA復(fù)制應(yīng)激中起調(diào)控作用的蛋白抑制劑也不斷涌現(xiàn),包括TopoⅠ和TopoⅡ抑制劑、烷化劑和鉑化合物等。
3.4 PARPi在腫瘤治療中的應(yīng)用
PARPs抑制劑(PARPi)是以合成致死的理念被用于BRCA1/2突變的腫瘤治療[51]。BRCA1和BRCA2是介導(dǎo)DNA雙鏈斷裂后同源重組(homologous recombination,HR)修復(fù)的關(guān)鍵蛋白,BRCA1/2突變同時抑制PARPs即同時阻斷單鏈修復(fù)和HR修復(fù)對腫瘤細(xì)胞致死,為PARPi的理論基礎(chǔ)。此外,PARPs參與并調(diào)控許多DNA損傷修復(fù)的過程包括DNA單鏈斷裂(SSB)、雙鏈斷裂(DSB)、堿基切除修復(fù)(BER)和核苷酸切除修復(fù)(NER)等[45],而腫瘤細(xì)胞更依賴PARPs的修復(fù)作用,因此,PARPi在腫瘤治療方面的應(yīng)用潛力巨大。
目前,有4種PARPi(奧拉帕利、盧卡帕利、尼拉帕利和他拉唑帕利)已獲得美國食品藥品監(jiān)督管理局(FDA)批準(zhǔn),主要用于治療卵巢癌、乳腺癌、前列腺癌、胰腺癌等,還有很多PARPi正處于不同的臨床試驗階段,以治療更多依賴PARPs的腫瘤。PARPi除單藥使用外,與化療或放療聯(lián)合亦能提高腫瘤細(xì)胞化療或者放療的敏感性,并一定程度上克服了耐藥性,如PARPi與ATR、血管內(nèi)皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)、CDKs、WEE1、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)等激酶抑制劑聯(lián)用均表現(xiàn)出顯著的協(xié)同抗腫瘤作用。PARPi自上市以來顯著改善了部分腫瘤的治療現(xiàn)狀,使患者受益。因此,尋找更適合PARPi使用的腫瘤生物標(biāo)志物、優(yōu)化PARPi聯(lián)合治療方案、克服耐藥性以及降低毒副作用已成為腫瘤治療的研究熱點。
4 展望
DNA復(fù)制失調(diào)是腫瘤基因組不穩(wěn)定的主要驅(qū)動因素,靶向DNA復(fù)制的藥物成為腫瘤治療的重要手段。目前這些藥物的設(shè)計主要是針對腫瘤細(xì)胞相對于正常細(xì)胞表現(xiàn)出的脆弱性,如腫瘤細(xì)胞更加依賴某些DDR通路或DNA復(fù)制起始和細(xì)胞周期調(diào)控的蛋白。因此,找到腫瘤細(xì)胞更多的補(bǔ)償性DDR通路和腫瘤發(fā)生發(fā)展中的關(guān)鍵性脆弱點將為腫瘤治療提供更多可能。

