抗血管生成藥物聯合程序性細胞死亡蛋白-1抑制劑治療晚期非小細胞肺癌的臨床效果
徐保辰
山東省新泰市人民醫院腫瘤三科,山東新泰 271200
非小細胞肺癌(non-small cell lung cancer,NSCLC)是腫瘤科常見的肺癌類型,多見于吸煙或被動吸煙群體中,該病的發病率可占肺癌患者的85%及以上。針對早期NSCLC,臨床以手術切除為主,而對于晚期或無法經手術切除的NSCLC,則多使用放療+化療聯合療法或靶向治療達到殺滅腫瘤細胞, 抑制腫瘤生長的目的。 有研究指出,NSCLC 的發生發展與免疫應答及血供關系密切。 程序性細胞死亡蛋白-1(programmed cell death protein-1,PD-L1)抑制劑是當前研究最多且臨床發展最快的一種免疫檢查點抑制劑,該藥可激活機體自身的免疫細胞,殺傷腫瘤細胞。抗血管生成藥物通過阻斷癌細胞血液供應達到治療惡性腫瘤的目的。但既往關于二者的研究較少。故本研究選取新泰市人民醫院腫瘤三科收治的86 例晚期NSCLC 患者作為研究對象, 觀察抗血管生成藥物聯合PD-L1 抑制劑治療晚期NSCLC 的效果。
1 資料與方法
1.1 一般資料
選取2019年8月至2020年12月新泰市人民醫院腫瘤三科收治的86 例晚期NSCLC 患者作為研究對象, 按照入院編號奇偶數分組法將其分為試驗組(43 例)和對照組(43 例)。對照組中,男27 例,女16例;年齡40~77 歲,平均(59.94±3.22)歲;臨床TNM 分期:Ⅲa 期16 例,Ⅲb 期21 例,Ⅳ期6 例;病理分型:腺癌25 例,鱗癌18 例;患病時間2~8 個月,平均(4.16±1.42)個月;吸煙史31 例。 試驗組中,男30 例,女13例;年齡41~79 歲,平均(60.12±3.04)歲;臨床TNM 分期:Ⅲa 期18 例,Ⅲb 期13 例,Ⅳ期12 例;病理分型:腺癌20 例,鱗癌23 例;患病時間2~9 個月,平均(4.27±1.56)個月;吸煙史35 例。 兩組患者的一般資料比較,差異無統計學意義,具有可比性(P>0.05)。 所有患者及家屬均對本研究知情同意,本研究獲得新泰市人民醫院醫學倫理會批準(醫學倫理編號:2020C011)。
納入標準:①患者經肺部核磁共振造影(magnetic resonance imaging,MRI)及實驗室指標檢查,確診為NSCLC;②均為晚期患者;③患者均存在PD-L1 高表達。排除標準:①合并小細胞肺癌患者;②合并早中期肺癌患者;③合并不能耐受藥物治療者;④合并肝腎等其他器官功能障礙者。
1.2 方法
對照組患者給予常規化療藥治療。 治療前6 h 口服20 mg 地塞米松(廣東雷允上藥業有限公司,國藥準字H44022582,生產批號:210709,規格:20 mg×5片)。入院后第1 天,給予紫杉醇注射(江蘇紅豆杉藥業有限公司,生產批號:315471,國藥準字H20067344,規格:5 ml∶30 mg), 將135 mg/m本品與0.9%氯化鈉溶液500 ml 混合后, 經靜脈滴注,3 h 內滴注完畢。 第2~4 天,加用順鉑注射液(濟南益民制藥有限公司,生產批號:ZBD1915,國藥準字H20050269,規格:2 ml∶10 mg),將20 mg/m本品與0.9%氯化鈉溶液500 ml混合后,經靜脈滴注。 連續用藥5 d。 間隔3~4 周重復1 次為1 個療程。 共治療2 個療程。 治療期間同時給予護肝、護胃、止吐等輔助治療。
試驗組患者采用抗血管生成藥物貝伐單抗(山東博安生物技術有限公司,生產批號:401238,國藥準字S20200015,規格:100 mg∶4 ml)與PD-L1 抑制劑替雷利珠單抗[諾華(中國)生物醫學研究有限公司,生產批號:JBD2613,國藥準字S20190045,規格:10 ml∶100 mg)]治療。 將200 mg 替雷利珠單抗與0.9%氯化鈉溶液500 ml 混合后經靜脈輸注, 輸注時間應在60 min以上。間隔3 周給藥1 次。貝伐單抗第一次給藥在化療后, 此后用藥可自主選擇。 將5 mg/kg 本品與0.9%氯化鈉溶液500 ml 混合后,經靜脈滴注,90 min內滴注完畢。 間隔14 d 給藥1 次為1 個療程,共治療2 個療程。
1.3 觀察指標及評價標準
1.3.1 比較兩組患者治療前后的血清學指標 治療前、治療2 個療程后,采集兩組患者的空腹上臂靜脈血樣4 ml,經乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝后,在離心半徑為20 cm 離心機(德國eppendorf 生命科學公司,型號:5427 R)中以3000 r/min的轉速離心5 min 后,取血清置于4℃冷藏。采用高效液相色譜分析儀[賽默飛世爾科技(中國)有限公司,型號:UHPLC 型]以酶聯免疫法檢測血管內皮生長因子(vascular endothelial growth factor,VEGF),實時熒光定量分析法檢測胰島素樣生長因子-1(insulin-like growth factor-1,IGF-1)、單磷酸腺苷(adenosine monophosphate,AMP)激活的蛋白激酶(AMP-activated protein kinase,AMPK)水平。
1.3.2 比較兩組患者治療前后的腫瘤標志物 治療前、治療2 個療程后,使用“1.3.1”項血清學指標檢測使用的化學發光免疫法檢測癌胚抗原(carcinoembryonic antigen,CEA)、 細胞角蛋白19 可溶性片段(soluble fragment of cytokeratin 19,CYFRA21-1)、甲胎蛋白(alpha-fetoprotein,AFP)值。 檢測儀器同“1.3.1”項。
1.3.3 比較兩組患者治療前后的腫瘤體積 治療前及治療1、2、3 周,使用64 層螺旋CT 掃描系統(飛利浦醫療有限公司,型號:Micro-CT)行3~5 mm 間隔掃描,獲得所有腫瘤圖像后上傳至計算機圖像分析系統,計算腫瘤體積(tumor volume,TV)。TV=腫瘤長徑×腫瘤短徑。
1.3.4 比較兩組患者的生存情況 包括中位無進展生存期(median progression-free survival,mPFS)、中位總生存期(median overall survival,mOS)。
1.3.5 比較兩組患者的治療效果 治療效果評價指標包括完全緩解、部分緩解、穩定、進展。 完全緩解(complete relief,CR)是指患者的病灶消失,腫瘤標志物恢復至正常水平,且隨訪半年未見新病灶產生;部分緩解(partial relief,PR)是指患者的病灶縮小面積在60%以上,腫瘤標志物較治療前下降,但未恢復至正常水平,隨訪半年未見新病灶產生;穩定(stabilization of disease,SD)是指患者的病灶縮小面積在25%~60%,腫瘤標志物較治療前無明顯差異,隨訪半年未見新病灶產生;進展(progression of disease,PD)是指患者的已有病灶面積較治療前擴大25%及以上,或有新病灶產生,腫瘤標志物水平持續升高。 腫瘤控制率(disease control rate,DCR)=CR+PR+SD。 客觀緩解率(objective response rate,ORR)=CR+PR。
1.4 統計學方法
2 結果
2.1 兩組患者治療前后血清學指標的比較
兩組患者治療前的VEGF、IGF-1、AMPK 水平比較,差異無統計學意義(P>0.05);治療2 個療程后,兩組患者的VEGF 均低于治療前,IGF-1、AMPK 均高于治療前, 試驗組患者的VEGF、IGF-1 低于對照組,AMPK 高于對照組,差異有統計學意義(P<0.05)(表1)。
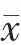
表1 兩組患者治療前后血清學指標的比較(±s)
2.2 兩組患者治療前后腫瘤標志物水平的比較
兩組患者治療前的CEA、CYFRA21-1、AFP 水平比較,差異無統計學意義(P>0.05);治療2 個療程后,兩組患者的CEA、CYFRA21-1、AFP 均低于治療前,且試驗組患者的CEA、CYFRA21-1、AFP 低于對照組,差異有統計學意義(P<0.05)(表2)。
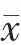
表2 兩組患者治療前后腫瘤標志物水平的比較(±s)
2.3 兩組患者治療前及治療1、2、3 周TV 的比較
兩組患者時間、組間、交互作用比較,差異有統計學意義(P<0.05)。 治療前,兩組患者的TV 比較,差異無統計學意義(P>0.05);治療1、2、3 周,兩組患者的TV 均小于本組治療前,且試驗組患者的TV 小于對照組,差異有統計學意義(P<0.05)(表3)。
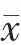
表3 兩組患者治療前及治療1、2、3 周TV 的比較(mm3,±s)
2.4 兩組患者生存情況的比較
試驗組患者的mPFS、mOS 均長于對照組, 差異有統計學意義(P<0.05)(表4)。
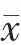
表4 兩組患者生存情況的比較(月,±s)
2.5 兩組患者治療效果的比較
兩組患者的ORR 比較,差異無統計學意義(P>0.05);試驗組患者的DCR 高于對照組,差異有統計學意義(P<0.05)(表5)。

表5 兩組患者治療效果的比較[n(%)]
3 討論
手術、化療、放療被稱作惡性腫瘤治療的三駕馬車。 常規放化療雖也能殺滅腫瘤細胞,但患者可能出現脫發、失眠、嘔吐等嚴重不良反應,治療體驗感較差。 隨著分子生物學的發展,臨床逐漸將抗癌重點傾向于細胞、基因層面,免疫治療、抗血管生成治療方案逐漸進入大眾視野。
腫瘤細胞的增殖、分化與機體的血液供應密不可分。 瘤體可自行生成新生血管,并經機體獲取營養供應自身生長。 VEGF 是常用的血管功能評價指標,它可特異性結合血管內皮細胞, 參與促進內皮細胞增殖、提高血管通透性。 VEGF 在惡性腫瘤中高表達,對瘤體新生血管形成、腫瘤生長及轉移均有重要作用。IGF-1 主要由肝臟產生, 可促進細胞增殖及分化,抑制細胞凋亡,是腫瘤重要的促生長因子。AMPK 具有調節能量代謝的作用。 高水平的AMPK 可調節神經元凋亡,減輕氧化應激反應,改善細胞線粒體功能,促進血管功能恢復。 本研究結果顯示,治療2 個療程后, 試驗組患者的VEGF、IGF-1 低于對照組,AMPK高于對照組,差異有統計學意義(P<0.05)。 提示抗血管生成藥物與PD-L1 抑制劑聯合使用, 可改善NSCLC 患者的血清學指標,抑制新生血管生成。 分析原因,貝伐單抗是一種新型抗血管生成藥物,該藥可與腫瘤細胞VEGF 相結合, 抑制VEGF 受體活化,從而抑制瘤體上生成新生血管,切斷腫瘤的血液和營養供應,起到持續抗腫瘤效果。 PD-L1 是機體重要的免疫抑制因子,可抑制免疫細胞活性,避免其被過度激活,穩定免疫系統生理功能。 但腫瘤細胞可改變機體內部微環境,誘導PD-L1 及PD-L2 高表達。 PDL1 抑制劑替雷利珠單抗通過阻斷PD-L1 及PD-L2分泌通路,部分恢復T 淋巴細胞功能,從而恢復受抑制的免疫系統功能。抗血管生成藥物與PD-L1 抑制劑聯合使用,具有協同增效作用,在抗瘤體新生血管生成的基礎上,通過激活免疫系統功能去攻擊腫瘤細胞,抑制癌細胞過度增殖、分化,保護機體正常的生理功能,進而達到調節血清學相關指標水平的目的。
腫瘤標志物是特異性反映腫瘤存在的物質,腫瘤標志物的存在及含量可提示腫瘤性質、治療效果及預后。 CEA 是常用的腫瘤標志物,在惡性腫瘤尤其是胃腸道癌、胰腺癌、肝癌、肺癌患者體內,CEA 高表達。CYFRA21-1 是肝癌的特異性診斷指標。 它是細胞角蛋白19 的可溶性片段。 在惡性腫瘤患者的上皮細胞內,細胞角蛋白19 被激活,細胞降解速度加快,大量細胞角蛋白釋放進入血液中,并與單克隆抗體特異性結合,為腫瘤生長創造條件。CYFRA21-1 顯著升高常提示腫瘤晚期。 AFP 是診斷肝癌和生殖細胞腫瘤的特異性標志物,約80%的肝癌患者體內均存在高濃度AFP。 本研究結果顯示,治療2 個療程后,試驗組患者的CEA、CYFRA21-1、AFP 低于對照組, 差異有統計學意義(P<0.05)。 提示抗血管生成藥物與PD-L1抑制劑聯合使用,可降低腫瘤標志物水平,提升治療效果。 分析原因可能與PD-L1 抑制劑與抗血管生成藥物聯合使用的機制有關。 兩種藥物聯合使用,不僅可抑制腫瘤生成新生血管,阻斷腫瘤營養供應,誘導瘤體凋亡,避免腫瘤繼續增殖、分化,穩定病情,同時還通過直接作用于免疫系統,減少腫瘤與免疫細胞巨噬細胞免疫球蛋白G 表面的Fc γ 受體結合, 發揮體液免疫及細胞免疫作用,促進腫瘤抗原的攝取、處理及遞呈, 消除抗體依賴的免疫細胞介導的吞噬效果,維持T 淋巴細胞正常的數量,從而提升抗腫瘤療效。 本研究結果顯示,治療1、2、3 周,試驗組患者的TV 小于對照組,DCR 高于對照組, 且PFS、OS 均長于對照組,差異有統計學意義(P<0.05)。 與既往研究類似,提示相較于常規化療藥物,抗血管生成藥物與PD-L1抑制劑聯合使用,可更好地促進瘤體體積縮小,還可延長患者生存期。 但本研究所選樣本量較少,研究結果還有待進一步深入研究驗證。
綜上所述, 晚期NSCLC 聯合抗血管生成藥物貝伐單抗與PD-L1 抑制劑替雷利珠單抗治療, 效果確切,可降低腫瘤標志物水平,改善血清學指標,還可縮小TV,延長患者生存期。

