磁控濺射法制備醫用鈦表面含銀抗菌涂層的研究進展
游 立,常培亮,馮 能,吳明超,黃 雷,喻 成
應用研究
磁控濺射法制備醫用鈦表面含銀抗菌涂層的研究進展
游 立,常培亮,馮 能,吳明超,黃 雷,喻 成
(武漢船用電力推進裝置研究所,武漢 430064)
本文分析探討了三種含銀復合抗菌涂層的相關科研成果,先后對含銀抗菌涂層的抗菌機理、不同體系的抗菌涂層基材與納米銀微粒制得的復合涂層的抗菌性能、成骨性能及相關問題進行分析探討,為高殺菌活性、高品質含銀復合抗菌涂層的研制開發提供更好的理論指導。
磁控濺射 納米銀 醫用鈦表面 抗菌涂層 成骨性能
0 引言
采用磁控濺射技術制得含銀復合抗菌涂層在醫用鈦及及其合金方面具有廣泛的用途,含銀復合抗菌涂層大體上可分為三大類:第一類是銀/陶瓷基復合抗菌涂層,常見的有Ag-TiO2、TaN-Ag等;第二類是銀/聚合物基復合抗菌涂層,聚合物材料主要有聚四氟乙烯等;第三類是銀與其他金屬元素復合抗菌涂層,例如與Ta、Ti等元素復合來拓展復合涂層的功能。
鈦及其合金因具有優良的生物相容性、耐腐蝕性和機械性能,在臨床上被廣泛用作骨骼、牙齒等人體硬組織的修復與替換材料[1-3]。然而,鈦及其合金植入體表面通常會由于細菌粘附、增殖形成生物膜(biofilm)[4-5],對醫用抗生素和人體免疫系統具有極強的耐藥性,從而有可能導致術后細菌感染和進一步的并發癥,造成手術失敗[6],甚至導致患者的死亡。因此,實現鈦及其合金植入體表面的抗菌性能,不僅有利于預防植入手術術后感染,而且對于有效減輕病患的痛苦、植入體有效使用壽命的延長均具有重要意義。
近年來,涉及在醫藥用鈦及其合金的外表面通過磁控濺射技術制得含銀復合抗菌涂層取得長效進步,并被廣泛報道[7-8]。納米銀是一種廣為人知的光譜抗菌材料,其主要是通過溶解釋放出銀離子與細菌的酶蛋白接觸進行有效殺菌,或通過直接對細菌的細胞壁進行有效破碎實現殺菌,當前已經在醫療器械、凈化水質處理、無菌棉紡織品、美容護膚、無菌包裝等民生醫療領域取得廣泛地應用[9-11]。與此同時,含銀復合抗菌涂層在醫藥鈦植入體的應用前景十分明朗,相關研究結果表明,植入體在生物體內溶解釋放出合適濃度納米銀微粒可促進生物體的成骨細胞增殖,大大增強植入體在生物體內的成骨活性。
當含銀復合抗菌涂層在醫用鈦及其合金的外表面應用技術比較成熟,不僅具備植入體材料結構性高強度的特點,同時具備功能涂層的殺菌活性及促進成骨生長的功效,因而備受醫療領域地廣泛關注。其制備方法大體上包括有化學水熱還原法、旋轉噴涂法、化學氣相沉積法、陽極氧化法、磁控濺射法等技術。
1 含銀抗菌涂層抗菌機理
金屬鈦及其合金作為植入體往往會存在術后細菌感染等后遺癥,植入體手術失敗的罪魁禍首主要由于細菌及其他生物交容易粘附于金屬鈦及其合金外表面形成生物膜,容易對植入體進行感染侵蝕。據統計,在關節置換手術病例中,大約有1%會發生假肢感染,而在牙科領域,種植體周圍炎的發生概率在前五年就高達14.4%,因此,病患需要進行長期的抗生素治療(可能持續數年),而植入體手術后由于生物膜和有機抗生素產生的耐藥性帶來的細菌感染等并發癥造成手術失敗,重新移植植入體產生高昂的費用同時會給病人帶來身理和心理上的痛苦。含銀抗菌涂層作為無機抗菌材料的重要代表,憑借其廣譜殺菌活性、良好的生物相容性、低毒性及不易產生耐藥性等獨特優勢而廣泛受到關注。
關于含銀抗菌涂層的殺菌機理在學術界還沒有形成權威的統一說法,但是相關人員普遍認為含銀抗菌涂層的納米銀微粒的殺菌性能主要與兩方面的因素有重要影響:銀離子釋放的數量/程度以及銀納米顆粒的活性(取決于納米銀顆粒的大小和形狀)。這兩大因素與控制細菌的增殖/生長機制直接相關,因為進入細菌的銀離子可以通過與某些組分(如酶)中的主要官能團結合而與細胞中的巰基(-SH)相互作用,從而阻止細菌分裂并破壞細胞膜[12];而尺寸較小的銀納米顆粒能夠直接與細胞接觸,破壞細胞膜,從而殺滅細菌。當前相關領域研究人員大多數采用磁控濺射技術將納米銀微粒與有機聚合物體系或陶瓷基體進行復合,并于醫用鈦及其合金的外表面制得含銀復合抗菌涂層。基體材料結構的高強度和耐磨性使得復合涂層不僅具有良好的機械耐磨性能,而且功能層中溶解釋放的納米銀會對機體的局部產生抗菌消炎的效果。
2 磁控濺射制備含銀復合抗菌涂層
作為典型的物理氣相沉積技術的鮮明代表磁控濺射技術,其具有操作簡單易控、沉積速率高、成膜致密均勻、涂層與基材結合力強、適合大批量規模化生產以及工藝綠色環保等優點,更由于能夠方便的調節納米銀在基相中的尺寸大小和空間分布,被廣泛應用于制備不同尺寸、不同功能應用領域的含銀復合抗菌涂層。磁控濺射技術的主要原理是利用外界電場的作用,將其施加在在真空室的兩個電極之間,注入真空室的工作氣體(一般是氬氣),可通過對工作氣體的電離,使得電離后的氣體離子可通過對靶材(陰極)上的原子或分子在襯底材料商進行噴射沉積(相關的磁控濺射技術的原理及過程如圖1所示)[13]。電場可以通過直流模式、射頻模式或者脈沖模式進行,取決于靶材的電導率和成膜質量要求。
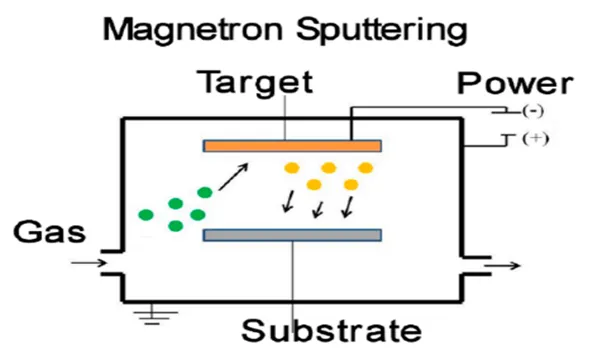
圖1 磁控濺射過程示意圖[13]
由于含銀抗菌涂層中納米銀微粒普遍存在粒徑小、比表面積大、活性高等特點,將其通過磁控濺射技術負載于不同的基體材料(有機聚合物、陶瓷)中會存在不同的分布情況,例如在銀/陶瓷基復合涂層中,會出現較嚴重的納米銀表面偏析現象,而在聚合物基中則不會。因此,對不同基體材料中含銀復合抗菌涂層的性能研究及相關差異性等問題的分析顯得十分重要。
2.1 銀/陶瓷基復合抗菌涂層
二氧化鈦(TiO2)是最早被用來磁控濺射制備含銀復合抗菌涂層的陶瓷基相材料之一。Ag-TiO2復合涂層可以采用Ag靶和TiO2陶瓷靶在氬氣氛圍制備,也可以利用反應磁控濺射技術,采用Ag靶和Ti金屬靶進行共濺射得到。Uhm等首先通過等離子體電解質氧化法在醫用鈦金屬表面生長TiO2納米管陣列,隨后在二氧化鈦(TiO2)納米管陣列上采用磁控濺射技術將納米銀微粒沉積在改基體上,可通過對銀靶材的濺射功能的調控來對沉積的納米銀微粒的形貌、大小及含量進行可控性調節,同時相關的抗菌性測試試驗結果表明,沉積有納米銀的TiO2納米管殺菌性能顯著優于單純的TiO2納米管[14]。F. Faupel等等通過同時采用二氧化鈦(TiO2)靶和銀靶,通過同時磁控濺射技術成功制得Ag-TiO2三維結構復合涂層,同時通過對含銀復合抗菌涂層中銀離子的溶解釋放速率進行表征來判定其抗菌性能[15]。該工作最大的亮點是系統研究了Ag-TiO2復合涂層抗菌的銀離子濃度“治療窗口”,即通過控制涂層中納米銀的顆粒分布與含量控制銀離子釋放速率,使其既具有抗菌性能,又不對人體正常細胞造成損害。Doo-Hoon Song等采用適宜于工業大批量大面積制備的反應磁控濺射技術,利用金屬Ti靶和Ag靶在醫用鈦表面共濺射沉積了Ag-TiO2復合涂層并表征其抗菌性能,其測試的銀離子釋放量均超過抗菌最低要求濃度0.1 ppb,顯示出涂層對大腸桿菌等具有優良的抗菌性能[16]。然而,在濺射沉積制備Ag-TiO2復合涂層中,由于沉積的納米銀微粒與二氧化鈦(TiO2)之間存在鍵合作用不明顯,反應活性較低等問題,使得納米銀微粒在基材表面表現出較強的流動性,磁控濺射沉積一旦停止,基材表面的納米銀微粒會自主發生團聚,進而表現出明顯的表面偏析現象[17](如圖2所示),導致銀顆粒在TiO2基相中的分布不均勻不可控,大量大尺寸銀顆粒富集的涂層表面無序釋放銀離子,可能對人體正常細胞造成潛在危害。嚴重制約了Ag-TiO2復合涂層的進一步應用。類似的磁控濺射技術過程中也常會出現在銀陶瓷基復合涂層中,納米銀微粒表現出表面偏析或富集的現象,例如(氮化鉭)TaN-Ag復合涂層[18],Ag-Hap(羥基磷灰石)[19]復合涂層和(二氧化鋯)ZrO2-Ag復合涂層等,雖然這些復合涂層都表現出優良的抗菌性能,但納米銀表面偏析導致的銀離子無序釋放的風險仍然存在[20]。Xiong等針對反應磁控濺射制備Ag-TiO2復合涂層中如何抑制納米銀表面偏析現象進行了深入、系統的研究。研究發現,在Ag-TiO2復合涂層表面原位沉積一定厚度二氧化鈦屏障層(barrier layer)可以有效抑制銀的表面偏析現象,而屏障層的致密程度越大,抑制效果越好[21]。

圖2 納米銀表面偏析現象[17]
2.2 銀/聚合物基復合抗菌涂層
有機聚合物基體自身表現出優藝的可加工性、耐高溫高濕性、耐酸堿腐蝕性等特點,在作為含銀抗菌復合涂層基相材料上具有較大優勢。付元靜采用磁控濺射法,在聚四氟乙烯(PTFE)膜上沉積納米銀膜,隨著納米銀濺射時間增加,銀離子在抗菌過程釋放總量增多,在殺菌活性測試試驗過程中可明顯看出其對金黃色葡萄球菌、大腸桿菌等均表現出抗菌性能隨著銀離子釋放總量的增多而逐漸增強[22]。而M. Irfan等采用磁控濺射法將銀與六甲基二硅氧烷(HMDSO)單體進行等離子體聚合,形成的Ag/HMDSO復合涂層對表皮葡萄球菌(一種革蘭氏陽性菌)具有顯著的抗菌效果[23]。尤其值得關注的是,由于有機聚合物材料良好的延展性、高彈性及可改性加工等特點,納米銀在其中流動性較弱,導致在含銀聚合物基復合涂層中基本沒有納米銀表面偏析現象被觀察到[24],主要歸因于納米銀微粒在有機聚合物體系中表現出高分散性,從而在制備醫用抗菌涂層方面具有較為廣闊的前景。
2.3 銀與其他金屬元素復合抗菌涂層
近些年來,相關科研人員通過磁控濺射共摻雜技術將金屬銀與其他金屬元素進行共沉積,制得功能型含銀復合抗菌涂層的報道越來越多。Wu Jun等通過射頻磁控濺射,在醫用鈦表面制備了Ag、Ta共摻雜的無定型磷酸鈣涂層,其所制得的Ag-Ta復合抗菌涂層不僅具有高效的殺菌活性,而且還具有良好的成骨性能。與此同時,研究人員首次發現金屬Ta的摻入可有效地抑制降低含銀復合抗菌涂層中銀離子的溶解釋放速率,一定程度上拓寬了含銀復合抗菌涂層的應用前景[25]。Thangavel等通過磁控濺射在鈦合金表面沉積了鎳鈦合金與銀的復合涂層,形成的復合涂層在摩擦系數、抗腐蝕性能等方面具有優異性能,不僅如此,Ni-Ti/Ag復合涂層對人類皮膚成纖維細胞展現出極高的細胞活性,顯示該復合涂層具有良好的成骨活性[26]。杭瑞強等以金屬鈦為基體,通過磁控濺射技術將金屬Ag和Ti實現共摻雜,實現Ti-Ag復合抗菌涂層,其中金屬Ag的質量分數在1.2%~21.6%范圍內,相關殺菌活性試驗結果表明,不同質量分數的銀對復合抗菌涂層的形貌表現出明顯的差異性,隨著銀含量的增加,復合涂層的形貌從密集的一維柱狀結構慢慢轉變為稀疏柱狀結構。所制得的金屬Ti-Ag復合抗菌涂層在殺菌活性試驗中對金黃色葡萄球菌表現出顯著的殺菌活性。此外,得益于涂層獨特的一維柱狀結構,Ti-Ag復合抗菌涂層顯示出良好的生物相容性和成骨活性[27]。He Xiaojing等通過磁控濺射在鈦金屬表面沉積了含有鍶(Sr)、Ag兩種金屬元素的TiO2復合涂層,其中金屬鍶是能夠促進新骨形成的重要元素。該研究發現適量濃度的銀離子可進一步促進醫用鈦植入體的成骨活性,而鍶的存在亦可有效減輕過量銀離子潛在的對人體的細胞毒性[28]。
3 結論與展望
開發自身具有抗細菌感染能力的醫用鈦植入體,避免病患因植入感染造成的二次手術痛苦,并改善植入材料成骨性能,是一項極具挑戰且意義重大的研究工作。在醫用金屬鈦及其合金外表面通過采用磁控濺射技術將單一或多種功能性金屬元素沉積在基體上制得含銀復合抗菌涂層是避免植入體手術術后細菌感染的最為有效地技術手段。本文主要深入分析探討了三種含銀復合抗菌涂層的相關科研成果,先后對含銀抗菌涂層的抗菌機理、不同體系的抗菌涂層基材與納米銀微粒制得的復合涂層的抗菌性能、成骨性能的相關研究進展進行了綜述,總結如下:
1)在銀/陶瓷基復合抗菌涂層中,需有效抑制納米銀的表面偏析現象,從而實現對銀離子釋放速率的精準調控,使其在有效抗菌的同時,又能避免細胞毒性。
2)在銀/聚合物基復合抗菌涂層中,應大力開發具有優良生物相容性和細胞活性的新型聚合物基體,促進銀/聚合物基復合抗菌涂層的進一步發展。
3)在銀與其他金屬元素復合抗菌涂層中,當前的研究熱點仍然是對含銀復合抗菌涂層的成骨性能的拓展研究,在摻雜不同金屬元素的同時,應關注涂層表面形貌、結構對成骨細胞黏附、生長的促進作用。
[1] 于振濤, 余森, 張明華, 等. 外科植入物用新型醫用鈦合金材料設計、開發與應用現狀及進展[J]. 中國材料進展, 2010, (12): 35-51.
[2] Geetha M, Singh A K, Asokamani R, et al. Ti based biomaterials, the ultimate choice for orthopedic implants A review[J]. Progress in Materials Science, 2009, 54(3): 397-425.
[3] Javed F, Al-Hezaimi K, Almas K, et al. Is Titanium Sensitivity Associated with Allergic Reactions in Patients with Dental Implants A Systematic Review[J]. Clinical Implant Dentistry and Related Research, 2013, 15(1): 47-52.
[4] Arciola C R, Campoccia D, Speziale P, et al. Biofilm formation in Staphylococcus implant infections. A review of molecular mechanisms and implications for biofilm-resistant materials[J]. Biomaterials, 2012, 33(26): 5967-82.
[5] Zimmerli W. Clinical presentation and treatment of orthopedic implant-associated infection[J]. Journal of Internal Medicine, 2014, 276(2): 111-119.
[6] Harris L G, Richards R G. Staphylococci and implant surfaces: a review[J]. Injury, 2006, 37(2): S3-S14.
[7] Zhang P, Zhang Z, Li W. Antibacterial coating incorporating silver nanoparticles by microarc oxidation and ion implantation[J]. Journal of Nanomaterials, 2013, 2013: 1-8.
[8] Zheng Y, Li J, Liu X, et al. Antimicrobial and osteogenic effect of Ag-implanted titanium with a nanostructured surface[J]. Int J Nanomedicine, 2012, 7: 875-84.
[9] Chernousova S, Epple M. Silver as antibacterial agent: ion nanoparticle, and mental[J]. Angewandte Chemie International Edition, 2013,52(6): 1636-1653.
[10] Marambio-Jones C, Hoek E M V. A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment[J]. Journal of Nanoparticle Research, 2010,12(5): 1531-1551.
[11] Morones J R, Elechiguerra J L, et al. The bactericidal effect silver nanoparticles[J]. Nanotechnology, 2005, 16(10):2346-2353.
[12] Lee S H, Jun B H. Silver nanoparticles: synthesis and application for nanomedicine[J]. International Journal of Molecular Sciences, 2019, 20: 865.
[13] Benetti G, Cavaliere E, Banfi F, et al. Antimicrobial nanostructured coatings: a gas phase deposition and magnetron sputtering perspective [J]. Materials, 2020, 13: 784.
[14] Uhm S H, Kwon J S, et al. Long-term antibacterial performance and bioactivity of plasma-engineered Ag-NPs/TiO2nanotubes for bio-implants[J]. Journal of Biomedical Nanotechnology, 2016, 12(10):1890- 1906
[15] Hrkac T, Rohl C, Podschun R, et al. Huge increase of therapeutic window at bioactive silver/titania nanocomposite coating surface compared to solution [J]. Materials Science and Engineering C, 2013, 33: 2367-2375.
[16] Song D H, Uhm S H, Lee S B, et al. Antimicrobial silver-containing titanium oxide nanocomposite coatings by a reactive magnetron sputtering [J]. Thin Solid Films, 2011, 519(20): 7079-7085.
[17] Calderon V S, Cavaleiro A, Carvalho S. Functional properties of ceramic-Ag nanocomposite coatings produced by magnetron sputtering. Progress in Materials Science, 2016, 84: 158-191.
[18] Huang H L, Chang Y Y, Lai M C, et al. Antibacterial TaN-Ag coatings on titanium dental implants [J]. Surface and Coatings Technology, 2010, 205(5): 1636-1641.
[19] Trujillo N A. Antibacterial effects of sputter deposited silver-doped hydroxyapatite thin films[J]. Disserta- tions & Theses-Gradworks, 2007, 32(8): 2135-44.馬福秋. 鎳鈦合金表面銀基復合鍍層的制備與性能研究[D]. 哈爾濱工程大學, 2012.
[20] Xiong J, Ghori M Z, Henkel B, et al. Controlling surface segregation of reactively sputtered Ag/TiOxnanocomposites[J]. Acta Materials, 2014,74: 1-8.
[21] 付元靜. 基于磁控濺射法制備AG/PTFE復合膜及其性能的研究[D]. 2018.
[22] Irfan M, Polonskyi O, Hinz A, et al. Antibacterial, highly hydrophobic and semi-transparent Ag/plasma polymer nanocomposite coating on cotton fabric obtained by plasma based co-deposition[J]. Cellulose, 2019, 26(16): 8877-8894.
[23] Mishra Y K, Mohapatra S, Chakravadhanula V S K, et al. Synthesis and characterization of Ag-polymer nanocomposites[J]. Journal of Nanoence & Nanotech- nology, 2010, 10(4): 2833.
[24] Wu J, Ueda K, Narushima T. Fabrication of Ag and Ta co-doped amorphous calcium phosphate coating films by radiofrequency magnetron sputtering and their antibacterial activity[J]. Materials Science & Engineering C, 2020, 109:110599.
[25] Thangavel E, Dhandapani V S, Dharmalingam K, et al. RF magnetron sputtering mediated NiTi/Ag coating on Ti-alloy substrate with enhanced biocompatibility and durability[J]. Materials Science and Engineering: C, 2019, 99: 304-314.
[26] Zhao, L Z, Hang R Q, Gao A, et al. Nanostructured titanium-silver coatings with good antibacterial activity and cytocompatibility fabricated by one-step magnetron sputtering[J]. Applied Surface Science, 2015, 355: 32-44.
[27] He X J, Zhang X Y, Bai L, et al. Antibacterial ability and osteogenic activity of porous Sr/Ag-containing TiO2coatings[J]. Biomedical Materials, 2016, 11(4): 045008.
Research progress of silver containing antibacterial coatings on medical titanium surface prepared by magnetron sputtering
You Li, Chang Peiliang, Feng Neng, Wu Mingchao, Huang Lei, Yu Cheng
(Wuhan Institute of Marine Electric Propulsion, Wuhan 430064, China)
TM272
A
1003-4862(2022)10-0105-05
2021-12-06
游立(1991-),男,工程師。研究方向:超細銀粉、電子漿料。E-mail: nickyou_cssc712@126.com

