2型糖尿病患者新型脂肪因子血清內臟脂肪素和內臟脂肪特異性絲氨酸蛋白酶抑制因子的表達水平與左心室肥厚的關系
馬藝欣 張仲迎 佀思聰 羅鴻宇 趙 歡 楊 偉
(首都醫科大學宣武醫院老年醫學綜合科,北京 100053)
左心室肥厚(left ventricular hypertrophy,LVH)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者常見的并發癥之一。LVH會影響心肌的收縮和舒張功能,導致心肌收縮不同步,嚴重者可能會出現心力衰竭甚至心源性猝死[1]。目前有學者[2]認為,胰島素抵抗、高脂血癥和糖尿病腎損害等可能是T2DM誘發LVH的危險因素。但也有研究[3]顯示,在調整了血糖控制情況、血脂水平、尿白蛋白排泄率和胰島素抵抗指數(homeostasis model assessment of insulin resistance,HOMA-IR)等相關危險因素后,LVH仍然與T2DM密切相關。因此,探討T2DM導致LVH的相關機制,有助于降低LVH在T2DM患者中的發病率,改善T2DM患者預后與生存質量。
內臟脂肪特異性絲氨酸蛋白酶抑制因子(vaspin)最早是由日本學者Hida 等[4]在2005年發現的一種脂肪因子,從 OLETF 大鼠(持續高血糖動物模型)的內臟脂肪中分離出來的,屬于絲氨酸蛋白酶抑制劑 serpin 家族的新型脂肪因子,vaspin只在肥胖的 OLETF 大鼠白色內臟脂肪中特異性表達,在其他脂肪組織中,如皮下脂肪、棕色脂肪、非脂肪組織、 LETO 大鼠白色內臟脂肪中均未發現其表達。并且研究[5]還顯示,vaspin 不在間質內皮、血管內皮細胞中表達,只表達在內臟脂肪組織的脂肪細胞中。vaspin與 T2DM、肥胖、胰島素抵抗及炎性反應等關系密切,胰島素抵抗會導致血清和脂肪組織中的vaspin濃度升高。Vaspin的分泌受多種因素的影響,既往vaspin相關研究[5]主要集中在肥胖及糖尿病相關的代謝綜合征,之后逐漸轉移至心血管系統疾病,但是,vaspin在代謝紊亂患者中的確切作用和潛在調節機制仍未明確,且vaspin是否與糖尿病人群的病理性心肌肥厚有關,目前還未有相關研究報道。
內臟脂肪素(visfatin)是一種由脂肪組織分泌的蛋白質因子,由Fukuhara等[6]在2005年首次發現。它是一種高表達于內臟脂肪組織的脂肪細胞因子,visfatin由內臟白色脂肪中的巨噬細胞釋放,有類似胰島素的生物學效應,可作為胰島素受體的配體,參與機體的新陳代謝、炎癥和應激反應。有文獻[7]顯示visfatin除了在脂肪組織中高度表達,在骨髓、肝臟和肌肉、心臟、胰腺和活化的淋巴細胞中也均有表達。近來的研究[8]顯示,visfatin與冠狀動脈粥樣硬化性心臟病(以下簡稱冠心病)、糖尿病、急慢性炎性反應性疾病等多種疾病的發生過程有關。
目前血清vaspin和visfatin表達水平在合并LVH的T2DM患者中的研究較少。本研究通過檢測LVH合并T2DM患者血清中vaspin和visfatin的表達水平,分析vaspin和visfatin與其他臨床指標的關系,探討vaspin、visfatin在T2DM誘發LVH過程中的作用和影響因素,為早期合并LVH的T2DM患者的診治提供臨床依據。
1 對象與方法
1.1 研究對象
本研究經首都醫科大學宣武醫院倫理委員會批準,倫理審批號:臨研審[2018]112號,臨研審[2022]140號。共納入首都醫科大學宣武醫院老年醫學科于 2017 年10月至2018年10月收治的93例T2DM患者,所有入組者已簽署知情同意書。將其中確診為LVH的45例患者作為病例組,未被診斷為LVH的48例患者作為對照組。
①入組標準:T2DM的診斷標準符合《中國2型糖尿病防治指南(2017年版)》[9]。②排除標準:I型糖尿病、糖尿病酮癥酸中毒、合并惡性腫瘤、急性感染、中重度瓣膜心臟病、繼發高血壓、肝腎功能不全、嚴重心律失常、糖尿病腎病、伴有甲狀腺功能亢進、甲狀腺機能減退、腎上腺疾病、長期口服調脂藥物或噻唑烷二酮類藥物等。
1.2 資料收集及方法
(1)一般臨床資料:身高、體質量、腰圍(waist circumference,WC)、臀圍、年齡、性別、合并疾病情況。
(2)實驗室檢查指標:空腹血糖(fasting plasma glucose,FPG)、空腹胰島素(fasting insulin,FINS)、糖化血紅蛋白(glycosylated hemoglobin type A1c,HbA1c)、超敏C反應蛋白(hypersensitive C-reactive protein,Hs-CRP)、血清C肽、總膽固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白膽固醇(high density lipoprotein-cholesterol,HDL-C)、同型半胱氨酸(homocysteine,Hcy)、尿酸(uric acid,UA)。使用酶聯免疫吸附法(enzyme linked immunosorbent assay,ELISA)測定血清vaspin和visfatin濃度。計算HOMA-IR,HOMA-IR=FPG× FINS/22.5。
(3)評估心臟結構:根據美國超聲心動圖學會(American Society of Echocardiography,ASE)的成人心腔定量評估指南[10]測定心臟相關指標,所有操作均由超聲科高年資主治醫師及以上進行。采用Devereux公式計算左心室心肌質量(left ventricular myocardial ,LVM)及LVM指數(LVM inden ,LVMI),以男性LVMI>115 g/m2、女性LVMI>95 g/m2為LVH的診斷標準。
1.3 統計學方法

2 結果
2.1 病例組與對照組臨床資料分析
病例組人群的平均年齡、合并冠心病比例、HOMA-IR、腰臀比(waist-hip ratio,WHR)、UA的濃度均高于對照組,HDL-C低于對照組,上述差異均有統計學意義(P﹤0.05),詳見表1。

表1 2型糖尿病人群左心室肥厚的單因素分析
2.2 血清visfatin、vaspin的表達水平與左心室肥厚的關系
表2結果顯示,病例組血清visfatin、vaspin濃度均高于對照組,差異有統計學意義(P<0.05),表明血清visfatin、vaspin的表達水平與左心室肥厚有關聯。
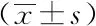
表2 兩組血清visfatin、vaspin的表達水平對比
2.3 血清visfatin的表達水平與左心室肥厚的關系的多因素分析
以左心室肥厚為因變量,將上述單因素分析中T2DM合并LVH相關的因素(性別、吸煙、年齡、合并冠心病、HDL-C、visfatin、vaspin、UA、WHR和HOMA-IR)為自變量,進行多因素Logistic 回歸分析。結果顯示,在控制了其他干擾因素的作用后,血清visfatin濃度仍然與 LVH 有關聯(P<0.05),但vaspin與LVH無關聯(P=0.068),隨著visfatin濃度升高,2型糖尿病患者左心室肥厚的危險性增大,此外冠心病是LVH的危險因素,HDL-C是LVH的保護因素,詳見表3。

表3 血清visfatin的表達水平與左心室肥厚的關系的多因素分析
2.4 Visfatin與糖脂代謝指標的相關性分析
以糖脂代謝相關指標[FPG、BMI、HOMA-IR、TG、TC、HDL-C、LDL-C、載脂蛋白B(apolipoprotein B,APOB)、UA及WHR]為自變量,visfatin為因變量,進行Spearman相關分析,結果顯示visfatin濃度與HOMA-IR(r=0.416)和UA(r=0.298)呈正相關;HDL-C(r=-0.305)與visfatin呈負相關(P<0.05),上述差異有統計學意義。詳見表4。

表4 血清visfatin的表達水平與糖脂代謝指標的相關性
3 討論
隨著糖尿病發病率的增加,全世界糖尿病患者的數量將在2025年翻倍至3億[11]。弗萊明翰(Framingham)心臟研究[12]結果顯示,糖尿病將男性心血管疾病發生風險增至2倍,女性增至3倍。糖尿病的心臟并發癥主要是冠心病和糖尿病性心肌病。有學者[13]提出,糖尿病可以通過引起糖脂代謝障礙、氧化應激、胰島素信號轉導異常、細胞膜電位及離子通道改變、微血管病變、自主神經病變及微RNA改變導致心肌細胞肥大、凋亡及間質細胞纖維化。T2DM患者左心室構型改變以向心性重塑為主,并與不良心血管事件有關,可能的機制為心肌的脂肪變性及能量代謝異常[14-15]。左心室心肌肥厚可以誘發心肌缺血、心律失常、充血性心力衰竭和心源性猝死[16-17]。因此,糖尿病人群的左心室結構和功能異常的初期檢查變得尤為重要。
性別、年齡、BMI、血壓、血糖、血脂等眾多因素均可影響心臟結構和功能。在血糖水平正常的狀態下,心臟收縮利用能量來源于葡萄糖和游離脂肪酸(free fatty acid,FFA)代謝。在高血糖水平,由于發生胰島素抵抗抑制葡萄糖轉運蛋白在心肌轉錄等因素,心肌的能量供應主要依賴于FFA生產底物[18]。糖尿病的“心臟代謝性重構”會導致心臟血管并發癥,主要指異常的糖及脂質代謝引起心肌原本能量利用途徑發生變化,使心臟構架和機械功能反常[19]。脂肪組織不僅僅是能量儲存庫,現在已經被看作是人體最大的內分泌器官,分泌多種被稱為脂肪因子的蛋白因子,例如脂聯素、抵抗素和vaspin等。脂肪因子作為新的心血管活性物質在心血管疾病的發病過程中扮演重要角色,參與多種生物功能調節,包括機體的免疫反應、糖脂代謝及炎性反應等過程。Visfatin是一種具有葡萄糖調節和促炎性反應特性的細胞因子,最初被確定為前B細胞集落增強因子,它在許多組織包括心臟和血管中表達[20]。臨床研究[21-22]證明,visfatin可以促進炎性反應并加重動脈粥樣硬化,是不穩定型心絞痛的炎性標志物。由于visfatin在炎性反應、血管損傷以及內皮功能紊亂等病理過程發揮著重要作用,提示其可能參與心肌肥厚及心臟衰竭發病過程。但目前visfatin對血管及心臟功能的影響仍尚有爭議。有研究[23]顯示冠心病患者腹部和心外膜脂肪組織的visfatin表達水平明顯高于健康人,且visfatin濃度與心外膜脂肪厚度呈正相關。而在另一項研究[24]中在兩組間的visfatin表達水平差異無統計學意義。目前visfatin在合并LVH的T2DM患者的研究亦不多見,因此血清visfatin是否能有效預測糖尿病心血管病的風險,成為評估T2DM合并LVH的標志物,仍是現階段亟待解決的問題。
Visfatin與糖脂代謝密切相關,研究者[8]從visfatin的角度探索糖尿病及其慢性血管并發癥的發病機制,本研究結果顯示T2DM患者存在心臟功能及結構改變,且visfatin在T2DM合并LVH患者中的表達水平更高,說明兩者可能在該病的發生、發展過程中起著至關重要的作用。目前關于visfatin表達與T2DM患者是否發生LVH的相關研究較少,具體機制尚不清楚。本研究中visfatin與糖脂代謝因素的相關性分析顯示T2DM可以加速動脈粥樣硬化,誘發心血管疾病。有學者[25]推測,T2DM患者在動脈高壓發展的早期階段,心臟血管的并發癥與促炎性和反炎性的脂肪細胞因子之間的失衡表達有關,從而影響心臟結構和功能的變化。Visfatin 與靶細胞表面的胰島素受體結合,通過受體酪氨酸亞基的磷酸化激活下游胰島素信號通路(Erk-1/Akt 和 p38 MAPK),介導了 STAT3 信號通路介導增殖反應,并顯著誘導炎癥增加促炎細胞因子(白細胞介素-6、腫瘤壞死因子α )的水平[26]。依據先前的理論研究推斷,Visfatin可能通過血管緊張素Ⅱ的協同作用促進心肌肥厚導致心臟功能改變[27]。而且本研究發現,T2DM合并LVH的人群在HDL-C的表達水平、胰島素抵抗指數及是否合并冠心病等因素與無LVH的人群中存在差異。Visfatin與HDL-C呈負相關性。Visfatin在LVH人群中呈高表達狀態,這與HDL-C恰好相反。HDL-C目前已被認為是心血管疾病的保護因子,且HDL-C的代謝與二氫尿嘧啶脫氫酶(nicotinamide adenine dinucleotide,NAD)密切相關,而visfatin是一種細胞內與NAD代謝相關的酶。Visfatin具有類胰島素樣作用影響糖脂代謝,這也提示在T2DM合并LVH人群中visfatin與脂質代謝之間存在著某種相關性。Visfatin也為T2DM合并LVH的發病機制研究增加了新內容。目前visfatin對于影響LVH的具體機制還有待于進一步探討,它在與糖脂代謝及動脈粥樣硬化等的關系上還需要進一步闡明。
本研究存在一些局限性,由于本研究為病例對照研究,尚無法明確相關因素的因果關系。且先前的研究[28]顯示vaspin在糖代謝、肥胖及動脈粥樣硬化中均有作用,而本研究顯示T2DM患者vaspin濃度與LVMI無相關性,本研究目前樣本量偏小,且為單中心研究,未進行隨訪,仍需擴大樣本量和多中心進行反復檢驗。且在本研究中涉及到相關的自變量較多,雖已有較為嚴謹的排除標準,但不除外存在共線性可能。本研究提示HDL-C濃度、冠心病在T2DM合并LVH中相關,visfatin作為新型脂肪因子,未來的研究應聚焦于脂肪因子、心肌代謝產物的變化和動脈粥樣硬化病理改變在合并LVH的T2DM患者中的變化和相關機制。
綜上所述,本研究顯示T2DM人群visfatin濃度與LVH關系密切,且HDL-C、冠心病及胰島素抵抗等因素也參與其中,有可能visfatin通過影響糖脂代謝、心肌損傷、缺血等因素導致心肌細胞肥厚,進一步介導心肌重構。這為臨床T2DM人群合并LVH的診斷、治療提供了新的靶點和思路。
利益沖突所有作者均聲明無利益沖突。
作者貢獻聲明馬藝欣:實驗、數據收集和論文撰寫;張仲迎:論文把關和審訂;佀思聰、羅鴻宇:數據的獲取、提供與分析;趙歡:數據收集;楊偉:研究設計和論文指導。

