貓泛白細胞減少癥病毒PCR檢測方法的建立
王利霞,扈嘉琪,王 平,鄔源泉,田 輝,楊文祥*
(1.湖北省疾病預防控制中心(應用毒理湖北省重點實驗室),湖北武漢 430070;2.新疆農業大學,新疆烏魯木齊 830052;3.武漢科前生物股份有限公司,湖北武漢 430070)
0 引言
貓泛白細胞減少癥是由貓泛白細胞減少癥病毒(Feline panleukopenia virus,FPV)引起的一種高度接觸性急性傳染病,也稱貓瘟熱、貓細小病毒病,該病在自然條件下可感染貓科、浣熊科和鼬科等家貓、野貓及野生動物包括動物園內如虎、獅、豹、浣熊等動物,患病動物表現為高熱、嘔吐、腹瀉和白細胞明顯減少等癥狀。
FPV屬于細小病毒科、細小病毒屬,于1928年首次被發現,1935年被正式命名為貓泛白細胞減少癥病毒。該病毒傳染性極強,可通過糞便、尿液、嘔吐物、唾液、鼻涕等進行傳播,可垂直傳播,亦可通過跳蚤等蟲媒傳播,可致妊娠母貓流產或畸胎,死亡率高。
貓在分類學上屬于動物門、哺乳綱、食肉目、貓科、貓屬。貓具有獨特的生物學特征,早在19世紀末,就有科學家將貓用于動物實驗。目前,廣泛應用于生物醫學研究領域,尤其是在神經類、心血管類藥物、降壓物質檢驗等領域,有著不可替代的地位。《中國藥典》規定貓是藥品檢驗——藥品降壓物質檢查實驗的唯一實驗用動物。
雖然貓被廣泛應用于實驗,但目前缺乏實驗用貓相應國家標準,僅有部分省份制定了地方標準,湖北省在實驗用貓標準這一塊尚為空白。現在用于實驗的貓多來源于農貿市場,遺傳背景不清楚,微生物和寄生蟲等病原攜帶情況不明確,貓的質量難以得到有效保障,實驗數據準確性、重復性無法保證。
因FPV是侵害貓的重要病原微生物,該病的發病率和死亡率均較高,嚴重影響貓的健康,本研究旨在建立一種針對FPV的快速高效的PCR檢測方法,用于篩選健康的實驗用貓,進而保障實驗的順利進行,同時為湖北省實驗用貓地方標準制定提供技術支撐。
1 材料和方法
1.1 材料
1.1.1 毒株與樣品。貓泛白細胞減少癥病毒(FPV)、貓皰疹病毒(Feline herpes virus,FHV)、貓冠狀病毒(Feline coronavirus virus,FCV)來自武漢科前生物股份有限公司;疑似FPV感染貓臨床樣品來自華中農業大學動物醫院和華星動物醫院(武漢大學店)。
1.1.2 主要儀器和試劑。D2000 DNA Marker、2×Taq plus Master Mix(含染料)購自北京蘭杰柯科技有限公司;血液基因組DNA提取試劑盒、微量樣品基因組DNA提取試劑盒購自天根生化科技(北京)有限公司。PCR 儀、凝膠成像分析系統購自美國 Bio-RAD公司;超微量紫外可見分光光度計購自美國丹諾爾Denovix公司。
1.2 方法
1.2.1 引物設計及合成。根據GenBank上FPV基因組(ID:KP769859.1)的保守序列VP2 基因,使用NCBI在線設計引物,序列為FPV-F:5’-TGGAAAACGGATGGGTGGAAA-3’;FPV-R:5’-TCCATGGAGTTGGTATGGTTGG -3’,目的片段長度為465 bp,引物由武漢賽維爾生物科技有限公司合成。
1.2.2 病毒DNA及樣品DNA的提取。FPV、FHV、FCV按照血液基因組DNA提取試劑盒說明書提取DNA,疑似FPV感染貓臨床樣品按照微量樣品基因組DNA提取試劑盒提取DNA。
1.2.3 PCR檢測方法的建立。構建PCR擴增體系25μL:2×Taq plus Master Mix 12.5μL,模板3μl,引物FPV-F和FPV-R(10μm/L)各0.2μl,雙蒸水補足25μl。95℃預變性3min;95℃變性30s,55℃退火30s,72℃延伸60s,35個循環;72℃延伸5min。PCR產物經1%瓊脂糖凝膠電泳檢測,目的片段送武漢賽維爾生物科技有限公司測序。
1.2.4 PCR檢測方法的優化。以提取的FPV基因組為模板,設置48.0℃,48.8℃,50.3℃,52.6℃,55.4℃,57.6℃,59.1℃,60.0℃共8個退火溫度進行PCR反應,確定最佳復性溫度。
1.2.5 PCR的敏感性檢測。利用超微量紫外可見分光光度計測定提取的FPV基因組濃度,將FPV基因組DNA連續10倍稀釋進行PCR擴增,凝膠電泳分析結果,確定PCR反應的敏感性。
1.2.6 PCR的特異性檢測。以構建的最佳PCR反應條件對FHV、FPV和FCV進行PCR擴增,凝膠電泳分析結果。
1.2.7 臨床樣品檢測。在華中農業大學動物醫院和華星動物醫院(武漢大學店)共采集了8份貓的肛拭子樣品,臨床診斷為疑似FPV感染。按照微量樣品基因組DNA提取試劑盒說明書對肛拭子樣品進行基因組DNA提取,使用本研究建立的PCR方法進行檢測和結果分析。
2 結果
2.1 PCR檢測方法的建立
引物FPV-F和FPV-R成功擴增出FPV的VP2基因目的片段,約500bp,與預期基因片段長度相符,見圖1。
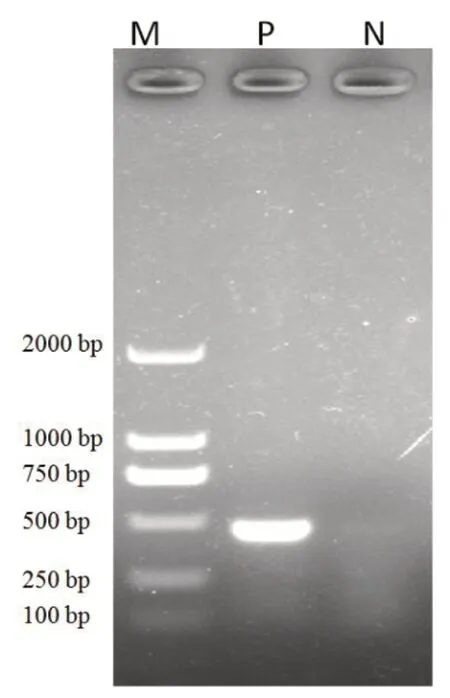
圖1 PCR擴增結果
2.2 PCR產物的鑒定及分析
PCR產物測序結果顯示獲得有效序列片段442bp,經BLAST分析,與GenBank公布的貓泛白細胞減少癥病毒HN39AA株VP2基因序列(ID:MK357738.1)同源性為98%,與設計引物的靶基因序列同源性為97%。
2.3 PCR檢測方法的優化
通過設置不同的退火溫度,優化PCR的擴增條件,結果如圖2 所示,8個退火溫度均能夠擴增到明顯目的帶,但是在55.4℃時,目的帶的亮度最高,因此確定55℃為最佳退火溫度。
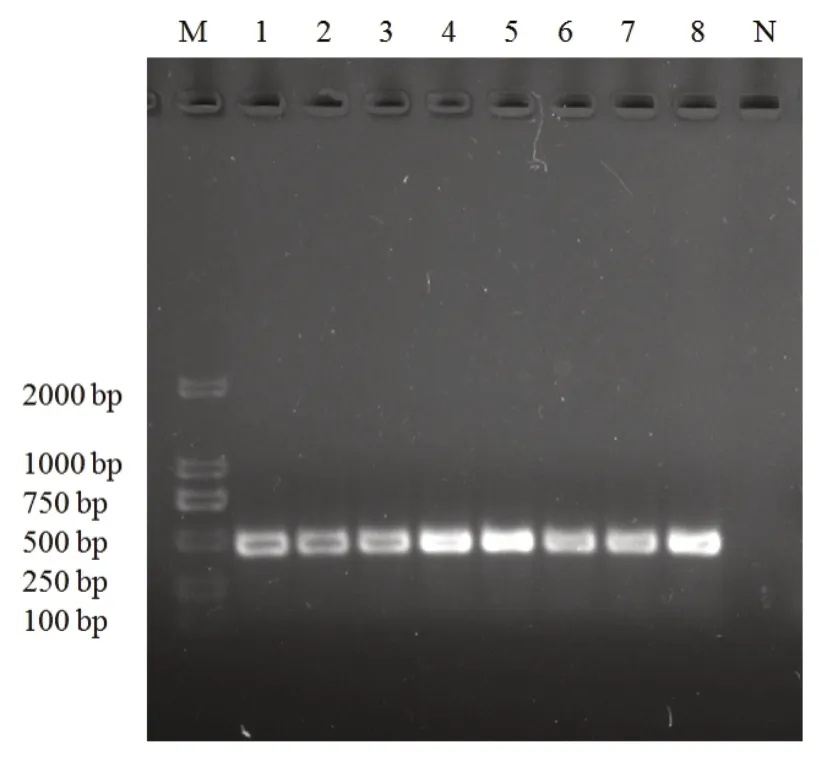
圖2 PCR檢測方法的優化
2.4 PCR的敏感性檢測
原始FPV基因組的質量為4.42 ng/μL,經連續10倍稀釋后作為模板進行PCR擴增,結果顯示PCR的最低檢測量為4.42×10-5ng/μL,見圖3。
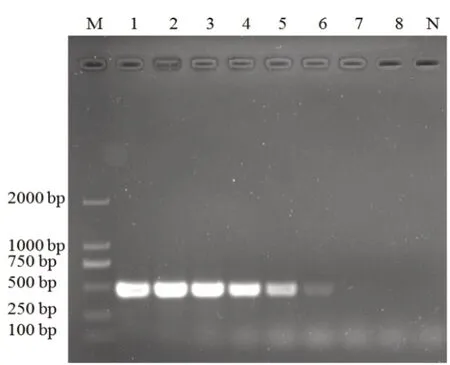
圖3 PCR的敏感性檢測
2.5 PCR的特異性檢測
選擇臨床上常見的感染貓的FHV、FPV、FCV進行特異性實驗,同時設陰、陽性對照。結果顯示,僅FPV可以擴增到特異性條帶(圖4)。
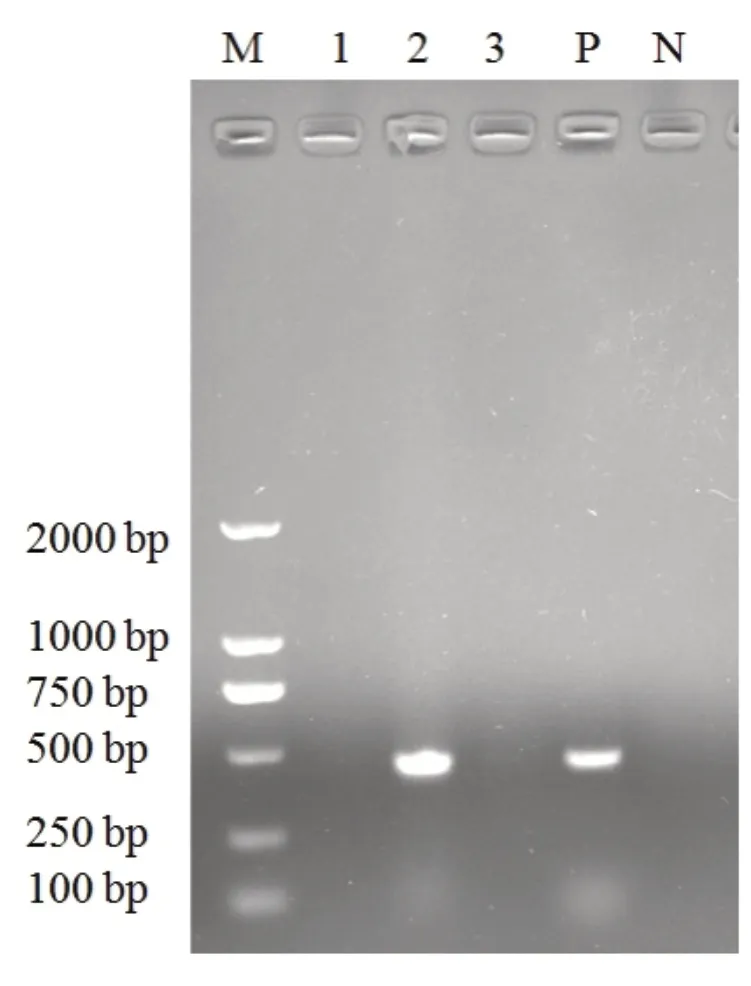
圖4 PCR的特異性檢測
2.6 臨床樣品檢測
采集8份疑似FPV感染的貓肛拭子樣品,提取DNA后,采用本研究建立的PCR檢測方法進行檢測,結果顯示2份樣品為FPV陽性(圖5)。
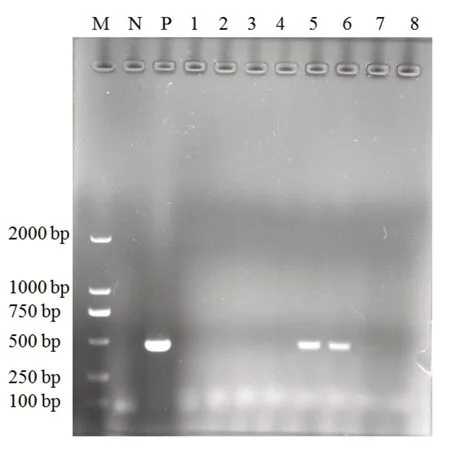
圖5 臨床樣品檢測
3 結論
貓泛白細胞減少癥常表現為白細胞計數嚴重減少和腸炎伴腸絨毛退化,具有高度傳染性,并伴有高發病率和高死亡率。隨著貓越來越多地應用到科學研究和藥物檢測中,增加了貓瘟等傳染性疾病傳播流行的潛在風險。PCR方法具有敏感、特異、技術成熟等優點,便于在臨床使用。
本研究通過優化PCR反應的退火溫度,確定最佳反應條件,并對擴增產物進行了測序分析,確定PCR反應可以有效擴增到目的片段。同時對PCR檢測方法的敏感性和特異性進行了檢測,確定該PCR反應的靈敏度高、特異性好,并進行了初步的臨床應用,該方法適用于貓泛白細胞減少癥病毒的檢測。
目前,標準化的實驗動物如大鼠、小鼠、豚鼠、兔、犬、猴等,均有相應的國家標準對其微生物和寄生蟲檢測指標做了規定,但缺乏貓的相應國家標準,我省擬制定實驗用貓的相關標準。貓泛白細胞減少癥病毒作為對貓健康狀況有重大影響的一個病毒,是我省實驗用貓需要檢測的微生物項目,本研究方法的建立將為地方標準的制定提供技術支撐。

