模擬Co膠體在壓水堆停堆氧化運行期間的溶解行為研究
李富海,梁維江,方 軍,林根仙,李新民,孫 云
(1.蘇州熱工研究院有限公司,江蘇 蘇州 215008;2.大亞灣核電運營管理有限責任公司,廣東 深圳 518000)
為實現碳達峰和碳中和目標,促進中國經濟的綠色、多樣化轉型,高效、清潔、低碳排放的核能將在中國能源結構中發揮更重要的作用[1-2]。核能的可持續發展要求核電站不斷提升運營水平。集體劑量是衡量核電站運行、維修、管理、輻射防護水平的重要指標,也是世界核電運營者協會(WANO)同行評議的重要性能指標[3-4]。降低集體劑量一直是各核電站和相關研究機構不斷努力的目標。
壓水堆大修期間活化腐蝕產物在一回路管道和設備表面的沉積,是導致堆芯外輻照場的主要原因,貢獻了約80%~95%的集體劑量[5-6]。以2020年大亞灣核電基地6臺機組為例,其中4臺機組大修集體劑量約占總劑量的80%以上(2臺機組未統計)[7]。
法國統計數據表明,活化腐蝕產物中60%的劑量貢獻來自60Co,15%的貢獻來自58Co[8]。因此,Co是壓水堆核電站最重要的活化腐蝕產物核素,是集體劑量的主要貢獻者。含Co活化腐蝕產物在一回路中可能以離子態、顆粒態或膠體態存在。
壓水堆的化學與容積控制系統(CVCS)的凈化單元通常為過濾器+除鹽床的組合,離子態Co很容易通過除鹽床的離子交換樹脂去除,Co顆粒與Co膠體則依賴過濾器去除。目前國內核電站采用的過濾器濾芯的濾徑逐步從0.4 μm升級到0.1 μm,可有效濾除直徑大于0.1 μm的腐蝕產物顆粒,但對直徑小于0.1 μm的Co膠體腐蝕產物清除能力有限。這些Co膠體腐蝕產物極易沉積在管道表面形成輻射“熱點”,對大修工作人員產生照射,從而對集體劑量產生貢獻。此外,這些未被清除的Co膠體還可能堵塞離子交換樹脂孔隙,使其交換能力下降或失效,增加放射性固體廢物的產生量。
Co膠體活化腐蝕產物對集體劑量的貢獻已逐漸凸顯出來,然而對其進行的專門研究還很少。由于一回路活化腐蝕產物的強放射性,無法直接取樣進行研究,在實驗室制備模擬Co膠體活化腐蝕產物開展研究便成為唯一的選擇。
在壓水堆停堆大修時,溫度與壓力逐步降低,同時經過硼化、除鋰操作,一回路的堿性-還原性環境變為酸性-還原性環境。當溫度降至80 ℃以下時,國內外大多數壓水堆采用強制氧化運行工藝,即向一回路注入雙氧水(H2O2),將一回路的環境進一步轉變為酸性-氧化性環境,促使沉積在堆芯的腐蝕產物快速釋放并溶解,然后通過RCV的除鹽床將其去除。氧化運行過程決定了一回路放射性的凈化效果[7-8]。其中溫度、pH值、H2O2濃度等水化學條件對Co膠體等腐蝕產物的溶解行為影響很大,然而目前缺乏系統深入的研究。
因此,本文模擬一回路水質與水化學環境,在實驗室制備粒徑小于0.1 μm的模擬Co膠體。然后在模擬氧化運行期間的水質與水化學條件下,深入研究溫度、pH值、H2O2濃度對模擬Co膠體溶解行為的影響,根據實驗結果取得對模擬Co膠體溶解去除最有利的水化學條件,為氧化運行工藝的優化提供參考。
1 實驗材料與方法
1.1 化學試劑和儀器
六水合氯化鈷(CoCl2·6H2O)、硼酸(H3BO3)、氫氧化鋰(LiOH)、85%聯氨溶液(N2H4)、30%雙氧水溶液(H2O2),分析純,國藥集團化學試劑有限公司。相關溶液均由超純水配制。
Milli Q超純水系統,德國默克公司,出水電導18.3 MΩ·cm;HH-6恒溫磁力攪拌水浴鍋,金城春蘭實驗儀器廠;JEOL 2010透射電子顯微鏡(TEM),日本電子株式會社(JEOL);VEGA TS 5136XM掃描電子顯微鏡(SEM),捷克泰思肯公司;Analytik Jena-contrAA 700原子吸收光譜儀(AAS),德國耶拿分析儀器股份公司。
1.2 模擬Co膠體制備
以大亞灣核電站為例,壓水堆一回路正常運行期間,溫度為300 ℃、壓力為1.57×107Pa,采用H3BO3與LiOH協調控制pH值,使冷卻劑呈弱堿性,pH300 ℃=7.2;注入少量溶解氫氣,使冷卻劑維持弱還原性,抑制水的輻射分解,減少材料腐蝕。為在常溫(25 ℃)下模擬一回路的弱堿性條件,使溶液中OH-的濃度與壓水堆正常運行期間相同,根據ChemWorks軟件計算水在不同溫度下的電離情況(表1),得到相應的pH25 ℃=9.8。同樣采用H3BO3與LiOH(B-Li緩沖液)調節pH值,經實驗確定,常溫(25 ℃)下固定B濃度為100 mg/kg(對應HBO3濃度為572 mg/kg),調節Li濃度為9.2 mg/kg(對應LiOH濃度為220 mg/kg),B-Li緩沖液的pH值為9.8。為模擬一回路的弱還原性條件,向反應液中加入50 mg/kg N2H4,N2H4是核電站采用的添加劑,不會引入其他雜質。

表1 不同溫度下純水的中性pH值Table 1 Neutral pH of pure water at different temperatures
實驗操作如下:向B-Li緩沖液中加入N2H4溶液,常溫(25 ℃)下以400 r/min磁力攪拌10 min,使溶液混合均勻,向上述B-Li-N2H4溶液中緩慢滴加CoCl2溶液,使最終溶液為:HBO3,572 mg/kg;LiOH,220 mg/kg;N2H4,50 mg/kg;CoCl2,0.5 mmol/L。反應2 h后,將反應后的溶液進行抽濾(0.22 μm濾膜),過濾出Co膠體,將Co膠體超聲再分散于純水中,再次進行抽濾。重復上述操作,直到濾液中檢測不出Cl-,將Co膠體收集分散于純水中備用。
1.3 模擬Co膠體表征
將模擬Co膠體于乙醇中超聲分散后,滴在銅網上,采用TEM表征其形貌和粒徑,采用高分辨TEM表征其表面的晶格條紋。采用SEM表征烘干后的塊狀模擬Co膠體的表面形貌,采用SEM配置的EDS(Octane SDD)測量其表面元素組成。
1.4 模擬Co膠體溶解行為
以大亞灣核電站為例,停堆氧化運行期間,一般保持B濃度為2 200~2 400 mg/kg、Li濃度為0~1.3 mg/kg,溫度維持在60~80 ℃。一回路氧化還原環境變化不能過于劇烈,H2O2濃度一般不超過20 mg/kg。Co膠體的總濃度控制為約5 mg/kg。
典型實驗操作如下:提前設置恒溫磁力攪拌水浴鍋到實驗溫度;稱取一定量的模擬Co膠體于錐形瓶(記為錐形瓶1)中,加入高純水超聲20 min分散均勻;加入磁子,將錐形瓶1轉入恒溫磁力攪拌水浴鍋,開啟磁力攪拌,同時預熱溶液;另取一錐形瓶(記為錐形瓶2),加入HBO3、LiOH、H2O2溶液,混合均勻,提前預熱至實驗溫度;將錐形瓶2中的溶液加入到錐形瓶1中,使反應液總質量為400 g。反應開始后,每隔一段時間取反應液,立即用一次性針頭過濾器(0.22 μm濾膜)過濾,然后采用AAS測量濾液中離子態Co的濃度。
2 結果與討論
2.1 模擬Co膠體的表征
CoCl2溶液本身呈淺粉紅色,當CoCl2溶液加入到B-Li-N2H4溶液后,反應液立即變為藍青色,反應一段時間后變為黃褐色。反應結束后可觀察到明顯的丁達爾效應,說明成功制備了Co膠體。
1) 模擬Co膠體的形貌
Co膠體的TEM形貌如圖1所示。從圖1清晰可見模擬Co膠體,進一步證明在模擬實驗條件下成功制備了模擬Co膠體。其形貌為不規則的球形。采用Nano Measurer軟件對圖1b、c中的模擬Co膠體粒徑進行統計,結果如圖2所示。由圖2可知,模擬Co膠體的粒徑小于100 nm,平均粒徑為40~50 nm。

圖1 模擬Co膠體的TEM圖像Fig.1 TEM image of simulated Co colloid
2) 模擬Co膠體的成分
模擬Co膠體的表面晶格結構如圖3所示。可見,模擬Co膠體表面晶格條紋無序,說明模擬Co膠體不是單晶而是多晶態。模擬Co膠體的表面成分如圖4所示。由圖4可知,模擬Co膠體表面的元素主要為Co和O,元素比(Co∶O)平均值為1.25∶1。因此,模擬Co膠體的主要成分為CoO和單質Co。

圖2 模擬Co膠體的粒徑統計分布直方圖Fig.2 Histogram of particle size distribution of simulated Co colloid

圖3 模擬Co膠體的高分辨TEM圖像Fig.3 TEM image of simulated Co colloid
2.2 模擬氧化運行條件下Co膠體的溶解行為
固定B濃度為2 350 mg/kg,溫度為80、70、60 ℃,研究0、5、10、20 mg/kg H2O2和0、0.5、1.3 mg/kg Li對Co膠體溶解行為的影響。
采用PHREEQC計算B-Li溶液在60~80 ℃下的pH值,如表2所列。在本研究的實驗條件范圍內,反應液均為弱酸性。
1) H2O2濃度對模擬Co膠體溶解行為的影響
在溫度為70 ℃、不同Li濃度下,H2O2濃度對模擬Co膠體溶解行為的影響如圖5所示。可看出,Co膠體的溶解反應速率很快,反應0.5~1 h后,基本達到平衡(反應(1)、(2))。相比不加H2O2,加入5~20 mg/kg H2O2后,Co膠體的溶解反應速率有所提高,且達到平衡時Co2+的濃度增大,說明加入H2O2會促進Co膠體溶解。這是因為模擬Co膠體的主要成分是CoO和Co單質,一方面,H2O2是一種弱酸,可增強溶液的酸性,促進Co膠體的溶解,但影響有限(反應(3))。另一方面,在酸性條件下H2O2具有強氧化性,可顯著促進單質Co氧化為離子態(反應(4))[9-10]。此外,調研發現,某些過渡金屬氧化物,如CoO等,對H2O2的分解有催化作用,在這個過程中,CoO被H2O2活化,反應性增強,因而CoO的溶解加快[11-13]。這是因為催化劑實際參與了反應過程,雖然在反應前后自身質量和化學性質不變,但物理性質(物相、形狀、密度、粒徑等)一般會改變[14-15],結構發生重排,粒徑變小,如塊狀的MnO2作為催化劑在反應后變成粉末狀。本實驗條件下,CoO在催化H2O2分解的過程中物理性質改變,粒徑變小,其活性增強,導致溶解加快。

圖4 模擬Co膠體的表面元素組成Fig.4 Surface element composition of simulated Co colloid

表2 PHREEQC計算的不同溫度下B-Li溶液的pH值Table 2 Calculated pH of B-Li solution at different temperatures by PHREEQC
CoO+2H+=Co2++H2O
(1)
Co+2H+=Co+H2
(2)
(3)
Co+H2O2+2H+=Co2++2H2O
(4)
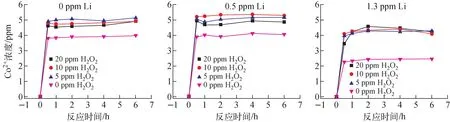
圖5 70 ℃下H2O2濃度對模擬Co膠體溶解行為的影響Fig.5 Effect of H2O2 concentration on dissolution behavior of simulated Co colloid at 70 ℃
綜合來看,加入10mg/kg H2O2已足夠,提高H2O2濃度到20 mg/kg,并未取得更好的促進Co膠體溶解的效果。這是因為H2O2具有強氧化性,在弱酸性、中性、弱堿性條件下,均可作為鈍化劑在金屬表面形成鈍化膜[16-18]。其他條件一定時,H2O2濃度越高,鈍化膜成膜速度越快,鈍化膜的耐蝕性越強[19-20]。在本實驗條件下,高濃度的H2O2可能在Co膠體表面形成鈍化膜,反而不利于Co膠體的溶解。
2) 溫度對模擬Co膠體溶解行為的影響
在0 mg/kg Li、不同H2O2濃度下,溫度(80、70、60 ℃)對Co膠體的影響如圖6所示。從圖6可看出,70 ℃時,Co膠體溶解反應速率最快,且達到平衡時Co2+的濃度最大,對Co膠體的溶解最有利,其次為80 ℃,60 ℃時Co膠體的溶解效果最差。這是因為CoO和Co單質的溶解都是放熱反應(反應(1)、(2)),溫度升高不利于Co膠體溶解反應的進行。但溫度越高,H2O2的氧化性越強[10],越有利于反應(4)的進行。因此,綜合上述兩種效應,對Co膠體溶解最有利的是適中的溫度70 ℃[21-22]。
3) Li濃度(pH值)對模擬Co膠體溶解行為的影響
70 ℃時,Li濃度(pH值)對模擬Co膠體溶解行為的影響如圖7所示。可看出,當Li濃度為0.5 mg/kg時,Co膠體溶解反應很快達到平衡。降低Li濃度為0 mg/kg,Co膠體溶解反應速率和平衡濃度變化不大。當Li濃度升高為1.3 mg/kg時,Co膠體溶解反應速率降低,且達到平衡時溶液中Co2+的濃度明顯較Li濃度為0 mg/kg和0.5 mg/kg時的低。說明Li濃度越低,酸性越強,有利于Co膠體的溶解,且當Li濃度低至0.5 mg/kg已可取得較好的效果。以上結果符合預期,一方面Li濃度越低,溶液酸性越強,H+濃度越高,會促進CoO與Co單質的溶解(反應(1)、(2)),另一方面,pH越低,H2O2的氧化能力越強,會促進反應(4)的進行。
3 結論
首先在實驗室條件下,模擬壓水堆一回路水質與水化學環境,成功制備了粒徑為40~50 nm的模擬Co膠體,TEM、SEM、EDS表征結果顯示其主要成分為CoO和Co單質。然后在模擬停堆氧化運行期間水質與水化學條件下,研究了溫度、Li濃度、H2O2濃度以及反應時間對模擬Co膠體溶解行為的影響,并討論了影響機理。通過本文研究,可得到如下結論:

圖6 0 ppm Li下溫度對模擬Co膠體溶解行為的影響Fig.6 Effect of temperature on dissolution behavior of simulated Co colloids at 0 ppm Li

圖7 70 ℃下Li濃度(pH值)對Co膠體溶解行為的影響Fig.7 Effect of Li concentration (pH) on dissolution behavior of simulated Co colloid at 70 ℃
1) Co膠體的溶解反應速率很快,反應0.5~1 h即達到平衡;
2) 加入適量H2O2會促進Co膠體的溶解,H2O2濃度為10 mg/kg時效果最好;
3) 低Li濃度(酸性)、溫度70 ℃時對Co膠體溶解最有利;
4) 在停堆氧化運行期間,為取得對Co膠體活化腐蝕產物最優的凈化效果,建議最佳的水化學條件為溫度70 ℃,調節Li 濃度盡量接近0 mg/kg,并加入10 mg/kg左右的H2O2。