免疫活性物質:結核病和非結核分枝桿菌病治療的新選擇
龔文平 米潔 吳雪瓊
化學治療是結核病和結核分枝桿菌潛伏感染(latent tuberculosis infection,LTBI)治療的主要手段;盡管近幾年有新藥及短程方案的出現,仍然需要探索更優的治療方案。免疫療法是近年來興起的一種被寄予厚望的治療方法。免疫療法可通過調節人體的免疫系統來抑制和清除體內的結核分枝桿菌(Mycobacteriumtuberculosis,MTB)或非結核分枝桿菌(nontuberculous mycobacteria,NTM)。越來越多的研究表明,免疫活性物質是一種潛在的結核病和非結核分枝桿菌病免疫治療方法[1-5]。免疫活性物質是指由免疫細胞或其他細胞產生的發揮免疫作用的物質,主要包括干擾素、白細胞介素、腫瘤壞死因子等細胞因子、抗體、溶菌酶和免疫阻滯劑等。本文中,筆者對免疫活性物質在結核病和非結核分枝桿菌病免疫治療方面最新的研究進展進行總結和凝練,以期為臨床治療結核病和非結核分枝桿菌病提供新的思路。
一、細胞因子
結核病是一種傳染性疾病,也是一種免疫性疾病[6-8]。MTB入侵和感染宿主的過程就是其侵襲力和宿主的免疫力之間的一場博弈(圖1)。宿主通過呼吸道吸入含有MTB的微液滴后,MTB在呼吸道上皮細胞或肺泡上皮細胞表面被宿主固有免疫系統發現。巨噬細胞、樹突狀細胞、自然殺傷細胞(NK細胞)、中性粒細胞等固有免疫細胞通過模式識別受體識別MTB的病原相關分子模式,激活固有免疫炎癥和殺菌效應。這些被激活的固有免疫細胞吞噬MTB后會向淋巴結遷徙,通過抗原提呈激活并啟動特異性免疫應答。
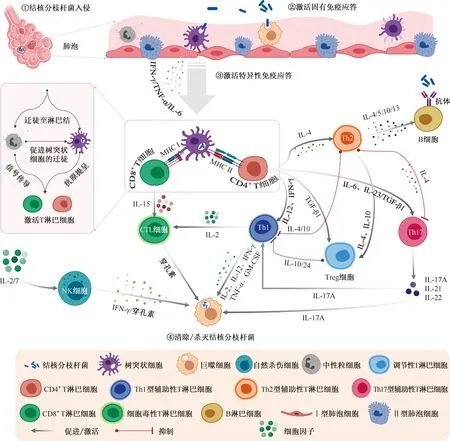
圖1 結核分枝桿菌感染后宿主免疫機制示意圖
特異性免疫應答主要由T淋巴細胞和B淋巴細胞來承擔。在MTB感染中,B淋巴細胞介導的體液免疫反應被認為是次要的,而T淋巴細胞介導的細胞免疫反應占主導地位[9-10]。T淋巴細胞是由胸腺內的淋巴干細胞分化而成,是淋巴細胞中數量最多,功能最復雜的一類細胞。按其功能可分為3個亞群:輔助性T細胞(helper T cell,Th)、抑制性T細胞和細胞毒性T淋巴細胞(cytotoxic T lymphocyte,CTL)。Th細胞又可分為3個亞群:Thl、Th2和Thl7。(1)原始Th0細胞在γ-干擾素(interferon-γ,IFN-γ)和白細胞介素-12(interleukin-12,IL-12)的刺激下會分化為Th1細胞。Th1細胞主要作用于巨噬細胞,能夠分泌IFN-γ、IL-2、IL-3、IL-12、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、TNF-β和粒細胞-巨噬細胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)等細胞因子,參與細胞免疫,在抗結核感染免疫中起重要的保護作用。(2)原始Th0細胞在IL-4的刺激下會分化為Th2細胞。Th2細胞通過分泌IL-4、IL-5、IL-10、IL-13和GM-CSF等細胞因子作用于B淋巴細胞,誘導體液免疫,同時抑制Th1細胞和巨噬細胞。(3)原始Th0細胞在IL-6、IL-23和轉化生長因子-β1(transforming growth factor-β1,TGF-β1)的刺激下會分化為Th17細胞,其作用于炎癥細胞,分泌IL-17等細胞因子作用于Th1細胞和巨噬細胞,促進對MTB的殺滅或清除。
由此可見,活動性結核病的發生是宿主免疫力和MTB侵襲力之間動態平衡被打破的結局之一,其主要的原因是免疫抑制分子TGF-β1和IL-10的過度表達及CD4+T淋巴細胞的凋亡[6, 11]。因此,通過增強Th1型免疫反應、抑制Th2型免疫反應和B淋巴細胞免疫反應的免疫調控因子是一種潛在的結核病治療方案。
研究表明,IFN-γ、TNF-α、IL-2、IL-7、IL-12、IL-15、IL-24、GM-CSF及粒細胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)等細胞因子對結核病有免疫治療作用。但細胞因子存在半衰期短和治療費用高的缺點。關于細胞因子在結核病治療方面的研究進展見表1。
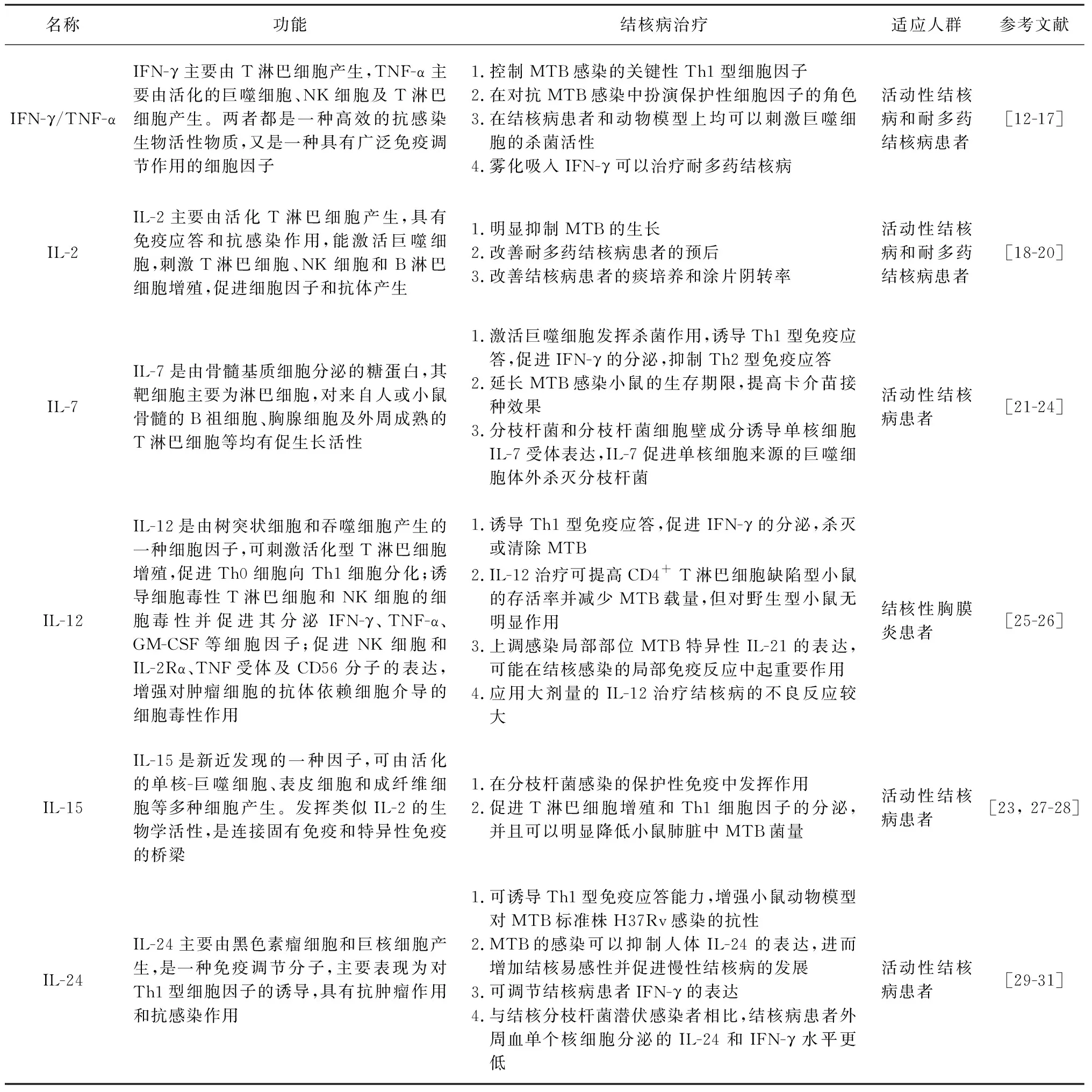
表1 細胞因子在結核病治療方面的研究進展

續表1
(一)IFN-γ和TNF-α
IFN-γ和TNF-α是具有抗病毒、抗腫瘤和免疫調節作用的細胞因子,它們與結核病的發生、發展、轉歸、診斷及治療都有著密切的關系。近年來,IFN-γ和TNF-α在結核免疫發病中的作用受到重視,它們是控制MTB感染的關鍵性Th1型細胞因子。基于其在結核病免疫中的特殊作用,IFN-γ和TNF-α目前已被用于結核病的診斷及免疫治療等方面。IFN-γ或TNF-α基因敲除小鼠動物模型上的研究表明,IFN-γ和TNF-α的缺乏可以促進MTB對小鼠的感染進程[12-13]。應用IFN-γ和(或)TNF-α治療小鼠結核感染模型,小鼠半數死亡時間明顯延長,35 d 內的死亡率從100%降低到20%,脾臟內活菌數明顯減少,脾細胞IFN-γ分泌水平明顯升高,IL-4分泌水平明顯降低,巨噬細胞產生一氧化氮水平明顯增加[14]。以上研究說明,這兩種細胞因子在對抗MTB感染中扮演著保護性角色。此外,不同的給藥途徑對兩者的治療效果也有一定的影響。采用氣溶膠途徑給小鼠吸入IFN-γ或TNF-α(100 μg)能夠抑制并明顯減少小鼠肺部MTB的增長[39]。這兩種細胞因子在誘導抑菌過程中都以相加或協同的方式發揮作用,IFN-γ也參與啟動TNF-α的分泌[40],而TNF-α與依那西普聯合用藥的治療效果明顯好于單用依那西普的治療效果[41]。
上述來自動物模型的數據可能與人類的實際情況之間存在差異,比如一氧化氮作為宿主防御機制的作用仍然存在爭議,因為還沒有關于人類巨噬細胞產生大量一氧化氮的報道。盡管在機制上存在一些差異,但IFN-γ和TNF-α在結核病患者中的主要作用與動物模型是類似的,即激活巨噬細胞的殺菌活性[15]。第一個使用IFN-γ治療結核病的報道來源于Raad 等[42]的研究。其對1例患有急性淋巴細胞白血病和耐多藥結核病的患者使用IFN-γ和GM-CSF輔助治療,最初的5個月內神經學和影像學都有明顯改善,持續12個月的治療使大腦和脊髓的損傷完全消失。對健康志愿者注射IFN-γ可檢測到血清水平和血液單核細胞活化標志物的升高,但未觀察到肺泡巨噬細胞的活化[43]。相反,霧化吸入IFN-γ可引起肺泡巨噬細胞活化標記物的劑量依賴性表達,可導致肺結核患者下呼吸道干擾素水平升高,且無與治療相關的局部或全身不良反應[44]。Condos等[16]首次報道了霧化吸入IFN-γ治療耐多藥結核病的小規模臨床試驗,所有患者均對1個月IFN-γ治療方案反應良好(以痰涂片陰轉和空洞病變減少為主要臨床指標),但停止治療后80%的患者痰涂片轉陽,表明霧化吸入IFN-γ可以治療耐多藥結核病。林存智等[45]利用重組人IFN-γ霧化吸入治療復治耐多藥肺結核,結果顯示,重組人IFN-γ霧化吸入治療耐多藥肺結核療效明顯,可以在臨床中推廣應用。其他的免疫途徑如皮下注射和肌肉注射也是潛在的選擇,但是皮下注射和肌肉注射IFN-γ的治療效果存在較大的個體差異,缺乏穩定性[46-48]。1999年,美國國家過敏和傳染病研究所開展了一項臨床Ⅰ/Ⅱ期研究,探討了不同劑量的IFN-γ治療耐多藥結核病的效果。該研究已經于2008年結束,但是研究結果并未公開(NCT00001407)。2006年,美國西北州立醫科大學開展了一項臨床Ⅰ/Ⅱ期皮下注射IFN-γ治療HIV感染和肺結核患者的療效和安全性的研究(NCT05065905)。在這項隨機對照的安全性和有效性研究中,IFN-γ的劑量為每天或隔天500 000 IU。該試驗已經于2021年10月結束,但是結果還沒有公布。關于細胞因子及其阻滯劑治療結核病的臨床試驗研究進展見表2。
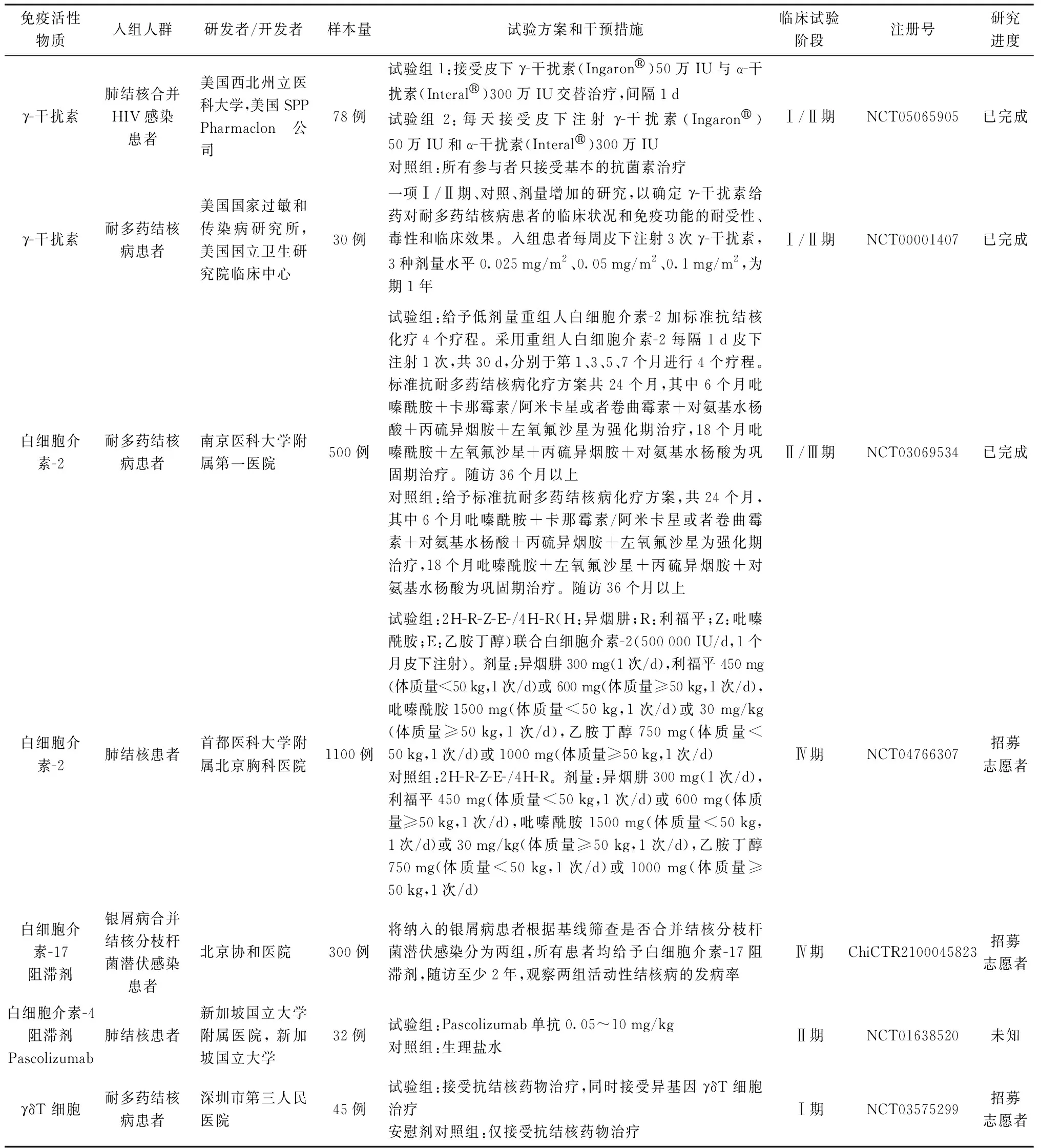
表2 細胞因子及其阻滯劑治療結核病臨床試驗研究進展
(二)IL-2
IL-2能促進結核抗原特異性T細胞克隆的增殖活化,促使T細胞分泌IFN-γ,活化NK細胞和巨噬細胞,從而增強巨噬細胞殺滅MTB的能力。早在20世紀80年代即有多項研究表明,在小鼠模型上,IL-2免疫治療可以明顯抑制MTB的生長[18-19]。1995年,Johnson等[49]就開始嘗試用低劑量重組人IL-2 (rhuIL-2)聯合抗結核藥物來治療肺結核,發現rhuIL-2聯合抗結核藥物治療難治性肺結核或耐多藥結核病,約60%的患者痰菌量減少或清除,與增強免疫系統激活有關[50]。為了明確其分子機制,Johnson等[51]從體外培養的卡介苗純蛋白衍生物試驗陽性個體經MTB和rhuIL-2刺激后獲得的外周血單個核細胞(peripheral blood mononuclear cell,PBMC),證實了rhuIL-2可以誘導基因的差異表達。這可能為分枝桿菌抗原特異性反應位點的白細胞活化和增強的抗菌反應的發展提供一個替代標記物,從而可能改善耐多藥結核病患者的預后。然而,隨后有研究表明,每天使用rhuIL-2治療并沒有增強結核病易感患者的細菌清除率或癥狀改善[52]。針對上述不一致的研究結果,2018年Zhang等[53]進行了薈萃分析,發現基于rhuIL-2的輔助免疫治療可以增強CD4+T細胞和NK細胞的增殖和轉化,改善結核病患者的痰培養(3個月及以后)和涂片陰轉率,說明rhuIL-2輔助治療結核病有一定的效果。此外,最新的研究還發現,將IL-2與唑來膦酸(adjunctive Zoledronate)聯合使用可以增強Vγ2Vδ2 T和αβ效應T細胞亞群來改善耐多藥結核病的治療結果[54]。
為了臨床驗證IL-2對結核病的治療作用,南京醫科大學附屬第一醫院于2009年開展了一項Ⅱ/Ⅲ期臨床試驗(NCT03069534,表2)。該研究將142例耐多藥結核病患者分為常規抗結核治療組和常規抗結核聯合rhIL-2治療組。結果發現,rhIL-2聯合治療組治愈率和MTB清除率明顯高于常規抗結核治療組,rhIL-2的使用還改善了Th1/Th17免疫應答,在耐多藥結核病患者中沒有出現安全問題[55]。2021年,首都醫科大學附屬北京胸科醫院開展了一項IL-2治療原發性涂陽肺結核的多中心隨機臨床試驗(NCT04766307,表2),該研究目前正在招募志愿者。
(三)IL-7
IL-7是一種特殊的細胞因子,與IL-2、IL-4或IL-10不同,它以一種非冗余的方式介導小鼠淋巴細胞的生成[56]。后來,人們從MTB感染的靈長類動物肺組織中發現IL-7和可溶性IL-7受體表達增加,提示IL-7代謝可能在結核病發病機制中發揮作用[57]。此外,IL-7還被證明可以延長MTB感染小鼠的生存期限,提高卡介苗接種效果[22-23]。最近,Adankwah等[24]在33例結核病患者和20例結核病患者無癥狀接觸者中研究了IL-7和IL-7Rα表達在單核細胞功能中的潛在作用,發現IL-7可以促進單核細胞來源的巨噬細胞體外殺滅分枝桿菌。目前,對IL-7或IL-7受體在人類結核病治療中可能發揮的作用尚不清楚[57]。
(四)IL-12
IL-12是一種異二聚體細胞因子(p70),由p35和p40兩個亞基組成。這種細胞因子由樹突狀細胞和吞噬細胞在受到微生物或細胞因子刺激后產生[58]。IL-12能促進NK細胞和T細胞的增殖及殺傷作用,促進IFN-γ的分泌,誘導Th1型免疫應答,進而達到殺滅或清除MTB的目的。Nolt和Flynn[25]通過呼吸道霧化吸入低劑量MTB建立結核感染動物模型,然后給予IL-12連續治療8周,結果顯示,IL-12治療可提高CD4+T細胞缺陷型小鼠的存活率并減少細菌載量,但對野生型小鼠無明顯的作用。此外,IL-12可以上調結核病患者病灶部位MTB特異性IL-21的表達,尤其是IL-21+IFN-γ+CD4+T細胞的頻率,可能在結核感染的局部免疫反應中起重要作用[26]。但應用大劑量的IL-12治療結核病不良反應較大,限制了其在臨床上的應用。
(五)IL-15
IL-15是新發現的一種細胞因子。與IL-2或IL-7相比,IL-15在體外增強了免疫效應細胞的溶細胞能力,有利于CD1b限制性T細胞的擴增,從而識別自體抗原提呈細胞表達的MTB相關抗原。IL-15在分枝桿菌感染的保護性免疫中發揮作用,MTB在小鼠和人類巨噬細胞中可以誘導IL-15的表達[28]。研究表明,將IL-7和IL-15與卡介苗(BCG)聯合免疫小鼠可以增強CD4+和CD8+T細胞的記憶免疫反應,促進T細胞增殖和Th1型細胞因子的分泌,并且可以明顯降低小鼠肺臟中MTB菌量[23],而且IL-15在BCG免疫后期可以保護激活的CD8+T細胞的凋亡[59]。
(六)IL-24
IL-24是一種新型的腫瘤抑制因子,是IL-10細胞因子家族的獨特成員。IL-24也是一種免疫調節分子,其可誘導人PBMC產生高水平IFN-γ、IL-6及TNF-α,誘導Th1型細胞免疫應答,具有抗腫瘤作用和抗感染作用。在小鼠模型中,IL-24可以通過激活CD8+T細胞IL-24受體信號通路誘導CD8+T細胞產生大量的IFN-γ來對抗MTB,這種活性依賴于中性粒細胞的早期參與[30]。將IL-24與Ag85A聯合免疫小鼠動物模型,可誘導小鼠獲得抗結核所需的Th1型免疫應答能力,增強小鼠抵抗MTB標準株H37Rv攻擊的能力[29]。此外,研究發現,與LTBI人群相比,活動性結核病患者PBMC分泌的IL-24水平更低[60]。有意思的是,外源性IL-24治療可以明顯提升活動性結核病患者PBMC分泌IFN-γ的能力,但是中和IL-24使得LTBI人群PBMC分泌IFN-γ水平降低[31]。臨床試驗表明,MTB感染抑制了人PBMC對IL-24的體外表達,使得結核病患者血清IL-24濃度明顯降低[30]。這些數據提示,MTB感染抑制了IL-24的表達,進而增加結核易感性并促進慢性結核病的發展。應用IL-24治療小鼠結核感染模型和活動性結核病患者均顯示具有抗結核作用。這一新發現將為開發一種新的基于IL-24的免疫治療方法奠定基礎。
(七)IL-32
IL-32是參與固有免疫和特異性免疫反應的一種重要的分泌性蛋白,雖然至今未發現IL-32受體,但是IL-32發揮著促炎性細胞因子和細胞內細胞因子調節子的作用[61-62]。IL-32可誘導TNF-α、IL-1β、IL-6、IL-8和巨噬細胞炎癥蛋白的產生,炎癥因子IFN-γ、IL-1β、IL-12和IL-18也誘導其表達。因此,IL-32在抗結核固有免疫中的放大效應,可上調TNF-α而促進細胞凋亡。最近研究發現,IL-32是宿主對MTB應答的調節因子,用熱滅活的MTB刺激人類PBMC能夠誘導其產生大量的IL-32[63]。IL-32還可以增強人類單核細胞來源的巨噬細胞清除MTB的能力[32]。用小干擾RNA(small interfering RNA,siRNA)干擾人THP-1巨噬細胞下調內源IL-32表達后,胞內重要的炎癥因子如TNF-α、IL-1β和IL-8水平明顯下降,細胞內MTB菌量增多。此外,與野生型小鼠相比,轉基因SPC-IL-32γTg小鼠Ⅱ型肺泡上皮細胞表達的人類IL-32γ能夠明顯減少肺部MTB菌量的85%[33]。最近的一項臨床試驗發現,與LTBI者和健康對照組相比,肺結核患者總IL-32的mRNA水平較低,在健康對照組PBMC中MTB感染下調了IL-32γ的表達而上調了IL-32β的表達,表明IL-32有助于預防MTB感染。這種作用可能取決于不同IL-32亞型的相對豐度[34]。這些研究表明,IL-32對MTB感染具有潛在的保護作用,可能是一種潛在的結核病治療候選靶標。
(八)GM-CSF/G-CSF
GM-CSF是一種由巨噬細胞、T淋巴細胞、肥大細胞、NK細胞、內皮細胞和成纖維細胞分泌的單體糖蛋白,具有細胞因子的功能。Bermudez等[35]利用重組GM-CSF和阿奇霉素或阿米卡星聯合治療鳥分枝桿菌感染的C57BL/6小鼠模型,發現小鼠血液、肝臟和脾臟中活菌數量明顯減少,但是單獨使用重組GM-CSF和阿奇霉素或阿米卡星組無明顯差異。Bai等[33]構建了一種能夠表達人類IL-32細胞因子的轉基因小鼠模型,并用MTB強毒株(W-Beijing HN878)同時感染該轉基因小鼠和野生型小鼠,發現與野生型小鼠相比,轉基因小鼠的肺臟和脾臟中MTB載量明顯降低,提示IL-32能夠提高轉基因小鼠的存活率。有趣的是,Francisco-Cruz等[36]利用重組腺病毒編碼的粒細胞-巨噬細胞集落刺激因子(adenoviruses encoding granulocyte-macrophage colony-stimulating factor,AdGM-CSF)對小鼠肺結核模型的免疫治療作用進行研究,發現AdGM-CSF可明顯降低細菌負荷,說明其在抗MTB感染和基因治療中發揮重要作用,可被用于預防LTBI或預防LTBI發展為活動性結核病。這兩項研究從不同的動物模型證明IL-32在MTB感染中扮演著保護宿主的角色。另外一項臨床試驗結果表明,重組GM-CSF治療后,AIDS患者的中性粒細胞和單核細胞并不能明顯抑制鳥分枝桿菌的生長[64]。此外,一項利用重組人GM-CSF聯合化療輔助治療活動性肺結核患者的Ⅱ期臨床試驗表明,重組人GM-CSF具有較好的安全性和耐受性,GM-CSF 組與安慰劑組的臨床表現相似,治療4周時痰涂片陰轉率無明顯差異,但在治療8周時有痰菌陰轉較快的趨勢,需在Ⅲ期臨床試驗中進一步評價其免疫治療的效果。
G-CSF是一種糖蛋白,可刺激骨髓產生粒細胞和干細胞,并將其釋放到血液中[65]。G-CSF刺激中性粒細胞前體和成熟中性粒細胞的存活、增殖、分化和功能。使用重組G-CSF可以改善機體對鳥分枝桿菌感染的防御機制。研究表明,G-CSF與克拉霉素聯合使用能抑制小鼠肺臟和脾臟中鳥分枝桿菌的菌量[3],G-CSF治療小鼠的中性粒細胞和巨噬細胞能夠抑制或殺死鳥分枝桿菌的生長[4]。但是Gon?alves和Appelberg[5]的研究表明,重組G-CSF可促進C57BL/6或褐家鼠廣泛的嗜中性粒細胞增多,但不能阻止鳥分枝桿菌感染的進程,而且G-CSF 也未能改善三種化療方案(克拉霉素+乙胺丁醇+利福平)的療效。
(九)免疫阻滯劑
在活動性肺結核進展過程中,長期慢性炎癥導致Th1和Th2免疫失衡、免疫抑制或T細胞耗竭,應用免疫阻滯劑阻斷某些有害免疫分子的作用也可達到免疫治療的目的。例如,應用抗IL-4抗體治療小鼠結核感染模型,阻斷Th2細胞因子IL-4的分泌,促使免疫應答向Th1應答方向偏離,可明顯降低小鼠肺和脾組織中的細菌數[66];應用重組β-聚糖[Ⅲ型腫瘤生長因子-β(tumor growth factor beta,TGF-β)受體]阻斷小鼠結核感染模型的細胞免疫下調因子TGF-β時,IFN-γ和IL-2的表達增加,IL-4明顯下調,肺組織中細菌數明顯減少;應用靶向TGF-β1的siRNA對慢性結核感染的鼠模型進行局部肺免疫治療,也阻斷了TGF-β對Th1型免疫應答的抑制,使Th1型免疫應答增強,抗微生物介質(一氧化氮和一氧化氮合酶)表達增高,肺組織中細菌數減少[67];應用單克隆抗體阻斷慢性結核感染小鼠的IL-10受體,可解除IL-10對巨噬細胞活化和Th1免疫應答的抑制,增加肺組織中T細胞的募集和IFN-γ的產生,減少肺組織中細菌負荷,提高小鼠存活率[68];應用抗IL-17A的單克隆抗體治療小鼠結核感染模型,可阻斷Th17過度反應而導致的大量中性粒細胞募集和組織損傷,又不破壞宿主反應,具有較低的臨床風險。
由此可見,在結核病治療中維持Th1/Th17平衡對促進抗結核免疫和避免炎癥組織損傷至關重要。地尼白介素-2注射劑(Denileukin Diftitox,Dd,ONTAK)是白喉毒素活性域與IL-2的重組融合蛋白毒素,它靶向表達高親和力IL-2受體(IL-2R)的CD25細胞,通過IL-2部分的結合引導白喉毒素殺傷表達IL-2受體的細胞;地尼白介素-2注射劑用于治療小鼠結核感染模型,可降低兩種免疫抑制性細胞Treg和髓源性抑制細胞(myeloid-derived suppressor cells,MDSC;CD11b+Gr1HI)的頻率,改善病理損傷,限制肺部細菌復制而使活菌數明顯降低,并抑制MTB從肺部向其他器官播散,增強化療效果。此外,抑制效應T細胞反應的程序性細胞死亡蛋白1(programmed cell death protein 1,PD-1)在活動性肺結核患者中表達水平較高,阻斷PD-1可使產生MTB特異IFN-γ的T細胞免于凋亡,存活率提高,而表達PD-1的T細胞數量明顯減少,從而可能逆轉結核病患者的T細胞耗竭,具有治療潛力。
近年來,一些細胞因子阻滯劑在結核病治療方面的研究逐漸出現。2012年,新加坡國立大學醫院開展了一項隨機、雙盲、安慰劑對照臨床試驗,評估了用Pascolizumab阻斷IL-4治療32例肺結核患者的安全性和有效性(NCT01638520,表2)。該研究結果尚未公開。2021年,北京協和醫學院開展了一項單中心、前瞻性、觀察性研究(ChiCTR2100045823,表2),驗證在不予化學預防的情況下,IL-17抑制劑長期治療銀屑病合并LTBI患者不會增加結核活動的風險。該研究計劃納入300例中重度銀屑病患者,根據基線篩查是否合并LTBI分為LTBI+和LTBI-兩組,所有患者均給予IL-17抑制劑,LTBI+組患者請感染科醫師會診,感染科醫師將評估患者結核活動的風險,根據是否存在其他結核病危險因素和化學預防禁忌,再結合患者意愿決定是否給予化學預防。化學預防的方案由感染科醫師制定。所有患者隨訪至少2年,觀察兩組活動性結核病的發病率。目前該臨床試驗正在招募志愿者。
(十)細胞治療
盡管細胞治療在腫瘤治療方面已經有了廣泛的使用,但是在結核病治療方面的應用才剛剛開始。深圳市第三人民醫院近期開展了一項Ⅰ期臨床試驗,評估γδT細胞治療結核病的療效(NCT03575299,表2)。該研究擬招募45例耐多藥結核病患者,試驗組將接受抗結核藥物治療,同時接受異基因γδT細胞治療;安慰劑對照組將僅接受抗結核藥物治療。該研究結果將為細胞治療結核病的效果提供最新的證據。
二、抗體
MTB是一種兼性的胞內寄生菌,人們普遍認為機體抵抗其感染主要依賴于T淋巴細胞介導的細胞免疫反應,而抗體在活動性結核病中沒有保護作用,甚至可能導致免疫病理改變[69]。然而,越來越多的證據表明,抗體對結核病具有保護作用,這再次引發了爭論[70]。這些新證據可以歸納總結為以下四個方面[71]:(1)人類抵抗MTB的抗體功能從無癥狀的潛伏感染到有癥狀的活動性結核病存在差異;(2)抗MTB的抗體功能受亞型和IgG Fc糖基化結構的影響;(3)MTB表面抗原特異性抗體反應的誘導可影響結核病疫苗的療效;(4)通過接種疫苗誘導的抗體可能與誘導的細胞對MTB的反應相補充和協同。
2013年,Achkar和Casadevall[72]進行的被動免疫研究表明,單克隆抗體對少數分枝桿菌抗原具有不同的保護作用。然而,目前對這些小鼠單克隆抗體的具體功能或抗原特異性人單克隆抗體的保護作用和功能了解甚少,最近發表的研究結果為人單克隆抗體對MTB的作用功能提供了令人信服的證據[73-78]。Lu等[75]采用無偏倚抗體分析方法,首次根據MTB感染特異性狀態的不同,在體外展示了IgG功能的差異,并發現這些差異與糖基化在IgG常量區域的不同有關。Zimmermann等[76]首次證實了抗體亞型與MTB感染特定宿主細胞的相關性,發現從暴露于MTB的健康個體中分離出的B淋巴細胞產生的人IgA單克隆抗體(而非IgG單克隆抗體)在體外可以抑制上皮細胞的分枝桿菌感染。這一發現表明,抗體亞型可能是影響特定宿主細胞抗體治療效果的另一個關鍵變量。Li等[77]首次在被動轉移MTB感染小鼠的實驗中,展示了來自LTBI的多克隆IgG與暴露但未感染MTB的醫護人員相對于MTB感染小鼠的體內保護效果的差異。Prados-Rosales等[78]通過由分枝桿菌多糖-蛋白結合疫苗誘導的免疫血清被動轉移,證明了多糖和蛋白結合抗體在控制小鼠MTB傳播方面的重要作用,進一步研究發現,在接種疫苗的小鼠中,誘導的體液免疫和細胞介導的免疫都有助于對MTB感染的保護性反應。Zuany-Amorim等[79]研究表明,高劑量靜脈注射抗體可通過調節CD8+T淋巴細胞,降低病理免疫反應,從而誘導明顯的抗結核作用。盡管高劑量的抗體可以刺激抗結核反應,但其也可能加重結核病。高劑量抗體中的IgG含有完全唾液酸化的Fc寡糖,這與結核病患者中發現的未唾液酸化的Fc寡糖不同。高劑量抗體中的IgG具有促炎作用,可誘導免疫病理損傷,導致結核病加重。遺憾的是,高劑量免疫球蛋白治療結核病的臨床試驗尚未見報道。
除了傳統的IgG等抗體外,最近一種新型的免疫球蛋白Y(IgY)也開始進入人們的視野。IgY是一種免疫球蛋白,是鳥類、爬行動物和肺魚血液中的主要抗體,其在蛋黃中也有很高的濃度。與其他免疫球蛋白一樣,IgY是一類由免疫系統對某些外來物質做出反應而形成的特殊識別蛋白。IgY已經被證實是一種潛在的結核病免疫治療免疫球蛋白[80]。2017年,Sudjarwo等[81]研究發現,MTB特異性IgY能夠刺激大鼠PBMC明顯增殖,并促進PBMC分泌IL-2和IFN-γ,提示IgY在PBMC中的抗結核作用可能是通過調節細胞因子的產生而介導的。Sudjarwo等[82]采用MTB抗原免疫羅曼蛋雞,從其蛋黃中分離純化出MTB特異性IgY。免疫后2周,蛋黃中MTB特異性IgY濃度升高,免疫后4周達到最高值。6周后,IgY水平逐漸下降。這些結果表明,蛋黃可以作為一種大規模生產MTB特異性IgY的實用策略,用于結核病的免疫治療。
三、小分子活性肽
小分子活性肽是介于氨基酸與蛋白質之間的一種生化物質,它比蛋白質分子量小,又比氨基酸分子量大,是一個蛋白質的片段,通常由2~15個氨基酸組成。小分子肽結構簡單、分子量小,可以透過皮膚屏障、血腦屏障、胎盤屏障、腸胃黏膜屏障直接進入細胞內發揮其生物活性[83]。目前,與結核相關的小分子活性肽包括轉移因子、抗菌肽、胸腺肽、先天防御調節肽及保爾佳等,其中,前4個小分子活性肽用于結核病輔助治療的報道較多,而有關保爾佳用于結核病輔助治療的報道較少(表3)。
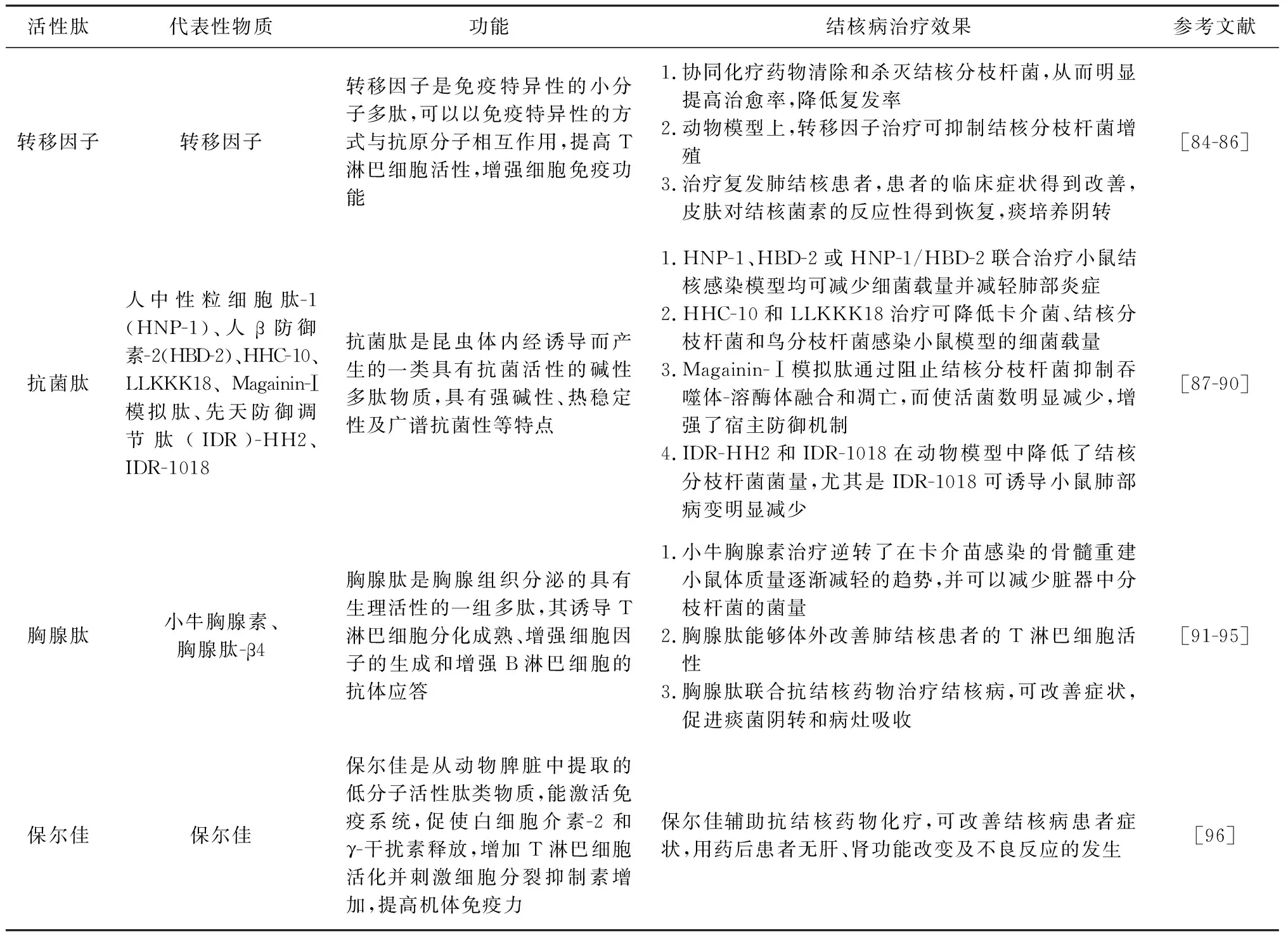
表3 小分子活性肽在結核病治療方面的研究進展
(一)轉移因子
研究表明,轉移因子是免疫特異性的。盡管具有這種活性的分子還沒有被完全鑒定出來,但有大量的證據表明它們是小多肽,并且可以以免疫特異性的方式與抗原分子相互作用[84]。轉移因子可提高T淋巴細胞活性,增強細胞免疫功能,協同化療藥物清除和殺滅MTB,從而明顯提高治愈率,降低復發率。動物模型研究發現,轉移因子治療MTB感染的BALB/c小鼠后,Th1細胞因子、TNF-α和一氧化氮合酶的表達上升并抑制了細菌增殖;轉移因子聯合常規化療治療小鼠具有協同作用,可更快地消除肺部MTB[85]。1977年,Kind等[86]報告1例嚴重的復發性肺結核患者,臨床表現為進行性惡化、結核菌素無反應、痰培養陽性。在轉移因子治療期間,患者的臨床癥狀得到改善,皮膚對結核菌素的反應性得到恢復,痰培養呈陰性。
(二)抗菌肽
抗菌肽是生物體產生的一種陽離子和兩親性多肽,廣泛存在于從原蟲到人類的各種生物體內,對革蘭陽性球菌、革蘭陰性桿菌甚至某些真菌、原生動物都有殺滅作用,其對MTB亦是有效的,且沒有傳統抗結核藥物的耐藥性和嚴重不良反應等一系列弊端,有可能成為結核病治療的一個新選擇[97]。研究表明,抗菌肽在體內和體外均表現出一定的抗結核活性。應用重組人中性粒細胞肽-1(human neutrophil peptide-1,HNP-1)、人β防御素-2(human beta-defensin-2,HBD-2)或HNP-1/HBD-2聯合治療小鼠結核感染模型均可減少細菌載量并減輕肺部炎癥。應用LL-37衍生肽HHC-10治療小鼠卡介菌感染模型可使細菌載量明顯降低[87]。LL-37衍生的抗菌肽LLKKK18也可治療MTB和鳥分枝桿菌感染而使菌落數減少[88]。合成的Magainin-Ⅰ模擬肽納米膠囊通過阻止MTB抑制吞噬體-溶酶體融合和凋亡,而使活菌數明顯減少,增強了宿主防御機制[89]。
先天防御調節肽(innate defence regulator peptides,IDR)是近年來興起的一種新型小分子免疫肽,其利用天然宿主防御肽作為模板,設計和開發具有增強免疫調節活性的合成肽[98]。目前,主要的IDR有Bac2A[99]、W3[98]、IDR-HH2[90]、IDR-1[100]、IDR-1002[90]、IDR-1018[90, 98]、IDR-1019[98]等。Rivas-Santiago等[90]通過體內外實驗評價了IDR-HH2、IDR-1018和IDR-1002等先天防御調節肽對2株MTB(1株對藥物敏感,另1株耐多藥)的活性。結果表明,所有肽段均無細胞毒活性,且僅具有適度的直接抗菌活性。盡管如此,IDR-HH2和IDR-1018在動物模型中降低了MTB菌量,尤其是IDR-1018誘導小鼠肺部病變的明顯減少。此外,還有研究發現IDR-1018、Bac2A和W3的免疫調節活性也有很大差異。Bac2A是一種非常弱的趨化因子誘導劑,沒有實際的抗內毒素活性,而W3和IDR-1018則可以誘導大量表達單核細胞趨化蛋白1,其中,IDR-1018的效果更佳[98]。這些結果表明,IDR具有作為一種新的結核病免疫治療選擇的潛力。
此外,目前已知的抗結核抗菌肽還有兩親性螺旋抗菌肽D-V13 K(D5)、抑菌素(Bcn1~Bcn5)、乳酸鏈球菌素A、乳鐵蛋白、嗜藍粒蛋白、S100鈣結合蛋白A12(S100A12)、人β防御素變異體、富含脯氨酸-精氨酸抗菌肽的PR-39、1-C134mer、短肽酰胺ATRA-1A、小鼠抗菌肽mCRAMP、修飾肽-藥物結合物dpMtx、變形鏈球菌細菌素MU1140及天蠶絲抗菌肽Cecropin B[101-103]。鑒于抗菌肽良好的應用前景,已經有抗菌肽從臨床前研究階段進入了臨床研究階段,包括處于臨床Ⅱ期的LTX-109[104]和HLF1-11[105],以及處于臨床Ⅲ期的MBI-226[106]。
(三)胸腺肽
胸腺肽又名胸腺素,是胸腺組織分泌的具有生理活性的一組多肽,屬于免疫增強劑。臨床上常用的胸腺肽是從小牛胸腺發現并提純的有固有免疫效應的小分子多肽,其能促進淋巴細胞轉化,增強巨噬細胞吞噬活性,既往常被用于各類原發性或繼發性T淋巴細胞缺陷病的治療,也可用于治療多種免疫缺陷病[107-108]。既往研究表明,胸腺肽可提高機體免疫力,對結核病有很好的輔助治療效果。早在1976年,Morrison和Collins[91]用小牛胸腺素治療BCG感染的骨髓重建小鼠和正常小鼠模型,結果表明,胸腺肽治療逆轉了BCG感染的骨髓重建小鼠體質量逐漸減輕的趨勢,并可以減少臟器中分枝桿菌的菌量。隨后,Vladimirsky等[92]研究發現胸腺肽能夠體外改善肺結核患者的T淋巴細胞活性。最近,Kang等[93]研究發現,活動性肺結核患者肉芽腫性肺組織中胸腺肽-β4的表達水平明顯升高,并且與低氧誘導因子-1α和血管內皮生長因子介導的炎癥和血管生成相關。此外,我國學者發現,胸腺肽聯合抗結核藥物治療結核病,可改善癥狀、促進痰菌陰轉、病灶吸收、無明顯不良反應[94],而且還可以促進復治涂陽肺結核患者病灶吸收及痰菌陰轉[95]。
(四)保爾佳
保爾佳又稱脾肽,是從動物脾臟中提取的低分子活性肽類物質,能激活免疫系統,促使IL-2和IFN-γ釋放,增加T淋巴細胞活化并刺激細胞分裂抑制素增加,提高機體免疫力。目前,有關保爾佳輔助治療的報道多集中在腫瘤領域,用于結核病輔助治療的報道較少。劉劍波等[96]通過對保爾佳輔助肺結核化療的臨床及實驗研究,發現用藥組及對照組患者癥狀的改善率分別為71%和48%,用藥后患者無肝、腎功能改變及不良反應發生,說明保爾佳是一種輔助治療肺結核的安全、有效的生物制劑及免疫調節劑。
四、溶菌酶
溶菌酶是一種能水解致病菌中黏多糖的堿性酶,主要通過破壞細胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡萄糖之間的β-1,4糖苷鍵,使細胞壁不溶性黏多糖分解成可溶性糖肽,導致細胞壁破裂,內容物逸出,從而使細菌溶解。溶菌酶廣泛存在于人體多種組織中,但是不同類型的患者血清中溶菌酶表達量存在差異,發生干酪樣壞死、細胞結節和纖維瘤樣結節的患者溶菌酶表達陽性率分別為90.1%、79.3%和63.3%,而且結核分枝桿菌L型感染的患者溶菌酶陽性率為64.4%,其中,L型抗原陽性的患者溶菌酶陽性率高于L型抗原陰性的患者溶菌酶陽性率,提示溶菌酶表達量可以作為MTB感染預后的評價指標[109]。
MTB作為一種古老的細菌,在漫長的進化歷程中已經擁有了眾多的防御策略來對抗外界環境對其細胞壁的破壞[110],其中的一種策略是通過一種新的糖基化和表面定位脂蛋白lprⅠ來消除溶菌酶的裂解活性。最近的一項研究表明,恥垢分枝桿菌感染巨噬細胞時lprI基因與glbN基因的表達同步上調,使其不僅能免受溶菌酶的破壞,而且有利于其在巨噬細胞中的存活[111]。因此,抑制MTB的lprI基因與glbN基因的表達是一種潛在的治療結核病的免疫治療策略。
五、問題和展望
免疫活性物質作為一種由免疫細胞或其他細胞產生的發揮免疫作用的物質,進入人們的視野有幾十載,但是在結核病治療方面的嘗試只是最近才開始。這得益于人們對結核病本質認識的不斷深入,即結核病不僅是一種傳染性疾病更是一種免疫性疾病。免疫活性物質不僅可以調節MTB感染個體的免疫系統,還能有效減少甚至消除MTB。作為一種新型的結核病治療手段,免疫活性物質在結核病防治方面的研究出現了百花齊放的盛況,特別是細胞因子和抗體等較為常見且已經被深入研究的一些免疫活性物質成為了研究的熱點。這些研究從不同角度、模型和水平探討了細胞因子和抗體在結核病治療方面的令人鼓舞的潛力。
隨著研究領域的拓展和科學技術的不斷發展,一些新型的免疫活性物質也開始走上舞臺,比如小分子活性肽、溶菌酶及免疫阻滯劑。盡管對于這些新型免疫活性物質在結核病治療方面的研究大多處于起步和探索階段,但是隨著精準醫療理念的生根發芽及免疫學新技術的日新月異,這些曾經被人們遺忘在角落或者還沒有被發現的新型免疫活性物質注定會大放光彩。
利益沖突所有作者均聲明不存在利益沖突
作者貢獻龔文平:醞釀和設計實驗、采集數據、分析/解釋數據、起草文章、獲取研究經費;米潔:采集數據、分析/解釋數據、起草文章;吳雪瓊:醞釀和設計實驗、對文章的知識性內容作批評性審閱、指導

