南雄辣椒炭疽病菌的分離鑒定與藥劑篩選
鄭 婕 莊遠航 郭梓琪 許 藝 鐘俊杰 黃維峰 胡 芳 李海渤 雷建軍,2* 吳 昊*
(1 韶關學院英東生物與農業學院,廣東韶關 512005;2 華南農業大學園藝學院,廣東廣州 510642;3 廣東省粵北食藥資源利用與保護重點實驗室,廣東韶關 512005)
辣椒(spp.)是茄科辣椒屬的重要蔬菜作物,也是我國栽培面積最大的蔬菜作物(鄒學校 等,2020;王立浩 等,2021)。廣東省作為我國重要的南菜北運基地,辣椒年種植面積達9.92 萬hm(李穎 等,2020)。隨著廣東省農業產業結構調整以及脫貧攻堅的大力開展,粵北地區辣椒種植面積逐年增大,辣椒病害發生也日趨嚴重。辣椒炭疽病是一種世界性的辣椒病害,每年全球因炭疽病導致辣椒減產約50%,熱帶或亞熱帶地區受到的影響最為嚴重(Than et al.,2008;Ridzuan et al.,2018)。印度每年因炭疽病造成辣椒減產10%~54%,越南因炭疽病導致辣椒產量下降最高可達80%(Saxena et al.,2016)。辣椒炭疽病在我國可導致辣椒減產30%~40%,嚴重時減產50%左右(林清 等,2005;周黛媛 等,2022),廣東省地處亞熱帶和熱帶,是辣椒炭疽病的高發地區。
辣椒炭疽病的典型癥狀是在病果和病葉上出現同心輪紋狀病斑,病原菌不僅為害生長期的辣椒果實和莖葉,還能在采后貯運過程中持續造成果實腐爛,嚴重影響干鮮椒的產量和品質。引起辣椒炭疽病的病原菌屬于半知菌亞門炭疽菌屬(),該屬種類繁多且類別復雜,常見優勢種有(異名)、(曾被鑒定為)以及(曾被鑒定為)(Mongkolporn,2019)。我國已報道的辣椒炭疽病致病菌至少有15種,且不同地區的優勢種差異較大(Diao et al.,2017)。由于不同的炭疽病菌對殺菌劑的敏感性存在差異(滿益龍 等,2016),而殺菌劑的不合理施用不僅會導致農藥浪費和環境污染,還可能導致病原菌出現耐藥性甚至抗藥性。因此有必要針對辣椒主要產區的炭疽病菌進行分離和鑒定,為指導田間高效防治藥劑的施用奠定基礎。為此,本試驗對采集自廣東省韶關市南雄市辣椒種植區的辣椒炭疽病病果進行病原菌分離純化和微生物學、分子生物學方法鑒定,并利用12 種殺菌劑進行室內毒力測定,以期為粵北地區辣椒炭疽病防治提供依據。
1 材料與方法
1.1 病原菌的分離純化
2020 年10 月于廣東省韶關市南雄市湖口鎮辣椒基地,采集疑似感染炭疽病的朝天椒果實樣本。將獲得的果實樣本帶回實驗室,通過組織分離法將病果的病健交界處剪成5 mm × 5 mm 小塊,用0.1%HgCl消毒1 min,滅菌ddHO 沖洗5~6 次后用無菌吸水紙吸干水分,接種到番茄燕麥瓊脂(tomato oatmeal agar,TOA)培養基中進行分離培養及菌落純化。TOA 培養基:番茄汁150 mL、CaCO0.6 g、燕麥片40 g、瓊脂粉20 g、蒸餾水1 L,121 ℃滅菌20 min。
1.2 病原菌孢子懸液制備
用打孔器在TOA 培養基上培養1 周的菌落邊緣打取直徑0.3 cm 的小菌塊,取3~5 個菌塊置于50 mL 液體TOA 培養基中,在28 ℃恒溫搖床中130 r·min培養72 h。在超凈工作臺中將培養好的菌塊轉移至新的無菌培養皿中,加入滅菌的蒸餾水,28 ℃光照條件下培養12 h。之后去除培養皿中的蒸餾水,置于28 ℃黑暗條件下處理12 h。待孢子囊成熟后,將菌塊轉移至無菌試管中,加5 mL 滅菌蒸餾水,利用渦旋儀振蕩2 min 使孢子囊脫落。孢子懸液用于顯微觀察和針刺接種。
1.3 病原菌的致病力測定
為了確定病原菌致病性,依據柯赫氏法則將病原分離物重新接種朝天椒,發病后再進行分離鑒定(方中達,1998)。取新鮮健康的朝天椒綠果,對果實表面進行消毒,采用針刺接種法將5 μL 病菌孢子懸浮液(孢子濃度為1 × 10個·mL)接種至果實表面,對照組接種等量滅菌ddHO,于28 ℃恒溫培養箱中培養,濕度80%,每個處理進行3 次生物學重復。
1.4 病原菌的形態學鑒定
觀察并記錄病原菌菌落在TOA 培養基上的形態、大小及顏色等特征。誘導病菌的孢子懸浮液并進行顯微制片,通過顯微鏡觀察并記錄病原菌的分生孢子形態特征。
1.5 病原菌的分子生物學鑒定
利用真菌基因組DNA 快速抽提試劑盒〔生工生物工程(上海)股份有限公司,B518229〕,對病原菌的基因組DNA 進行抽提和純化。對病原菌的核糖體轉錄間隔序列(internal transcribed spaces,ITS)、β-微管蛋白基因(β-tubulingene,)、3-磷酸甘油醛脫氫酶基因(glyceraldehyde-3-phosphate dehydrogenase gene,)、幾 丁質合成酶A 基因(chitin synthase A gene,)和肌動蛋白基因(actin gene,)進行PCR 擴增,所用引物見表1。PCR 的反應體系包括病原菌基因組DNA 100 ng,引物4 mmol·L,KOD 酶0.4 μL,2× KOD buffer 10 μL,dNTP 4 mmol·L,ddHO 補足至20 μL。PCR 程序設置為:98 ℃預變性5 min;98 ℃變性30 s,60 ℃退火45 s,68 ℃延伸30 s;共35 個循環。PCR 產物通過1%的瓊脂糖凝膠進行電泳檢測,將擴增長度符合預期的PCR產物連接到pEASY-blunt zero 載體上,對陽性克隆進行測序及進一步的序列分析。

表1 病原菌分子鑒定相關基因克隆所用引物
1.6 多基因的系統發育樹分析
將、、、和基 因片段的測序結果在GenBank 中進行BLAST 序列比對,利用數據庫中的炭疽菌屬模式菌株的、、、和基因序列作為參考序列(Diao et al.,2017)。將上述基因序列進行串聯分析,利用Geneious v4.8.3 軟件對組合數據集進行鄰接(neighbor-joining,NJ)系統聚類分析,通過自展法(bootstrap analysis)對系統發育樹進化枝的穩定性進行評估,重復1 000 次。本試驗涉及的炭疽菌屬模式菌株的相關信息詳見表2。

表2 用于系統發育樹分析的炭疽菌菌株
1.7 藥劑室內毒力測定
供試12 種常用殺菌劑購買于本地市場(表3)。先將12 種殺菌劑配制成待測母液,然后按比例加至TOA 培養基中:在無菌條件下,按10、100、1 000 μg·mL的終濃度將所需母液量加入培養基中,空白對照為加入等量無菌水的培養基。用接種針挑取直徑為3 mm 的菌塊接種至培養基的中央,28 ℃培養7 d,每個濃度梯度進行3 次生物學重復。采用“十”字交叉法對菌落直徑進行測量并記錄數據。將抑菌效果較好的6 種有效藥劑挑出進行第2輪試驗,其中咪鮮胺、苯甲·丙環唑和甲基硫菌靈濃度梯度為0.5、1.0、2.0、4.0、8.0 μg·mL,腈菌唑、唑醚·代森聯和醚菌酯濃度梯度為5、10、20、40、80 μg·mL。采用生長速率法測定和計算不同藥劑的抑菌率。根據各殺菌劑濃度對數值及對應的抑菌率作回歸分析,計算各殺菌劑的毒力回歸方程(=+)、抑菌有效中濃度(EC)及相關系數()。

表3 供試藥劑及生產廠家
抑菌率=(對照菌落直徑-處理菌落直徑)/(對照菌落直徑-接種菌餅直徑)× 100%
1.8 數據分析
采用Microsoft Excel 2010 軟件進行數據處理和作圖,利用DPS v7.05 軟件進行數據統計分析。
2 結果與分析
2.1 南雄朝天椒炭疽病的危害及病原菌的分離
辣椒炭疽病多發生于每年7 月初至9 月中旬,正是成熟辣椒大量采收和貯運的關鍵時期。2020年,廣東省韶關市南雄市朝天椒種植區大面積暴發辣椒炭疽病,嚴重地塊的病果率高達80%。該病原菌主要為害紅熟后的辣椒果實,并在采后貯運過程中持續造成果實腐爛。發病初期,被害果實出現褐色不規則病斑。貯運過程中密封的濕熱環境加速病害的蔓延,病斑上出現橘黃色的孢子團。發病后期,病斑擴散至整個果實,病果失水干枯并發生脫落(圖1-a)。

圖1 南雄辣椒炭疽病發病癥狀及病原菌形態
通過組織分離法,在TOA 培養基上分離到白色的真菌菌落(圖1-b)。對分離得到的病原菌進行純化,菌落在培養基上呈圓形,菌絲呈白色絨狀,后期逐漸變為灰色,并有同心環紋(圖1-c)。分生孢子為無色單胞,形狀為長棒狀,長軸為8~17 μm,短軸為4~6 μm(圖1-d)。
2.2 病原菌的致病性測定
利用針刺接種法對新鮮的朝天椒綠果進行炭疽病菌孢子懸液的接種,2 d 后接種位置出現炭疽病病斑,病情發展迅速。接種后第6 天,炭疽病病斑凹陷,呈長橢圓形,直徑可達10~15 mm,中央產生大量橙色粘稠的孢子團,外周呈褐色;對照未出現病斑,針刺位置可清晰辨認(圖2)。根據柯赫氏法則,將本次試驗的發病組織重新進行組織分離,得到的病原菌與之前分離的原始病原菌一致,確定該菌為南雄朝天椒炭疽病的致病菌,并將該菌株命名為NX-1。

圖2 辣椒炭疽病病原菌的致病性測定結果
2.3 病原菌的分子生物學鑒定
對南雄辣椒炭疽病菌NX-1 的、、、和基因進行PCR 擴增,獲得長度分別為558、759、248、291 bp 和 250 bp的DNA 序列(圖3)。對上述基因片段進行測序,測序結果通過多基因的系統發育樹進行分析,結果表明病原菌NX-1 與炭疽菌模式菌株CBS 120708 為一個進化支(圖4)。結合NX-1 的形態學特征和多基因系統發育樹分析結果,將南雄辣椒炭疽病菌NX-1 鑒定為炭疽菌。

圖3 NX-1 分子鑒定相關基因的PCR 擴增
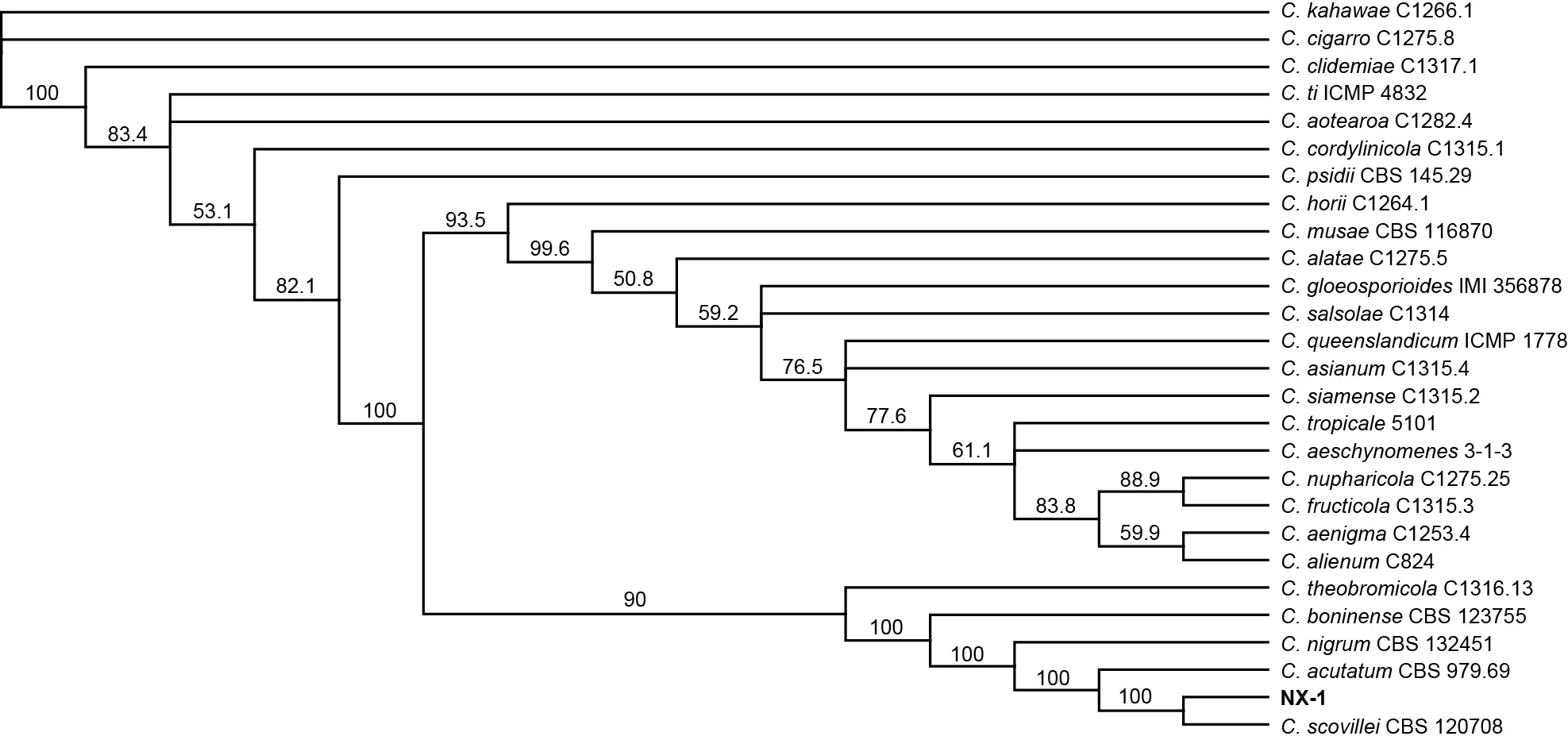
圖4 炭疽病菌NX-1 的多基因系統發育樹分析結果
2.4 12 種藥劑對辣椒炭疽病菌的抑菌效果鑒定
通過10、100、1 000 μg·mL3 個濃度梯度的12 種藥劑對炭疽病進行初步的抑菌效果鑒定,結果表明:咪唑類和三唑類的單劑(咪鮮胺和腈菌唑)或復配劑(苯甲·丙環唑)均表現出良好的抑菌效果;取代苯基類的甲基硫菌靈抑菌效果較好,但百菌清效果一般;甲氧基丙烯酸酯類的單劑(醚菌酯)或復配劑(唑醚·代森聯)也表現出較好的抑菌效果;春雷·王銅和甲霜·噁霉靈這兩種復配劑只能在高濃度條件下具有抑菌作用;噁霉·絡氨銅的抑菌效果較差;烯酰嗎啉和噻菌酮幾乎沒有抑菌作用(圖5、6)。

圖5 不同濃度殺菌劑對炭疽病菌NX-1 菌絲生長的抑制作用

圖6 不同濃度殺菌劑對炭疽病菌NX-1 的抑制率
2.5 6 種有效藥劑對辣椒炭疽病菌的室內毒力測定
采用咪鮮胺、苯甲·丙環唑、甲基硫菌靈、腈菌唑、唑醚·代森聯和醚菌酯6 種抑菌效果較好的殺菌劑對NX-1 進一步進行室內毒力測定,結果表明,6 種藥劑均能不同程度地抑制炭疽病菌菌絲的生長,其抑菌作用由強到弱依次為:咪鮮胺>苯甲·丙環唑>甲基硫菌靈>腈菌唑>唑醚·代森聯>醚菌酯(圖7)。咪鮮胺和苯甲·丙環唑的EC均在1 μg·mL以內,分別為0.019 6 μg·mL和0.282 8 μg·mL,抑菌效果較強;其次是甲基硫菌靈和腈菌唑,EC分別為1.694 6 μg·mL和7.475 6 μg·mL;唑醚·代森聯和醚菌酯的EC較高,分別為16.130 8 μg·mL和19.942 8 μg·mL(表4)。

圖7 6 種有效藥劑對炭疽病菌NX-1 菌絲生長的抑制作用

表4 6 種有效殺菌劑對炭疽病菌NX-1 的室內毒力測定
3 討論與結論
近年來,廣東省南雄市的辣椒種植逐漸成為了具有地方特色的北運蔬菜產業。然而,辣椒的炭疽病害也隨著南雄辣椒種植面積的擴大而日趨嚴重。本試驗從南雄市湖口鎮辣椒基地采集疑似辣椒炭疽病的自然發病朝天椒果實,獲得分離純化的辣椒炭疽病病原菌,通過致病性測定、微生物形態學分析和分子生物學研究方法確定南雄朝天椒炭疽病病原菌的種類為。近年來,分子生物學在真菌的分類研究中發揮了很大作用,序列分析、多基因的系統發育樹分析等方法被廣泛應用(Marin-Felix et al.,2017)。基因是分子檢測中最常用的靶基因,但該基因沒有足夠的變異位點用以區分所有的菌種(Innis et al.,1991)。本試驗使用的多基因系統發育樹分析是基于、、、和5 個基因的串聯分析,該方法在親緣關系較近、外形相似的真菌間的分析比較與種類鑒定中較單基因序列分析更具優勢。
通過對12 種殺菌劑的抑菌效果鑒定和室內毒力測定,表明咪鮮胺、苯甲·丙環唑、甲基硫菌靈、腈菌唑、唑醚·代森聯和醚菌酯均對南雄辣椒炭疽病菌表現出不同程度的抑制作用。從EC來看,咪鮮胺和苯甲·丙環唑的抑菌作用最強,其EC分別為0.019 6 μg·mL和0.282 8 μg·mL。因此,咪鮮胺和苯甲·丙環唑均可用于南雄辣椒炭疽病的防治,可將咪鮮胺作為首選殺菌劑,或二者交替使用。此外,由于田間環境影響因素較多,殺菌劑的室內毒力與田間實際防治效果可能有所差異,今后將進一步測定咪鮮胺和苯甲·丙環唑在大田中對辣椒炭疽病菌的影響,以期在實際的辣椒生產中指導企業和農民在辣椒炭疽病害管理過程中科學、高效用藥,降低生產成本和農藥施用量,為食品安全和生態環境提供保障。

