老芒麥種子染色體端粒及抗氧化防御系統對自然老化的響應
孫守江, 馬 馼, 祁 娟, 師尚禮, 劉文輝
(1.甘肅農業大學草業學院/草業生態系統教育部重點實驗室/甘肅省草業工程實驗室/中-美草地畜牧業可持續研究中心, 甘肅 蘭州 730070; 2.中國農業大學草業科學與技術學院/草業科學北京市重點實驗室, 北京 100193; 3.青海省畜牧獸醫科 學院青海省青藏高原優良牧草種質資源利用重點實驗室, 青海 西寧 810016)
種子是農業生產的重要資料,收獲后需要對其貯藏,但是種子內部在貯藏過程中會不可避免地自然發生一系列生理生化反應導致種子老化[1]。不良的儲藏條件會加快種子的衰老,使細胞內的活性氧異常累積,細胞遺傳物質、蛋白質、脂質等生物大分子發生氧化損害,進而發生一系列的生理及生化變化,例如細胞膜通透性變化、代謝產物外滲、抗氧化酶活性下降等[2-5]。其中端粒序列是富含鳥嘌呤的線性染色體末端,端粒DNA容易受到活性氧的攻擊導致端粒縮短,使其原有的保護功能減弱甚至消失,最終導致細胞停止分裂[5-7]。因此,種子在貯藏過程中自然發生且不可避免的這一系列生理生化反應的類型和速度與貯藏環境有著密不可分的聯系,這些反應會直接影響種子內部的蛋白質、核酸等生物大分子,對細胞結構產生影響[8-9],種子內部多種酶活性的變化又對這些生理生化反應產生了反饋調節[10]。同時,種子過度老化還會影響細胞器的結構[11]。
研究發現,在種子老化過程中端粒長度也呈現一定的變化規律,Kilian等[12]研究發現,植物端粒DNA是一種動態結構,在分化和衰老過程中會縮短,端粒被認為是種子老化的可靠標志。Bucholc等[13]證明了新鮮和儲存小麥(Triticumaestivum)種子之間端粒序列長度的顯著差異,盡管它們在發芽率方面相似。且小麥和黑麥(Secalecereale)種子的試驗表明,端粒長度與種子老化呈負相關。Dona等[14]報道了白玉草(Silenevulgaris)和蠅子草(Sileneacaulis)的干燥和再水化種子的平均端粒長度存在顯著差異。復水后,端粒長度明顯增加,人工老化后,端粒長度明顯減少。從這些研究可以看出,在種子人工老化或者自然老化過程中,端粒長度呈現一定的變化規律,但是種子端粒長度與種子所處狀態也具有很大的關系。
老芒麥(Elymussibiricus)是禾本科披堿草屬多年生牧草,作為中國北方地區的農業生產及生態建設草種之一在我國西北、華北以及東北一帶被廣泛種植,因此種子產業各部門都對老芒麥的種子產量高低以及種子質量優劣極為關注[15]。大量研究表明,人工加速老化處理方法能快速達到種子老化目的[16-19],便于檢測老化后的種子活力以及生理生化特性變化,但是該方法的反應過程過于快速,種子老化細節難以掌握[20]。基于此,本研究選用不同貯藏年限老芒麥種子為研究對象,從種子發芽特性、抗氧化防御系統以及端粒酶活性水平探討種子在自然老化過程中,種子活力、生理生化代謝產物、種子抗氧化酶活性以及端粒酶活性變化規律,以期為老芒麥種子的正確貯藏方式以及人工延緩老芒麥種子老化進程提供參考依據,同時本研究對老芒麥種質資源的近一步開發利用也具有積極意義。
1 材料與方法
1.1 試驗材料
2012,2013,2014,2016,2017年在青海牧科院種子擴繁試驗基地(位于100°23′ E,36°44′ N,海拔3 010 m)收獲‘青牧1號’老芒麥(ElymussibiricusL.‘Qingmu No.1’)種子,使用布袋分裝后常溫貯藏于無任何控制溫、濕度設施的種子庫中,種子庫位于青海省畜牧獸醫科學院,該地2011—2018月平均氣溫見圖1。于2018年6月—2018年7月以貯藏在種子庫中1,2,4,5和6年的老芒麥種子為試驗材料,在甘肅農業大學草業學院實驗室進行相關試驗指標的測定,參照牧草種子檢驗規程(GB/T 2930.8-2017)測定供試種子初始含水量,見表1。

表1 供試老芒麥種子樣品信息Table 1 Basic information of Elymus sibiricus seeds

圖1 青海省海北州海晏縣2011—2018年月平均氣溫和月累計降雨量圖Fig.1 Monthly average temperature and cumulative rainfall of Haiyan County,Haibei Prefecture,Qinghai Province, 2011—2018
1.2 試驗方法
1.2.1發芽試驗 參照牧草種子檢驗規程(GB/T2930.4-2017)進行老芒麥種子的發芽試驗[21],采用紙床法進行培養。每個貯藏年限都選取無病蟲害、大小均勻的老芒麥種子100粒,放入提前盛有兩層濾紙的圓形玻璃培養皿中,在GXZ-380B-LED培養箱中進行培養,光照周期為8 h光照16 h黑暗,溫度條件為25℃/15℃變溫,每個處理重復4次。以長成正常種苗作為種子發芽標準,每日統計種子發芽情況,第5 d統計種子發芽勢,第12 d統計種子發芽率,第12 d在每皿中隨機選取10個正常種苗量取芽長和根長。計算種子各項發芽指標,計算方法見公式(1)(2)(3)(4)。
發芽率=(第12 d正常種苗數÷供試種子總數)×100%
(1)
發芽勢=(第5 d正常種苗數÷供試種子總數)×100%
(2)
發芽指數(GI)=Σ(Gt/Dt)
(3)
活力指數=(平均根長+平均芽長)×發芽指數
(4)
式中:Gt為第t天的發芽種子數;Dt為對應的發芽天數。
1.2.2生理生化指標測定 不同貯藏年限的種子吸脹6 h后進行相關生理指標測定。參照國際種子檢驗協會《種子活力測定方法手冊》中的方法進行種子浸出液電導率測定[22];分光光度法測定葡萄糖含量[23];考馬斯亮藍G-250染色法測定可溶性蛋白含量[23];硫代巴比妥酸法測定丙二醛(Malondialdehyde,MDA)含量[23];超氧化物歧化酶(Superoxide dismutase,SOD)、過氧化物酶(Peroxidase,POD)、過氧化氫酶(Catalase,CAT)的活性測定分別采用氮藍四唑法、愈創木酚法、紫外分光光度法[24]。
1.2.3種子端粒酶活性測定 老芒麥種子端粒酶活性檢測參照上海賢綿生物科技有限公司的植物端粒酶(TE)ELISA檢測試劑盒說明書(LP-P03356),不同貯藏年限的種子吸脹6 h后液氮速凍,用低溫高通量種子研磨儀(QC-WT1t)研磨后稱取1 g粉末裝入15 mL離心管中,加入10 mmol·L-1pH=7.3的PBS溶液,渦旋振蕩均勻后12 000 g,4℃離心20 min,將上清液轉入新的15 mL離心管中,放入-80℃冰箱待測。
1.3 數據統計分析
數據的顯著性分析使用Microsoft excel 2016和SPSS 23.0 軟件。所有數據均為4個重復的平均值±標準誤(±SE),用單因素方差分析(ANNOVA)和鄧肯檢驗(Duncan test)比較不同處理的平均值(P<0.05)。
2 結果與分析
2.1 貯藏年限對老芒麥種子萌發及幼苗生長的影響
由表2可知,老芒麥種子的一系列發芽指標總體上都隨貯藏年限的增加呈現下降趨勢。但是貯藏2年種子的各項發芽指標普遍高于貯藏1年的種子。從種子發芽率中可以看出,貯藏初期發芽率基本保持穩定,貯藏1年與貯藏2,4和5年相比,無顯著性差異,貯藏5年后種子發芽率快速下降;而種子發芽勢和發芽指數下降趨勢漸緩,貯藏2年與貯藏1年相比無顯著差異,貯藏4,5和6年與貯藏1年相比,差異均顯著(P<0.05),貯藏5年后發芽勢和發芽指數發生了大幅度下降;種子活力指數也隨著貯藏年限的增加而呈現下降趨勢,貯藏4,5和6年與貯藏2年相比,差異均顯著(P<0.05),貯藏4年與貯藏1年相比無顯著差異。
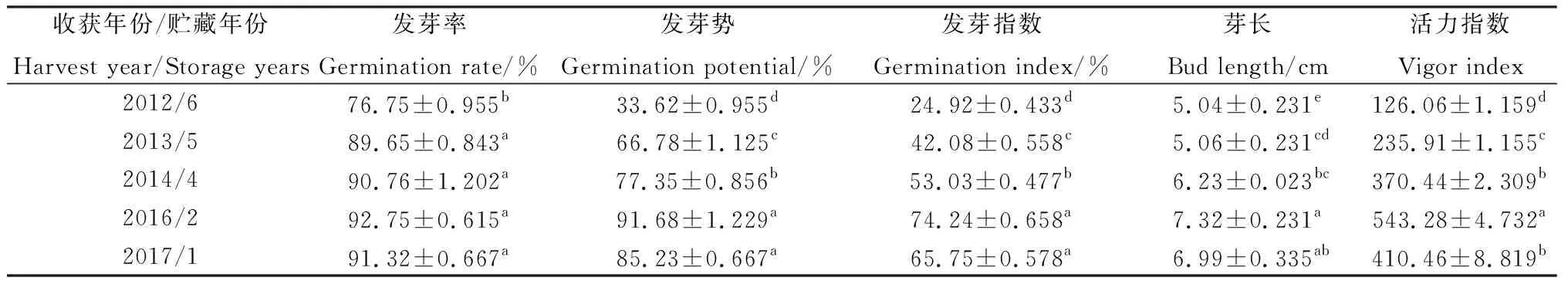
表2 不同貯藏年限對老芒麥種子活力的影響Table 2 Effects of different storage years on seed vigor of Elymus sibiricus
2.2 貯藏年限對老芒麥種子端粒酶活性的影響
隨著貯藏年限的增加,老芒麥種子中的端粒酶活性也逐年上升,貯藏2,4,5和6年與貯藏1年相比,差異均顯著(P<0.05),貯藏2年與貯藏4年相比,差異不顯著,與貯藏5年和貯藏6年相比差異顯著(P<0.05,圖2)。
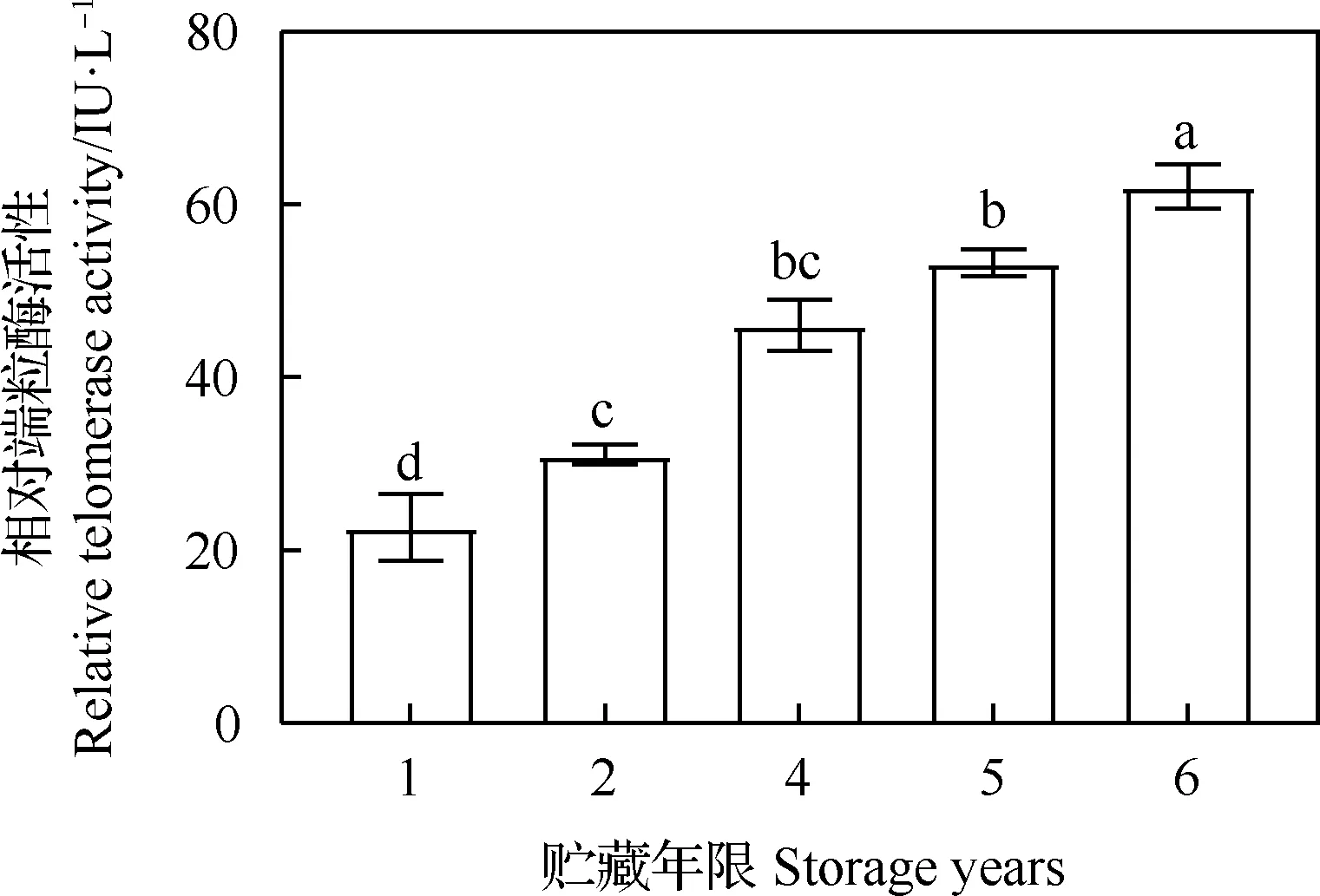
圖2 不同貯藏年限對老芒麥種子端粒酶活性的影響Fig.2 Effect of different storage time on telomerase activity of Elymus sibiricus注:圖中不同小寫字母表示不同處理間差異顯著(P<0.05),下同Notes:Different lowercase letters indicate significant differences among the different treatments at 0.05 level,the same as below
2.3 貯藏年限對老芒麥種子電導率、可溶性蛋白含量和葡萄糖含量的影響
不同貯藏年限對老芒麥種子電導率、葡萄糖含量和可溶性蛋白含量的影響見圖3。隨著貯藏年限的增加,老芒麥種子浸出液電導率逐漸上升,但是隨著貯藏年限的進一步增加,上升趨勢逐漸變得平緩,貯藏2,4,5和6年與貯藏1年相比,差異均顯著(P<0.05),貯藏5年與貯藏6年相比無顯著差異(圖3A)。隨著貯藏年限的增加,種子內部的葡萄糖含量逐漸增加,貯藏2,4,5和6年與貯藏1年相比,差異均顯著(P<0.05,圖3B)。隨著貯藏年限的增加,可溶性蛋白含量則呈現出下降的趨勢,貯藏初期含量下降較緩慢,貯藏4年后急劇下降,貯藏1年與2年相比無顯著差異,貯藏6年則顯著低于貯藏1年(P<0.05,圖3C)。
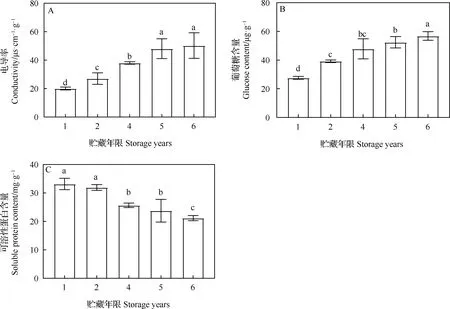
圖3 不同貯藏年限對老芒麥種子電導率、葡萄糖含量和可溶性蛋白含量的影響Fig.3 Effects of storage years on the conductivity,the glucose content and the soluble protein content of Elymus sibiricus seeds
2.4 貯藏年限對老芒麥種子MDA含量的影響
老芒麥種子中的MDA含量隨貯藏年限的增加而上升,且在貯藏2年后含量急劇上升,貯藏5年后含量上升較平緩。貯藏4,5和6年與貯藏1年相比,差異均顯著(P<0.05),貯藏1年與貯藏2年相比無顯著差異(圖4)。
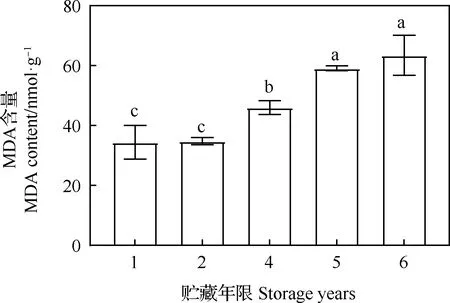
圖4 不同貯藏年限對老芒麥種子MDA含量的影響Fig.4 Effect of storage years on MDA content of Elymus sibiricus seeds
2.5 貯藏年限對老芒麥種子SOD,POD和CAT活性的影響
隨貯藏年限的增加,老芒麥種子的SOD,POD和CAT活性總體呈下降趨勢,SOD和POD活性在貯藏前2年無顯著差異,基本保持不變;貯藏2年后活性急劇下降,各貯藏年份之間差異顯著(P<0.05),但是貯藏5年以后SOD,POD活性下降相對較平緩,貯藏5年與6年之間不存在顯著差異(圖5A,圖5B)。隨貯藏年限的增加CAT活性下降,各貯藏年限之間差異均顯著(P<0.05,圖5C)。
2.6 不同貯藏年限老芒麥種子活力相關指標、端粒酶活性以及抗氧化防御指標相關性分析
由圖6可知,12個指標中大部分都具有較高的相關性。種子發芽率(GP)與發芽指數(GI)、活力指數(VI)、芽長(BL)、電導率(EC)、端粒酶活性(TA)和葡萄糖含量(Glu)顯著正相關,但是與SOD和CAT活性顯著負相關。活力指數作為種子活力的一個代表性評價指標,與9個指標具有顯著相關性,正相關指標包括發芽率、發芽指數、芽長、電導率、端粒酶活性和葡萄糖含量;負相關指標包括SOD,POD和CAT活性。從此結果可以看出,老芒麥種子代謝產物含量變化、抗氧化酶活性變化以及端粒酶活性變化在一定程度上指示著種子自然老化的程度,因此可以將該指標用作貯藏過程中種子質量的評價。
3 討論
3.1 貯藏年限對老芒麥種子萌發及幼苗生長的影響
種子是種子植物最重要的繁殖器官,種質資源的保存和農牧業的發展密不可分,種子質量的好壞直接決定了后代植株的生長發育狀況,因此,也就成了直接影響農業生產成敗的關鍵[25]。種子在貯藏過程中含水量是影響種子活力的一個重要因素,本研究中,隨著貯藏年限增加,老芒麥種子含水量變化較小,因此可以看出,在種子含水量相對穩定的狀態下,影響種子活力的另一個因素是貯藏年限。種子活力是評價種子質量的重要指標之一,種子吸脹萌發并長成正常種苗以及后期幼苗生長狀況是種子活力的具體體現。種子通常在生理成熟或之后不久達到最高活力,但是受到貯藏條件不佳以及貯藏時間延長的影響,種子會不可避免地發生劣變,最終導致不可逆轉的種子老化[26]。高活力種子在種子萌發以及后續的幼苗生長中都具有明顯的優勢。在本研究中,隨著貯藏年限的增加,老芒麥種子的各項發芽指標基本都呈現出逐漸降低的趨勢,這與狗尾草(Setariasphacelata)和紫花苜蓿(Medicagosativa)等種子貯藏研究結果一致[27-29]。本研究也發現貯藏2年種子的一系列發芽指標均高于貯藏1年的種子,這是由于種子收獲后還尚未完全成熟,需要在適宜的環境下貯藏一段時間才能完全成熟,為種子生理后熟現象。這在披堿草(Elymusdahuricus)、狼牙根(Cynodondactylon)等種子萌發研究中也有類似的相關報道[30-32]。
3.2 貯藏年限對老芒麥種子滲透調節物質含量的影響
種子在老化期間會不可避免地發生老化現象,這個過程涉及種子內部眾多復雜生理生化反應[33],在這個過程中,種子內部結構受損,正常的呼吸、代謝等生理功能受到影響,會表現出抗氧化酶活性降低、細胞膜透性變大、代謝物外滲等生理現象[34]。本研究中,隨著貯藏年限的增加,種子電導率、葡萄糖含量和MDA含量上升,這與付藝峰等[35]的研究結果一致。種子浸出液電導率隨著貯藏年限的增加而上升的現象則說明細胞膜受破壞程度隨著種子老化程度的加深而加重,種子內部ROS過量累積,攻擊細胞膜結構時多不飽和脂肪酸與ROS發生一連串氧化反應最后導致細胞膜脂分解成MDA等小分子物質[36],因此其含量的高低可以用來說明細胞膜在受到脅迫時的損傷程度,說明種子貯藏過程中細胞膜脂過氧化的程度也逐漸加重[37]。
3.3 貯藏年限對老芒麥種子抗氧化酶活性和膜脂過氧化作用的影響
正常細胞中ROS的產生與清除處于動態平衡狀態,在種子老化過程中,除不同代謝物的含量變化外,更為主要的特點是ROS的產生速率大于清除速率,導致ROS在細胞中積累,以及一系列生理生化反應的發生,如核酸降解[38]。抗氧化系統發揮著清除ROS,減少氧化損傷的功能,細胞中含有多種抗氧化酶,如SOD,POD,CAT等,它們的作用主要是清除ROS,防止ROS對細胞的破壞[39],同時也可以反映植物體內抗氧化系統的抗氧化能力強弱[40]。本研究中,隨著貯藏年限的增加,SOD,POD和CAT酶活性都呈現出逐漸降低的趨勢,貯藏初期,SOD和POD活性下降較緩慢,但是貯藏5年以后,活性基本維持穩定狀態,CAT活性呈現出持續降低的趨勢,說明這3種酶在抗氧化系統中發揮著不同的作用,這與對玉米(Zeamays)、新麥草(Psathyrostachysjuncea)等種子老化研究的結果一致。另外,細胞中MDA含量的持續積累會在一定程度上抑制細胞抗氧化酶活性,本試驗結果中表明,種子貯藏初期MDA含量較低,貯藏2年以后含量急劇升高,同時,SOD,POD,CAT酶活性也急劇降低,SOD和POD酶活性的降低與MDA含量的變化同步或者略遲于MDA的變化,說明SOD,POD,CAT酶活性的降低可能與MDA的持續積累具有潛在的聯系,這還有待進一步深入研究。
3.4 貯藏年限對老芒麥種子端粒酶活性的影響
ROS對種子細胞內的生物大分子物質—蛋白質、核酸和脂質具有很強的破壞力,當ROS濃度較低時,它可以作為信號分子誘導細胞中某些抗氧化酶基因的表達以提高植物的抗氧化能力,清除過量的ROS,從而達到生成和清除的平衡狀態[42]。真核細胞線型染色體末端即端粒DNA是由嘌呤堿基重復序列DNA組成,該部分對ROS極度敏感,端粒DNA損傷后需要端粒酶對其進行修復,因此端粒酶活性的變化在一定程度上反應端粒DNA的變化[41]。從本試驗結果可以看出,在貯藏初期SOD和POD活性較高,說明SOD和POD在種子貯藏初期發揮著清除ROS,保護細胞結構的作用,但是隨著種子貯藏時間的延長,種子老化程度進一步加重,種子內部抗氧化系統受損,SOD,POD和CAT等抗氧化酶的活性開始降低,清除ROS的能力下降,使得ROS的產生和清除發生失衡,造成不正常累積。高濃度ROS可直接作用DNA,使細胞核內DNA降解。本研究中,隨著貯藏年限增加,端粒酶活性增加,這與王楊等[43]在擬南芥中的研究結果一致。端粒酶(TERT)一直被認為是依賴端粒酶RNA(TER)的DNA聚合酶,在細胞中執行延長染色體末端的端粒結構的功能。端粒酶除了維持端粒長度和染色體穩定之外,還具有許多非端粒的功能,例如對非生物脅迫的明顯響應。端粒酶在抗氧化系統中的非端粒功能以及內在調控規律還有待進一步深入研究。
4 結論
自然老化降低了老芒麥種子的活力。老芒麥種子的發芽率、發芽勢、發芽指數和活力指數隨著貯藏年限延長逐漸降低。老芒麥種子抗氧化酶活性下降以及細胞膜脂過氧化是導致種子活力下降的重要原因。老芒麥種子在自然貯藏過程中抗氧化酶活性的降低造成活性氧不能及時被清除,導致細胞膜脂過氧化,膜通透性增加,繼而影響種子的萌發以及后期幼苗的生長。

