多糖對炎癥性疾病及腸道菌群調控作用的研究進展
黃宇哲,吳前震,許騰龍,陳 浩,張坤峰,陳潔琳,李大祥,陳 彥
(1.安徽大學生命科學學院,生態工程與生物技術安徽省重點實驗室,安徽 合肥 230000;2.南京康之春生物科技有限公司,江蘇 南京 210000;3.安徽農業大學茶與食品科學技術學院 茶樹生物學與利用國家重點實驗室,安徽 合肥 230036)
多糖是通過糖苷鍵連接,由10個以上單糖分子構成的鏈狀糖,廣泛存在于天然產物中,其中包括高等植物多糖(菊糖、果膠等)、海洋多糖(海藻酸、殼聚糖等)、微生物胞外多糖(透明質酸、葡聚糖)等[1]。近年來,研究表明不同來源的多糖具有免疫調節、抗腫瘤、抗病毒、抗氧化、降血糖、降血脂等多種生物活性。隨著腸道微生物研究的不斷深入,人們發現存在于自然界中的多糖普遍具有調節腸道菌群功能,腸道菌群對多糖的降解是多糖生物活性產生的基礎。
研究表明,人體胃腸道內分布著大量的菌群,龐大的微生物體系是機體趨于健康態的“橋梁”,它們不但控制著物質的消化吸收和機體免疫,而且具有預防和治療代謝性疾病等作用[2]。研究顯示,β2-1果聚糖和β-葡聚糖能夠顯著增加益生菌雙歧桿菌的豐度,其中β-葡聚糖可為菌群繁殖產生乳酸提供條件,并發揮酵解多糖作用改善代謝相關疾病[3]。車前子多糖提高卵圓擬桿菌的相對豐富度,在降解β-1,4鏈接木聚糖中發揮重要作用[4]。大豆多糖促進益生菌雙歧桿菌的生長并抑制致病菌,與此同時產生大量的乙酸、乳酸,改善腸道微生態。綜上結果均提示多糖與腸道菌群相互作用是影響機體健康的關鍵因素。
多糖已被證明對機體腸道菌群組成影響顯著,但由于宿主-腸道菌群-營養代謝三者間的相互作用研究不健全,其生理機制尚不清楚。目前,基于分子方法測序、DNA指紋、熒光原位雜交(FISH)、獵槍元基因組測序、元基因組學和元轉錄組技術與代謝組學方法的聯用為菌群分析提供了新的研究模式。本文將根據國內外研究成果,重點綜述多糖與腸道菌群的相互作用,展望以腸道菌群為靶點,多糖發揮“益生元功效”干預炎性相關疾病的治療前景。如Fig 1。
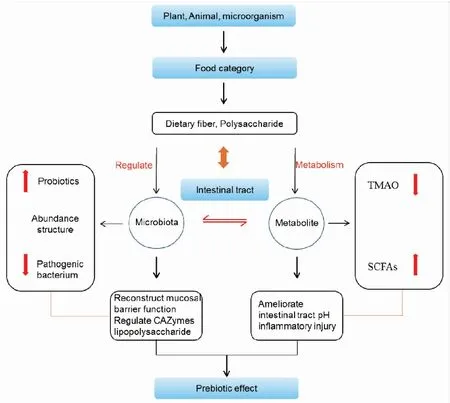
Fig 1 Impact of active compounds from polysaccharides on gut microbiota
1 腸道菌群的結構
腸道內定植著龐大數量的微生物群落,菌群數約在103~104之間,種類約有1 000種,編碼超過300萬個基因,產生的數千個代謝物參與完成人體正常的物質轉化,被認為是人體重要的“虛擬器官”維持機體健康。腸道菌群在人體主要分為4大類群,分別為厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、變形菌門(Proteobacteria)和放線菌門(Actinobacteria),其中厚壁菌門和擬桿菌門是優勢菌門,占據腸道菌群總量的90%以上[5]。Joshua Lederberg 教授在2000年提出“超級生物體”概念后,越來越多的科研工作者將重點轉向人體與腸道菌群之間相互作用關系研究。結果發現益生菌可以修復腸道黏膜損傷,維持腸道功能平衡。
人體腸道菌群結構容易受飲食、年齡、生活方式及藥物等因素影響。華大基因研究院覃俊杰等研究人員基于元基因組測序技術對124個歐洲人糞便樣本進行提取檢測,發現人群的腸道基因99%源自細菌,數量約1 000~1 150種[6]。其中,擬桿菌門(Bacteroidetes)和厚壁菌門(Firmicutes)為優勢菌,真桿菌屬(Eubacterium)、瘤胃球菌屬(Ruminococcus)、雙歧桿菌屬(Bifidobacteria)、鏈球菌屬(Streptococci)等在腸道內也占據一定的比例。這一發現再次證明機體的健康受菌群基因的調控。Nishijima S 等[7]研究表明腸道菌群與地理環境,飲食差異存在密切的聯系,通過宏基因組數據比較日本、歐洲、美國、中國等11個國家健康人群,發現日本人腸道菌群中放線菌門和雙歧桿菌屬比其他國家更豐富,此外,約90%的日本人擁有分解海苔和裙帶多糖類相關酶基因,上述結果提示腸道菌群組成受長期飲食影響較大。因此,通過調控腸道菌群結構,或可成為促進機體健康和預防疾病的新靶點。
2 腸道菌群降解多糖的作用
多糖由單糖亞基和糖苷鍵構成,不能被人體直接消化吸收,其在體內發揮效用取決于腸道菌群的酵解,由于人類自身基因組只能編碼17種多糖消化酶,大多數多糖需借助數量龐大的碳水化合物活性酶(CAZymes)參與降解、修飾及生成糖苷鍵功能。
多糖被CAZymes分步驟的降解成低分子量的寡糖或單糖,易于機體吸收,與此同時產生活性代謝物質-短鏈脂肪酸(short chain fatty acids,SCFAs)滋養腸道菌群并維持腸道微生態平衡。Bernard Henrissat根據其作用將CAZymes分為糖苷水解酶、多糖裂解酶、碳水化合物酯酶、糖基轉移酶和輔助氧化還原酶5類,其中糖苷水解酶(GHs)、多糖裂解酶(PLs)和碳水化合物酯酶(CEs)是影響多糖結構降解變化的關鍵酶,目前,GHs分為130個家族,PLs分為22個家族,它們在降解同一復雜多糖時將發揮協同特性,這些活性酶影響著基因簇編碼聚糖系統發揮降解作用[8]。結構越復雜的多糖,降解所需的關鍵菌就越多,Ndeh 等[9]發現B.thetaiotaomicron可利用已知結構最復雜的果膠多糖-II型鼠李半乳糖醛酸聚糖(rhamnogalacturonan-II,RG-II),研究挖掘得到了3個多糖利用位點(polysaccharide utilization loci,PULs)上的40余種酶參與RG-II降解過程。多糖進入體內作為“碳源”滋養腸道菌群,CAZymes將大分子物質分級轉化成小分子物質、代謝產物和ATP被機體吸收,進而發揮調節免疫,抑制炎癥等作用。如Fig 2。
菌群不同對多糖的降解能力有差異,編碼的CAZymes 基因數量決定某類菌群對多糖的降解有通用性還是專化性。Rivière A等[10]研究發現擬桿菌屬平均編碼137.1個CAZymes 基因,具有降解多種多糖的能力,而厚壁菌屬僅編碼39.6個CAZymes 基因,只能降解部分特異性多糖。如卵形擬桿菌(Bacteroidesovatus)ATCC8483 能增加菊粉形成小分子產物被普通擬桿菌代謝利用;直腸真桿菌(Eubacteriumrectale)僅分解阿拉伯木聚糖的樹膠醛糖側鏈,長雙歧桿菌(Bifidobacteriumlongum)則進一步代謝初級產物形成單糖,供直腸真桿菌利用[11]。活性酶之間協同完成多糖降解,主鏈通過GHs和部分PLs完成降解,側鏈則需要木糖苷酶、甘露糖苷酶及大量水解酶參與,側鏈的移除暴露新末端,為主鏈繼續降解提供作用位點。不同的腸道菌群對多糖的降解特性存在差異,菌群分泌的活性酶對不同多糖的敏感性也有區別,擬桿菌在體內發揮益生作用,通過水解和發酵多糖,產生短鏈脂肪酸,被腸上皮細胞吸收利用。Gordon 等[12]于2006年發現并檢測出擬桿菌門基因組內存在多糖利用位點(PULs)的獨特特征,闡明其消化、降解和轉運方式。每個PULs協調單個或多個特定聚糖分解,并編碼蛋白質組成淀粉利用系統(Sus-like systems)。多形擬桿菌編碼α-甘露糖苷酶、β-葡糖醛酸糖苷酶、α,β-葡糖苷酶等261種糖苷水解酶及多糖裂解酶,這一發現為菌群編碼活性酶在多糖結構中的應用提供理論基礎。
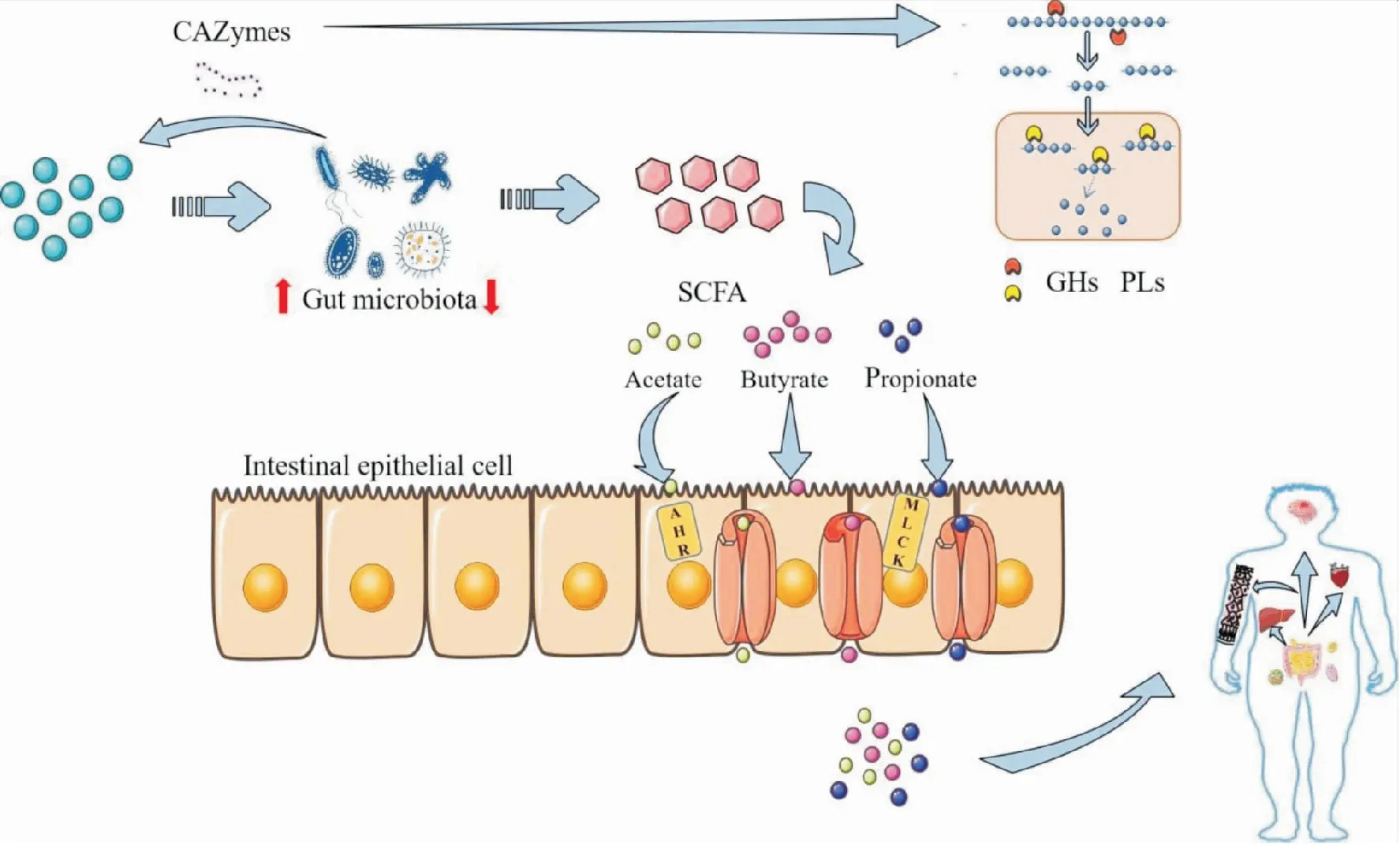
Fig 2 Schematic diagrm of CAZymes degrades polysaccharides
3 天然多糖調節腸道菌群作用
長久以來,腸道菌群調節人體代謝機制一直被人們忽視,但隨著宏基因組學和代謝組學在腸道菌群中研究的深入,腸道菌群所發揮的作用不僅影響機體生命活動,而且決定著眾多疾病的走向。天然多糖不能被人體直接消化吸收,需進入腸道內被腸道菌群分解后才能被機體利用,腸道菌群對多糖的降解是多糖生物活性產生的基礎。2016年國際益生菌與益生元科學協會(ISAPP)將其重新定義為能夠被宿主體內的菌群選擇性利用并轉化為有益于宿主健康的物質,提出了益生元的3個標準,一是不能在消化道被消化吸收;二是能促進有益菌的增殖;三是有利于促進機體健康。根據定義及標準,多糖可作為腸道菌群的碳源促進有益菌生長,起到益生元的作用。Tab 1中展示了活性多糖治療的相關疾病及腸道菌群的結構變化。
3.1 調節腸道菌群豐度和多樣性多糖在健康人的腸道中能發揮益生元作用保護腸黏膜,滋養益生菌生長。Chang等[13]研究發現,靈芝多糖即逆轉肥胖小鼠腸道微生態失衡,促進腸道屏障完整,降低代謝性內毒血癥和厚壁桿菌與擬桿菌間的比值,證明靈芝高分子量多糖具有更好的益生元活性。Cui等[14]探討了從黃芩中分離出的一種均質多糖SP2-1對潰瘍性結腸炎(UC)的影響。結果表明,SP2-1治療可減輕DSS誘導的UC小鼠的體質量減輕,減輕DAI,改善結腸病理損傷,降低MPO活性。SP2-1也能抑制了炎性細胞因子水平。此外,SP2-1可使ZO-1、Occludin和Claudin-5的表達上調,腸道屏障得到了修復,與模型組相比,SP2-1處理后厚壁菌門、雙歧桿菌、乳酸桿菌和羅斯伯氏菌的豐度明顯增加。SP2-1對擬桿菌、變形桿菌門和葡萄球菌的水平有顯著抑制作用。綜上,基于其天然的免疫活性和腸道菌群的調節功能,多糖在維持黏膜屏障功能方面作用顯著。
3.2 腸道菌群免疫調節腸道免疫系統在與炎癥的發生發展緊密相關,隨著自身免疫性疾病人數逐年增加,免疫調節劑的研究逐漸被科研工作者廣泛關注,菌群協助腸道恢復免疫功能,是抵御眾多疾病的重要手段,因此從天然產物中篩選免疫調節劑是安全可行的。早在1976年,香菇多糖的調節免疫作用就被證實,并用作臨床輔助治療。Liu Q等[15]建立小鼠骨髓抑制模型,發現香菇多糖具有調節絲裂原活化蛋白激酶(MAPK)和NF-κB的作用,減輕四氫吡喃阿霉素介導的骨髓抑制。Wang 等[16]研究證實香菇多糖(LNT)可以通過調節仔豬腸道菌群的組成和代謝產物來減輕大腸桿菌脂多糖(LPS)誘導的腸道損傷,口服給予LNT 治療能顯著抑制炎癥信號通路(TLR4、NLRs)和促炎因子(IL-1、IL-6)的釋放。由此提示香菇多糖的免疫調節作用需借助腸道菌群與多種途徑協同發揮功效。此外,經腸道菌群酵解的多糖產生短鏈脂肪酸,激活下游信號通路FFAR2,抑制單核細胞釋放白介素(IL-1β)等炎癥因子,促進免疫細胞分化(T→Th2),增加IL-10釋放,減緩炎癥發展進程。Zhang等[17]研究證實,牛蒡子水溶性多糖也可有效調節巨噬細胞和小鼠血清中炎癥細胞因子水平,提高乳桿菌、歐式桿菌和考拉桿菌等有益菌的豐度,增加SCFAs含量改善代謝紊亂。Bing等[18]評估了靈芝多糖(GLP)緩解DSS誘導的結腸炎的治療能力,經GLP治療后的結腸炎小鼠TNF-α、IL-1β和IL-6水平顯著下調,抑制MAPK和NF-κB通路緩解了小鼠結腸炎。近期,本課題組也進行了相關研究,結果發現虎掌菌多糖(SAP)能有效激活巨噬細胞的MAPKs 信號通路釋放免疫因子,降低腸道內厚壁菌門與擬桿菌門(F/B)比值,提高疣微菌門(Verrucomicroia)與變形菌門(Proteobacteria)的豐度[19]。
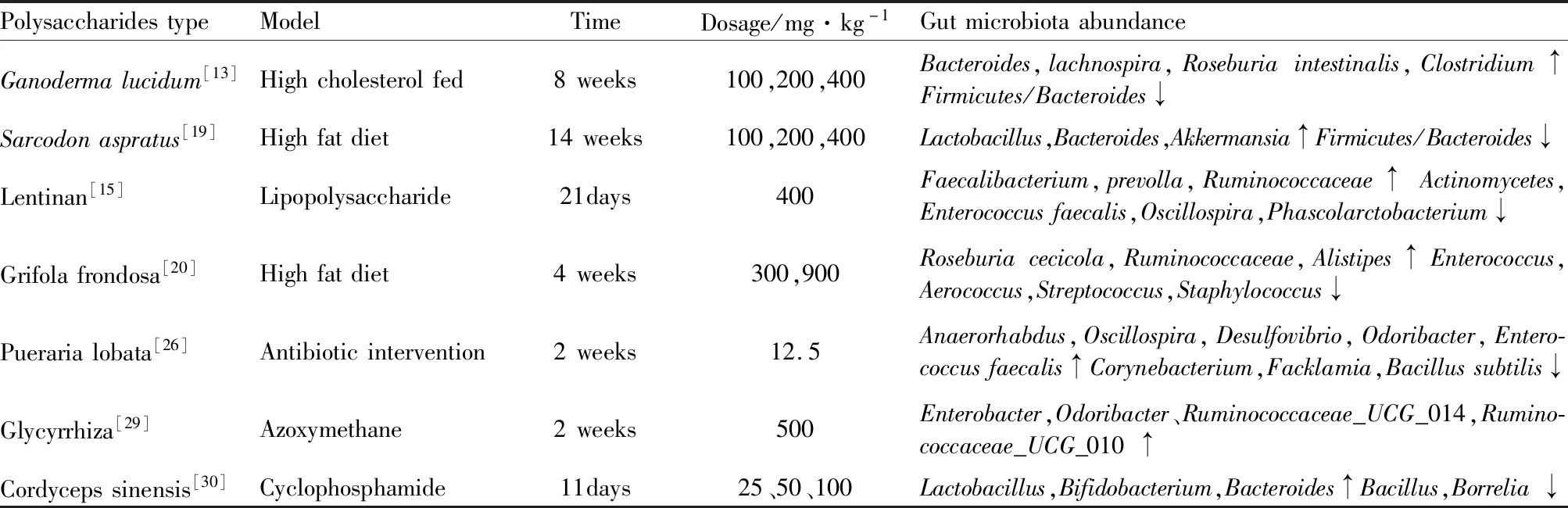
Tab 1 Influence of polysaccharides on gut microbiota
3.3 腸道菌群與炎性疾病的關系新技術的發明和應用促進了全面了解腸道微生態環境,如腸道菌群和疾病發病機制之間的關系,腸道菌群組成與膳食營養之間的關系,腸道菌群和免疫系統之間互作等。研究發現,長期高膽固醇攝入會影響腸道菌群組成,增加氧化三甲胺等有害物質的產生,從而導致肥胖、高血壓、糖尿病和心血管疾病等疾病的發生。不健康的生活方式和藥物的濫用同時破壞了健康腸道菌群的架構,使宿主更易感染或患病。因此,改善腸道菌群結構是建立機體健康的重要途徑。
3.3.1調節糖/脂紊亂作用 根據《柳葉刀》和中國疾病預防控制中心報道顯示,截止到2021年,我國成人肥胖率為16.4%,BMI指數高于25 kg·m-2的人數超過了9億,其中肥胖人群占6億(BMI>30 kg·m-2)。腸道菌群是參與機體能量轉換和新陳代謝重要途徑,菌群在結腸、盲腸內酵解復雜的碳水化合物,空腸和十二指腸內消化脂肪和單糖,并分泌出保護腸道黏膜的抗菌劑,抵御外界致病菌的入侵,腸道內細菌豐度改變,被認為是影響機體糖、脂代謝的關鍵因素。Guo等[20]發現,灰樹花多糖(GFP)能夠抑制高脂飲食(HFD)誘導的小鼠體質量增加和鏈脲佐菌素(STZ)誘導的糖尿病小鼠血糖值,顯著降低肝臟TC、TG 和游離脂肪酸(NEFA)水平,這些作用與其調控小鼠腸道菌群密切相關(降低與肥胖正相關的腸球菌屬、氣球菌屬、鏈球菌屬和葡萄球菌屬數量;增加與肥胖負相關的羅斯氏菌屬和另枝菌屬的數量),使高脂小鼠腸道菌群恢復到正常豐度水平。Chen等[21]采用16SrDNA測序和1HNMR譜分析方法,檢測了靈芝多糖(GLP)對高脂飲食和STZ誘導的T2DM大鼠腸道微生物群和糞便代謝物的影響,結果表明,給予GLP可導致大鼠空腹血糖和胰島素水平的顯著降低。此外,GLP處理降低了氣球菌、瘤胃球菌、棒狀桿菌和變形桿菌等有害細菌的豐度,并增加了布勞氏菌、脫鹵桿菌、副擬桿菌和擬桿菌的水平。PICRUSt分析表明,GLP可以恢復T2DM大鼠腸道細菌群落中氨基酸代謝、碳水化合物代謝、炎癥物質代謝和核酸代謝紊亂,非靶向代謝組學分析觀察到的大部分代謝變化與這些結果一致。Xu等[22]研究表明,龍須菜多糖能夠治療高脂飲食引起的代謝綜合征作用,減少小鼠組織中脂肪的積累和炎癥,其效應與腸道菌群改善緊密相關(上調擬桿菌門/厚壁菌門的比例,減小整體腸道菌群組成比例變化),純化的多糖D-GLPs 對部分擬桿菌成員的增殖促進更好,這些結果均表明腸道菌群對多糖結構(聚合物長度、分支度、糖苷鍵連接等)具有選擇性,從而為精確調控腸道菌群和制備低聚糖提供基礎理論依據。沙嵩多糖(ASPK)對高脂昆明小鼠給予小鼠200 mg·kg-1、400 mg·kg-1、800 mg·kg-1ASPK持續8周后,高劑量ASPK顯著增加Coprococcus,Anaerotruncus,Dorea和Bifidobacterium的豐度,降低Rikenella的相對豐度分別,同時下調ACC-1,FAS,SREBP-1c 和PPARc脂肪酸合成基因表達,減少肝臟脂質積累,發揮降血脂、降血糖和保肝等生物活性[23]。研究發現球藻多糖(Mw≈5.63×106u)能夠改善小鼠腸道菌群的豐度和多樣性,同時調節菌群組成,增加Coprococcus_1、Lactobacillus和Turicibacter的豐度,減少[Ruminococcus]_gauvreauii的豐度。此外,球藻多糖能改善血漿和肝臟脂質代謝,加速盲腸總膽汁酸和短鏈脂肪酸代謝[24]。Yao等[25]探討了青錢柳多糖(CCPP)對2型糖尿病大鼠腸道微生物群和腸道代謝物,特別是短鏈脂肪酸(SCFAs)的影響,結果得出,CCPP治療后大鼠血糖水平受到抑制,糖耐量和血脂參數得到改善。此外,CCPP增加了體內和體外SCFAs的產生,而腸道微生物群是這一過程的關鍵因素。在CCPP處理的大鼠中,GPR41、GPR43和GPR109a受到顯著刺激,并伴隨著GLP-1和PYY的表達上調。總結,CCPP可以通過增加可產生SCFA的菌群,促進SCFAs的產生,上調SCFA-GLP1/PYY相關的受體來緩解2型糖尿病癥狀。以上研究提示我們腸道菌群的改變與機體代謝之間存在密切的聯系,有益菌豐度的提升將在一定程度上協助宿主腸道內環境穩定,減少內毒素入血,防止如胰島素抵抗等在內宿主代謝紊亂的發生。
3.3.2炎癥調節作用 腸道內菌群的變化時刻影響著體內炎癥的發生發展,腸道黏膜表面寄居著種類繁多的微生物,是腸道內外環境穩定的生理屏障:構成的物理屏障、分泌抗菌肽和粘蛋白,能夠有效地保護宿主不被外源微生物入侵,防止腸黏膜受損。國內外大量研究證明,炎癥的發生和發展均會伴隨著腸道屏障功能的損傷以及ZO家族蛋白(zonula occludens,ZOs)、咬合蛋白(occludin)等細胞緊密連接表達水平的改變。千日菊中分離出的鼠李糖半乳糖醛酸(RGal)在小鼠腸道炎癥實驗模型中的保護和愈合作用。結果得出,與對照相比,RGal除了保護膠原穩態和增加細胞增殖外,還能保護結腸上皮,促進黏膜腸上皮細胞和黏液分泌杯狀細胞的維持。在體外屏障功能試驗中,RGal降低了IL-1β暴露后的細胞通透性,同時降低了IL-8的分泌和claudin-1的表達,并保留了咬合蛋白的分布。Chen等[26]通過葛根多糖(PPL)以12.5 mg·kg-1給予正常和抗生素相關腹瀉型小鼠2周后發現,PPL降低了異戊酸濃度,顯著增加顫螺菌和厭氧棍狀菌屬等有益菌豐度。此外,其還能緩解結腸炎性病變闡明PPL是一種優良的腸道菌群功能調節劑。Thomson等[27]研究發現,菊粉分別與乳桿菌、雙歧桿菌培養時可產生大量乳酸和乙酸,而木聚糖與共生梭菌、擬桿菌共培養能產生較多的丁酸,乙酸和丁酸都具有抑制炎癥因子TNF-α、IL-8 和NF-κβ表達的作用,進而緩解炎癥反應。Yan等[28]揭示了黃秋葵多糖(OP)激活了炎癥通路TLR4/ NF-κB 和MAPKs信號對CUMS誘導的抑郁癥小鼠產生炎性細胞因子的抗炎作用,同時OP改善菌群定植小鼠的焦慮和抑郁行為,揭示OP抗抑郁作用的潛在機制與“腸腦軸”雙向調節相關。上述研究提示,多糖與腸道菌群之間的相互作用對宿主內慢性炎癥的產生至關重要,保持菌群內結構合理將對炎癥因子的改善產生積極的作用。
3.3.3腫瘤作用 多糖具備優秀的抗腫瘤活性,近年來研究發現,其發揮作用的機制與腸道菌群功能的調節密不可分。以往的研究大多局限于多糖天然活性對腫瘤的抑制作用,然而,目前越來越多的研究結果指向腫瘤發生過程伴隨著腸道菌群失調。Zhang等[29]研究同樣證實,甘草多糖(GCP)發揮抗腫瘤作用主要與其調控腸道菌群有關,研究通過糞便移植實驗對比治療組與模型組之間的腸道菌群組成存在差異,其中Enterorhabdus、Odoribacter、Ruminococcaceae_UCG_014、Ruminococcaceae_UCG_010、Enterococcus和Ruminiclostridium_5豐度恢復正常,而經抗生素處理后的GCP治療組也失去了抗腫瘤活性,表明GCP發揮腫瘤抑制作用依賴專屬菌群調控。研究同樣認為多糖發揮抗腫瘤活性主要與改善機體免疫功能作用有關,如冬蟲夏草多糖(CSP)通過調節腸道黏膜免疫,發揮保護微生物的作用,提高了益生菌乳酸菌、雙歧桿菌、擬桿菌的豐度,降低了致病菌(梭狀芽孢桿菌、柔螺旋體)的豐度,從而降低抗腫瘤藥物環磷酰胺導致的腸道紊亂問題,組織切片結果表明其具有減毒增效的作用[30]。雖然對于多糖調節腸道菌群的抗腫瘤作用已有相關報道證明,但其優秀的活性也僅體現在部分天然活性多糖成分中,現在絕大部分多糖的抗腫瘤作用依然基于其免疫調節作用,研究者可以充分挖掘天然產物中的功能活性產物,為多糖活性的機制研究提供更多的理論依據。
3.3.4其他疾病 隨著天然多糖研究不斷深入,其通過調節腸道菌群發揮治療疾病的作用被廣泛關注。例如有效改善阿爾茨海默病患者的神經功能退化、減少病毒引起的腸黏膜損傷、緩解細菌引發的肝腎功能衰竭和身體乏力、腹瀉等病癥。研究具有益生元作用的活性多糖及腸道菌群關系,探討多糖-腸道菌群-疾病相互作用規律,揭示活性多糖在腸道中降解利用的機制,為多糖功能因子改善人體腸道健康研究提供重要科學依據。
4 結論和展望
腸道菌群在宿主健康中發揮著至關重要的作用,人們逐漸認識到腸道菌群在調節宿主代謝中重要性。相較于機理、遺傳和環境等難控因素,通過天然產物活性成分調節腸道菌群促進機體健康已成為研究的趨勢和熱點。因此,探究不同類型多糖對腸道菌群的影響,能夠為今后通過合理膳食調節腸道菌群結構促進宿主健康提供相應理論依據。
在總結多糖與腸道菌群關系的過程中,我們逐漸意識到,多糖作為一種“大分子物質”具有調節多種生物活性的能力,因此類似的“橋”概念也可以應用于人類健康。其中最主要的是宿主腸道內穩態的自我調節。許多研究表明,多糖可以通過調節腸道微生態來預防和緩解疾病的發生,但對于人體器官間復雜的調節機制仍有進一步研究的空間。目前的主流觀點是相對分子質量和聚合物長度影響多糖在微生物間的識別和糖酵解過程中的參與。因此,有必要加強對天然多糖結構與腸道微生態調節關系的研究。為了確保多糖的安全有效劑量,還需要進行更多的臨床試驗。研究學者通過研究腸道菌群構建起天然多糖與人體健康的“橋梁”是具有深遠意義的,而解析多糖的結構與腸道微生物的作用關系也同等重要,且具有更加重要的價值。越來越多的研究工作表明,天然多糖對腸道內的真菌和病毒等低水平微生物有顯著的作用。在一定的適宜條件下,需要利用多糖資源豐富、療效穩定、副作用小的優點。可以認為是未來腸道微生態調節的疾病預防、治療選擇的發展方向。

