脊髓背角星形膠質細胞Cx43組成的半通道在大鼠急性切口痛中的作用
顏茹芳,李佳璟,查 進,黃煥森,汪靈芝
(廣州醫科大學附屬第二醫院麻醉科,廣東 廣州 510260)
研究表明,大約有86%的患者在接受手術治療后會明顯感受到疼痛。盡管多模式鎮痛在臨床廣泛應用,但患者對手術后急性疼痛的一般治療手段滿意度仍舊低于47%~75%[1]。另有研究顯示,約10%~50%的術后急性疼痛在不經恰當的臨床治療后可發展為慢性疼痛[2]。而應用藥物或者康復治療有效地控制術后急性疼痛,可以極大地加快患者的康復并提高患者滿意度,已然成為加速康復外科在圍術期應用的重要組成部分。因此,探討術后急性疼痛的發生機制將具有重要的意義。
細胞縫隙連接通道(gap junction,GJ)在20世紀60年代首次發現,其由連接蛋白(connexin,Cx)組成。目前已知Cx有21個亞型,所有已知的Cx亞型在結構上相似,均有4個跨膜域(TM),2個細胞外環(EL),1個細胞內環(CL),1個氨基端(NT)和1個C末端(CT)。6個環繞在一起的Cx蛋白在細胞膜上形成單一膜通道稱為半通道(hemichannel)。兩個相鄰細胞膜上的半通道對接形成GJ。細胞胞漿中分子量<1 ku的小分子物質或者信號分子通過GJ擴散,是細胞之間信號傳遞的一種重要方式[3]。除此之外,Cx 組成的半通道(hemichannel)本身也具有極其重要的功能,可通過旁分泌或者自分泌方式釋放活性物質,如釋放ATP、ADP等作用于周圍細胞產生作用[4]。
既往研究顯示,脊髓星形膠質細胞通過其表達的Cx43及其組成的半通道在慢性神經病理性疼痛的發生和后續維持階段發揮極其重要的作用[5]。我們通過前期研究發現,Cx43在急性切口痛大鼠脊髓背角中的表達在術后24 h內增加[6]。另有研究表明,通過使用非特異性縫隙連接通道抑制劑CBX可以緩解大鼠急性痛[7],但Cx43半通道在急性痛中是否發揮作用仍未知。因此,本研究擬在急性切口痛大鼠通過鞘內給予特異性Cx43半通道抑制劑Gap19觀察Cx43半通道對大鼠急性切口痛的影響及可能的機制。
1 材料與方法
1.1 材料
1.1.1實驗動物 SPF級雄性SD大鼠60只,體質量(120~140)g,由廣東省醫學實驗動物中心,生產許可證號:SCXK(粵)2018-0002提供。所有實驗操作均遵循美國國立衛生研究院(NIH)的動物實驗指南,且通過廣州醫科大學附屬第二醫院動物倫理委員會批準。
1.1.2 實驗藥物與試劑Gap19購于美國TopScience公司;GFAP鼠單克隆抗體(MAB360)購于美國Millipore 公司;Cx43兔多克隆抗體 (ab11370),熒光二抗(ab150113,ab150080)購于美國Abcam公司;TNF-α兔多克隆抗體(17590-1-AP),山羊抗兔二抗(SA00001-2),山羊抗鼠二抗(SA00001-15)購于武漢三鷹;大鼠TNF-α ELISA試劑盒(RTA00)購于美國R&D公司;大鼠IL-1β ELISA試劑盒(1310122),大鼠IL-6 ELISA試劑盒(1310602)購于達科為公司。
1.1.3主要儀器 電泳儀(BIO-RAD,美國),倒置熒光共聚焦顯微鏡(Leica DM4100,德國),冰凍切片機(Leica DM1600,德國),臺式低溫離心機(Eppendorf,德國)等。
1.2 實驗方法
1.2.1實驗分組及干預 取雄性SD大鼠60只,根據隨機數字表法分為3組,每組20只,C組:對照-生理鹽水組;I組:切口痛-生理鹽水組;Gap19組:切口痛+Gap19組。I組和Gap19組均制備趾部急性切口痛模型;C組、I組均于造模手術前30 min鞘內注射生理鹽水10 μL,Gap19組則于術前30 min鞘內注射Gap19 10 μL(10 g·L-1)。
1.2.2大鼠趾部切口模型 急性切口痛大鼠模型參考Brennan等[8]的方法制備。采用5%異氟烷誘導大鼠,待大鼠進入麻醉狀態后,2%~3%異氟烷維持麻醉,將大鼠固定于恒溫動物手術臺,固定左后肢,消毒。自大鼠左后跟約0.5 cm處,向遠端做一縱行切口,長約1 cm;眼科鑷鈍性分離肌肉筋膜組織并挑起足底肌肉,再行一次縱向切割(注意不損傷附近血管神經),紗球輕壓止血后用5-0尼龍線縫合肌肉皮膚并消毒。術后大鼠干凈單籠飼養,保暖,待大鼠蘇醒后行后續實驗。模型的制備由熟悉模型操作的同一人完成。
1.2.3行為學測定 在造模前1 d、造模后2 h、6 h、24 h、48 h、3 d、7 d隨機抽取6只大鼠進行機械縮足反應閾值(mechanical paw withdrawal threshold,MPWT)測定。測定開始前30 min,將大鼠置于金屬網上的有機透明玻璃盒內適應實驗環境,隨后使用一系列標準化的纖維絲(Von Frey纖維絲),采用“up and down”法,用8根不同力度的纖維絲(1.4、2、4、6、8、10、15、26 g)刺激大鼠腓側即外側皮膚直至纖維絲彎成S形,保持5~8 s并觀察是否出現縮足、舔足等陽性反應。每次刺激間隔30 s。給予大鼠的疼痛刺激從中等力度6 g開始,當該力度無法引起上述陽性反應時,30 s后采用大一級力度的纖維絲繼續予以疼痛刺激;如出現陽性反應,則間隔30 s后采用小一級力度的纖維絲,如此反復直到出現第一次騎跨,即陽性和陰性(或陰性和陽性)反應交替時,再連續測量4次。根據Dixon[9]的方法將數據轉換為50%PWT[50%PWT(g)=10Xf+κδ,其中Xf=log(f),δ為各纖維絲力度取log后的均差]。
1.2.4Western blot蛋白印跡分析 各組隨機抽取4只大鼠,稱體質量,腹腔注射1%戊巴比妥鈉麻醉,劑量為50 mg·kg-1,頸椎脫臼處理后快速剝離出L4~6節段脊髓組織,在立體顯微鏡下分離出脊髓背角,稱質量裂解后冰上靜置20 min,隨后離心10 min(4 ℃ 12 000 r·min-1),收集上清液,應用BCA法測定各蛋白樣品濃度,隨后加入緩沖液配置成同一濃度,99 ℃金屬浴10 min后得到蛋白樣品。上樣電泳,濕轉法轉膜;5%脫脂牛奶(2.5 g/50 mL)室溫封閉1 h,分別加入兔來源Cx43(1 ∶8 000,abcam ab11370)、鼠來源 GFAP(1 ∶2 000,18 Millipore MAB360)、兔來源TNF-α(1 ∶1 000,proteintech 17590-1-AP)和鼠來源β-actin (1 ∶20 000,proteintech 66009-1-Ig),4 ℃過夜;洗去多余一抗,加入HRP標記的山羊抗兔(1 ∶1 0000,proteintech SA00001-2)和山羊抗鼠(1 ∶2 000,CST 7076)于室溫孵育1 h。暗室內用ECL全自動凝膠成像儀(勤翔)顯像,采用ImageJ軟件計算灰度值。
1.2.5免疫熒光染色 各組于術后6 h和7 d隨機選取3只大鼠,麻醉后暴露心臟,從心尖穿刺將20ml注射針頭插管到達升主動脈,依次灌注預冷后的PBS溶液和4%多聚甲醛,切開背部皮膚,暴露脊柱,并切取脊髓L4~6節段,小心剝除硬脊膜等膜樣組織,獲得脊髓組織,浸入4%多聚甲醛進行后固定,然后依次浸入10%、20%、30%蔗糖溶液于4 ℃進行濃度梯度脫水。冰凍切片,每片厚30 μm。熒光染色(漂片法):PBST 洗片3次,每次5 min。加入10%山羊血清/0.3%TritonX-100室溫輕搖2 h,進行封閉及破膜。棄去封閉液,加入一抗GFAP(1 ∶800,Millipore MAB360)、Cx43(1 ∶500,abcam ab11370)4 ℃孵育過夜。PBST 洗片 3次,每次5 min,加入Alexa Fluor 488標記山羊抗鼠IgG (1 ∶800,abcam ab150113),Alexa Fluor 594 標記山羊抗兔IgG (1 ∶800,abcam ab150080),室溫輕搖2h,進行熒光雙標染色,注意避光;PBST洗片3次,每次5min,滴加 DAPI及防猝滅劑(abcam,ab104139),室溫靜置 5min,蓋上蓋玻片。置于倒置熒光顯微鏡觀察并拍攝圖像。使用Image J軟件分析測量各組大鼠脊髓背角組織切片在相同倍數視野下紅色熒光(代表Cx43)陽性信號及綠色熒光(代表GFAP)陽性信號平均熒光強度Mean gray value。
1.2.6ELISA檢測炎癥因子含量 隨機選取各組術后6 h的3只大鼠,麻醉后暴露脊柱,于立體顯微鏡下快速剝離脊髓L4~6節段背角組織,稱質量后按1 ∶9加入預冷PBS,冰上研磨勻漿,4 ℃ 12 000 r·min-1,離心10 min,吸取上清,使用大鼠TNF-α ELISA Kit(RD,RTA00)、大鼠IL-1β ELISA Kit(達科為,1310122)及大鼠IL-6 ELISA kit(達科為,1310602),試劑恢復至室溫,按照各試劑盒說明書,96孔板內每孔加入50 μL稀釋液,隨后分別加入50 μL標準品、樣品,混勻,貼封口膜,室溫孵育2 h。棄去孔中液體,洗板5次,隨后每孔加入100 μL耦聯物,室溫孵育2 h。再次棄去孔中液體,洗板5次,每孔加入100 μL顯色劑,室溫避光孵育30 min。隨后每孔加入100 μL終止液,在30 min內盡快讀數,設置波長為450 nm,矯正波長為540 nm或570 nm。根據標準品的濃度及OD值做出標準曲線,將樣品OD值讀數代入曲線,分別得到L4-6脊髓背角組織中TNF-α、IL-1β及IL-6的濃度。
2 結果
2.1 Cx43在急性切口痛大鼠脊髓背角的表達Western blot觀察急性切口痛大鼠6 h、3 d和7 d的脊髓背角Cx43蛋白及星形膠質細胞GFAP蛋白的表達情況。Fig 1結果顯示,與C組相比,I組大鼠脊髓背角Cx43和GFAP的表達在術后6 h明顯增加,其差異有統計學意義;而術后3 d和7 d脊髓背角Cx43和GFAP的表達逐漸減少,其變化與對照組相比無統計學意義。
2.2 Cx43特異性半通道抑制劑對急性切口痛大鼠急性疼痛的影響通過鞘內應用Cx43半通道特異性抑制劑Gap19,觀察脊髓背角Cx43半通道在大鼠趾部切口痛中的作用。各組大鼠的術前基礎MPWT
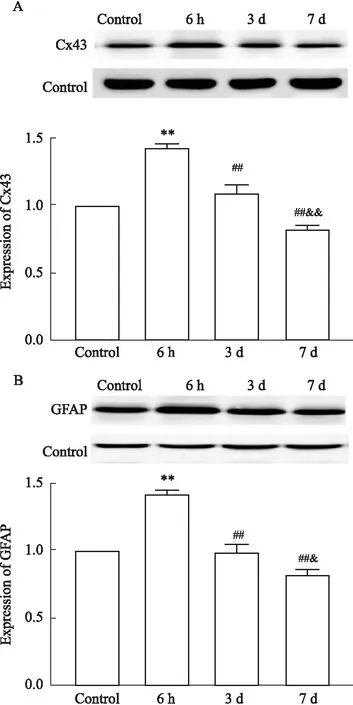
Fig 1 Expression of connexin43 and GFAP in astrocytes of rat spinal cord dorsal horn after incision
間的差值無統計學意義。與術前相比,模型組和鞘內應用Cx43特異性抑制劑Gap19組大鼠在切口建立后2 h、6 h、24 h、3 d的MPWT明顯降低(P<0.01),術后7d的MPWT與術前相比無改變。與模型組相比,應用特異性抑制劑Gap19后大鼠的MPWT在術后2、6、24 h明顯增加,但術后3 d和7 d,鞘內應用Gap19并未改變大鼠的縮足反應閾值(P<0.01),見Tab 1。
2.3 術后不同時間點Cx43特異性半通道抑制劑對大鼠脊髓背角Cx43表達的影響急性切口痛術后6 h,Fig 2免疫熒光結果顯示,相較于C組GFAP平均熒光強度為49.196±2.347,I組大鼠脊髓背角GFAP表達明顯增加,平均熒光強度上升至66.893±4.256,兩組相比有統計學意義(P<0.01)。C組Cx43為39.831±8.093,I組上升至70.134±2.764%,兩組相比差異有統計學意義(P<0.01)。

Tab 1 Change of MPWT at different time points in each
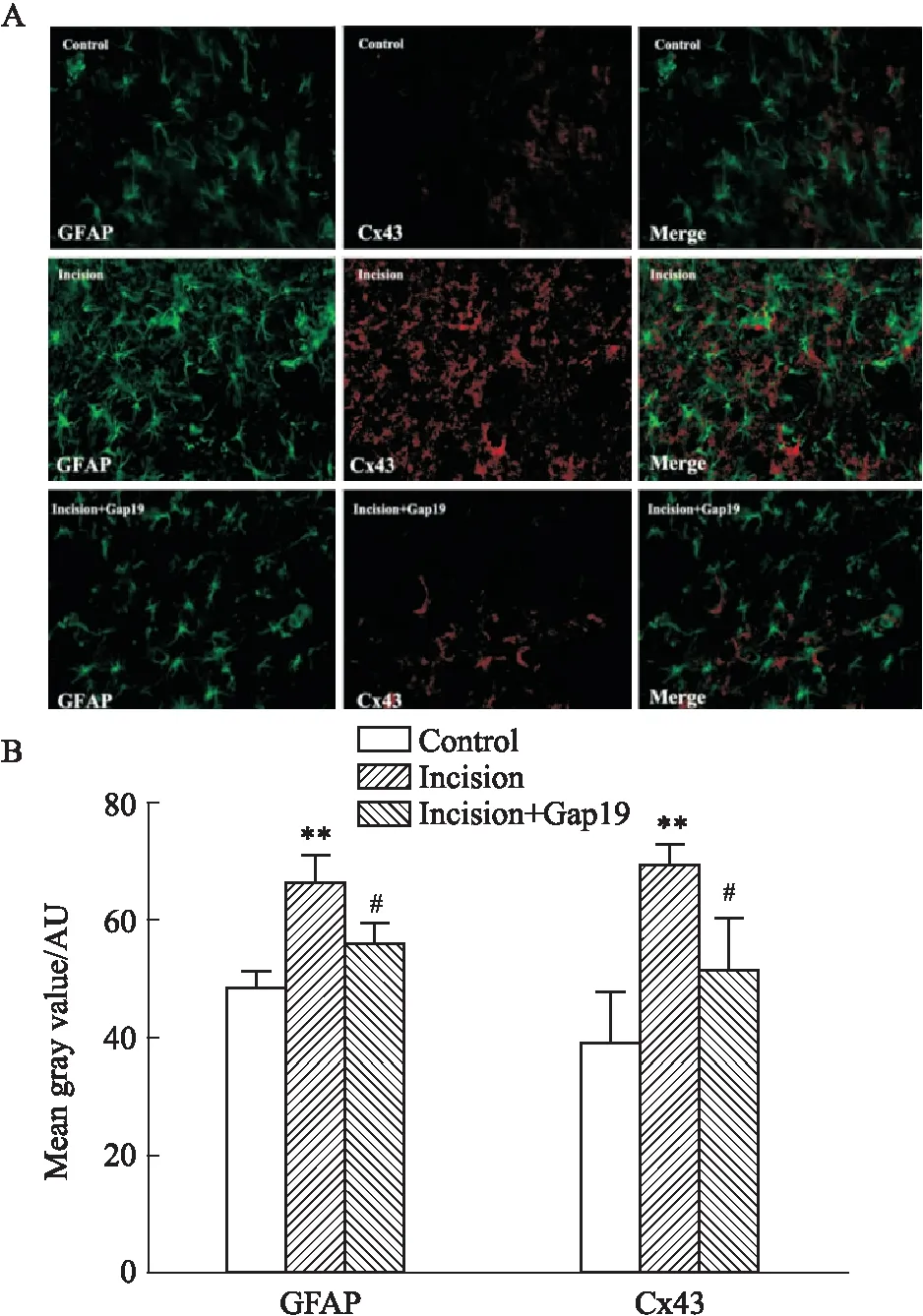
Fig 2 Effect of Gap19 on expression of Cx43 and GFAP in astrocytes of rat spinal cord dorsal horn 6 h
與I組相比,鞘內應用Cx43半通道抑制劑Gap19能夠明顯抑制星形膠質細胞標志性蛋白GFAP的表達,減少至56.412 ± 3.123,同時膠質細胞上Cx43的表達也明顯下降至51.816±8.809,差異具有統計學意義(P<0.05)。
在術后7 d的免疫熒光結果中,C組GFAP和Cx43的平均熒光強度分別為126.477 ± 6.120和104.563 ± 3.883。I組熒光GFAP和Cx43分別為147.764±11.396和97.059±4.003,兩組相比均無統計學意義。鞘內應用Cx43半通道抑制劑Gap19熒光后GFAP和Cx43分別為140.737±7.242和107.550±4.655,與I組相比,鞘內應用Cx43半通道抑制劑Gap19對GFAP和Cx43的熒光表達變化無統計學意義。
2.4 Cx43半通道特異性抑制劑抑制脊髓炎癥因子的表達切口痛大鼠于術后6 h取脊髓背角組織進行ELISA檢測炎癥因子表達。Fig 3結果表明,與C組相比,I組大鼠脊髓背角炎癥因子IL-1β,IL-6以及TNF-α的表達明顯增多(P<0.05);與I組相比,鞘內應用Cx43半通道特異性抑制劑能明顯抑制3種炎癥因子的表達(P<0.05)。

Fig 3 Effect of Gap19 on expression of Cx43 and GFAP in astrocytes of rat spinal cord dorsal horn on 7 d after incision
3 討論
術后疼痛是指在承受手術應激后外科患者表現的一種生理、心理及行為改變等綜合反應。術后急性疼痛控制不佳將使患者承受巨大的痛苦,嚴重時將引起一系列器官功能受損,同時也將延長住院時間,增加社會負擔[10]。本研究采用經典的Brennan建立的大鼠趾部切口急性痛模型,術后大鼠表現為自發痛和痛覺過敏,不同程度的舔足或抬足行為,其與臨床上的術后疼痛相似。本研究表明,大鼠切口建立后的2 h、6 h、24 h、3 d的機械縮足反應閾值明顯降低,以2 h和6 h表現最為顯著,而術后7 d的機械縮足閾值回復到正常水平。這與他人以及我們之前的研究結果相吻合[6]。
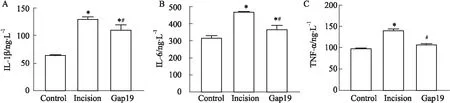
Fig 4 Effect of Gap19 on expression of inflammation factors in rat spinal cord dorsal horn 6 h after incision
星形膠質細胞是中樞神經系統內數量最多的膠質細胞,主要表達的細胞縫隙連接蛋白是Cx43[11]。近來越來越多的研究發現,星形膠質細胞不僅對神經元起著支持及營養作用,同時還參與細胞間生物信號傳遞功能。大量研究表明,脊髓背角的星形膠質細胞與中樞痛覺過敏的產生和維持密切相關[12]。通過脊髓損傷模型發現 Cx43/Cx30 雙基因敲除后大鼠的機械性痛閾和溫度敏感閾值明顯提高,而Cx30單基因敲除的大鼠痛閾未見明顯變化,因此認為Cx43而非 Cx30參與了中樞神經損傷導致的慢性神經病理性疼痛[13]。另有研究發現,在神經損傷性病理性疼痛、炎性痛和癌痛等慢性疼痛中都伴隨有脊髓星形膠質細胞Cx43表達的改變,而抑制星形膠質細胞Cx43組成的通道功能能明顯抑制痛覺過敏的發生[14]。在急性切口痛中,我們之前的研究曾首次報道Cx43的表達在24 h內增加明顯[6],本研究在此基礎上進一步明確在術后3d和7 d脊髓星形膠質細胞GFAP和Cx43的表達無變化。另有研究也發現,切口痛大鼠脊髓星形膠質細胞在24 h內激活,GFAP表達量增多,而小膠質細胞活化在術后3 d才明顯增加[15]。結合前人研究,我們推測急性疼痛中外周傷害信號導致脊髓神經元敏化,繼而星形膠質細胞Cx增多并活化,進一步促進脊髓神經元興奮性發生改變。
Gap19是來源于Cx43胞漿端的模擬九肽,能夠通過與Cx43蛋白C末端結合,從而阻止Cx43蛋白分子內胞漿端與C末端的交互作用。Gap26和Gap29等Cx43半通道抑制劑,在抑制半通道的同時會抑制GJ,而Gap19在抑制Cx43半通道功能時并不影響GJ功能,是一種公認的針對Cx43半通道的特異性抑制劑,廣泛應用于多種疾病發生的病理生理機制研究[16]。本研究采用鞘內給藥法,Gap19的給藥劑量參考他人的研究中的常用劑量[16]。我們的結果顯示,在大鼠急性切口痛模型中特異性抑制Cx43組成的半通道能明顯減輕大鼠術后24 h內的大鼠痛覺過敏,而對術后3 d和7 d大鼠痛覺無影響。我們還發現,Gap19能明顯抑制星形膠質細胞標志性蛋白GFAP和Cx43的表達。因此,這提示我們脊髓星形膠質細胞Cx43在大鼠趾部切口急性痛中的作用與其半通道功能有關。研究表明,Cx43組成的半通道可直接釋放ATP、谷氨酸、前列腺素等信號分子從而產生作用[11]。在慢性疼痛中,Chen等[5]還發現脊髓星形膠質細胞Cx43組成的半通道可通過釋放細胞因子,參與炎癥因子介導的神經元敏化。研究表明在包括慢性疼痛在內的神經系統疾病發生機制中發現炎癥因子在介導膠質細胞-神經元相互作用中具有至關重要的作用[10]。最近研究者發現,化療藥物紫杉醇引起膠質細胞釋放炎癥因子TNF-α是其導致急性痛的可能機制[17],而且IL-1β在其發生機制中也扮演重要的角色[18]。本研究在急性切口痛大鼠脊髓中發現IL-1β、IL-6以及TNF-α促炎因子的表達明顯增多,而應用Gap19能明顯減少3種炎癥因子的表達。盡管炎癥因子在急性切口痛中發揮作用的機體機制尚待進一步明確,但我們的研究結果說明星形膠質細胞Cx43半通道可能通過調控炎癥介質參與大鼠急性切口痛的發生。
綜上所述,鞘內半通道抑制劑可明顯抑制脊髓背角Cx43表達和星形膠質細胞活化和炎癥因子釋放,同時顯著提高切口痛大鼠的痛閾。這些研究結果表明,星形膠質細胞縫隙連接蛋白Cx43可能通過調控膠質細胞的激活和炎癥微環境參與術后早期急性疼痛的發生。盡管Cx43半通道參與急性切口痛大鼠痛覺過敏的深入機制還有待進一步研究,但這些研究結果將為探尋術后急性痛新的治療靶點提供新的線索。

