水中菌落總數3種檢測方法的比較
曹新塏,張 琦,尹寶國,張寶華,張雨晨
(北京市自來水集團有限責任公司水質監測中心,北京 100012)
菌落總數作為評價水質優劣的衛生指示標準指標,是微生物檢測的重要參數之一。現階段國內常用的水中菌落總數檢測方法為傳統平皿計數法,該方法所使用的營養瓊脂平板不能滿足厭氧菌等特殊細菌的生理需求,導致部分細菌難以繁殖生長[1]。且在整體試驗過程中不僅前處理操作繁瑣,易引入外來污染與人為誤差,同時對實驗室無菌環境及試驗人員技術能力要求較高,部分實驗室檢測能力難以達到要求,不適用于實驗室的日常檢測。
酶底物法(SimPlate法)培養基底物可與微生物特異性酶反應生成藍色熒光的物質,培養后統計分析得到最終菌落總數[2-3]。美國環保署(EPA)于2002年將SimPlate法納入EPA 9215E中,表明飲用水及地表水可以使用其檢測菌落總數[4];廣東省地方標準《水中菌落總數復合酶底物檢測方法》(DB 44/T 1163—2013)[5]于2013年將SimPlate法引入國內;國家城市供水水質監測網武漢監測站于2019年采用定量盤法檢測水中菌落總數,該方法的試驗原理與SimPlate法基本一致,其檢測結果與平皿計數法相比也沒有顯著的統計學差異[6];《生活飲用水標準檢驗方法 微生物指標》(GB/T 5750.12—XXXX)(2022年征求意見稿)[7]中也表明,可以使用SimPlate法檢測生活飲用水及水源水的菌落總數。與平皿計數法相比,SimPlate法無需配制培養基,采用SimPlate法,不稀釋的情況下1 mL水樣可以檢測738 MPN/mL的菌落總數,減少了培養基配制及樣品稀釋的誤差,且不需要嚴格的無菌環境,更適用于檢測水中菌落總數較高的樣品。
EasyDisc法是對平皿計數法的革新,于2021年研發成功,目前還處于試用階段。2022年,孫杰[8]采用EasyDisc法檢測水中菌落總數,其檢測結果與平皿計數法相比沒有顯著的統計學差異。EasyDisc法的PCA培養基脫水固定于47 mm的平皿底部,無需配制,微生物生長的代謝產物與PCA培養基中的顯色物質反應生成藍色菌落,便于人工計數。與平皿計數法相比,EasyDisc法減少了配制培養基等試驗步驟,試驗操作簡便,生成的藍色菌落便于計數,顯著降低了外來污染和人為誤差。
本文采用酶底物法、EasyDisc法和平皿計數法3種方法檢測NSI菌落總數定量質控樣品和實際樣品,并將檢測結果進行統計學分析[9-10]。
1 試驗部分
1.1 試驗設備
SimPlate法培養基、84孔分配盤、EasyDisc法培養基、NSI菌落總數定量質控樣品、無菌緩沖液、無菌取樣瓶等耗材購自愛德士公司;平皿計數法使用的營養瓊脂購自青島海博生物技術有限公司;試驗使用經計量部門校準合格的國產隔水式恒溫生物培養箱,溫控精度為±0.5 ℃。
1.2 試驗步驟
1.2.1 高濃度NSI菌落總數定量質控樣品制備
從-10 ℃ 以下的冰柜中取出NSI菌落總數定量質控樣品,常溫狀態下平衡15 min后,轉移至100 mL無菌緩沖液中,水平搖勻,制備成高濃度NSI菌落總數定量質控樣品。待樣品完全溶解后,需在30 min內完成檢測。
1.2.2 低濃度NSI菌落總數定量質控樣品制備
將1.2.1小節的高濃度NSI菌落總數定量質控樣品充分混勻后,吸取10 mL轉移至100 mL無菌取樣瓶中,用無菌水稀釋至刻度線,制備成低濃度NSI菌落總數定量質控樣品。
1.2.3 實際樣品采集
采集北京地區出廠水、濾池出水及水源水各10組實際水樣,采集過程參照《生活飲用水標準檢驗方法 水樣的采集與保存》(GB/T 5750.2—2006)[11]中樣品采集及保存要求,并在4 h內完成檢測。
1.2.4 SimPlate法測定水中菌落總數
量取1 mL待測樣品及9 mL無菌水加入SimPlate法培養基中,充分混勻,轉移至84孔分配盤中,水平旋轉分配盤使待測樣品均勻分配于每個樣品孔中,多余液體由盤內海綿吸收,倒置放入36 ℃ 培養箱中培養48 h后,在366 nm紫外燈下統計藍色熒光孔數,對照MPN表查詢菌落總數檢測結果。
1.2.5 EasyDisc法測定水中菌落總數
量取1 mL待測樣品加入EasyDisc法平皿中,水平混勻,使樣品均勻分布于EasyDisc法平皿中,常溫下靜置20 min,使樣品與培養基充分接觸,正置放入36 ℃ 培養箱中培養48 h后,統計菌落總數檢測結果。
1.2.6 平皿計數法測定水中菌落總數
平皿計數法試驗過程參照《生活飲用水標準檢驗方法 微生物指標》(GB/T 5750.12—2006)[12]中1.1小節平皿計數法進行檢測。
2 試驗結果分析
2.1 高濃度NSI菌落總數定量質控樣品檢測結果分析
將同一高濃度NSI菌落總數定量質控樣品以3種方法平行檢測10次。其檢測結果表明,3種方法檢測結果的合格率均為100%。為進一步評價3種方法的準確性和穩定性,計算10組檢測結果與真值的相對誤差及檢測結果的相對標準偏差,可得RSD(平皿計數法)=9.63%,RSD(SimPlate法)=5.69%,RSD(EasyDisc法)=6.07%,如表1、圖1所示。結果表明,SimPlate法與EasyDisc法檢測結果與真值的相對誤差及相對標準偏差均小于平皿計數法。由此可知,SimPlate法與EasyDisc法檢測高濃度NSI菌落總數定量質控樣品時的準確性及穩定性優于平皿計數法。
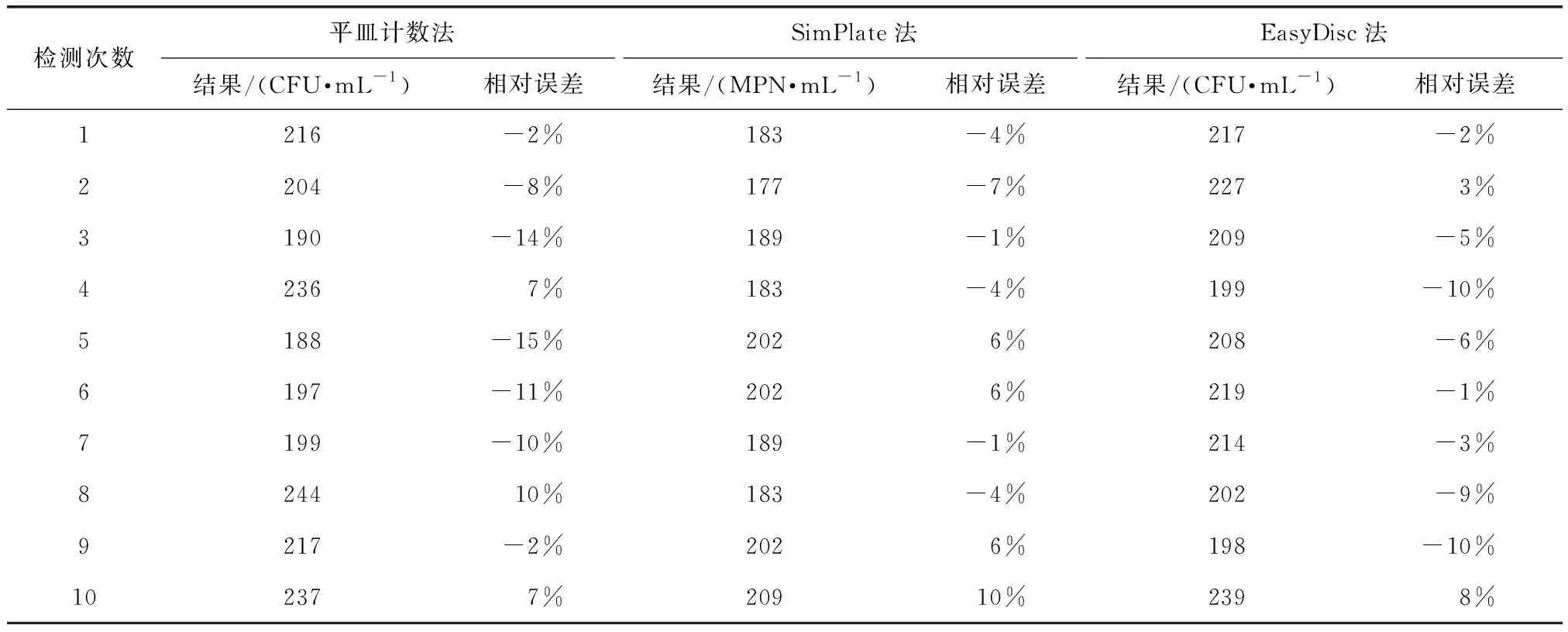
表1 3種方法檢測高濃度NSI菌落總數定量質控樣品的檢測結果Tab.1 Detection Results of High Concentration NSI Total Number of Colonies QC Samples by Three Methods
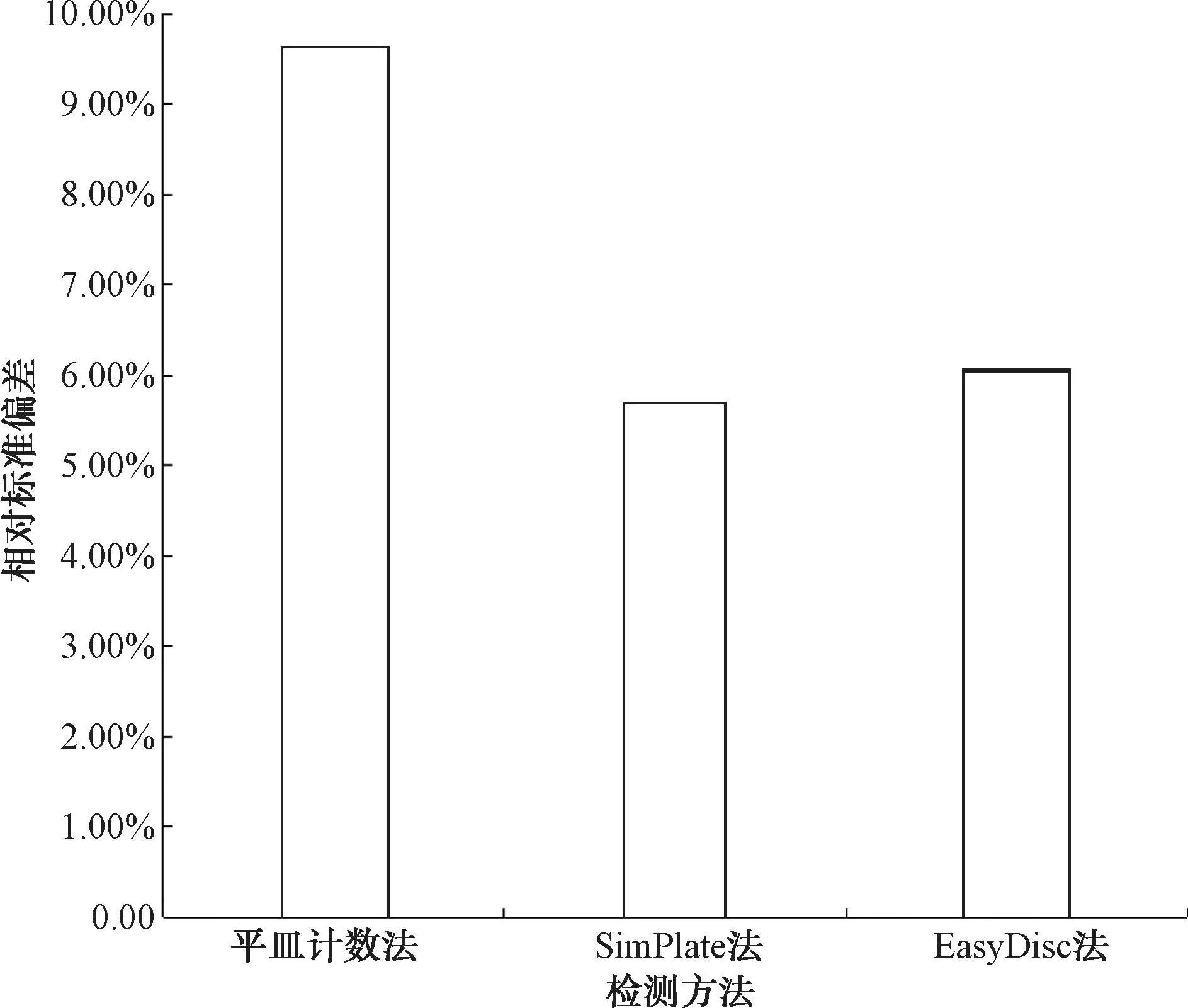
圖1 3種方法檢測高濃度NSI菌落總數定量質控樣品檢測結果的相對標準偏差Fig.1 Relative Standard Deviation of High Concentration NSI Total Number of Colonies QC Samples by Three Methods
2.2 低濃度NSI菌落總數定量質控樣品檢測結果分析
為驗證3種方法檢測低濃度樣品的準確性及穩定性,分別以3種方法平行檢測同一低濃度NSI菌落總數定量質控樣品10次,最終檢測結果為檢測結果×稀釋倍數。其最終檢測結果表明,3種方法檢測結果的合格率均為100%。為進一步評價3種方法檢測低濃度樣品的準確性及穩定性,計算10組檢測結果與真值的相對誤差及檢測結果的相對標準偏差,可得RSD(平皿計數法)=12.37%,RSD(SimPlate法)=8.13%,RSD(EasyDisc法)=8.72%,如表2、圖2所示。結果表明,檢測低濃度NSI菌落總數定量質控樣品時,SimPlate法與EasyDisc法檢測結果與真值的相對誤差及相對標準偏差均小于平皿計數法,其準確性及穩定性仍優于平皿計數法。
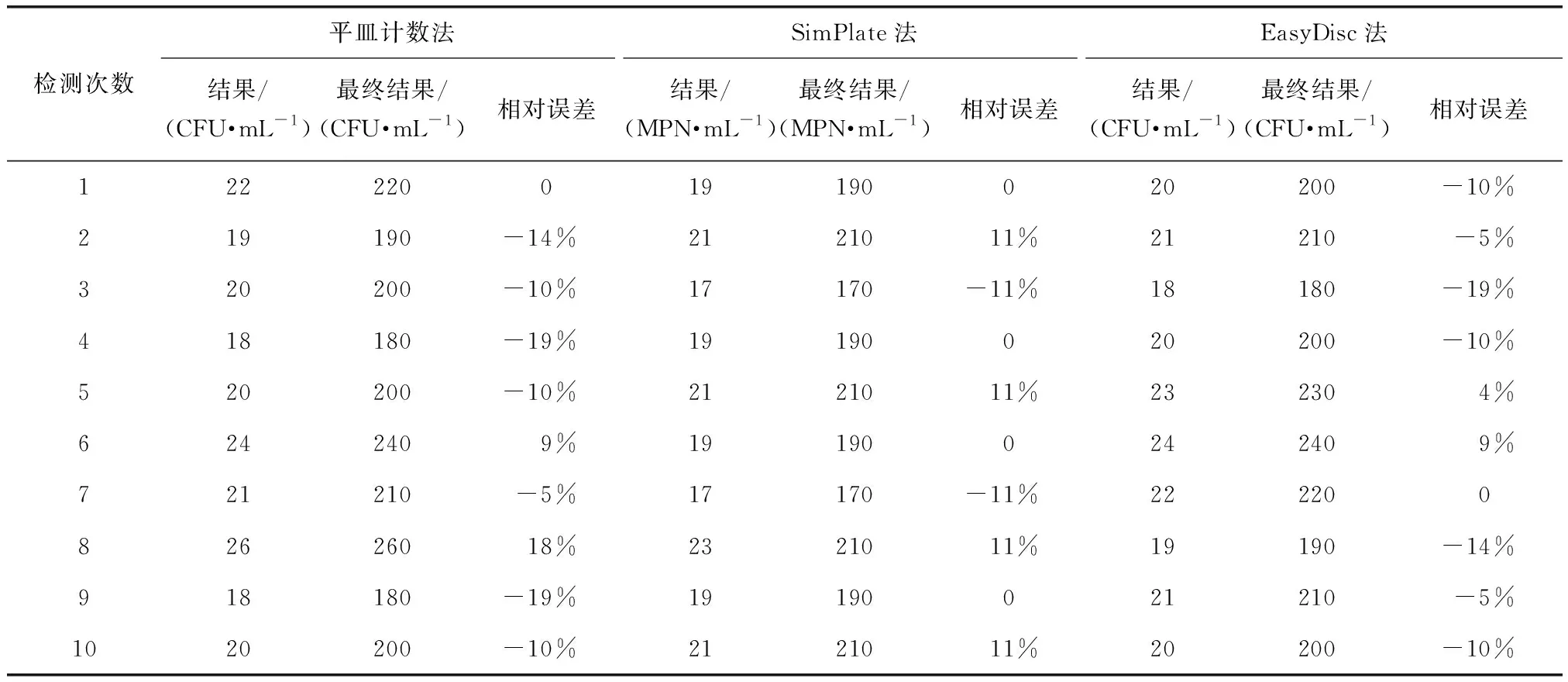
表2 3種方法檢測低濃度NSI菌落總數定量質控樣品的檢測結果Tab.2 Detection Results of Low Concentration NSI Total Number of Colonies QC Samples by Three Methods
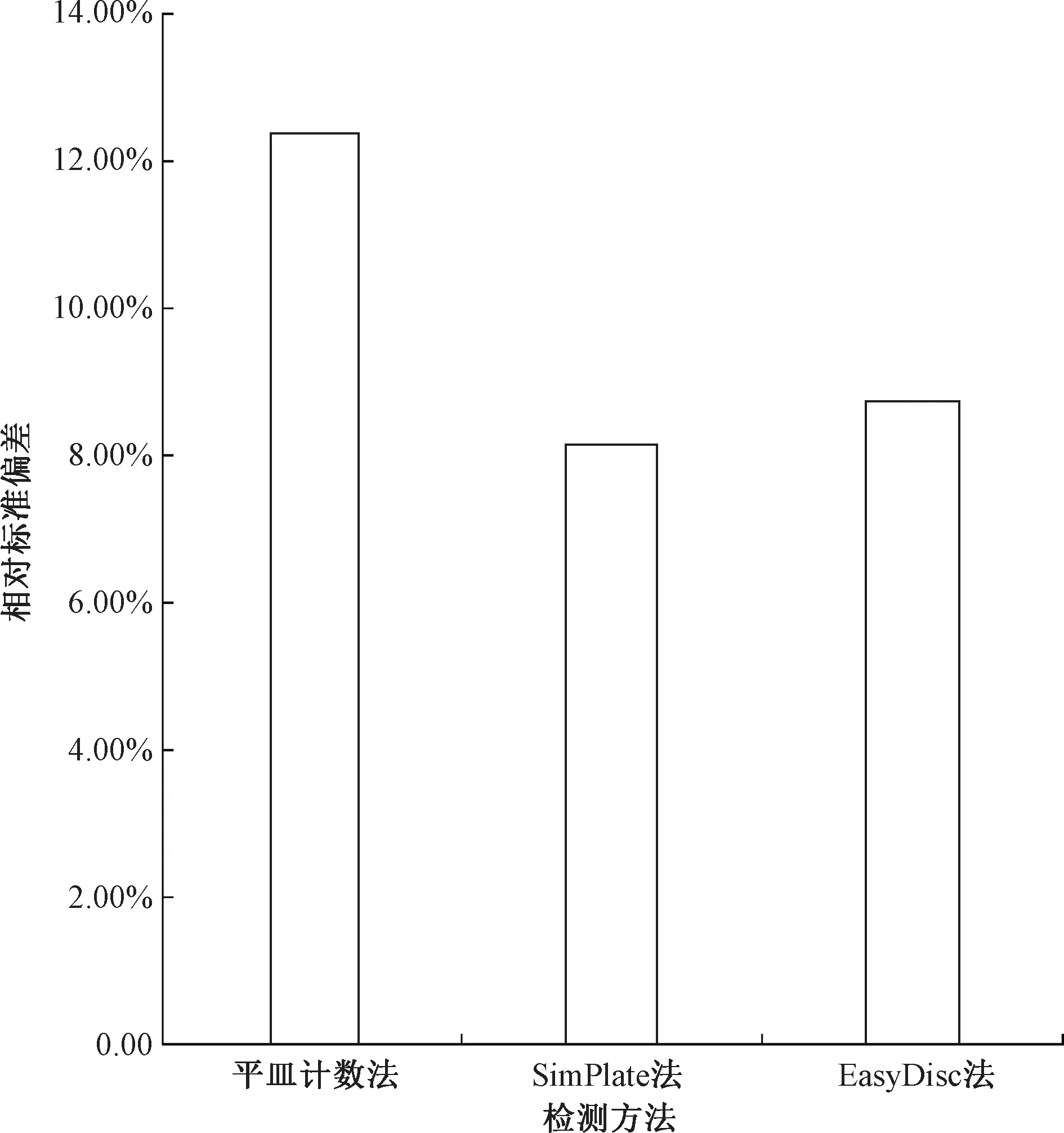
圖2 3種方法檢測低濃度NSI菌落總數定量質控樣品檢測結果的相對標準偏差Fig.2 Relative Standard Deviation of Low Concentration NSI Total Number of Colonies QC Samples by Three Methods
2.3 實際樣品檢測結果分析
選取北京地區出廠水、濾池出水及水源水各10組,分別以3種方法檢測選取的30組實際樣品。其中樣品序號21~30為水源水樣品,稀釋10倍后進行檢測,最終檢測結果=檢測結果×稀釋倍數,3種方法的檢測結果如表3所示。為進一步探究3種方法在檢測實際樣品時是否存在差異性,將3種方法檢測結果做對數處理滿足正態分布后,運用軟件SPSS 軟件進行t檢驗分析,結果如表4所示。平皿計數法與SimPlate法、EasyDisc法的泊松相關系數分別為0.945、0.981,屬極強相關性;t檢驗結果分別為P=0.366(>0.05)、P=0.798(>0.05),表明平皿計數法與SimPlate法、EasyDisc法的檢測結果高度一致,無統計學差異。可認為3種方法均可有效檢測水中菌落總數。
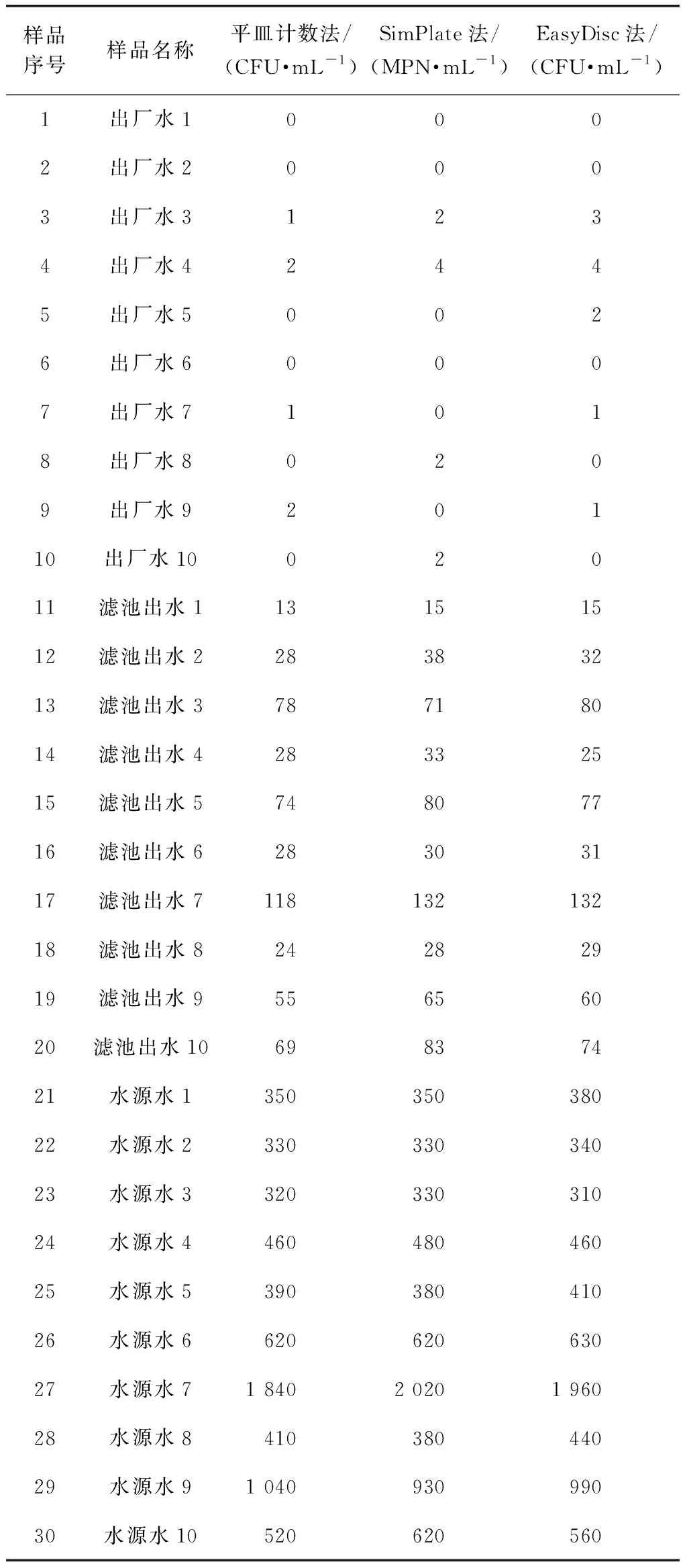
表3 北京地區實際樣品的3種方法檢測結果Tab.3 Detection Results of Actual Samples in Beijing by Three Methods
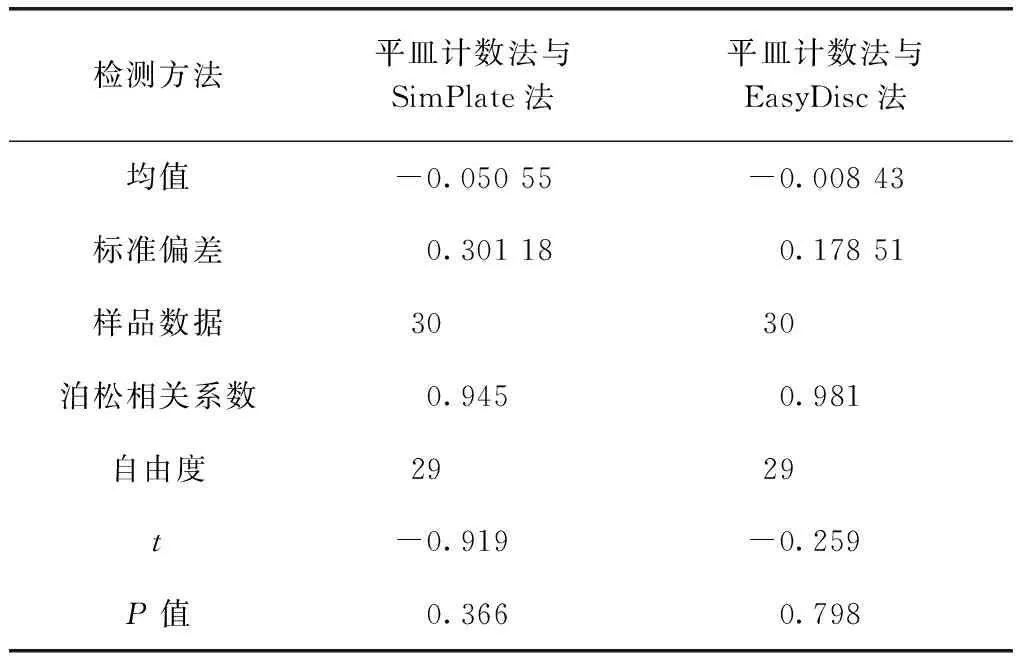
表4 3種方法實際樣品檢測結果的t檢驗Tab.4 t-Test of Results of Actual Sample by Three Methods
2.4 陰性樣品檢測結果分析
各選取3組滅菌生理鹽水、無菌純水和無菌緩沖液,在非無菌環境下分別以3種方法進行檢測,其檢測結果如表5所示。在非無菌環境下,平皿計數法檢測陰性樣品時部分陰性樣品有菌落檢出;SimPlate法和EasyDisc法檢測陰性樣品時所有陰性樣品均未檢出。由此表明,SimPlate法和EasyDisc法可以在非無菌條件下進行試驗,降低了水中菌落總數檢測項目對實驗室無菌環境的要求。
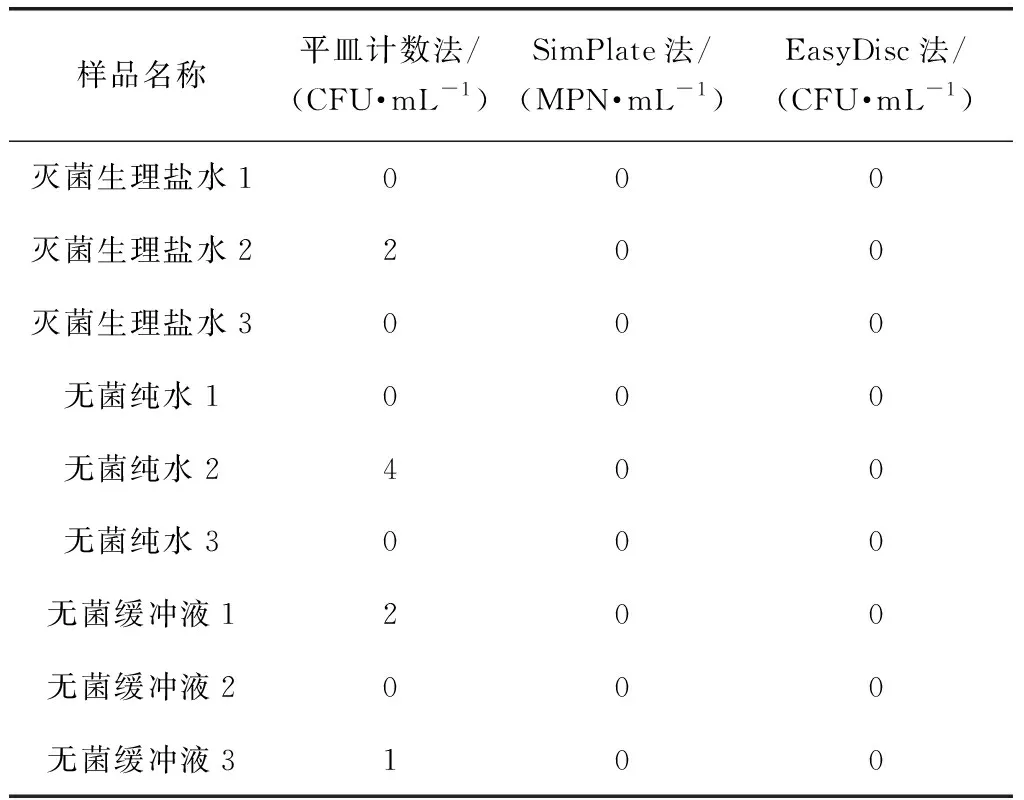
表5 陰性樣品的3種方法檢測結果Tab.5 Detection Results of Negative Samples by Three Methods
3 討論
3.1 NSI菌落總數定量質控樣品檢測結果分析
檢測20組高濃度和低濃度質控樣品時,平皿計數法共有12組檢測結果相對誤差不低于10%,大于SimPlate法及EasyDisc法。造成此類結果的原因是平皿計數法配制培養基的操作步驟(稱量、溶解、調節pH、高壓滅菌、保存及復溶等)過于繁瑣,易引入外來污染,且營養瓊脂生成的菌落顏色較淺,不易觀察,易造成人為計數誤差;而SimPlate法及EasyDisc法無需配制培養基,特制的培養基與細菌代謝產物發生反應,生成易觀察的反應產物,減少了外來污染,降低了試驗及人為誤差。
平皿計數法、SimPlate法及EasyDisc法在檢測高濃度和低濃度質控樣品時其檢測結果與真值相對誤差的標準偏差分別為9.27%、5.75%及5.86%和11.64%、8.30%及8.21%。由上述計算結果可知SimPlate法和EasyDisc法檢測結果的真值相對誤差相較于平皿計數法的真值相對誤差更小,表明SimPlate酶底物法和EasyDisc法的檢測結果更接近真值,準確度更高,性能更加穩定,更適用于水中菌落總數的檢測。
3.2 實際樣品及陰性樣品檢測
對于出廠水、濾池出水及水源水等實際樣品,SimPlate法及EasyDisc法與平皿計數法的泊松相關系數分別為0.945和0.981,表明兩種檢測方法皆與平皿計數法具有極強相關性;同時t檢驗結果分別為P=0.366(>0.05)、P=0.798(>0.05),也表明SimPlate法及EasyDisc法與平皿計數法的檢測結果無統計學差異,均可有效檢測水中菌落總數。在非無菌環境下SimPlate法和EasyDisc法檢測陰性樣品時陰性樣品均未檢出,表明SimPlate法和EasyDisc法無需在專業無菌室環境操作,既滿足實驗室對水中菌落總數的檢測需求,也降低了實驗室維護無菌環境的成本。
3.3 SimPlate法和EasyDisc法優缺點
SimPlate法和EasyDisc法特異性培養基可與細菌發生相關反應,使SimPlate法和EasyDisc法假陰性概率大幅下降。相較于平皿計數法,SimPlate法結果判讀方式更簡單,不受菌落蔓延等意外因素的影響,適用于水源水的菌落總數檢測;而EasyDisc法的47 mm平皿減少占用培養箱空間,適用于大批量樣品及應急樣品的菌落總數檢測。但EasyDisc法計數值是0~300 CFU/mL,不太適宜用于原水檢測,當菌落數較大時,容易發生菌落蔓延的情況,SimPlate法的操作步驟相對復雜,不利于大批量使用,且兩種方法價格相比平皿法價格較貴。
4 結論
(1)常用檢測水中菌落總數的傳統平皿計數法具有一定的局限性,如配制培養基操作繁瑣、對整體實驗室的無菌環境及人員能力要求較高等。而SimPlate法和EasyDisc法無需配制培養基,試驗操作過程簡便,更適合實驗室日常檢測。
(2)實驗室使用SimPlate法和EasyDisc法檢測水中菌落總數,其高濃度與低濃度定量質控樣品的檢測結果準確性及穩定性均優于傳統的平皿計數法,實際樣品的檢測結果與平皿計數法具有極強相關性,無統計學差異,檢測結果準確可靠。
(3)陰性樣品的檢測結果表明,SimPlate法和EasyDisc法無需在專業的無菌環境下操作,降低了實驗室維護無菌室的成本,適用范圍更廣,滿足實驗室對水中菌落總數的檢測需求。

