抗腫瘤多肽M1-21的劑型優化
譚擁軍 裴超柱 程浩杰 卜會銅 譚桂湘 鄧磊





摘要:通過去溶劑化方法,將單體抗腫瘤多肽M1-21納米化,形成50 nm左右大小的多肽納米顆粒(Nano-M1-21).運用動態光色散技術(DLS)和低壓透射電鏡(TEM)對Nano-M1- 21進行表征,并進行體外37℃條件下顆粒穩定性測試,運用乳腺癌MDA-MB-231、MCF-7和4T1細胞驗證Nano-M1-21的抗腫瘤效果,結果表明Nano-M1-21更容易被細胞攝取;相比單體多肽,達到抑制腫瘤細胞的濃度更低.運用小鼠乳腺癌4T1細胞活體腫瘤移植模型,發現Nano-M1-21展示出良好的抑瘤效果.總之,單體肽M1-21經納米劑型優化后,有利于改善細胞的攝取,顯示出更好的抑瘤效果.
關鍵詞:M1-21;Nano-M1-21;納米化;抑瘤效果;多肽
中圖分類號:Q784文獻標志碼:A
Desolution Optimization of Anti-tumor Peptide M1-21
TAN Yongjun,PEI Chaozhu,CHENG Haojie,BU Huitong,TAN Guixiang,DENG Lei
(College of Biology,Hunan University,Changsha 410082,China)
Abstract:The anti-tumor peptide M1-21 monomer was used to create nanoparticles(Nano-M1-21,about 50 nm)by the desolution method. The characteristics of Nano-M1-21 were determined by the dynamic optical dispersion (DLS)and the low pressure transmission electron microscopy (TEM). The stability of Nano-M1-21 particles was measured in vitro at 37 degrees centigrade. To verify the anti-tumor effects of Nano-M1-21,we used breast cancer MDA-MB-231,MCF-7 and 4T1 cells to show that Nano-M1-21 was easily absorbed by the cells and its tumor inhibitory concentration was lower than that of monomer peptide. With a mouse breast cancer 4T1 cell-grafting tumor model,we found that Nano-M1-21 showed a good suppressive effect on the tumors. In conclusion,compared to the monomer peptide M1-21,the optimized Nano-M1-21 nanoparticles provide benefits to improve the cellular uptake and anti-tumor effects.
Key words:M1-21;Nano-M 1-21;nanoization;antitumor effect;peptides
自1920年胰島素療法問世以來,多肽藥物以持續穩定的速度進入臨床開發[1].天然多肽由于較差的化學和物理穩定性以及較短的血漿半衰期,通常不適合直接用于治療,已經利用許多化學的修飾的方法,或增強肽的二級結構(即折疊)來防止被蛋白水解酶降解,從而改善多肽藥物的體內半衰期[2-5].
多肽可自組裝成不同的結構,包括納米管、納米球、納米線和納米纖維[6].這些有序納米結構的形成與各種分子間非共價相互作用的協同效應有關,包括氫鍵、π-π堆積、靜電、疏水和范德華相互作用[7].自組裝球形肽(NPs)直徑小于100 nm,由于易被細胞吸收特別適合生物醫學應用.NPs還可以在自組裝過程中將疏水性藥物加載到其內核中,從而使其成為藥物遞送系統的理想候選藥物[8-9].較小的顆粒(<100 nm)避免被網狀內皮系統(RES)立即清除,而較大的顆粒(>250 nm)通過吞噬作用和腎臟的天然過濾系統迅速清除[10].腫瘤血管系統的高滲透性允許大分子和納米顆粒進入腫瘤間質空間,這種自發性積累或“被動”靶向作用被稱為增強的通透性和保留(EPR)效應,EPR效應介導的藥物遞送目前被認為是將藥物引入腫瘤的有效方法,特別是大分子藥物和載有藥物的藥物納米載體[11-12].
本課題組篩選出了一種來源于FOXM1的抗腫瘤多肽M1-21(專利號:CN108440671B),已經展現出抗腫瘤效果[13],具體的藥理機制已經完成正在投稿中.我們通過去溶劑化的方式,使抗腫瘤多肽M1- 21自組裝形成一定大小的納米顆粒,增強了多肽的二級結構,不易被水解酶快速降解,并且Nano-M1- 21可通過EPR效應在腫瘤組織部位富集,更好地發揮抗腫瘤的效果.
1材料與方法
1.1材料
二氯樹脂、氨基酸購于希施生物科技有限公司,DMF、PIP、DIEA、HBTU、DCM、TFA、EDT、YIS、無水乙酷、乙腈(色譜級)、無水乙醇、甲醇、異丙醇、吡啶等購于國藥集團化學試劑有限公司,DMEM培養基購于GIBCO公司,胎牛血清(FBS)為Hyclone公司產品,乳腺癌MDA-MB-231、MCF-7、4T1細胞購自TACC,臺盼藍、FITC、BCA試劑盒購自生工生物工程有限公司,balb/c小鼠購自湖南斯萊克景達實驗動物有限公司.
1.2方法
1.2.1設置程序進行多肽M1-21的合成以及純化、鑒定、標記
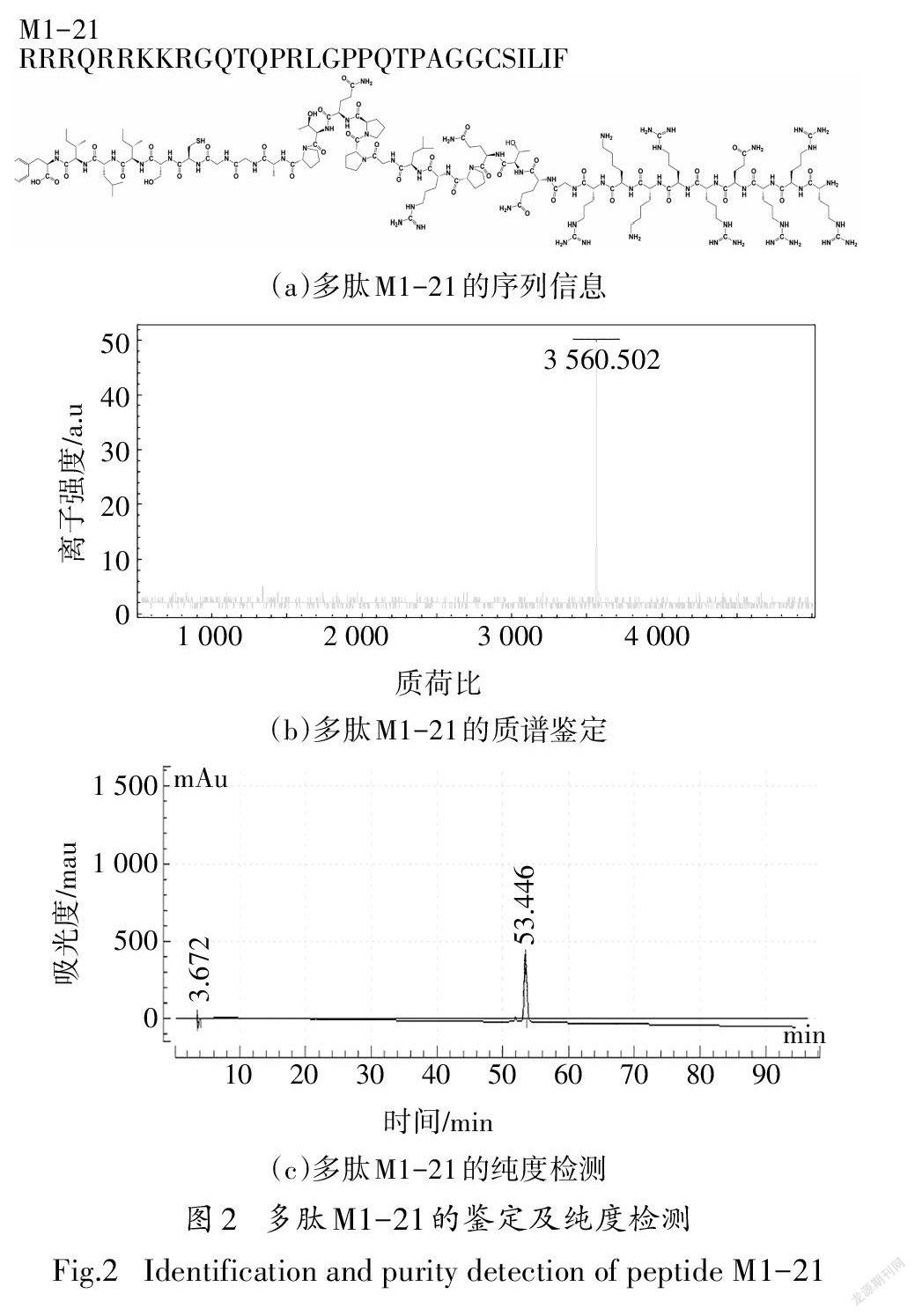
利用全自動多肽合成儀合成多肽M1-21[圖2(a)],合成的多肽粗品在蛋白純化儀上使用C18柱反向層析進行純化,流動相分別是水(0.05%TFA)和乙月青(0.05%TFA),乙月青上升洗脫.先對純化出的多肽進行質譜定性分析,再用高效液相色譜儀對純化的多肽M1-21進行純度檢測,采用C18柱反向層析進行,流動相分別是水(0.05%TFA)和乙腈(0.05%TFA),乙腈上升洗脫,最后軟件積分求出峰面積百分比.用過量摩爾比的FITC對多肽進行標記,FITC粉末溶于Py:DMF:DCM=12:7:5的混合溶液中,再與連有多肽的二氯樹脂混合反應6h,反應結束后用DMF、異丙醇、DCM,先后各洗兩遍,再用切割液將標記好的多肽切割下來,用9倍體積乙醚進行沉淀,凍干.
1.2.2單體M1-21去溶劑化形成Nano-M1-21及表征
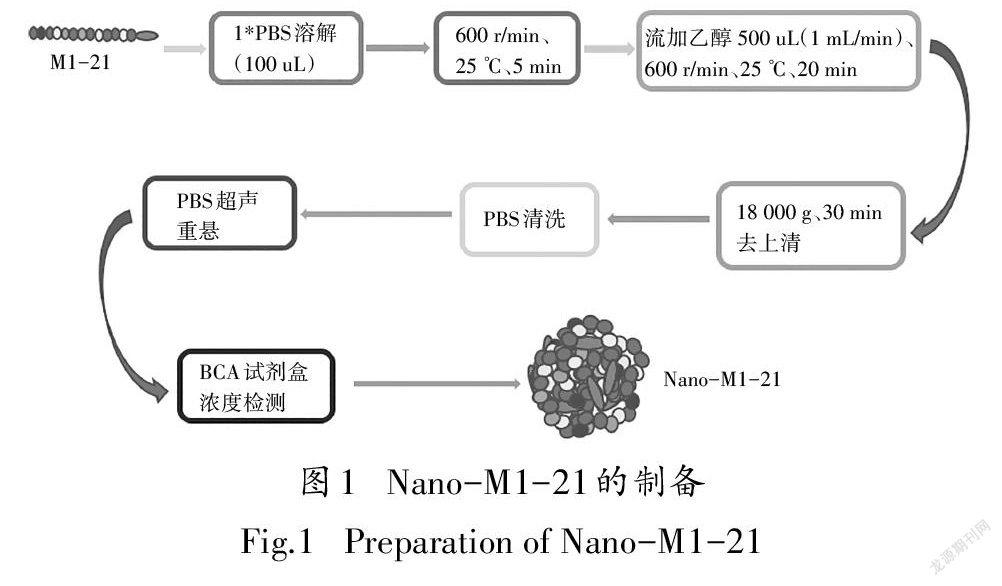
10 mg的多肽M1-21溶于1 mL的1*PBS中,取100 μL于反應瓶中,置于磁力加熱攪拌器上(600 r/min,25 ℃)攪拌,以1 mL/min的流速加入4倍體積的無水乙醇,持續攪拌20 min,18 000 g離心收集沉淀,用PBS清洗沉淀,去上清,再用PBS超聲重懸Nano- M1-21.最后用BCA試劑盒測量Nano-M1-21的濃度(圖1).動態光色散(DLS)儀測量納米顆粒流體動力學直徑及其分布.取10 μL乙酸鈾染色的Nano-M1-21懸浮液滴吸附在碳涂層的300目銅網上5 min,然后用濾紙除去殘留的液體,干燥,再進行TEM觀察.
1.2.3Nano-M1-21細胞水平效果驗證
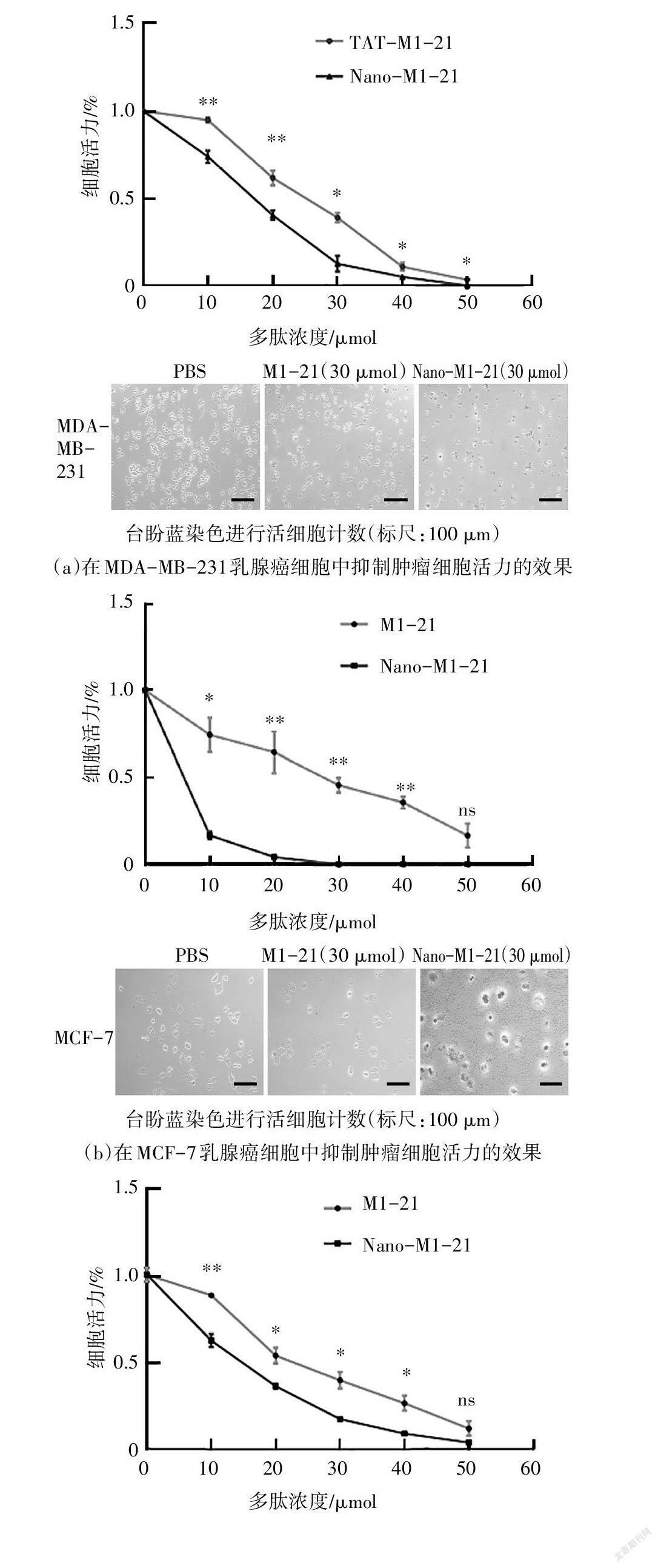
將MCF-7、MDA-MB-231、4T1乳腺癌細胞鋪到24孔板中,待細胞貼壁后,按10 μM、20 μM、30 μM、40 μM、50 μM的濃度分別加入M1-21、Nano-M1- 21,36h后去上清加入0.04%的臺盼藍溶液處理3~5 min,去除臺盼藍溶液并用PBS清洗兩遍,顯微鏡下拍照,再進行活細胞計數.按照上述方法,將FITC標記的M1-21與未標記的多肽按1:9的比例混合制備帶熒光的Nano-M1-21,按照前面相同的方法測量濃度以及表征.再按30μM的濃度加入到MCF-7,MDA-MB-231乳腺癌細胞中處理2 h,然后觀察熒光判斷M1-21、Nano-M1-21進入細胞的情況.
1.2.4Nano-M1-21動物水平效果驗證
狀態較好的balb/c小鼠,年齡達到6周后,皮下接種5×10個4T1乳腺癌細胞建立皮下實體瘤模型.3 d 后,M1-21,Nano-M1-21分別以25 mg/kg的劑量尾靜脈給藥,隔天給藥一次,并對小鼠體重和腫瘤大小進行測量.
2結果
2.1多肽M1-21的合成與鑒定
為了檢測多肽合成的質量,我們通過質譜分析多肽M1-21[圖2(a)],質譜結果顯示[圖2(b)]在3560處有明顯峰圖,與M1-21相對分子質量一致,說明多肽M1-21合成成功,并且高效液相色譜檢測純化后的M1-21濃度高達96.161%[圖2(c)].
2.2Nano-M1-21的制備與表征
單體多肽M1-21通過去溶劑化自組裝形成納米顆粒(圖1),TEM和DLS的結果顯示納米顆粒大小均勻地分布在50 nm左右[圖3(a)(b)].體外37 ℃穩定性測試(DLS檢測)可知,24h后納米顆粒的大小主要分布在45 nm左右,48 h后大小主要分布在27 nm 左右,8 d后納米顆粒大小一直維持在27 nm左右[圖3(c)],說明納米顆粒在37 ℃下具有比較好的穩定性,不會完全解聚為單體.
2.3細胞水平上Nano-M1-21能更好地抑制腫瘤細胞的活力
為了驗證Nano-M1-21的效果,在MDA-MB- 231、MCF-7、4T1乳腺癌細胞中,將M1-21和Nano- M1-21按濃度梯度分別加入這三種腫瘤細胞中,36 h后,用臺盼藍染色后活細胞計數發現,Nano-M1-21達到和M1-21單體多肽相同的效果所需的量更少. 在MDA-MB-231,MCF-7和4T1細胞中,相對于M1- 21,Nano-M1-21的IC50分別減少1.53倍、3.37倍以及1.5倍(見圖4).
2.4Nano-M1-21更易于被細胞吸收
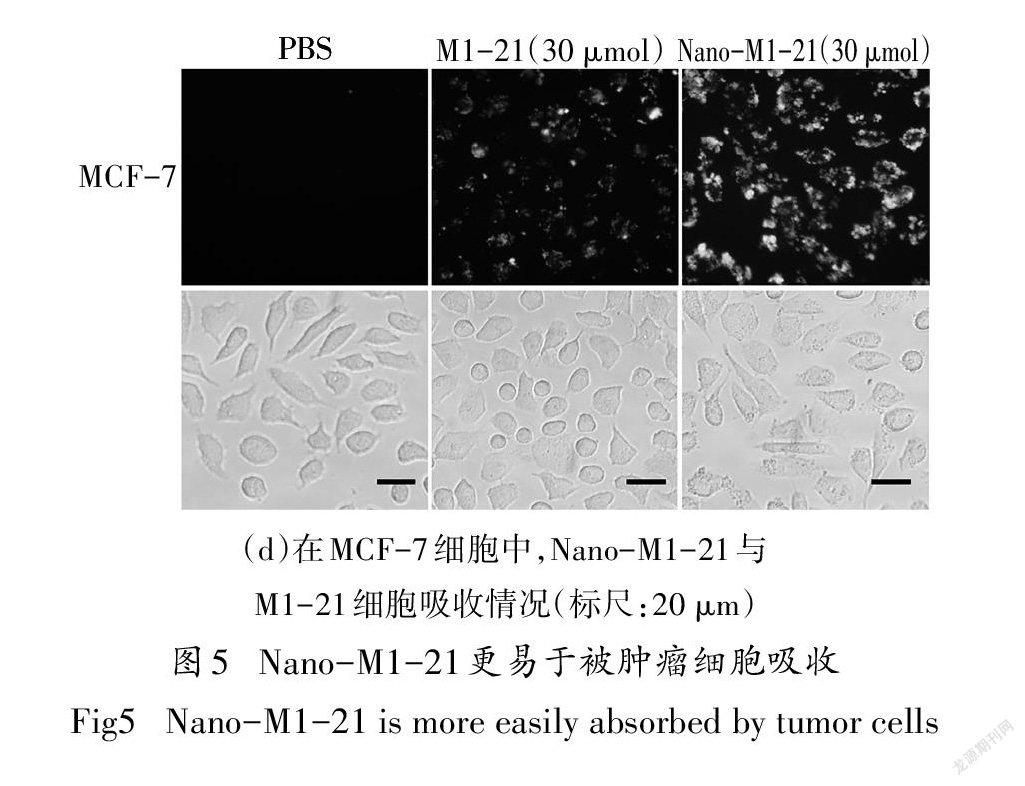
按照前面去溶劑的方法,將FITC標記的M1-21和未標記的M1-21按1:9混合制備了帶熒光的Nano-M1-21,DLS和TEM表征發現,顆粒大小均勻分布在50 nm左右[圖5(a)(b)].在MDA-MB-231、MCF-7乳腺癌細胞中,熒光圖[圖5(c)(d)]乳可知Nano-M1-21更易于被細胞吸收,可能由于納米化后改變了細胞對M1-21的攝取方式,明場細胞圖發現Nano-M1-21組的細胞形態發生了明顯改變.
2.5Nano-M1-21明顯抑制balb/c荷瘤小鼠腫瘤的生長
在balb/c小鼠皮下實體瘤模型中,通過隔天尾靜脈給藥進行治療,給藥過程中[圖6(a)],小鼠體重沒有發生明顯變化[圖6(b)],Nano-M1-21比起M1-21 單體肽展現出更好的抑瘤效果[圖6(c)],治療結束后,將小鼠處死,取出每組皮下瘤觀察大小[圖6(d)]并稱量瘤子的質量[圖6(e)],這些結果都表明,在小鼠腫瘤模型中Nano-M1-21有更好的抑瘤效果.
3討論
肽類藥物給藥后可能受到蛋白水解酶降解或誘導免疫反應而受到限制,所以將多肽充分遞送至腫瘤部位是具有挑戰性的[14].因此,部分肽類藥物需要改進其遞送方式以成功開發出抗癌肽.藥物遞送研究的基本目標是通過改善治療分子的遞送來提高治療分子的功效.制劑、控釋、遞送途徑和保存期限的改進大大提高了治療效果[15-19].納米顆粒已被用于改善小分子抗癌藥(例如阿霉素和紫杉醇)的藥代動力學特性和治療效果[20].通過這種方式,納米顆粒具有通過增強滲透和保留(EPR)效應在腫瘤微環境中維持藥物暴露的能力[21].另外,可以用與腫瘤細胞表面特異性的靶標結合的配體來修飾納米顆粒[22],從而達到抗癌藥物靶向腫瘤治療的效果.
因此,我們在具有抗腫瘤效果的多肽M1-21的基礎上,通過去溶劑化的方式,使單體多肽分子間在疏水力的相互作用下自組裝形成50 nm左右的多肽納米顆粒.納米化后,細胞對顆粒物質進行胞吞,納米顆粒的大小會影響它與細胞膜的相互作用,并最終影響細胞內吸收,直徑約50 nm的納米顆粒通常更容易被細胞吸收[23],因此M1-21單體多肽通過納米化后易于被細胞吸收,改善了多肽對于腫瘤的抑制效果.而自組裝方法可用于治療性肽藥物的劑型改造,以改善其穩定性和治療活性,從而開發無載體的藥物遞送系統.在本次研究中,Nano-M1-21在小鼠腫瘤模型中取得了比較好的抗腫瘤活性,但Nano-M1-21通過EPR效應在腫瘤部位的富集以及延長其代謝周期還需進一步驗證.除了通過M1-21本身自組裝形成納米顆粒完成遞送外,還可嘗試其他可自組裝的兩親性材料(脂質體等)來完成多肽M1-21的遞送,這兩種方法往往只是EPR效應的被動靶向.想要取得更好的靶向效果,可以考慮采用主動靶向的策略,在納米粒子表面直接修飾與腫瘤細胞表達的受體定向結合的配體(iRGD)來靶向腫瘤細胞.因此,多肽M1-21可嘗試結合被動靶向和主動靶向的優化策略,達到更好的抑瘤效果.
最后,多肽在自組裝過程中可將疏水性藥物(紫杉醇,阿霉素)載入其疏水內核[9],那么我們的多肽M1-21成為藥物遞送系統的理想候選藥物的同時也可聯合其他藥物共同治療腫瘤.一種重組蛋白(四聚體M2e)可通過去溶劑化先形成納米粒子核心,然后在其表面交聯抗原肽(HA),這種納米顆粒疫苗可誘導持久且強大的免疫力[24],所以Nano-M1-21可成為有效抗原的載體,進入體內關鍵區域誘導免疫反應.
參考文獻
[1] LAU J L,DUNN M K. Therapeutic peptides:historical perspectives,current development trends,and future directions [J]. Bio- organic & Medicinal Chemistry,2018,26(10):2700-2707.
[2] LEE A C L,HARRIS J L,KHANNA K K,et al. A comprehensive review on current advances in peptide drug development and design [J]. International Journal of Molecular Sciences,2019,20 (10):2383.
[3] TIMMERMAN P,PUIJK W C,MELOEN R H. Functional reconstruction and synthetic mimicry of a conformational epitope using CLIPS?technology [J]. Journal of Molecular Recognition,2007,20(5):283-299.
[4] HOUSTON M E Jr,CAMPBELL A P,LIX B,et al. Lactam bridge stabilization of alpha-helices:the role of hydrophobicity in controlling dimeric versus monomeric alpha-helices[J].Biochemistry,1996,35(31):10041-10050.
[5] SIM S,KIM Y,KIM T,et al. Directional assembly of a-helical peptides induced by cyclization[J].Journal of the American Chemical Society,2012,134(50):20270-20272.
[6] WANG J,LIU K,XING R R,et al. Peptide self-assembly:thermodynamics and kinetics [J]. Chemical Society Reviews,2016,45(20):5589-5604.
[7] WHITESIDES G M,GRZYBOWSKI B. Self-assembly at all scales[J].Science,2002,295(5564):2418-2421.
[8]CHAN K H,LEE W H,ZHUO S M,et al.Harnessing supramolecular peptide nanotechnology in biomedical applications[J].In- ternational Journal of Nanomedicine,2017,12:1171-1182.
[9]DE BRUYN OUBOTER D,SCHUSTER T,SHANKER V,et al. Multicompartment micelle-structured peptide nanoparticles:a new biocompatible gene- and drug-delivery tool[J].Journal of Biomedical Materials Research Part A,2014,102(4):1155- 1163.
[10] UN K,SAKAI-KATO K,OSHIMA Y,et al.Intracellular trafficking mechanism,from intracellular uptake to extracellular efflux,for phospholipid/cholesterol liposomes[J]. Biomaterials,2012,33 (32):8131-8141.
[11] MAEDA H,WU J,SAWA T,et al.Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J].Journal of Controlled Release,2000,65(1/2):271-284.
[12] MAEDA H,SAWA T,KONNO T.Mechanism of tumor-targeted delivery of macromolecular drugs,including the EPR effect in solid tumor and clinical overview of the prototype polymeric drug SMANCS[J].Journal of Controlled Release,2001,74(1/2/3):47-61.
[13]譚擁軍,張振旺,余景衛,一種來源于FoxM1蛋白的抗腫瘤多肽:中國專利.CN108440671B[P].2020-03-06.
TAN Y J,ZHANG Z W,YU J W.An anti-tumor peptide derived from FOXM1 protein:CN108440671B,2020-03-06 [P]. 202003-06.(In Chinese)
[14] TALMADGE J E.Pharmacodynamic aspects of peptide administration biological response modifiers[J].Advanced Drug Delivery Reviews,1998,33(3):241-252.
[15] SAHA R N,VASANTHAKUMAR S,BENDE G,et al.Nanoparticulate drug delivery systems for cancer chemotherapy[J].Molecular Membrane Biology,2010,27(7):215-231.
[16] LIM S B,BANERJEE A,ONYUKSEL H. Improvement of drug safety by the use of lipid-based nanocarriers[J].Journal of Controlled Release,2012,163(1):34-45.
[17] SANNA V,ROGGIO A M,SILIANI S,et al.Development of novel cationic chitosan-and anionic alginate-coated poly(D,L- lactide-co-glycolide)nanoparticles for controlled release and light protection of resveratrol[J].International Journal of Nano- medicine,2012,7:5501-5516.
[18] IBRAHIM B M,PARK S,HAN B,et al.A strategy to deliver genes to cystic fibrosis lungs:a battle with environment[J].Jour- nal of Controlled Release:Official Journal of the Controlled Release Society,2011,155(2):289-295.
[19] KOVACEVIC A,SAVIC S,VULETA G,et al.Polyhydroxy surfactants for the formulation of lipid nanoparticles(SLN and NLC):effects on size,physical stability and particle matrix structure[J].International Journal of Pharmaceutics,2011,406(1/2):163-172.
[20] KRATZ F,WARNECKE A.Finding the optimal balance:chal- lenges of improving conventional cancer chemotherapy using suit - able combinations with nano-sized drug delivery systems[J].Journal of Controlled Release,2012,164(2):221-235.
[21] MANZOOR A A,LINDNER L H,LANDON C D,et al.Overcom- ing limitations in nanoparticle drug delivery:triggered,intravascu- lar release to improve drug penetration into tumors[J].Cancer Research,2012,72(21):5566-5575.
[22] KAMALY N,XIAO Z Y,VALENCIA P M,et al.Targeted polymeric therapeutic nanoparticles:design,development and clinical translation[J].Chemical Society Reviews,2012,41(7):2971- 3010.
[23] KUMARI A,YADAV S K.Cellular interactions of therapeutically delivered nanoparticles[J].Expert Opinion on Drug Delivery,2011,8(2):141-151.
[24] DENG L,MOHAN T,CHANG T Z,et al.Double-layered protein nanoparticles induce broad protection against divergent influenza A viruses[J].Nature Communications,2018,9(1):359.

