IL-6致非小細胞肺癌PD-1抑制劑治療抵抗的效應和機制研究*
張衡,盧從華,趙茜,羅諾,李鑫,王任源,趙呈龍,王治國,祝夢曉,封明霞,何勇,李力
400042 重慶,陸軍軍醫大學附屬陸軍特色醫學中心 呼吸與危重癥醫學科
肺癌的發病率和死亡率均位居我國惡性腫瘤首位,其中非小細胞肺癌(non-small cell lung cancer,NSCLC)約占肺癌總數的85%[1-2]。大多數NSCLC患者在確診時已處于晚期階段,喪失手術機會[3]。近年來,分子靶向治療和免疫治療顯著改善了NSCLC患者的預后[4]。對于驅動基因陰性的晚期NSCLC患者,以程序性細胞死亡蛋白1(programmed cell death protein-1,PD-1)/程序性死亡配體1(programmed cell death ligand-1,PD-L1)抑制劑為代表的免疫治療顯著改善了患者生存,已成為一線標準治療方案[5]。然而,并非所有NSCLC患者都能對PD-1/PD-L1抑制劑治療產生良好應答,甚至可能出現嚴重的不良反應。所以,發現PD-1/PD-L1抑制劑療效預測因子,闡明其治療抵抗機制,對于擴大免疫治療獲益人群、增強免疫治療療效至關重要[6]。
目前,腫瘤細胞PD-L1表達已被廣泛用于預測PD-1/PD-L1抑制劑治療的療效。對于PD-L1表達強陽性(≥50%)的患者,可一線單藥免疫治療[7]。除此之外,腫瘤突變負荷(tumor mutation burden,TMB)、微衛星不穩定(microsatellite instability,MSI)對免疫治療療效也有一定的預測作用[8]。近年來研究發現,腫瘤免疫微環境(tumor immune microenvironment,TIME)在腫瘤生長和轉移的調控中起著重要作用。TIME包括各種微環境中的免疫細胞(髓樣細胞、淋巴細胞、抗原呈遞細胞等)以及細胞因子、趨化因子和生長因子等可溶性免疫因子[9]。細胞因子在募集免疫細胞到腫瘤微環境過程中起重要調節作用[10],其中白細胞介素-6(interleukin 6,IL-6)是TIME中重要的細胞因子,可激活腫瘤細胞和腫瘤浸潤免疫細胞中的JAK/STAT3信號,促進免疫抑制性微環境形成并導致腫瘤細胞增殖、存活、侵襲和轉移,抑制抗腫瘤免疫反應[11-12]。近期研究報道,IL-6可能為PD-1抑制劑治療黑色素瘤的療效預測標志物[13],但其在NSCLC免疫治療中的作用和機制尚未完全闡明。
因此,本回顧性研究擬探索IL-6與NSCLC患者PD-1抑制劑療效的相關性,同時通過一系列相關體外研究,初步探討IL-6導致PD-1抑制劑抵抗的作用機制。
1 資料與方法
1.1 研究設計和對象
篩選2017年1月1日至2021年10月31日期間,在陸軍特色醫學中心(即大坪醫院)確診為NSCLC且接受PD-1抑制劑治療的患者,納入標準如下:1)病理證實為Ⅲ/Ⅳ期NSCLC患者,無法接受手術;2)接受PD-1抑制劑單藥或聯合治療,治療線數不限,治療周期≥2個;3)免疫治療前1周之內檢測外周血IL-6;4)隨訪時間≥6個月。主要排除標準:1)基線合并細菌感染;2)6個月之內失訪;3)資料不全,無法評估療效。IL-6的數據自病歷系統采集,IL-6檢測由本中心檢驗科使用酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)完成。本研究經陸軍特色醫學中心倫理委員會審查并批準(編號:2022132)。數據隨訪截止日期為2022年4月12日。
1.2 療效評估
依據實體瘤療效評價標準1.1版(RECIST 1.1),每位患者的短期療效分為完全緩解(complete response,CR)、部分緩解(partial response,PR)、疾病穩定(stable disease,SD)或疾病進展(progressive disease,PD)。無進展生存期 (progression-free survival,PFS)被定義為從開始治療到臨床醫生評估影像學進展、死亡或末次隨訪的時間。總生存期 (overall survival,OS)被定義為第一次接受治療的日期至因任何原因死亡的日期,或最后一次隨訪的日期。持續臨床獲益(durable clinical benefit,DCB)定義為CR、PR或SD≥6個月,無持續獲益(non-durable clinical benefit,NDB)定義為SD<6個月或PD[14]。客觀緩解率(objective response rate,ORR)定義為完全緩解加上部分緩解之和(CR+PR)占總研究人群的比例。
1.3 細胞培養和試劑
人肺癌細胞系H1299和A549細胞購自美國模式培養物集存庫(American Type Culture Collection,ATCC)。人外周血T細胞自上海賽笠生物科技有限公司(中國上海)采購。腫瘤細胞均采用含10%胎牛血清和1%青霉素/鏈霉素的RPMI-1640(Hyclone)培養基,在37℃及5% CO2細胞培養箱中培養。重組人IL-6蛋白和白細胞介素2(interleukin 2,IL-2)蛋白均購自PeproTech(美國新澤西州),抗STING、TBK1、p-TBK1、STAT3、p-STAT3、AKT、p-AKT和β-tubulin均從Cell Signaling Technology(美國馬薩諸塞州)采購。
1.4 T細胞介導的腫瘤細胞殺傷試驗
活化T細胞步驟參考先前研究[15],簡述如下:人外周血T細胞通過在含有IL-2(10 ng/mL)和ImmunoCult human CD3/CD28/CD2 T細胞激活劑(25 μL/mL)的ImmunoCult-XF T細胞擴增培養基(均購自STEMCELL Technologies,加拿大溫哥華)中培養1周而活化。所有T細胞介導的腫瘤細胞殺傷試驗都在含有抗CD3抗體(100 ng/mL;Thermo Fisher Scientific,美國馬薩諸塞州)和IL-2(10 ng/mL)的DMEM/F12培養基中進行。
1.5 CCK-8檢測細胞存活率
細胞存活率通過細胞計數試劑盒(CCK-8;MedChemExpress,美國新澤西州)檢測。將長勢良好且處于對數期的各肺癌細胞株接種于96孔板內,接種量為每孔3 000個細胞,設置3個復孔,按每孔100 μL加入RPMI-1640完全培養基培養過夜。第二天,以不進行任何處理的細胞為對照組,以含T細胞及T細胞和IL-6處理的細胞為實驗組,更新DMEM/F12培養基并再培養48 h。然后更新培養基,每孔加入10 μL的CCK-8溶液,設置只有培養基和CCK-8溶液的孔作為調零孔。輕輕搖晃混勻后放入培養箱中繼續培養2 h,酶標儀檢測450 nm下吸光度值并進行記錄。
1.6 Ki67染色
細胞增殖通過Ki67標記(Boster,中國武漢) 檢測。取長勢良好的細胞經胰蛋白酶消化并計數。在6孔板中放入無菌蓋玻片,于蓋玻片上滴加細胞懸液,每孔接種細胞數30萬,每孔加入RPMI-1640完全培養基2 mL培養過夜。待細胞貼壁,于次日按細胞存活率測定方案分對照組、T細胞處理組及T細胞和IL-6處理組,更換培養基繼續培養48 h。于顯微鏡下初步觀察,去除培養基,磷酸緩沖鹽溶液(phosphate buffered saline,PBS)洗3次后用4%多聚甲醛固定20 min。再次用PBS清洗3遍,每次2~3 min,然后加入0.25% TritonX-100透化處理20 min。PBS洗3次后用10%山羊血清封閉1 h,然后加一抗Ki67(1∶100稀釋)于4℃孵育過夜。經PBS 3次清洗后加熒光二抗CY3(1∶100稀釋)及4’,6-二脒基-2-苯基吲哚(DAPI,1∶500)孵育1 h。最后經PBS清洗后在熒光顯微鏡下觀察。
1.7 蛋白質印跡(Western Blot)
蛋白質印跡步驟參考先前研究[16]。細胞接種于6孔板,根據實驗分組處理48 h,置于顯微鏡下觀察后去除培養基,用PBS清洗3次,于冰上操作,加入RIPA 裂解液(添加了1%蛋白酶和磷酸酶抑制劑)裂解30 min。經震蕩超聲充分裂解后于4 ℃下12 000 g離心20 min,取上清液,采用BCA法測定蛋白濃度。按說明分別配制分離膠和濃縮膠,待膠體凝固,根據測定的蛋白濃度確定上樣量,配制上樣體系。將樣品于100 ℃熱變性5 min,110 V電泳90 min。然后以90 V電轉80 min將蛋白移至PVDF膜上。之后,在室溫下用TBST配置的5%脫脂牛奶封閉1 h。根據目標蛋白相對分子質量切膜并與相應抗體(1∶1 000)在4 ℃下孵育過夜。然后用TBST洗膜3次,每次5 min,分別加辣根過氧化物酶標記的山羊抗兔IgG(1∶5 000)室溫孵育1 h。最后,經TBST洗膜3次,每次5 min后,用ChemiDoc Touch凝膠成像系統對膜進行顯影。
1.8 統計學方法
計量資料首先采用Shapiro-Wilk test進行正態性檢驗,符合正態分布的采用均數±標準差進行描述,組間比較采用獨立樣本t檢驗;非正態性分布數值描述采用中位數進行描述,組間比較采用Mann-Whitney U test。計數資料采用頻數和百分比進行描述,組間比較采用卡方檢驗或Fisher′s精確檢驗。基線IL-6水平根據臨床界值確定為高(≥7 pg/mL,n=20)或低(<7 pg/mL,n=10)兩組, Kaplan-Meier分析兩組PFS。三次獨立實驗數據以均數±標準差進行描述,組間比較采用獨立樣本t檢驗。所有統計分析均使用SPSS 26.0軟件進行,以P<0.05為差異有統計學意義。
2 結 果
2.1 患者特征
本研究共篩選出160例確診為晚期NSCLC且接受PD-1抑制劑治療的患者。根據納入及排除標準,130例被排除,剩余30例患者納入研究。其中25例診斷為腺癌,5例診斷為鱗癌。共有22例的患者有吸煙史。28例的患者接受一線免疫治療,25例的患者接受了免疫聯合治療。研究人群中位隨訪時間為12.0個月(IQR:9.0~17.3個月),中位PFS為11.0個月(IQR:7.0~15.3個月)。在隨訪期間,30名患者中有83.3% (n=25)通過PD-1抑制劑治療達到DCB,16.7%(n=5)達到NDB。另外,6.7%(n=2)的患者達到CR,43.3%(n=13)的患者達到PR,23.3%(n=7)的患者達到SD,26.7%(n=8)的患者療效為PD(表1)。
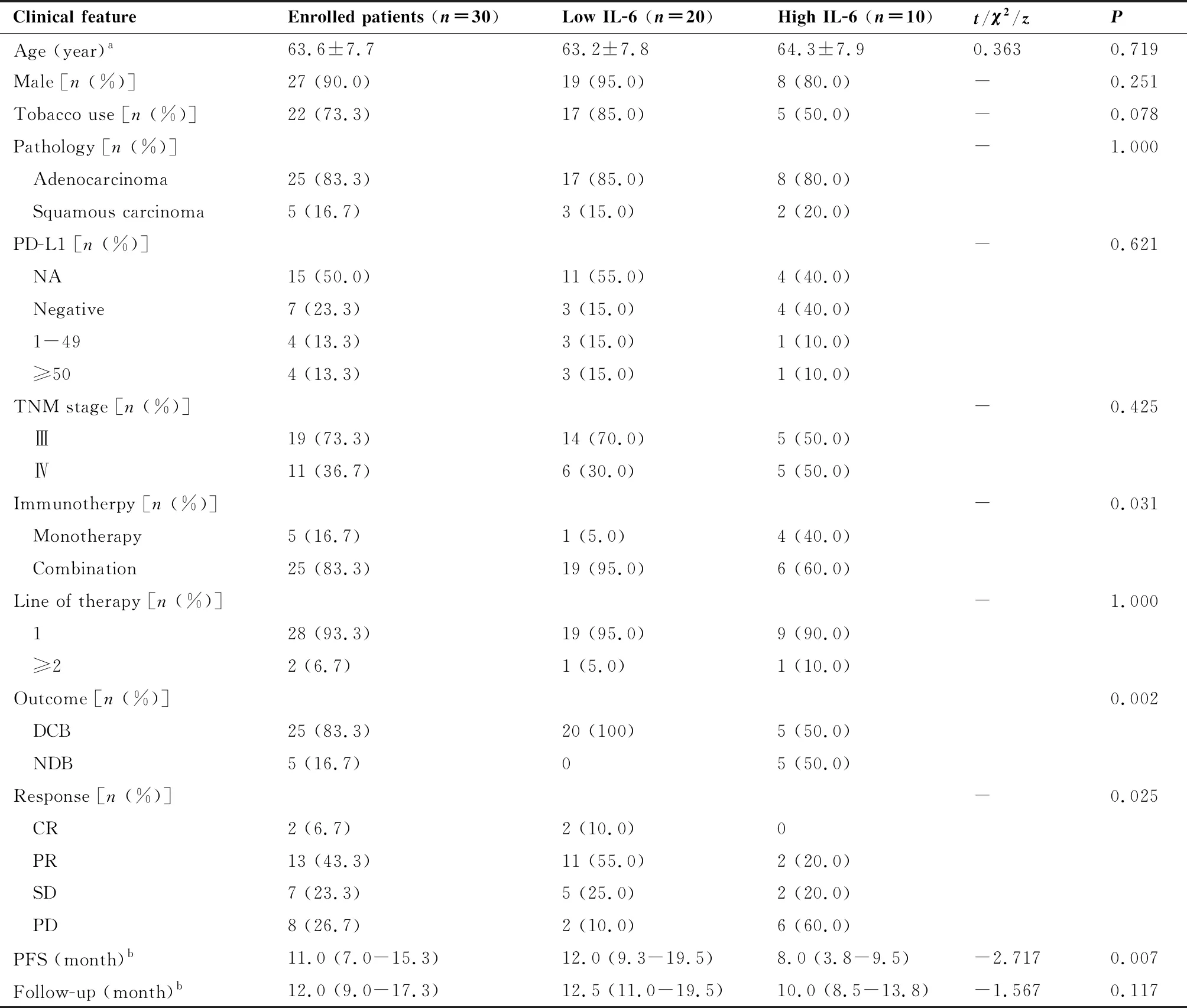
表1 入組患者的臨床特征
2.2 基線外周血IL-6水平與NSCLC患者PD-1抑制劑治療療效負相關
為了探究基線外周血IL-6水平與NSCLC患者PD-1抑制劑治療療效的相關性,我們首先對比了DCB和NDB患者的基線外周血IL-6水平,結果顯示DCB組IL-6水平顯著低于NDB組(中位數4.60 pg/mLvs12.88 pg/mL,P=0.002)(圖1A)。根據基線IL-6水平臨床參考閾值分為高(≥7 pg/mL,n=20)或低(<7 pg/mL,n=10)兩組。如圖1B所示,低IL-6組的DCB率顯著高于高IL-6組(100%vs50%,P=0.002)。另外,與高IL-6組相比,低IL-6組ORR更高(65%vs20%,P=0.025)。其中,高IL-6組60%的患者療效為PD(圖1C)。接下來,我們進一步分析了基線IL-6水平與PFS的相關性。結果顯示,基線外周血IL-6水平高的患者的中位PFS為 8.00 個月(IQR:3.8~9.5個月),而基線外周血IL-6水平低的患者未達到(未達到vs8個月,P=0.007)(圖1D)。
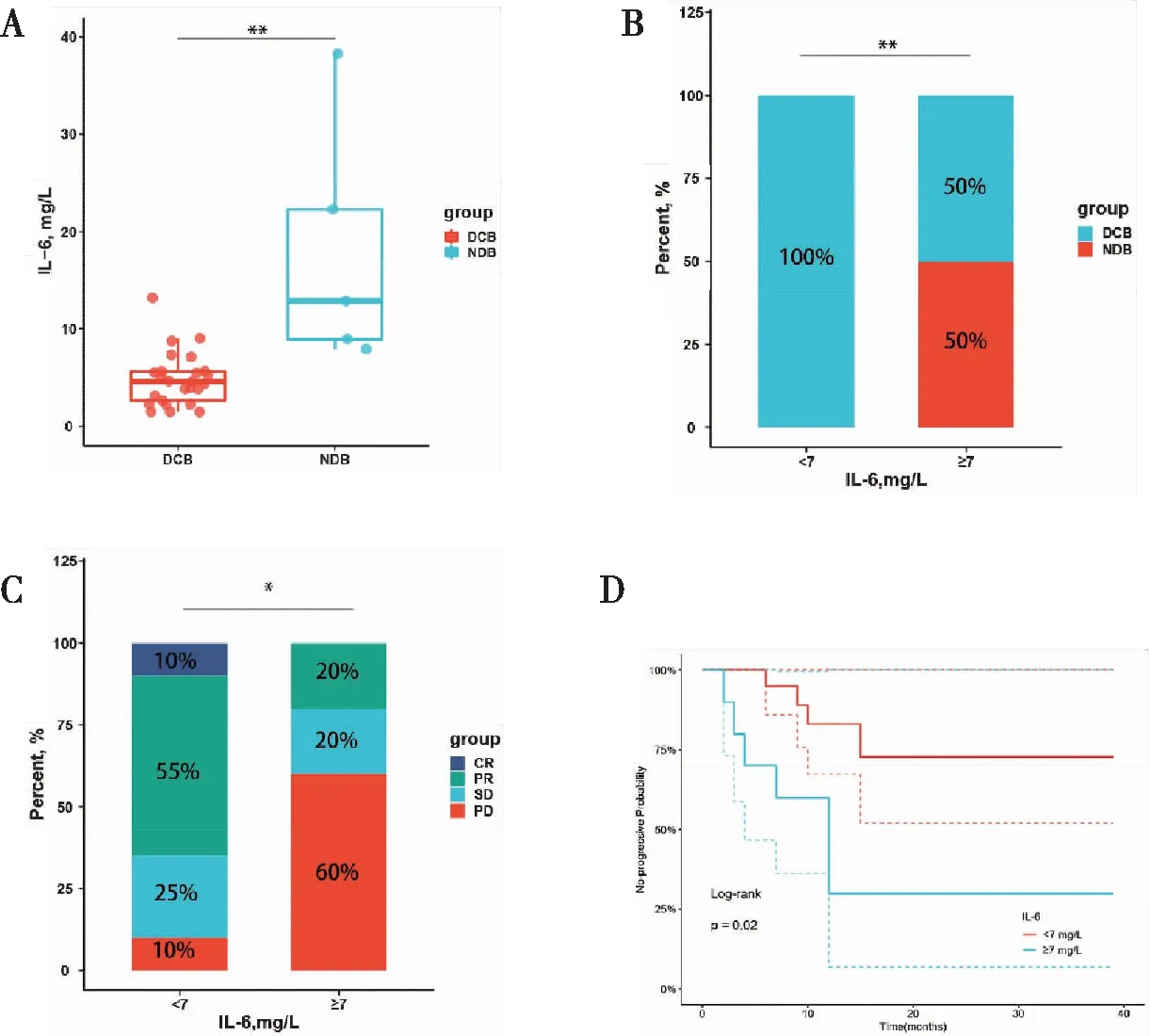
圖1 IL-6與PD-1抑制劑療效的相關性
2.3 IL-6減弱T細胞介導的對肺癌細胞H1299和A549細胞的殺傷作用
接下來,我們通過T細胞介導的腫瘤細胞殺傷試驗觀察IL-6對T細胞殺傷效應的影響。Ki67實驗結果提示,與對照組相比,活化T細胞能顯著降低Ki67陽性細胞的百分比,而外加IL-6后Ki67陽性細胞百分比顯著增高,提示在IL-6存在的情況下,T細胞不能有效抑制H1299和A549肺癌細胞的增殖(圖2A)。與之類似的是,CCK-8實驗提示,活化的T細胞可顯著降低H1299和A549肺癌細胞的存活率,而外加IL-6后,腫瘤細胞存活率顯著升高,提示IL-6顯著抑制活化T細胞對腫瘤細胞的殺傷(圖2B)。這些結果表明IL-6 對T細胞介導的腫瘤細胞殺傷起抑制作用。
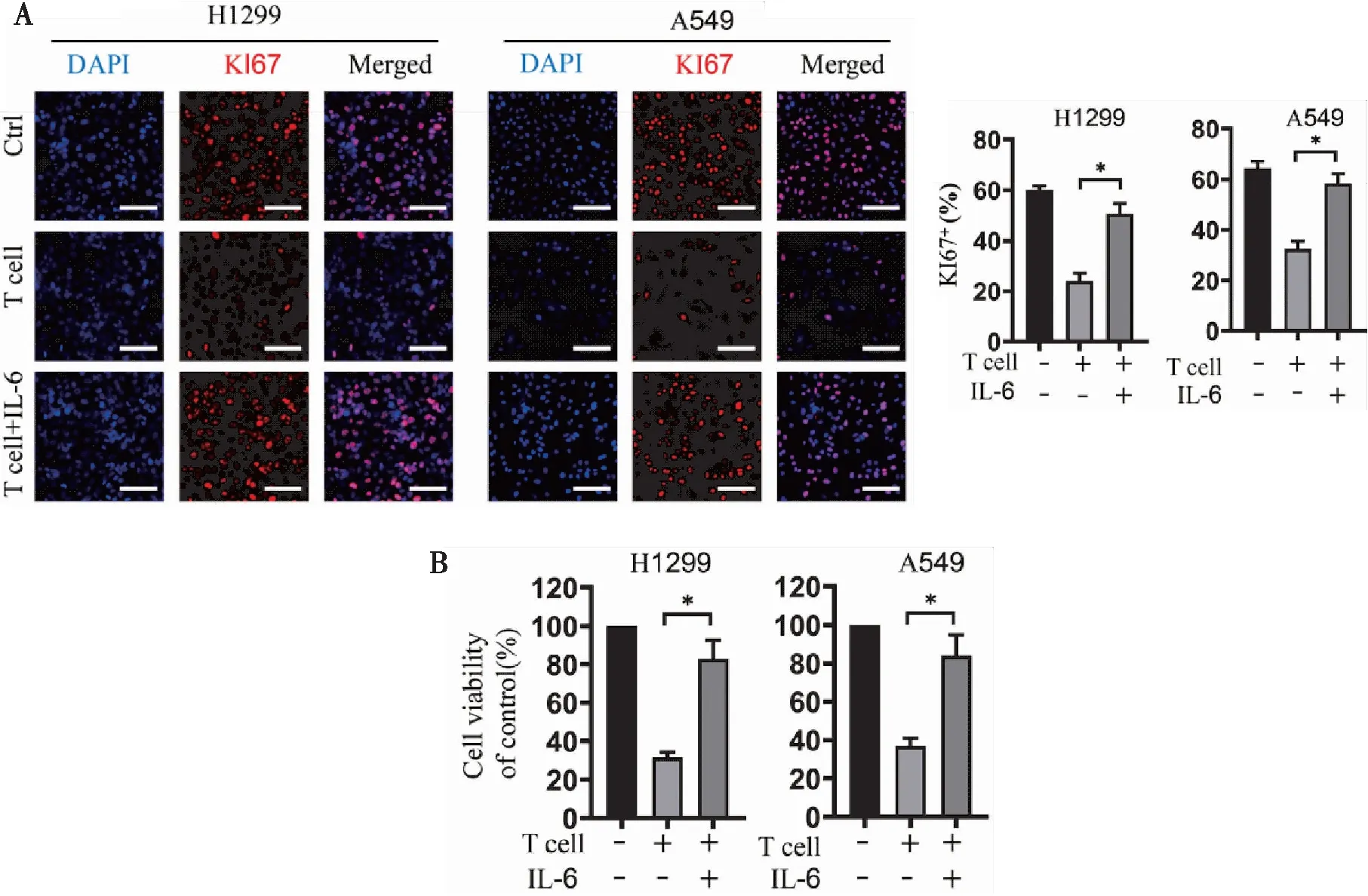
圖2 IL-6抑制T細胞介導的對肺癌細胞的殺傷作用
2.4 IL-6活化STAT3-AKT并抑制STING-TBK1通路
為了初步闡明IL-6影響免疫治療療效的機制,我們采用Western blot檢測了關鍵信號通路的活性。既往研究及我們近期的研究均提示,STING的活化在抗腫瘤免疫治療中起關鍵作用[15,17]。Western blot結果顯示,相較于單獨T細胞處理,外加IL-6處理可顯著上調p-STAT3和p-AKT的表達,同時降低了STING和p-TBK1的水平(圖3)。以上結果提示,IL-6可能通過活化STAT3-AKT通路抑制STING表達并減弱TBK1的活化,進而引起免疫治療抵抗。
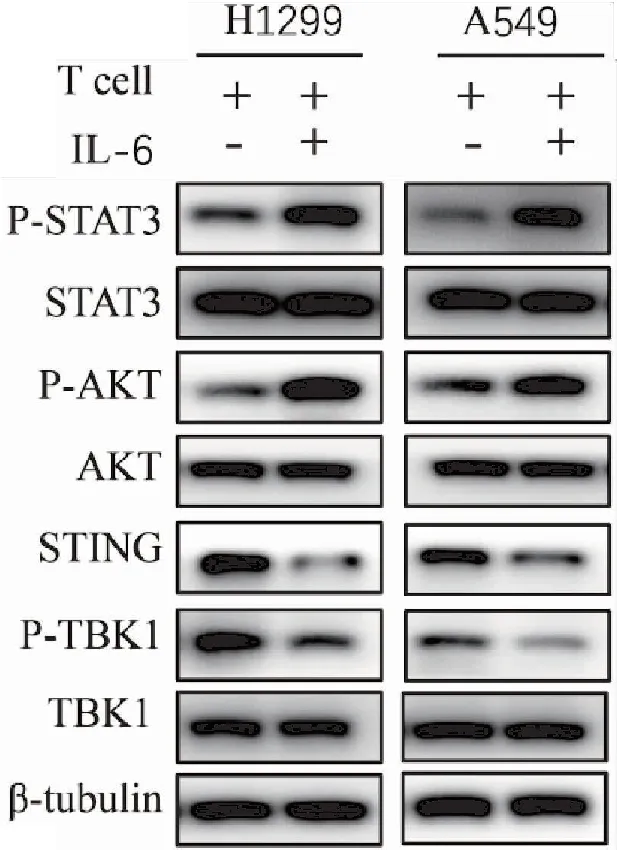
圖3 Western blot檢測IL-6處理對H1299和A549細胞中STAT3/AKT和STING/TBK1通路的影響
3 討 論
本研究發現,接受PD-1抑制劑治療的晚期 NSCLC患者治療前IL-6水平與治療療效相關。IL-6可能通過活化STAT3-AKT通路抑制STING表達并減弱TBK1的活化,進而抑制T細胞介導的腫瘤細胞殺傷作用,導致免疫治療抵抗。
IL-6是一種促炎細胞因子,是癌癥和多種炎癥性疾病的核心參與者[18],已被證實可促進腫瘤細胞增殖和轉移,調控腫瘤的發生、發展[19-21]。研究發現,在接受PD-1抑制劑治療的黑色素瘤患者中,較高的IL-6水平與較短的OS有關[13]。另有研究表明在NSCLC接受PD-1抑劑制治療過程中,IL-6水平下降與PFS較長有關[22]。本研究發現,接受PD-1抑制劑治療的NSCLC患者治療前低IL-6水平與臨床獲益相關,與既往研究同樣表明IL-6的水平可能作為NSCLC患者免疫治療的療效預測因子。目前,預測肺癌免疫治療療效的生物標志物主要是PD-L1表達和TMB[23]。但是PD-L1表達和TMB需要對腫瘤組織進行檢測,存在異質性且標本不易獲得[24],而外周血IL-6檢測方便易行,在預測免疫治療療效方面有潛在的臨床應用價值。本研究TMB、PD-L1表達的檢測病例少,未能進一步深入進行IL-6與TMB一致性檢驗,需要擴大樣本量來驗證PD-1抑制劑治療療效與PD-L1的關系,以及進一步探索IL-6預測PD-1抑制劑治療療效與PD-L1預測療效的效能是否具有一致性。
IL-6導致免疫治療抵抗的可能機制主要有, IL-6增加樹狀突細胞的凋亡,從而減少CD8+和CD4+T細胞激活和分化[25];另IL-6活化JAK/STAT3通路促進腫瘤增殖和細胞代謝[26]。既往研究發現STAT3的活化可抑制STING,而STING的活化對抗腫瘤免疫治療起關鍵作用[27-28]。近期我們同樣發現STING的活化是免疫治療當中很重要的一個關鍵分子[15]。本研究中,我們發現IL-6可能通過活化STAT3-AKT通路抑制STING的表達,進而減弱p-TBK1的活化,提示這可能是IL-6引起NSCLC患者PD-1抑制劑治療抵抗的潛在機制。近年來,抗IL-6受體抗體托珠單抗(tocilizumab)[29]和抗IL-6抗體司妥昔單抗(silkuximab)已經在某些腫瘤的治療方面顯示出潛在的臨床獲益[30],但其能否克服IL-6所致的PD-1抑制劑治療抵抗、增強免疫治療療效,有待進一步研究。
本研究有幾個局限性。首先,本研究為回顧性研究,且納入病例數偏少,可能存在選擇偏倚,限制了結果的普遍性;其次,由于病例數限制,本研究僅收集了基線IL-6數據,無動態IL-6水平變化;第三,本研究采集的為外周血IL-6,這與組織IL-6水平可能存在差異,需要進一步的研究來評估兩者關聯。
綜上所述,IL-6可能通過抑制STING-TBK1通路,減弱T細胞介導的腫瘤細胞殺傷作用,進而導致NSCLC患者PD-1抑制劑治療抵抗。本研究的發現為擴大免疫治療獲益人群、增強免疫治療療效提供了參考。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

