三勒漿安全性評價及功能作用研究
莫太剛 樊三虎 鄭有德 陳小紅 孟倫秀 駱學慶 張立實 黃 輝 張定堃
(1 成都三勒漿藥業(yè)集團四川華美制藥有限公司,成都,610045; 2 乳品營養(yǎng)與功能四川省重點實驗室,成都,610023; 3 成都三勒漿藥業(yè)集團-成都中醫(yī)藥大學產(chǎn)學研聯(lián)合實驗室,成都,610045; 4 新控國際健康管理有限公司,成都,610045;5 四川大學華西公共衛(wèi)生學院,成都,610044; 6 成都中醫(yī)藥大學藥學院,成都,611137)
三勒漿源于李肇《唐國史補》“三勒漿……法出波斯,三勒者謂庵摩勒、訶梨勒、毗梨勒”,唐代時從絲綢之路傳入我國,成為當時的宮廷飲品并延續(xù)至今,由使君子科植物訶梨勒(訶子TerminaliachebulaRetz.)和毗梨勒[毛訶子Terminaliabellirica(Gaertn.)Roxb.],與大戟科植物庵摩勒(余甘子PhyllanthusemblicaL.)3種植物果實制作而成[1-2]。“三勒”也稱“三果”,3種藥材被奉為藏藥之王,藏藥經(jīng)典《晶珠本草》和《中國藏藥》《中華人民共和國藥典》中均有收錄[3]。在印度阿育吠陀傳統(tǒng)醫(yī)藥文化中,三果(Triphala)是最著名的常用藥物之一,也是日常食用的果品和咀嚼料[4]。三勒漿牌三勒漿飲品(以下簡稱“三勒漿”)是在此基礎(chǔ)上輔以L-精氨酸、L-天門冬氨酸、蜂蜜等組成的保健食品,其中所含的多酚類成分可清除人體內(nèi)的自由基,從而減輕自由基對人體的損傷,使其具有良好的調(diào)節(jié)免疫及抗疲勞等活性[5-8]。
本研究依據(jù)《食品安全性毒理學評價程序和方法》及《保健食品功能學評價程序和檢驗方法》[9-10],開展口服急性毒性、30 d喂養(yǎng)實驗、埃姆斯(Ames)實驗、小鼠微核實驗、小鼠精子畸形實驗研究[11],以及抗疲勞、免疫調(diào)節(jié)和耐缺氧的功能作用[12-14],為三勒漿作為保健食品的安全性與功效學提供實驗依據(jù)。
1 材料與方法
1.1 材料
1.1.1 動物
1.1.1.1 經(jīng)口急性毒性動物 2周齡,昆明種小鼠(合格證號:川實動管質(zhì)第85號),體質(zhì)量(20±2)g,40只,雌雄各半;6周齡,SD大鼠(合格證號:川實動管質(zhì)第92號),體質(zhì)量(200±20)g,40只,雌雄各半,均由四川省抗菌素工業(yè)研究所提供。
1.1.1.2 30 d喂養(yǎng)實驗動物 6周齡,SD大鼠(合格證號:川實動管質(zhì)第92號),體質(zhì)量90~130 g,80只,雌雄各半,由四川省抗菌素工業(yè)研究所提供。
1.1.1.3 小鼠骨髓細胞微核實驗動物 4周齡,雄性昆明種小鼠(合格證號:川實動管質(zhì)第85號),體質(zhì)量25~30 g,50只。
1.1.1.4 小鼠精子畸形實驗動物 4周齡,雄性昆明種小鼠(合格證號:川實動管質(zhì)第85號),體質(zhì)量25~30 g,雌雄各半,25只。
1.1.1.5 抗疲勞功能評價實驗動物 2周齡,成年雄性昆明小鼠(合格證號:川實動管質(zhì)第98-6號),200只,由原衛(wèi)生部生物制品研究所提供。
1.1.1.6 免疫調(diào)節(jié)功能實驗動物 2周齡,雌性BALB/C小鼠(合格證號:川實動管質(zhì)第64號),體質(zhì)量(20±2)g,250只,雌雄各半,由華西醫(yī)科大學實驗動物中心提供。
1.1.1.7 耐缺氧功能評價實驗動物 2周齡,昆明種小鼠(合格證號:川實動管質(zhì)第67號),體質(zhì)量(20±2)g,160只,由四川省抗菌素工業(yè)研究所提供。
1.1.1.8 飼養(yǎng)環(huán)境及條件 以上清潔級動物均常規(guī)飼養(yǎng)于潔凈動物房(合格證號:川實動管81號),并提供動物全價基礎(chǔ)營養(yǎng)飼料,動物自由攝食和飲水。
1.1.2 樣品 三勒漿樣品由四川華美制藥有限公司提供(批號:9904009)。
1.1.3 試劑與儀器 絲裂霉素C(MMC,中國食品藥品檢定研究院,批號:19980706)、2-胺基芴(2-AF,上海皓鴻生物醫(yī)藥技術(shù)有限公司,批號:19980523),TA97、TA98、TA100、TA102:(美國分子毒理有限公司,批號:19981103)、環(huán)磷酰胺(CP,上海卓因生物醫(yī)學技術(shù)有限公司,批號:19981101)、2,4,7-三硝基-9-芴酮(TNFone,上海皓鴻生物醫(yī)藥技術(shù)有限公司,批號分別為19971208、19980318)、疊氮化鈉(科密歐化學試劑有限公司,批號分別為19980325)、動物肝細胞S-9混合液(無錫欣潤生物科技有限公司,批號:19981106)、乙醚(成都科隆化學試劑廠,批號:19980612)、鈉石灰,凡士林,亞硝酸鈉(成都科隆化學試劑廠,批號分別為19980919、19980821、1998052)、綿羊紅細胞(Sheep Red Blood Cel,SRBC)采自健康綿羊頸靜脈、雞培養(yǎng)紅細胞(Cultured Red Blood Cell,cRBC)采自健康公雞心臟血。希森美康血液分析儀(上海愷梵實業(yè)有限公司,型號:XT-2000i);電子秤(上海大和衡器常廠,型號:ACS-3);切片機(賽默飛公司,美國,型號:HM325)、自動組織包埋機(江蘇常州中威電子儀器廠,型號:BMJ-Ⅲ)、病理組織漂烘儀[普瑞斯星(常州)醫(yī)療器械有限公司,型號:PHY-Ⅲ型];Nikon顯微鏡(上海衡浩儀器有限公司,型號:eclipse80i);酶標分析儀(上海第三分析儀器廠,型號:511)。
1.2 方法
1.2.1 安全性實驗方法
1.2.1.1 急性毒性實驗方法 霍恩法(Horn)小鼠和SD大鼠均按4.64、10.0、21.5 mL/kg系列劑量,給藥1次,灌胃后連續(xù)觀察2周。
1.2.1.2 30 d喂養(yǎng)實驗方法 斷乳SD大鼠,依據(jù)體質(zhì)量按照隨機數(shù)字表法隨機分為4組(下同),每組20只,雌雄各半。低劑量組、中劑量組、高劑量組每日分別按2.5、5.0、10 mL/kg灌胃給三勒漿,共30 d。另設(shè)一空白對照組(劑量為0)。測定實驗期內(nèi)動物的每周飼料給料量和剩余量、體質(zhì)量,計算攝食量、平均增重和食物利用率。實驗結(jié)束后,進行血液學、血清生化及組織病理學的檢查和臟器系數(shù)(器官對體質(zhì)量的相對重量)測定。
1.2.1.3 Ames實驗方法 按《食品安全性毒理學評價程序和方法》以TA97、TA98、TA100和TA102實驗菌株進行加與不加大鼠肝S9的標準平板滲入法。實驗樣品設(shè)5個劑量:12.5、25.0、50、100、200 μL/皿。每次實驗同時設(shè)陰性(蒸餾水100 μL/皿)和陽性對照。不加S9的陽性對照:TA97和TA98用TNFone,TA100用NaN3,TA102用MMC;加S9實驗的陽性對照均用2-AF。每個實驗劑量作3個平行皿,重復實驗2次。
1.2.1.4 小鼠微核實驗方法 昆明種小鼠按體質(zhì)量隨機分為5組,每組10只,雌雄各半。三勒漿2.5 mL/kg組、5.0 mL/kg組和10.0 mL/kg組;陰性對照組蒸餾水灌胃;陽性對照組,給環(huán)磷酰胺40 mg/kg。分別于第0小時和第24小時2次經(jīng)口給藥,第30小時處死小鼠,取胸骨骨髓制片,固定后染色,鏡下觀察1 000個嗜多染紅細胞,記錄帶微核的細胞數(shù)。
1.2.1.5 小鼠精子畸形實驗方法 雄性昆明種小鼠每組5只,共5組。3組三勒漿劑量:2.5、5.0和10.0 mL/kg;陰性對照組,蒸餾水灌胃;陽性對照組,給環(huán)磷酰胺40 mg/kg。灌胃給三勒漿5 d,于首次灌胃后第35天處死動物,取雙側(cè)附睪作精子涂片,固定后染色,鏡下觀察精子形態(tài)。每支動物觀察1 000精子,記錄形態(tài)異常的精子數(shù)。
1.2.2 抗疲勞功能實驗方法 成年雄性昆明種小鼠,按體質(zhì)量隨機分為4組,即蒸餾水對照組和三勒漿2.5 mL/kg組、三勒漿5.0 mL/kg組、三勒漿10.0 mL/kg組(分別相當于推薦人體飲用量的5、10、20倍)。各組均按2%體積每天灌胃,連續(xù)30 d。于末次灌胃30 min后,分別進行負重游泳實驗(小鼠尾部負重5%鐵絲)、血清尿素氮、肝糖原、血乳酸含量測定。
1.2.3 免疫調(diào)節(jié)功能實驗方法
1.2.3.1 動物分組與給藥 雌性小鼠,基礎(chǔ)飼料喂飼3 d后,按體質(zhì)量隨機分為三勒漿5.0 mL/kg組、三勒漿10.0 mL/kg組和三勒漿15.0 mL/kg組(分別相當于廠方推薦的成人日食用量的10、20和30倍及對照組,實驗動物以相應(yīng)劑量的三勒漿灌胃,對照組以蒸餾水灌胃,1次/d,連續(xù)灌胃25 d。
1.2.3.2 遲發(fā)性變態(tài)反應(yīng)(足趾增厚法) 連續(xù)灌胃20 d后,用2%(v/v)SRBC腹腔免疫,每只0.2 mL,免疫4 d后,測量左后足趾部厚度,測定3次取平均值;然后在測量部位皮下注射20%(v/v)SRBC,每只20 μL注射后于24 h測量左后足趾部厚度,測定3次取平均值。計算攻擊前后足趾厚度的差值,以差值表示小鼠的遲發(fā)性變態(tài)反應(yīng)的程度,并進行統(tǒng)計學處理。
1.2.3.3 血清溶血素測定(血凝法) 連續(xù)灌胃20 d,每只小鼠腹腔注射2% SRBC 0.2 mL免疫,繼續(xù)灌胃4 d后,摘除眼球取血于離心管內(nèi),放置1 h,剝離,2 000 r/min,離心半徑16 cm,離心10 min,收集血清,用生理鹽水將血清進行倍比稀釋,每份稀釋14孔,將不同稀釋度的血清置于血凝板中,每孔100 μL,再加入0.5% SRBC懸液100 μL,混勻,置濕盒37 ℃ 3 h,觀察結(jié)果,記錄每孔的凝集程度,按公式計算抗體積數(shù)(抗體積數(shù)=S1+2S2+3S3+……nSn),并進行統(tǒng)計學處理。
1.2.3.4 小鼠腹腔巨噬細胞吞噬雞紅細胞實驗(半體內(nèi)法) 連續(xù)灌胃25 d后,于每鼠腹腔注射20%雞紅細胞懸液1 mL,30 min后,頸椎脫臼處死,將其固定在鼠板上,正中剪開腹壁皮膚,經(jīng)腹腔注入生理鹽水2 mL,轉(zhuǎn)動鼠板1 min,吸出腹腔洗液1 mL,平均滴于2張載玻片上,置濕盒37 ℃ 30 min,取出在生理鹽水中漂洗,晾干,固定,4%吉姆薩染色3 min,蒸餾水漂洗晾干,鏡檢。按公式計算吞噬百分率及吞噬指數(shù),進行統(tǒng)計學處理。
1.2.3.5 自然殺傷細胞活性測定 連續(xù)灌胃25 d后,頸椎脫臼處死動物,取出脾臟,撕碎,過200目篩網(wǎng)后,用漢克平衡鹽溶液洗3次,用完全1640培養(yǎng)液配成5×106個/mL細胞懸液。將各只鼠的細胞懸液取300 μL分置于96孔培養(yǎng)板中,每孔加靶細胞(YAC-1細胞,1×105個/mL)100 μL,同時做靶細胞自然釋放孔(靶細胞100 μL+培養(yǎng)液100 μL)及最大釋放孔(靶細胞100 μL+1% NP-40 100 μL)各3孔,37 ℃ 5% CO2培養(yǎng)4 h,取出1 500 r/min,離心半徑16 cm,離心5 min。將各孔上清液100 μL置于另一培養(yǎng)板中,每孔再加入100 μL基質(zhì)液,10 min后加入1 mol/L HCl 30 μL終止反應(yīng),在490 nm處測定吸光度值,按公式計算自然殺傷細胞活性,并進行統(tǒng)計學處理。
1.2.4 耐缺氧功能實驗方法
1.2.4.1 常壓耐缺氧實驗 小鼠按體質(zhì)量隨機分為5 mL/kg組、10 mL/kg組、15 mL/kg組(相當于人體推薦食用量的10、20、30倍)及對照組。各劑量組每日經(jīng)口灌胃相應(yīng)濃度的三勒漿,對照組灌胃等量蒸餾水,連續(xù)30 d。末次灌胃后1 h,將各組小鼠分別放入盛有15 g鈉石灰的250 mL磨口廣口瓶內(nèi)(每瓶1只),用涂有適量凡士林的瓶塞蓋緊瓶口,立即計時,以呼吸停止為指標,觀察記錄小鼠因缺氧而死亡的時間。
1.2.4.2 急性腦缺血性缺氧實驗 小鼠按體質(zhì)量隨機分為上述4組。各劑量小鼠每日經(jīng)口灌胃相應(yīng)濃度的三勒漿,對照組灌胃等量蒸餾水,連續(xù)30 d。末次灌胃后1 h,各組小鼠在乙醚淺麻醉的情況下自頸部逐只斷頭,立即計時,觀察記錄小鼠斷頭后至張口喘氣停止時間。
1.2.4.3 亞硝酸鈉中毒存活實驗 小鼠按體質(zhì)量隨機分為上述4組。各劑量小鼠每日經(jīng)口灌胃相應(yīng)濃度的三勒漿,對照組灌胃等量蒸餾水,連續(xù)30 d。末次灌胃后1 h,各組小鼠均腹腔注射亞硝酸鈉220 mg/kg立即計時,觀察記錄小鼠死亡的時間。
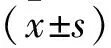
2 結(jié)果
2.1 安全性實驗結(jié)果
2.1.1 口服急性毒性實驗結(jié)果 在整個觀察期內(nèi),無論小鼠或大鼠,各三勒漿組均無動物死亡,三勒漿對小鼠和大鼠的經(jīng)口半數(shù)致死劑量均大于21.5 mL/kg。
2.1.2 30 d喂養(yǎng)實驗結(jié)果 經(jīng)過30 d喂養(yǎng)實驗后,各組動物平均增重和食物利用率測定測定結(jié)果:三勒漿給藥各組平均增重和食物利用率與對照組比較差異均無統(tǒng)計學意義(均P>0.05)。見表1。血液學指標白細胞計數(shù)、紅細胞計數(shù)、血紅蛋白和血小板含量三勒漿給藥各組與對照組比較均差異無統(tǒng)計學意義(均P>0.05)。見表2。血糖、膽固醇、三酰甘油和肝腎功能實驗等所檢測的10項血清生化指標,三勒漿給藥各組測定值與對照組間差異均無統(tǒng)計學意義(均P>0.05)。見表3。臟器系數(shù)結(jié)果:與對照組比較,差異均無統(tǒng)計學意義(均P>0.05)。大體解剖結(jié)果,三勒漿給藥各組動物未見異常。對心、肝、腎、胃、腸等器官的組織病理學鏡檢,三勒漿給藥各組也未見任何具有病理學意義的改變。見表4。

表1 三勒漿灌胃30 d對大鼠平均增重和食物利用率的影響

表2 三勒漿灌胃30 d對大鼠血液學指標的影響

表3 三勒漿灌胃30 d對大鼠血清生化指標的影響

表4 三勒漿灌胃30 d對大鼠臟器系數(shù)的影響
2.1.3 Ames實驗結(jié)果 無論加與不加S9混合液的實驗,陽性對照組皿的平均回變菌落數(shù)(+S9,TA102除外)均大于陰性對照組(劑量0)的2倍;而實驗樣品各劑量組的平均回變菌落數(shù)與陰性對照組相近。見表5。

表5 三勒漿每皿回變菌落數(shù)個/皿)
2.1.4 小鼠骨髓細胞微核實驗結(jié)果 小鼠骨髓細胞微核實驗結(jié)果。陽性對照組的平均微核出現(xiàn)率明顯高于陰性對照組(P<0.01),三勒漿各劑量組的微核率與陰性對照組差異無統(tǒng)計學意義。見表6。

表6 三勒漿小鼠微核實驗結(jié)果
2.1.5 小鼠精子畸形實驗結(jié)果 小鼠精子畸形實驗結(jié)果:陽性對照組的平均精子畸形率明顯高于陰性對照組(P<0.01),而三勒漿各劑量組與陰性對照組比較,差異無統(tǒng)計學意義(P>0.05)。見表7。

表7 三勒漿精子畸形實驗結(jié)果(n=5)
2.2 抗疲勞作用結(jié)果 負重游泳實驗、血清尿素氮、肝糖原與血乳酸含量實驗結(jié)果:對照組小鼠的平均游泳時間僅為(6.70±2.26)min,灌胃三勒漿30 d后,各劑量組均能顯著延長小鼠的負重游泳時間(P<0.01),且三勒漿10.0 mL/kg組效果最優(yōu),平均負重游泳時間接近0.5 h,約為對照組的5倍。血清生化指標表明,服用三勒漿后,各劑量給藥組小鼠血清尿素氮含量顯著低于對照組,肝糖原含量明顯高于對照組,血乳酸含量顯著低于對照組。見表8。

表8 三勒漿對抗疲勞實驗結(jié)果
2.3 免疫調(diào)節(jié)作用結(jié)果 三勒漿對小鼠遲發(fā)性變態(tài)反應(yīng)的影響結(jié)果、對小鼠血清溶血素的影響結(jié)果、對小鼠巨噬細胞吞噬功能的影響結(jié)果、對小鼠自然殺傷細胞活性的影響結(jié)果:在小鼠遲發(fā)變態(tài)反應(yīng)實驗中,與對照組比較,三勒漿10.0 mL/kg組和三勒漿15.0 mL/kg組小鼠的足趾腫脹度差異有統(tǒng)計學意義(P<0.01)。在血清溶血素實驗中,各劑量組與對照組比較,其抗體積數(shù)差異均有統(tǒng)計學意義(均P<0.01)。在小鼠腹腔巨噬細胞吞噬雞紅細胞實驗中,三勒漿10.0 mL/kg組和三勒漿15.0 mL/kg組與對照組比較,其吞噬百分率及吞噬指數(shù)差異均有統(tǒng)計學意義(P<0.01)。在自然殺傷細胞活性實驗中,各劑量組與對照組比較,其自然殺傷細胞活性差異均無統(tǒng)計學意義(均P>0.05)。見表9。

表9 三勒漿對小鼠免疫調(diào)節(jié)的影響
2.4 耐缺氧作用結(jié)果 三勒漿對小鼠常壓耐缺氧時間的影響:給予小鼠三勒漿30 d后,各三勒漿劑量組小鼠的常壓耐缺氧時間均有增加趨勢,但差異無統(tǒng)計學意義。但三勒漿對小鼠急性腦缺血性缺氧時間有明顯影響,3個劑量小鼠的急性腦缺血性缺氧時間與對照組比較均有顯著延長(P<0.05或P<0.01)。見表10。三勒漿對小鼠亞硝酸鈉中毒存活時間的影響結(jié)果:給予三勒漿30 d后,三勒漿10.0 mL/kg組、三勒漿15.0 mL/kg組小鼠的亞硝酸鈉中毒存活時間與對照組比較顯著延長(P<0.05或P<0.01)。見表11。

表10 三勒漿對小鼠耐缺氧時間的影響

表11 三勒漿對小鼠亞硝酸鈉中毒存活時間的影響
3 討論
按照評價依據(jù):三勒漿對小鼠和大鼠的經(jīng)口半數(shù)致死劑量都大于21.5 mL/kg,急性毒性屬實際無毒(級);大鼠30 d喂養(yǎng)實驗的無作用劑量大于10.0 mL/kg;3項遺傳毒性實驗均為陰性結(jié)果;三勒漿具有明顯的抗疲勞作用、具有免疫調(diào)節(jié)和耐缺氧作用[9-10]。
本研究證實了三勒漿具有很好的安全性和確切的抗疲勞、免疫調(diào)節(jié)和耐缺氧作用,這也為傳統(tǒng)經(jīng)典名方三果湯散(Triphala)的現(xiàn)代開發(fā)以及中藥保健食品走向世界提供了科學依據(jù)[15]。基于本實驗研究當時是依據(jù)首次頒布的保健食品毒理學及功能學評價程序,經(jīng)過20余年的科技進步,保健食品注冊法規(guī)體系不斷完善和修訂[16-18]。三勒漿歷經(jīng)30余年的市場檢驗,受眾易疲勞者、免疫力低下者及處于缺氧環(huán)境者,獲得良好口碑。但目前我們對疲勞的分類、疲勞與抗疲勞的機制處于探索階段,近期研究從細胞能量代謝的角度來建立疲勞的細胞模型,以解決快速篩選疲勞組分的方法,為抗疲勞功能保健食品研發(fā)提供新思路[19-20]。鑒于三勒漿中植物成分的復雜性,特別富含多酚類成分,具有廣泛活性的特點,尚需深入研究其特征活性成分與疲勞的相關(guān)性,為抗疲勞作用提供理論支撐。

