氯酸鉀-亞甲基藍體系催化光度法測定 干制水產品中甲醛
◎ 易靈紅,郭峰君,唐秋霞
(北海職業學院,廣西 北海 536000)
水產品中含有豐富的蛋白質、維生素A、維生素D以及鈣、磷、鉀等礦物質元素,備受消費者喜愛,但是水產品中含有一定量的甲醛。水產品中甲醛的來源主要有天然存在、人為添加和環境污染3個方面。水產品中天然存在的甲醛含量一般較低,但人為添加和環境污染會導致水產品的甲醛含量顯著上升,會嚴重影響人們的身體健康,有致癌和致畸作用。一直以來對水產品中甲醛含量的檢測是監管部門日常抽檢的重要內容,備受國內外學者的關注。
測定甲醛的方法較多,但催化動力學光度法具有儀器要求簡單、選擇性好、成本低等優點,是發展非常快速的一種方法。目前,催化動力學光度法一般都使用溴酸鉀作為氧化劑,已有關于溴酸鉀氧化溴甲酚綠[1-3]、二甲酚橙[4-5]、甲基橙[6-10]、酸性鉻藍K[11]、山梨酸[12]、甲基紫[13]、鉻天青S[14]和苯胺藍[15]測定甲醛的報道,未見采用氯酸鉀作氧化劑氧化亞甲基藍褪色測定甲醛的報道。由反應2KBrO3+Cl2=2KClO3+Br2可知,溴酸鉀的氧化性比氯酸鉀強。實驗研究發現,在硫酸介質中,采用氯酸鉀作為氧化劑,空白體系與催化體系的吸光度差值ΔA更大,且反應速度更容易控制。因此本文選用氯酸鉀作氧化劑,利用甲醛對氯酸鉀氧化亞甲基藍褪色的催化作用,建立了催化動力學光度法測定甲醛的方法,該方法可應用于水產品蝦仁干和魷魚干中甲醛的直接測定。
1 材料與方法
1.1 材料與試劑
蝦仁干、魷魚干購自北海市當地超市。
甲醛標準儲備液(1.0 mg·mL-1,廈門海標科技有限公司);甲醛標準工作液(10 μg·mL-1,臨用時由甲醛標準儲備液稀釋而成);亞甲基藍儲備液 (1.00 g·L-1);亞甲基藍工作液(0.05 g·L-1);H2SO4溶液(3.0 mol·L-1);KClO3溶液(0.5 mol·L-1)。
實驗所用試劑除甲醛為標準品外,其余試劑均為分析純。
1.2 儀器與設備
UV-1800PC-DS2型紫外可見分光光度計(上海美譜達儀器有限公司);HWS-12電熱恒溫水浴鍋(上海齊欣科學儀器有限公司);FW100高速萬能粉碎機(天津市泰斯特儀器有限公司)。
1.3 樣品前處理
先將蝦仁干、魷魚干樣品用粉碎機搗碎,混合均勻后稱取10.0 g樣品于圓底燒瓶中,加入30 mL H2O,浸泡30 min后,加入10%的H3PO4溶液10 mL,加幾粒玻璃珠,進行水蒸氣蒸餾,接收瓶置于冰浴中,收集蒸餾液約90 mL,轉入100 mL容量瓶中定容后進行測定。
1.4 實驗方法
在一系列25 mL玻璃具塞比色管中,依次加入 0.05 g·L-1亞甲基藍工作液3.00 mL,3.0 mol·L-1H2SO4溶 液5.00 mL,10 μg·mL-1甲 醛標準 工 作液 一 定量(空白不加),用水稀釋至20 mL,搖勻,再加入 0.5 mol·L-1KClO3溶液4.50 mL,用水定容,充分搖勻。將比色管置于60 ℃恒溫水浴鍋中加熱反應15 min,取出流水冷卻5 min以終止反應。以水為參比,用 1 cm石英比色皿在667 nm處分別測定空白溶液的吸光度A0和含甲醛溶液的吸光度A,并計算ΔA的值(ΔA=A0-A),以ΔA對甲醛濃度制作工作曲線,測定并計算待測樣品中甲醛含量。
2 結果與分析
2.1 吸收光譜
按照1.4實驗方法,配制3種不同反應體系溶液,在光譜掃描界面設置波長為560~800 nm,以水為參比進行吸光度測定,所得吸收光譜曲線如圖1所示。
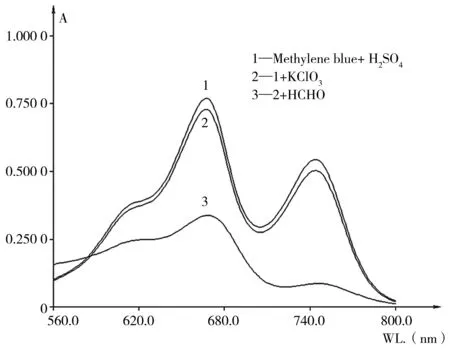
圖1 亞甲基藍吸收光譜圖
在H2SO4介質中,KClO3可以輕微氧化亞甲基藍使其褪色,亞甲基藍在667 nm和744 nm處吸光度均有所降低,但氧化作用不明顯。加入甲醛后,KClO3對亞甲基藍的氧化作用明顯增強,吸光度顯著降低,表明甲醛對KClO3氧化亞甲基藍有顯著的催化作用。由于3種反應體系溶液的最大吸收波長均為667 nm,因此實驗選擇667 nm作為測定波長。
2.2 H2SO4用量
本實驗考察了HCl和H2SO4作酸性介質對反應體系ΔA值的影響。結果表明,在H2SO4介質中,ΔA值較大。因此,選擇H2SO4作為酸性介質。此外,還考察了不同體積的H2SO4溶液用量(1.00~7.00 mL)對ΔA值的影響。結果表明隨著H2SO4用量的增加,空白體系和甲醛催化體系溶液的吸光度均不斷減小,但甲醛催化體系反應較快,ΔA值不斷增加。當加入H2SO4溶液5.00 mL時,ΔA最大,繼續增加H2SO4用量,ΔA變化不大,趨于穩定。因此選擇H2SO4用量為5.00 mL。
2.3 亞甲基藍用量
在反應體系中,亞甲基藍既是吸光物質也是還原劑,亞甲基藍用量的選擇以有較大的ΔA值且反應體系溶液吸光度值在0.2~0.8為依據。本文考察了2.00~4.00 mL亞甲基藍溶液對ΔA值的影響。結果表明,隨著亞甲基藍溶液用量的增加,空白體系和甲醛催化體系溶液的吸光度均不斷增大,且ΔA值不斷增大。當亞甲基藍溶液用量大于3.50 mL時,空白溶液吸光度值大于0.8,偏離朗伯比爾定律。因此,選擇亞甲基藍溶液用量為3.00 mL。
2.4 KClO3用量
本實驗考察了不同體積KClO3溶液(2.50~5.50 mL) 對ΔA值的影響。由于KClO3氧化亞甲基藍溶液褪色,需在甲醛催化條件下才能進行,因此隨著KClO3溶液用量增加,空白體系吸光度值變化不大,但甲醛催化體系吸光度值不斷減小,ΔA值隨著KClO3溶液用量增加而不斷增大。當KClO3溶液用量為4.50 mL 時,ΔA值最大,繼續增加KClO3溶液用量,ΔA值趨于穩定。因此,選擇KClO3溶液用量為4.50 mL。
2.5 反應溫度的影響
溫度對催化動力學光度法的反應速度起重要作用,對溫度的考察應以得到較大的ΔA值且反應易于控制為依據。本文考察了不同反應溫度(40~75 ℃)對ΔA值的影響。結果表明,當溫度從40 ℃增加至 60 ℃時,反應速度不斷加快,ΔA值不斷增加;當溫度為60~65 ℃時,ΔA值達到最大;當溫度高于 65 ℃時,催化體系反應速度趨于穩定,但空白體系反應速度還在繼續增加,ΔA值反而減小。因此,選擇反應溫度為60 ℃。
2.6 反應時間的影響
在催化動力學光度法中,催化劑甲醛的濃度對氧化反應速度有決定作用。甲醛濃度在不同的范圍,所需加熱反應時間不同[16]。本實驗以得到較大ΔA值為依據,考察了甲醛濃度為0.2~1.4 μg·mL-1時,加熱反應時間對ΔA值的影響。結果表明,隨著加熱反應時間的增加,ΔA值不斷增大。當加熱反應時間為15 min時,ΔA值最大,繼續延長加熱反應時間,ΔA值趨于穩定。因此,選擇加熱反應時間為15 min。
2.7 共存物干擾實驗
本文考察了部分有機化合物和常見離子對反應體系中甲醛含量測定的影響。結果表明,當相對誤差在±5%以內,測定1.0 μg·mL-1甲醛標準溶液時,1 000倍的葡萄糖、蔗糖、甲醇、乙醇,500倍的K+、Na+、Ca2+、Mg2+、Zn2+,200倍 的Cu2+、Al3+、NH4+,50倍的Cl-對反應體系甲醛含量的測定均沒有干擾。Fe3+對測定有干擾,測定前應予以分離。
2.8 工作曲線和檢出限
按照1.4實驗方法,移取10 μg·mL-1甲醛標準工作液0 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL、3.00 mL 和3.50 mL,配制成0~1.4 μg·mL-1的甲醛標準溶液,在667 nm處測定溶液的吸光度,以吸光度差值ΔA對甲醛質量濃度繪制工作曲線,如圖2所示。甲醛質量濃度在0~1.4 μg·mL-1時,與ΔA值呈良好的線性關系,線性回歸方程為ΔA=0.294 1c?0.002 5,相關系數R2為0.997 8,表觀摩爾吸光系數為8.9×103L·mol?1·cm?1。 對標準空白溶液測定11次,得到相對標準偏差為1.10%,根據3倍空白溶液測定值的標準偏差與標準曲線斜率的比值計算方法的檢出限(3σ/K),結果為0.11 μg·mL-1。
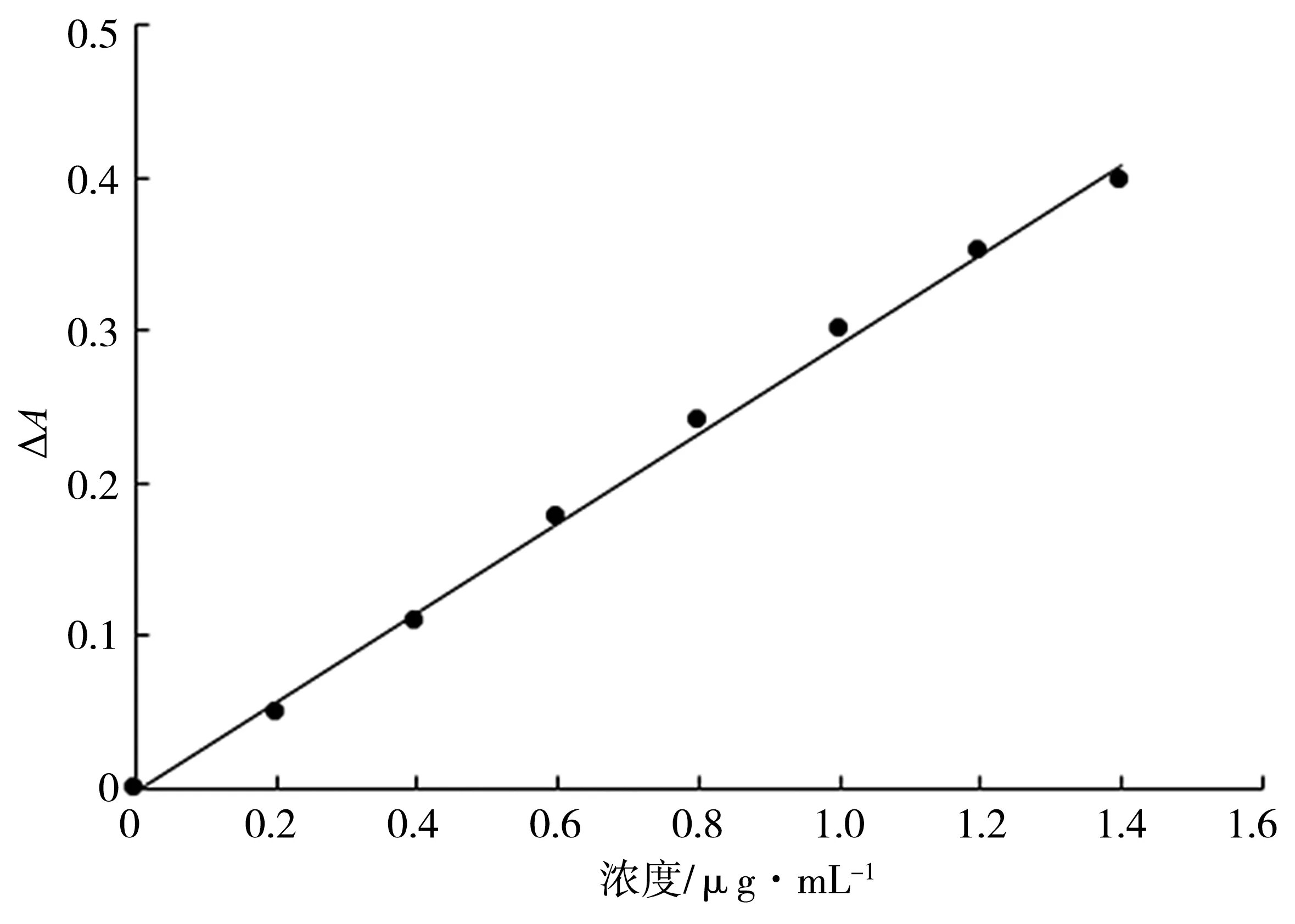
圖2 工作曲線圖
2.9 樣品測定
對樣品蒸餾液進行預測定,根據樣品蒸餾液中甲醛濃度的預測定結果,移取一定體積的樣品溶液,按1.4實驗方法進行測定,求得ΔA值,代入工作曲線,計算出樣品測定液中甲醛的濃度c,再按公式(1)計算待測樣品中甲醛含量。測定結果見表1。
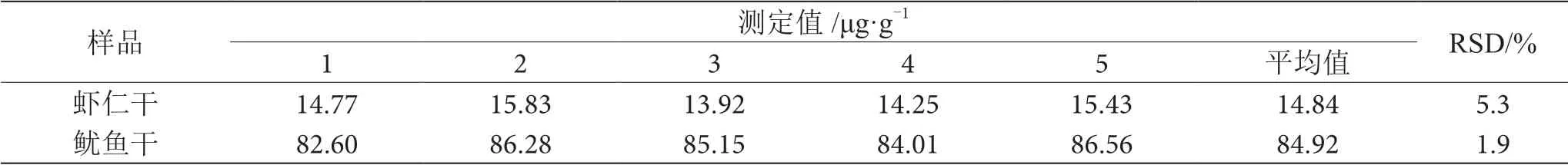
表1 樣品中甲醛含量測定結果表(n=5)
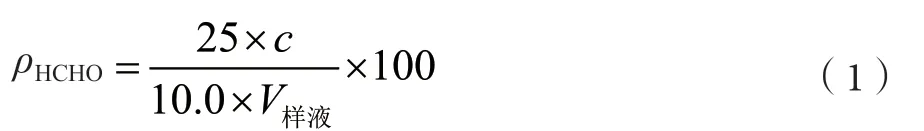
式中:ρHCHO為待測樣品中甲醛含量,μg·g-1;c為 樣品測定液中甲醛的濃度,μg·mL-1;V樣液為移取樣品蒸餾液的體積,mL。
2.10 回收實驗
按1.4實驗方法,在比色管中加入一定量的前處理得到的樣品蒸餾液和甲醛標準工作液,空白不加,進行加標回收實驗,實驗結果見表2。樣品加標回收率在94.90%~101.85%,說明該方法可應用于水產品蝦仁干和魷魚干中甲醛的測定,且結果準確。

表2 加標回收率實驗結果表(n=3)
3 結論
本文建立了一種采用氯酸鉀-亞甲基藍體系催化動力學光度法測定水產品中甲醛的方法,優化后的最佳實驗條件為在25 mL比色管中,加入0.05 g·L-1亞甲基藍工作液3.00 mL,3.0 mol·L-1H2SO4溶液5.00 mL, 0.5 mol·L-1KClO3溶液4.50 mL,反應溫度60 ℃,反應時間15 min。在此實驗條件下,該方法的線性范圍為0~1.4 μg·mL-1,檢出限為0.11 μg·mL-1。該方法儀器要求低、選擇性好、結果準確,是一種成本較低且簡單便捷的測定方法,可應用于水產品蝦仁干和魷魚干中甲醛的測定。

