基于甘油穩定碳同位素的葡萄酒摻糖鑒別研究
◎ 李信萍,張 昂,馬紫朝,楊彥寶
(1.寧夏大學 食品與葡萄酒學院,寧夏 銀川 750021;2.秦皇島海關技術中心,河北 秦皇島 066000;3.甘肅民族師范學院,甘肅 甘南 747000;4.寧夏大學 農學院,寧夏 銀川 750021)
隨著我國葡萄酒市場日漸繁榮,2021年,我國葡萄園面積已達78.3萬hm2,葡萄酒消費量約在10.5億L, 呈快速增長趨勢[1-2]。在經濟利益驅動下,不法生產商在葡萄酒釀造過程中,通過摻廉價糖、摻外源乙醇、摻水等方式欺騙消費者[3]。這些行為侵犯了消費者的權益,同時損害了葡萄酒行業的形象[4]。目前國內外鑒別葡萄酒摻假的方法較多,其中行之有效的當屬利用各種穩定同位素建立的鑒別方法。例如,王廣浩[5]利用EIM-IRMS和SNIF-NMR測定葡萄酒樣品中δ2H值來鑒別葡萄酒中外源糖的添加,發現葡萄酒樣品中乙醇不可交換位點δ2H值可以被用來鑒別摻糖葡萄酒。譚夢茹等[6]采用EA-IRMS對不同種類純正葡萄汁中的糖、有機酸δ13C值進行測定,初步建立了純正葡萄汁中δ13C值的數據庫,根據糖和有機酸δ13C值間的差異鑒別葡萄汁中C4植物糖的摻假。基于此,本文通過制備不同δ13C值分布的外源糖,并將其添加到純正葡萄汁中進行發酵,測定發酵后葡萄酒樣品中甘油δ13C值,建立葡萄酒摻糖鑒別模型,旨在為我國葡萄酒摻糖鑒別的深入研究提供思路,以期促進葡萄酒產業的健康發展。
1 材料與方法
1.1 材料與試劑
蔗糖,選取來自黑龍江、吉林、內蒙古等主要產區的甜菜糖和廣西、福建、廣東等主要產區的蔗糖作為試樣,信息如表1所示;葡萄汁,實驗室現榨葡萄汁;水,實驗室純凈水。
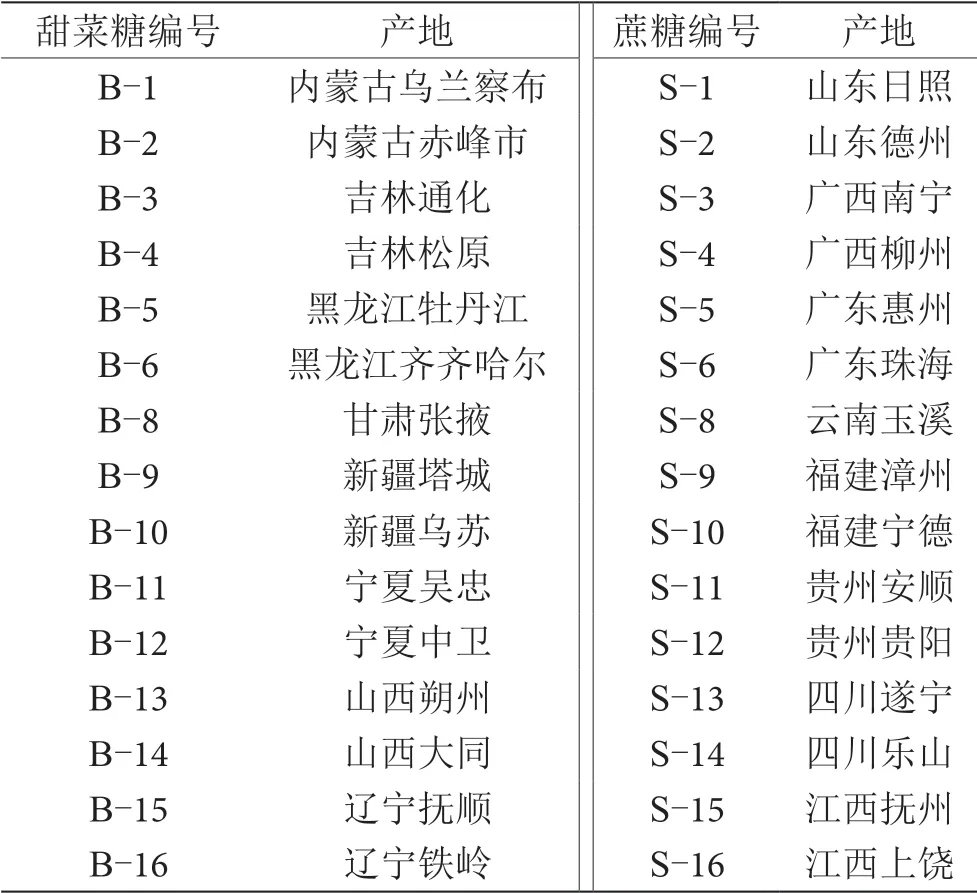
表1 不同穩定碳同位素比值分布的外源糖樣品信息表
甲醇(色譜純),天津永晟精細化工有限公司;4-甲級-2-戊醇(99%),北京百靈威科技有限公司;超純水,Millipore公司的Milli-Q系統制備;淀粉標準物質(δ13C值:-24.55‰),奧地利維也納國際原子能機構,作為碳穩定同位素參照標準;Chromosorb W 吸附劑,Sercon公司。
1.2 儀器與設備
元素分析儀(EA GSL),英國Sercon公司;超純水制備儀(Milli-QG),美國Millipore公司;氣相色譜儀(GC 2023),日本島津公司;恒溫恒濕培養箱(HPP260),德國Memmert公司。
1.3 實驗方法
1.3.1 采用EA-IRMS測定不同δ13C值分布的外源糖
制備外源糖樣品:分別稱取每個編號的蔗糖和甜菜糖樣品10 g置于燒杯中,加入20 mL純凈水,低溫加熱溶解,搖勻后移入容量瓶中對應編號備用。
采用移液器移取制備好的樣品1~3 μL。稱樣時,選用規格為5 mm×8 mm的錫杯,先在錫杯中加少量吸附劑,然后用柱塞式移液器吸取制好的液體樣品2 μL注入錫杯中,用彎曲的鑷子將錫囊置于潔凈平磁板上,并用鑷子輕輕鑷緊錫杯側壁使之閉合;以側面平置錫杯,用一只鑷子壓住其底部,以另一只鑷子的扁平面適當用力刮壓錫杯使之側壁完全閉合成扁平狀;然后將其疊成小圓球狀,并將其壓緊[7]。設定標準物質名稱,輸入標準物質參數,按照已設定檢驗順序,在自動進樣器上擺放好待測外源糖樣品,在計算機軟件控制下,運行檢測批進行測定。測定完畢后,試樣的δ13C值由計算機自動計算給出。δ13C值按公式(1)計算。

式中:X為13C/12C;R樣品和R標準分別為樣品和標準物中的重輕同位素的豐度比。
1.3.2 模擬摻糖葡萄酒樣品發酵
發酵預實驗:在250 mL三角瓶中量取200 mL純正葡萄汁、摻水葡萄汁、摻糖葡萄汁。發酵7.0%(v/v, 下同)、13.0%葡萄酒(接入酵母0.06 g/200 mL),發酵16.0%葡萄酒(另加酵母多糖0.08 g/200 mL),紗布封口,置于恒溫恒濕培養箱發酵。設定發酵條件為溫度28 ℃;濕度60%RH,發酵時間根據發酵酒精度數設定,發酵期間多次對酒樣搖勻并觀察氣泡變化,待氣泡完全消失用滴定法測得葡萄酒樣品中殘糖量小于4 g·L-1時,發酵完全,采用滴定法測得葡萄酒中總糖含量為241.6 g·L-1,按理論上17.5 g的糖可以轉化 1.0%的酒精度,純正葡萄汁可發酵成潛在酒精度為13.8%的葡萄酒。
根據葡萄汁發酵后潛在酒精度13.8%,將純正葡萄汁通過加水稀釋使其能發酵成3.0%、3.5%、4.0%、4.5%、5.0%、6.0%、9.0%、9.5%、10.0%、10.5%、11.0%和12.0%的葡萄汁,通過加糖(與純正葡萄汁δ13C值相同的糖)使其能發酵成12.5%、13.0%、13.5%、14.0%和15.0%的葡萄汁,再將1.3.1制備好的不同δ13C值分布的外源糖摻入以上葡萄汁中,紗布封口,置于恒溫恒濕培養箱中發酵(條件同上),使其發酵成國家標準中要求的最低酒精度7.0%,生活中普遍可見的酒精度為13.0%以及普通酵母耐受的酒精度為16.0%。發酵結束后,采用氣相色譜儀測定葡萄酒樣酒精度(以已知葡萄酒的酒精度為基準)。
1.3.3 采用LC-IRMS測定葡萄酒中甘油δ13C值
將7%vol的葡萄酒樣品用超純水稀釋50倍,13.0%、16.0%的葡萄酒樣品用超純水稀釋100倍,過0.22 μm尼龍濾膜,移至樣品瓶中,供LC-IRMS測定葡萄酒中乙醇和甘油的δ13C值。在測定酒樣之前,先要用蔗糖IAEA-CH6(δ13C值:-10.4‰)碳穩定同位素參考標準對實驗室工作標準(葡萄糖水合物:δ13C值:-26.03‰±0.2‰)進行校準測定,再使用實驗室工作標準對CO2氣體進行標定,每次測定樣品使用CO2標準參考氣體計算δ13C值。將經過前處理的葡萄酒樣品上機測樣,以上步驟均由儀器軟件程序自動控制。
2 結果與分析
2.1 不同穩定碳同位素比值分布的蔗糖和甜菜糖
采用EA-IRMS對不同產區蔗糖和甜菜糖樣品δ13C值進行測定,測定結果如表2所示。每個產區蔗糖和甜菜糖δ13C值都在C3(-34‰~-22‰)和C4(-19‰~-9‰)植物δ13C值之間。從測定結果中選取δ13C值為-12.68‰的蔗糖和-26.68‰的甜菜糖,進行任意質量配比,制備實驗中所需不同δ13C值分布的外源糖。
2.2 不同δ13C值分布的外源糖測定結果表
將表2中δ13C值為-12.68‰的蔗糖和-26.68‰的甜菜糖以任意比例混合均勻,采用EA-IRMS測定δ13C值,結果如表3所示。從表3測定結果中篩選出δ13C值分別為-14.64‰、-16.63‰、-18.67‰、-20.65‰、-22.68‰和-24.64‰的外源糖,將這8種不同δ13C值分布的外源糖添加到純正葡萄汁中進行發酵來模擬摻糖葡萄酒樣品,根據表3測定的結果發現:這些不同δ13C值分布的外源糖基本處于C3(-34‰~-22‰)和C4(-19‰~-9‰)植物的δ13C值范圍內。

表2 不同穩定δ13C值分布的蔗糖和甜菜糖表

表3 不同穩定碳同位素比值分布的外源糖表(n=3)
2.3 發酵后葡萄酒中甘油δ13C值測定
采用LC-IRMS技術測定不同酒精度葡萄酒樣品中甘油δ13C值,結果如表4所示。不同δ13C值分布的外源糖發酵的葡萄酒樣品中甘油穩定碳同位素比值的結果為-33.27‰~-25.37‰。
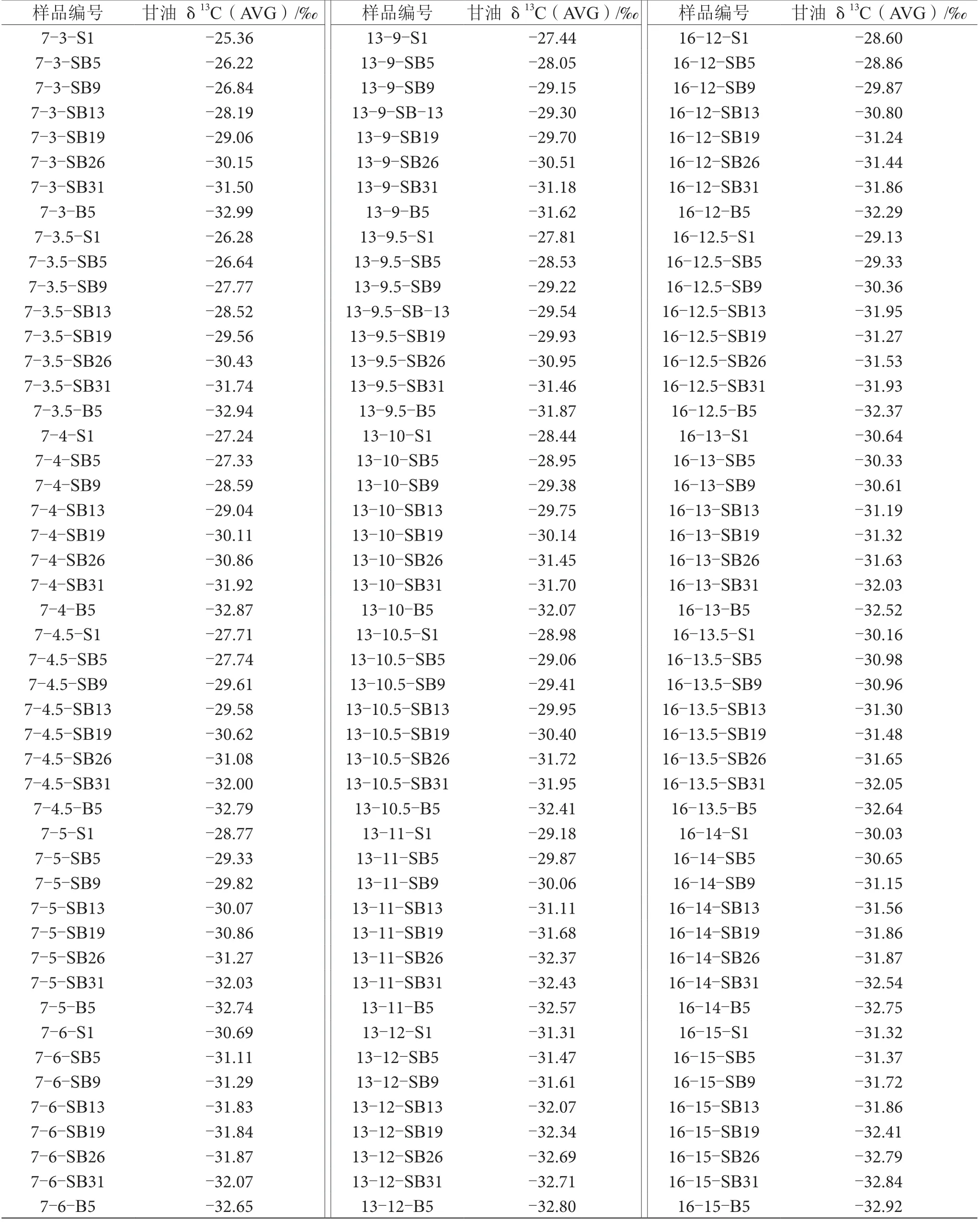
表4 葡萄酒中甘油穩定碳同位素比值測定表
2.4 基于甘油穩定碳同位素的葡萄酒中外源糖鑒別技術
2.4.1 外源糖添加量與葡萄酒中甘油δ13C值的相關性分析對不同外源糖添加量的葡萄酒中甘油穩定碳同位素值測定并進行相關性分析,結果如表5、圖1、圖2所示。對不同穩定碳同位素比值分布的外源糖添加量與葡萄酒中甘油δ13C值數據進行線性判別分析,由圖1可知,摻入與葡萄汁同位素值(δ13C值:-25.17‰) 相比,偏正的外源糖進行發酵后,葡萄酒中甘油δ13C值會明顯偏正,不同外源糖添加量與葡萄酒中甘油δ13C值呈良好正相關關系,擬合方程分別為YS1=0.46X-32.31,R2=0.9 9 4;YSB5=0.4 7X-3 2.8 7,R2=0.9 9 6;YSB9=0.38X-32.87,R2=0.982;YSB13=0.31X-32.73,R2=0.9 7 0;YSB19=0.2 4X-3 2.7 8,R2=0.9 9 2;YSB26=0.15X-32.45,R2=0.989;YSB31=0.09X-32.93,R2=0.999;由圖2可知,摻入與葡萄汁同位素值(δ13C值:-25.17‰)相比,偏負的外源糖進行發酵后葡萄酒中甘油δ13C值會明顯偏負,不同外源糖添加量與葡萄酒中甘油δ13C值呈良好負相關關系,擬合方程為y=0.04x-32.61,R2=0.984。

圖2 偏負外源糖添加量與葡萄酒中甘油穩定碳同位素圖

表5 不同外源糖添加量的葡萄酒中甘油穩定碳同位素測定結果表

圖1 外源糖添加量與葡萄酒中甘油穩定碳同位素圖
2.4.2 葡萄酒中甘油δ13C值顯著性差異分析
葡萄酒作為一種營養成分豐富的低酒精度飲料,在發酵過程中添加非來自葡萄的乙醇、糖、水以增加葡萄酒中乙醇含量,使其滿足葡萄酒國家標準對酒精度的要求。這不僅給合法生產者帶來了經濟損失,同時也使消費者對食品供應鏈及政府監管產生不信任[8]。因此,針對葡萄酒摻假現象,建立葡萄酒真實性的鑒別方法至關重要[9]。
葡萄酒釀造過程中,約8%的糖轉化為甘油,是僅次于水和乙醇的重要副產物,在酒精發酵開始時,參加3-磷酸甘油醛轉化為3-磷酸甘油酸這一反應所需的輔酶Ⅰ(NAD),是通過磷酸二羧丙酮的氧化作用來提供的,甘油伴隨著這一氧化作用產生[10-11]。因此,甘油δ13C值間的差異也可用于鑒別葡萄酒發酵過程中有無外源糖的添加。通過測定對照組和摻糖葡萄酒樣品中甘油δ13C值來鑒別外源糖的摻入。對照組中葡萄酒中甘油δ13C值為-32.78‰,與摻糖葡萄酒樣品中甘油δ13C值進行SD分析,當SD>0.100時,認為兩個樣品存在顯著性差異,可以檢出葡萄汁在發酵過程中添加了外源糖,分析結果如表6~13所示。
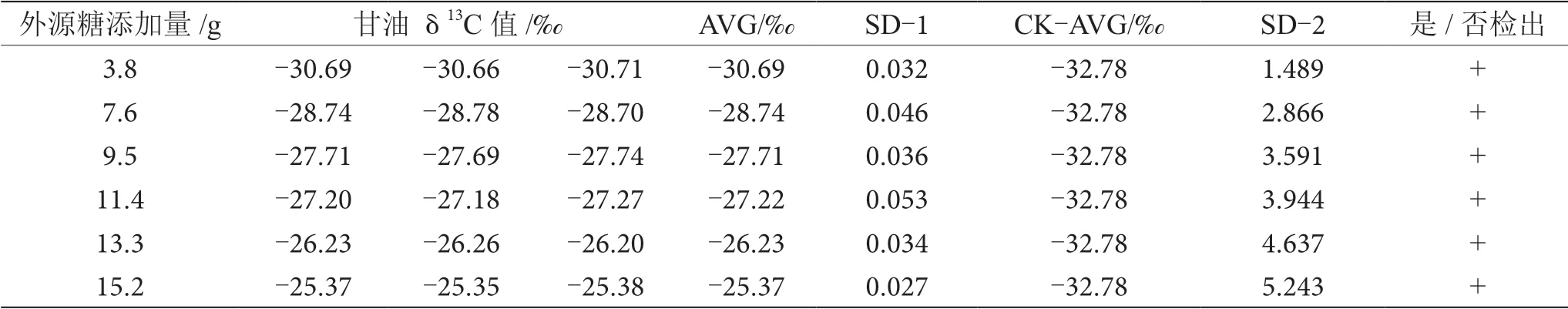
表6 摻δ13C值為-12.68‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表
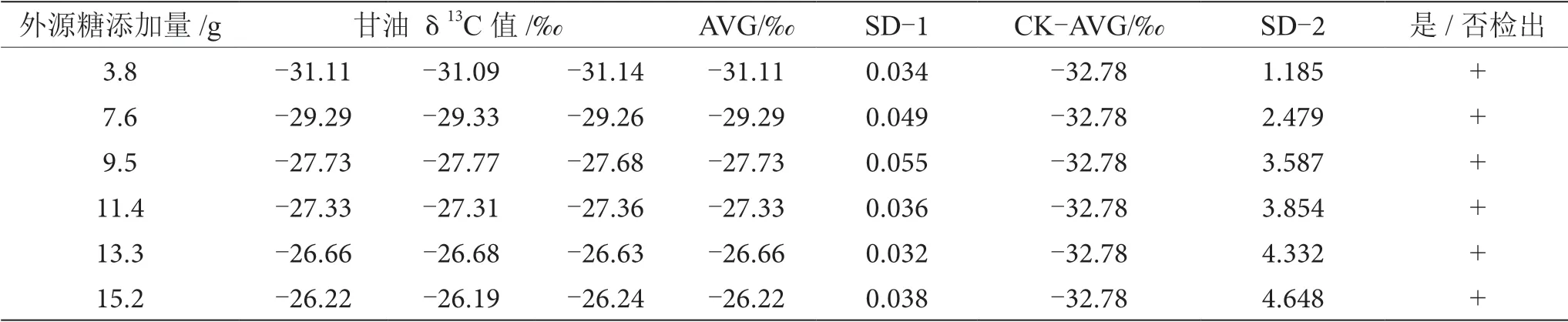
表7 摻δ13C值為-14.64‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表

表8 摻δ13C值為-16.63‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表
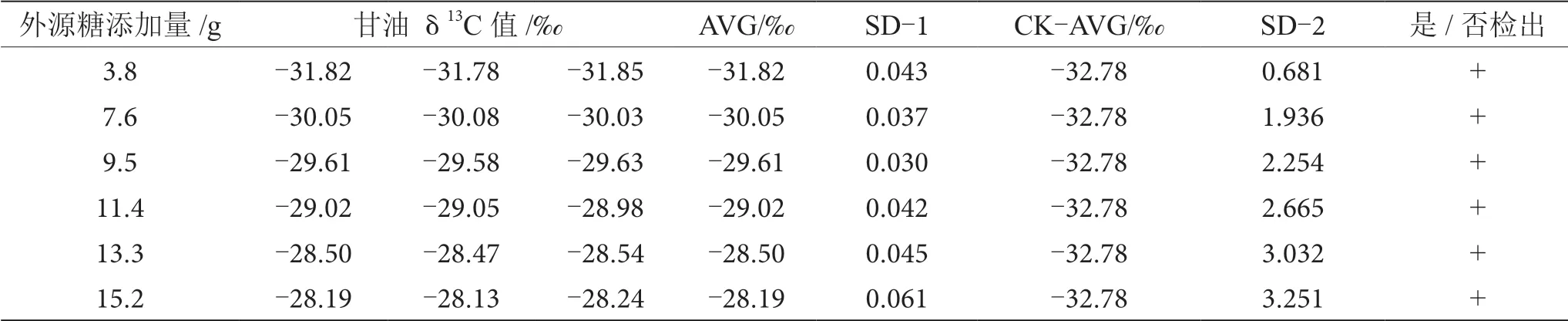
表9 摻δ13C值為-18.67‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表

表10 摻δ13C值為-20.65‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表

表11 摻δ13C值為-22.68‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表
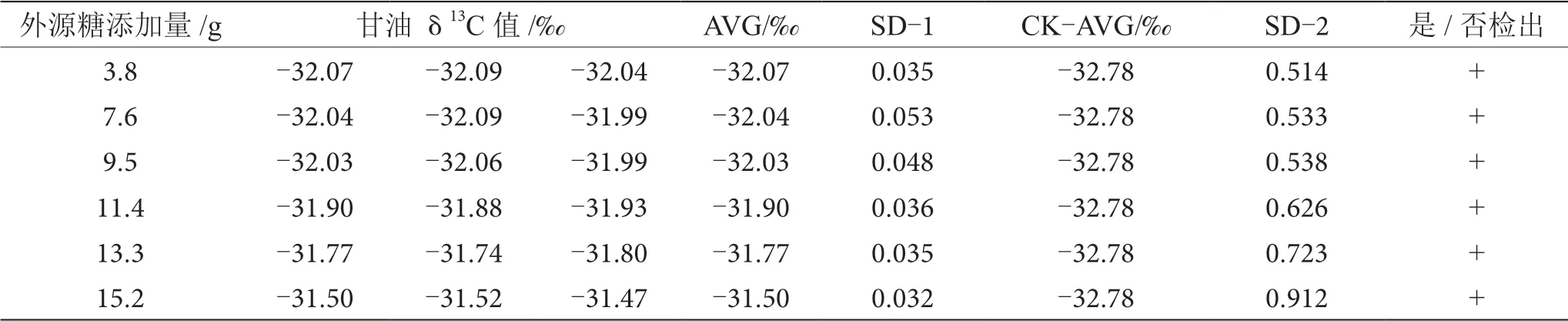
表12 摻δ13C值為-24.64‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表
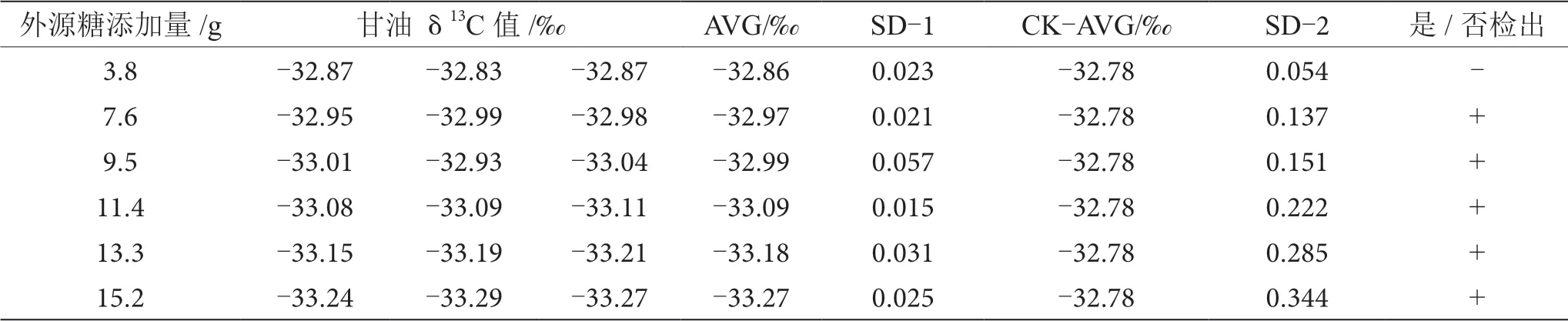
表13 摻δ13C值為-26.68‰的外源糖葡萄酒中甘油δ13C值顯著性差異分析表
由表6~13可知,在200 mL的葡萄酒樣品中,摻入δ13C值為-12.68‰、-14.64‰、-16.63‰、-18.67‰、 -20.65‰、-22.68‰和-24.64‰的外源糖,葡萄汁與外源糖δ13C值分別相差12.49‰、10.53‰、8.54‰、6.50‰、4.52‰、2.49‰和0.53‰,酒精度調節1.0%時,SD>0.100,說明當摻入δ13C值為-12.68‰、-14.64‰、 -16.63‰、-18.67‰、-20.65‰、-22.68‰和24.64‰的外源糖時,該預測模型至少能夠檢出酒精度提升1.0%時的添加量;在200 mL的葡萄酒樣品中,當摻入與葡萄汁較相近的δ13C值為-26.68‰的外源糖時,葡萄汁與外源糖δ13C值相差1.53‰,酒精度調節1.0%時,對照組樣品與葡萄酒摻糖樣品中甘油δ13C值相差0.08‰,SD<0.100,不能檢出,酒精度調節2.0%時,對照組樣品與葡萄酒摻糖樣品中甘油δ13C值相差0.19‰,SD>0.100,能檢出,說明該預測模型至少能夠檢出酒精度提升2.0%的添加量。
3 討論
葡萄酒是新鮮葡萄或葡萄汁經發酵后獲得的低酒精度飲料產品,酵母菌可以將葡萄漿果中的糖分解為乙醇、甘油、有機酸等其他副產物,反應過程相當復雜,有許多連續反應和中間產物,且需要一系列酶參與。酒精發酵主要分為糖分子、丙酮酸的分解、甘油發酵。因此,在葡萄汁發酵過程中添加外源糖時,外源糖也會參加以上的生化反應,會產生乙醇、甘油等其他副產物。因此可以根據葡萄汁發酵過程中碳的去向,通過測定發酵產物甘油δ13C值有效鑒別外源糖摻入。
江偉等[12]基于不同植物來源糖發酵后乙醇不同位點D/H含量存在差異的原理,采用SNIF-NMR分析了加糖釀造葡萄酒乙醇分子中同位素的變化。結果表明,當葡萄酒在發酵過程中添加蔗糖和甜菜糖時,乙醇分子(D/H)Ⅰ含量和R值都會發生變化,通過測定乙醇分子中甲基位(D/H)Ⅰ的含量,可判斷葡萄酒在釀造前是否添加了外源糖。相比之下,本課題的研究是基于對照組與摻糖葡萄酒中甘油δ13C值間的SD建立葡萄酒摻糖鑒別模型,且該模型可以鑒別外源糖的添加,并有效鑒別了葡萄酒征求意見稿中酒精度提升2.0%的外源糖添加量。
4 結論
穩定同位素聯用技術與其他化學計量法聯合使用對同位素進行分析,能夠有效降低葡萄酒摻糖判定誤差,提高葡萄酒摻糖的鑒別效率,已成為解決葡萄酒摻糖的強有力手段。本文通過該技術制備了8種不同δ13C值分布的外源糖添加到葡萄汁中進行發酵,獲得了國家標準規定最低酒度7.0%、生活中普遍可見酒度13.0%以及普通酵母耐受酒度16.0%的葡萄酒樣。測定發酵后葡萄酒樣中甘油的δ13C值,與對照組樣品進行差異性分析可得,在200 mL的酒樣中,摻入δ13C值-12.68‰、-14.64‰、-16.63‰、-18.68‰、 -20.68‰、-22.68‰和-24.64‰外源糖的量調節1.0%酒精度時,都能有效檢出外源糖的摻入,且該預測模型外源糖的最小檢出限為3.8 g,摻入δ13C值為-26.68‰的外源糖的量調節1.0%酒精度時,由差異性分析可知SD<0.100,無法鑒別外源糖的摻入,當摻入的量調節2.0%酒精度,能有效檢出外源糖的摻入,且該預測模型外源糖的最小檢出限為7.6 g。針對葡萄酒征求意見稿中提出的發酵過程中允許添加白砂糖作為外源糖提高酒精度的最大添加量不超過產生2.0%酒精,利用本文建立的外源糖鑒別技術可以有效地進行鑒別,這種聯用技術為我國葡萄酒摻糖鑒別的深入研究提供了思路,同時也對實現我國葡萄酒市場的有效監管、促進葡萄酒市場向規范化發展具有極其重要的指導意義。

