糖尿病下肢動脈病變診斷方法的現狀與展望
楊宇祥 史壯志 張 甫 張林杉 朱 艷 李中林
1(湖南師范大學工程與設計學院,長沙 410081)
2(復旦大學附屬中山醫院內分泌科,上海 200032)
3(湖南師范大學第一附屬醫院內分泌科,長沙 410005)
4(湘潭糖尿病醫院,湖南湘潭 411100)
引言
糖尿病(diabetes mellitus,DM)是一種因體內胰島素水平異常引起的慢性代謝性疾病,其原因是胰島素分泌絕對或相對不足,或體內細胞不能有效利用胰島素而導致高血糖[1]。2016年世界衛生組織(World Health Organization,WHO)發布的第一份“全球糖尿病報告”稱,至2014年全球糖尿病患病人數已達4.22 億人,占全球總人口的8.5%[2]。2019年國際糖尿病聯盟(International Diabetes Federation,IDF)發布的全球糖尿病地圖表明:全球有4.63 億糖尿病患者,中國糖尿病患者占其中的四分之一,約為1.298 億,居全球首位[3]。根據IDF 的估計,到2030年全球糖尿病患病人數將增至5.52億,而到2040年將增至6.42 億[4]。糖尿病可引發心、腦、腎、眼、足等多器官并發癥[5],是繼腫瘤和心腦血管疾病之后第3 大威脅人類健康的重大非傳染性疾病[6]。
糖尿病并發癥包括微血管和大血管病變,是導致糖尿病患者致殘、致死的主要原因[7]。在糖尿病所引發的各種并發癥中,糖尿病足是最嚴重且治療費用最多的慢性并發癥,而下肢動脈病變(lowerextremity arterial disease,LEAD)是引發糖尿病足的主要危險因素之一[8-9]。由于該病變早期癥狀隱匿,且缺少有效檢測方法,極易漏診,導致其患病率居高不下。因此,早期診斷成為降低糖尿病下肢動脈病變(DM-LEAD)發病率的關鍵。文中系統回顧現有各種用于DM-LEAD 的診斷方法,對比各自優勢與不足,并根據最新的研究成果展望了未來糖尿病下肢動脈病變診斷方法的發展趨勢及突破路徑。
1 下肢動脈病變概述
下肢動脈病變(LEAD) 是外周血管病變(peripheral vascular disease,PVD)或外周動脈病變(peripheral arterial disease,PAD)[10]的主要形式,是指由于下肢一條或多條動脈部分或完全阻塞引起的一種臨床病變及其導致下肢功能持續衰退或致殘[11]。據文獻報道,2010年全球確診的LEAD 病例為2.02 億[12]。在LEAD 的幾個主要致病危險因素中,糖尿病排第二位,僅次于吸煙[13]。最新文獻表明,全世界糖尿病相關下肢并發癥的人數約有1.31億,占全球人口的1.8%[14]。在糖尿病患者中,LEAD 既是引發糖尿病足的主要危險因素,也是截肢和致死的主要原因之一[15]。2020年IDF 表示,世界上每30 s 就有1 名糖尿病患者因LEAD 而施行截肢手術[16]。
由于當前LEAD 的檢查方法與診斷標準的不同,加上地域、種族、年齡及生活方式的差異,LEAD在全世界不同人群中的患病率報道存在較大差異[13],且隨著年齡的增長LEAD 的患病率會逐年增加[15]。踝肱指數(ankle-brachial index,ABI)是目前被普遍采用的測定指標,一般以ABI≤0.90 作為LEAD 的診斷標準。以此為標準,在1999-2000年美國健康與營養檢查中,美國40 歲以上成年人的LEAD 患病率為4.3%,70 歲以上人群的LEAD 患病率為14.5%[17];而1999-2004年美國國家健康和營養檢查結果則顯示,美國40 歲以上成年人的LEAD患病率為5.9%[18];一項在英國開展的研究顯示,55至74 歲人群的LEAD 患病率為9%[19]。
研究表明,糖尿病患者的LEAD 患病率是非糖尿病患者的2~7 倍[13]。在多個不同國家開展的針對糖尿病患者的LEAD 篩查研究中,LEAD 患病率分別為8.52%[20]、13%[21]、13.98%[22]、14%[23]、18.3%[24]、20%[25]、30.7%[26]、31.6%[27]。一項統計德國6880 例65 歲以上人口的研究發現,糖尿病患者的LEAD 患病率高達26.3%,而在非糖尿病人群中僅為15.3%[28];尼日利亞一項對比研究也表明,糖尿病和非糖尿病人群的LEAD 患病率分別為22.0%和8.0%[29]。另有一項比較研究稱,糖尿病患者的LEAD 患病率介于20%至50%之間,而非糖尿病患者的LEAD 患病率介于10%至26%之間[30]。
我國的糖尿病患者已超1 億人,居全球首位[31]。由北京大學人民醫院紀立農教授發起的糖尿病下肢動脈病變篩查研究項目(China-DiaLEAD)調查結果顯示,我國糖尿病患者LEAD 的總患病率為21.2%[32];國內多中心研究資料顯示我國50 歲以上糖尿病患者并發LEAD 的比例為19.5%,單中心研究顯示60 歲以上糖尿病患者并發LEAD 的比例為35.4%[33]。由此可知我國糖尿病患者罹患LEAD 的人數之眾。
據調查統計,在全世界超過2 億的LEAD 患者中,約三分之二的患者無癥狀[34]。與非糖尿病LEAD 相比,糖尿病合并LEAD 更易發生在肢體末端,早期無癥狀或癥狀不典型的患者比例也更高[35]。糖尿病下肢動脈病變早期癥狀隱匿,且多數合并有糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN),導致病人對疼痛的感覺遲鈍,往往要發展到晚期出現間歇性跛行、靜息痛、潰瘍和壞疽等不可逆性的嚴重后果后才被發現[36],因此糖尿病下肢動脈病變長期保持高發病率、高致殘率和高病死率,以及低診斷率、低治療率和低知曉率[37]。且與非糖尿病LEAD 相比,糖尿病LEAD 的發病年齡更早、病變更廣泛、病情更嚴重、預后更差,截肢率與死亡率更高,但由于早期診斷的缺失,LEAD 仍然被臨床診斷所忽略[15]。
早期診斷是降低糖尿病LEAD 患病率的關鍵。有報告顯示,85%由糖尿病足導致的截肢可通過早期預防而避免[38]。另一項統計分析表明,在無癥狀階段對糖尿病下肢動脈病變進行治療是非常有益的,特別是在減輕不同級別血管動脈粥樣硬化的常見風險因素方面,具有長期的醫療成本效益[16]。早期診斷一方面可以判別病變的發生及其進程,便于確定相應干預,從而延緩甚至避免下肢動脈病變的發生,進而控制糖尿病足的發生發展,降低截肢率;另一方面針對陽性結果可對癥治療,并有助于減少發生心腦血管疾病如冠心病、腦卒中的危險,降低病死率[39]。
如圖1 所示,目前診斷下肢動脈病變的常規方法大致可以分為三大類型:(1)主觀評測法,以足部脈搏觸診、量表分級法與皮膚溫度檢查為代表;(2)影像學檢測法,包括有創的數字減影血管造影(digital subtraction angiography,DSA)、CT 血管造影(computed tomography angiography,CTA),無創的彩色多普勒超聲(color doppler ultrasound,CDU)、磁共振血管造影(magnetic resonance angiography,MRA),以及新興的激光多普勒微循環血流檢測技術(laser doppler flowmetry,LDF)、激光散斑微循環血流成像技術(laser speckle contrast imaging,LSCI)等;(3)生理參數檢測法,以經皮氧分壓(transcutaneous oxygen pressure,TcPO2)、分段血壓測量(segmental limb pressure,SPL)、踝肱指數(ABI)及脈搏波速度(pulse wave velocity,PWV)為代表。
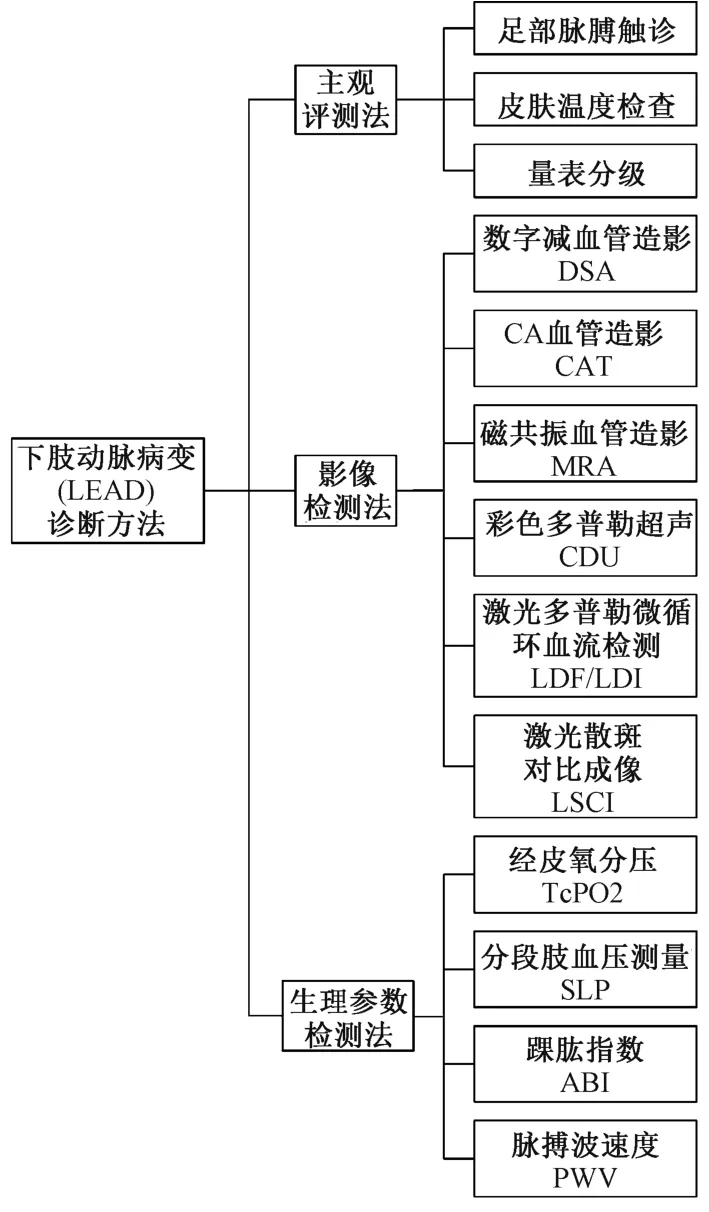
圖1 現有的下肢動脈病變(LEAD)診斷方法分類結構Fig.1 Classification structure of the present diagnostic methods for lower extremity arterial disease (LEAD)
2 主觀評測法
2.1 足部脈搏觸診法
足部脈搏觸診(足底遠端、脛后動脈、腘動脈和股動脈)是一種簡單廉價的臨床檢查,也方便用于患者自助監測。美國糖尿病協會(American Diabetes Association, ADA)建議針對所有糖尿病患者應首先且系統地應用脈搏觸診,作為LEAD 的初步篩查[40]。有研究顯示,脈搏異常與足部缺血癥狀有顯著的相關性[41]。但因存在假陽性,脈搏觸診也備受質疑,因為即使沒有血管疾病,足背脈搏也可能消失[11];此外它還依賴于醫生的經驗和檢查條件[42]。
2.2 皮膚溫度檢查法
皮膚溫度變化是皮膚灌注、環境溫度、組織炎癥反應等多方面因素共同作用的結果,與LEAD 的發生和發展有一定相關性。自我檢測或臨床初檢,可采用簡單的手觸法皮溫檢查,即通過檢查者以同一只手背接觸雙下肢同水平面對應部位,判斷兩側有無明顯溫度差別。目前,主流方法是使用紅外線皮溫測量儀測試皮溫,無需接觸患者皮膚。不同研究對皮溫差陽性的界值定義有較大差別。柴萌等[43]以差別1℃以上判定為皮溫減低,與DSA 相比,患肢皮溫測定的準確度為87.2%,敏感度為87.9%,特異度為83.3%。李虎山等[44]以彩色多普勒超聲檢查為標準,采用皮溫檢查判斷下肢血管狹窄情況,得到皮溫差界值最佳臨界點為6.35 ℃,此時皮溫測量的靈敏度為72%,特異度為60%,準確度為66%。可見不同皮溫差界值的診斷效果差異較大。此外,該方法測量的是小范圍的皮溫,可能會遺漏皮溫異常區域。目前,皮溫測量并未被ADA和國際糖尿病足工作組(International Working Group on the Diabetic Foot,IWGDF)及《中國2 型糖尿病防治指南》[45]推薦[46]。
2.3 量表分級法
LEAD 的臨床表現可以根據傳統的Fontaine 或Rutherford 分類進行評估[47],此兩種分類多強調間歇性跛行和靜息痛等癥狀表現,而2017年歐洲心臟病學會(European Society of Cardiology, ESC)發布的《外周動脈疾病診斷與治療指南》[48]則進一步強調了“隱匿性LEAD”(masked LEAD)的概念,開始重視針對大多數無典型癥狀患者的診斷[49]。鑒于糖尿病患者接受慢性肢體缺血治療的比例不斷增加,美國血管外科學會(American Society for Vascular Surgery, SVS)根據影響截肢風險的3 個主要因素:創傷、缺血和足部感染,提出了一種新的傷口/缺血/足部感染(wound/ischemia/foot infection,WIfI)分類系統,目的是為下肢受威脅的患者提供準確的風險分層,協助臨床管理[50]。WIfI 分類可能會在未來的LEAD 臨床評估中獲得普及,但它主要針對下肢已經出現明顯缺血損傷癥狀的情況,并不適合用于LEAD 的更早期診斷。
3 影像檢測法
3.1 數字減影血管造影
數字減影血管造影(DSA)通過計算機技術與血管造影技術相結合,動態觀察對比劑在血管中通過的全過程,可清晰顯示下肢血管的狹窄、栓塞所在的部位,異常斑塊的位置、大小、形態,并且對于側支細小血管具有較高的分辨能力,因此對LEAD的檢測更加直觀,被認為是診斷LEAD 的“金標準”[12]。但是DSA 存在若干局限性:(1)DSA 屬于侵入性檢測,需要對患者實施穿刺及插管,并注入一定劑量的造影劑[51],因此有損傷患者腎臟功能的風險,并且在造影時容易引起血管壁損傷,使得血栓形成的風險性升高[52];檢查費用昂貴,從而在基層醫院中受到一定限制[48,52];(2) 由于糖尿病LEAD 主要涉及膝關節腘動脈以下部位血管,其走向復雜,形狀細長,注入造影劑后,造成遠端目標血管的顯影效果差,因此操作時間較長,并伴有創傷和造影劑增強的足部疼痛,以及增加了患不良并發癥的風險[53]。因此DSA 不能作為診斷LEAD 的首選方法,而是作為診斷困難時的備選方案[39]。
3.2 CT 血管造影
CT 血管造影(CTA)屬于微創血管檢查方法,其優勢在于:僅需從肘靜脈注射對比造影劑,安全性高,掃描時間短,空間分辨率高,與DSA 類似,可顯示血管化的“路線圖”(即病變部位和嚴重程度,以及上游/下游狀態),提供關于血管狹窄的特征信息,如閉塞病變的位置、數量和長度、鈣化程度和鈣成分的排列、遠端徑流的質量等,在診斷LEAD 中顯示出巨大價值。據報道CTA 的分辨率可達1.5 mm,評估LEAD 的敏感性為91.6%,準確性為73.3%,陽性率為78.5%[54]。CTA 的缺點是:(1)不能提供病變部位的血流動力學數據;(2)血管在明顯鈣化的情況下診斷能力較差;(3)評估側支血管的敏感性僅為62.7%,明顯低于DSA;(4)需要使用靜脈碘造影劑,受試者存在過敏反應的風險;(5)檢測費用較高[55]。
3.3 磁共振血管造影
磁共振血管造影(MRA)是隨著磁共振成像技術的發展應運而生的一種血管檢測手段,它利用造影劑使血管和周圍組織弛豫時間不同的特性成像,可有效減少偽影、噪聲、靜脈顯影的干擾。相比于CDU 和CTA,MRA 不受動脈鈣化的影響,故MRA對于評價糖尿病患者下肢血管的不同程度鈣化有著明顯的優勢,且對膝下血管狹窄程度評估的敏感性要優于CTA[56]。MRA 也有其不足之處:一是由于渦流、邊緣放大效應、膝以下靜脈污染等原因,MRA 有高估病變的風險;二是有較多禁忌癥,如嚴重腎功能不全、體內支架置入、心臟瓣膜置換術的病人不允許行MRA 檢查;三是成本昂貴[57]。
3.4 彩色多普勒超聲
彩色多普勒超聲(CDU)屬于非侵入性檢查,可清晰顯示下肢動脈壁及管腔內的變化,通過檢查血管內-中膜厚度(IMT)能夠較早提供動脈管壁硬化的形態學信息,反映動脈結構的早期改變[58]。有研究表明,CDU 診斷LEAD 的敏感性和特異性分別為98%和100%,陽性預測值達94.6%,陰性預測值為97.8%,總體準確率高達96%[59],因此CDU 在LEAD 的診斷中扮演著重要角色,。然而CDU 對LEAD 的診斷也有一定的自身缺陷:一是對某些特殊的受檢者,如肥胖、肢體壞疽等,血管全貌的觀察較動脈造影效果差;二是操作者自身技術水平及經驗對結果會產生影響,如探頭壓力、聲束與血流夾角、彩色增益的調節等;三是CDU 在評估下肢血管狹窄情況時,股動脈至腘動脈之間的血管管腔內徑較大,其狹窄率可用管腔縮小的面積來計算,而小腿以下血管如脛前動脈的血管直徑小,同時內膜不規則增厚及斑塊形成引起管腔不平整,用管腔縮小來評估狹窄或閉塞的情況,結果有爭議性。這時需借助彩色多普勒血流成像(color Doppler flow imaging,CDFI)來觀察血管腔內血液流動情況有無充盈和缺損才能判斷狹窄情況[59]。總的來說,CDU和CDFI 技術是目前最常用的診斷大血管狹窄或閉塞等結構性病變的手段,但并不擅長診斷LEAD 更早期的微血管病變及其引發的肌肉缺血、營養不良等功能性病變。
3.5 激光多普勒微循環血流檢測
激光多普勒血流儀(LDF)及其衍生的激光多普勒血流成像儀(laser doppler flowmetry imaging,LDFI)是一種無創微循環血流檢測系統,已成為微循環血流測量的常用方法。其根據多普勒頻移效應原理,通過激光照射,檢測經微血管內運動的血細胞反射光的頻移,測定血流速度及血流量等微循環參數[60]。通過多點的線性掃描探頭,可以獲得二維組織表面的微循環血流灌注圖(LDFI)[61]。目前主要用于皮膚及表面粘膜下微循環血流監測。在臨床上,已成熟用于燒傷診治,用于燒傷深度評判、皮瓣移植術及術后監測,預后評估等,也已用于糖尿病足潰瘍和小腿靜脈潰瘍、褥瘡、瘢痕進程等存在皮膚微循環障礙病癥的診斷和動態監測等[62-63]。已有研究應用LDF 技術評估LEAD 對微循環的影響。劉亮等[64]利用LDFI 測定老年下肢動脈局部組織微循環血流灌注量,通過對比ABI 指標,該研究發現,LDFI 所代表的微循環指標比ABI 等傳統評價指標更能反映下肢動脈硬化閉塞程度。LDF 操作簡便、靈敏、實時、快速無創,且檢測成本低廉,無需使用造影劑或同位素追蹤,但其不足在于不能直接評價各級動脈病變,目前也還不能直接檢測組織微循環血流灌注的絕對血流值,也難以檢測皮下深層組織的血流灌注狀態[65],且易受運動偽影和皮膚或環境溫度變化影響[66]。LDFI 這種非接觸測量技術可以掃描較大面積的微循環血流圖,較LDF 可更全面反映組織血流分布,查找壞死區域或灌注不足區域,目前與LDF 一樣,LDFI 也無法實現深層組織血流灌注的檢測,測量深度約為1 ~1.5 mm[67]。雖然該技術應用潛力很大,但目前尚未廣泛應用于臨床,也未形成相關檢測標準,特別對于下肢動脈硬化閉塞患者的肢體灌注評估尚未能形成統一的共識[63]。
3.6 激光散斑對比成像
激光散斑對比成像(LSCI) 是一種利用相干激光與紅細胞相互作用形成散斑圖樣,散斑信息與運動的血細胞相關,通過計算模型,形成二維的動態微循環血流分布圖[68],可測量血管密度、血流速度、血液灌注量等指標[69]。多項研究表明,LSCI 可用于糖尿病足潰瘍、糖尿病腦血管病變及微循環改變的早期評估。Katsui 等[70]利用LSCI 技術評價足背近端和遠端因加熱引起的微循環灌注波動,認為LSIC 技術對足部嚴重缺血均有診斷價值;Mennes等[71]對33 名糖尿病足潰瘍患者進行LSCI 檢測,發現LSCI 是評估糖尿病足部潰瘍患者微循環狀態的一種穩定和可重復性的技術,在非缺血性、缺血性和危重缺血性患者群體中顯示出顯著差異。作為一種大視場血流成像技術,LSCI 具有較高的時空分辨率、無需造影劑、可實時快速非接觸成像等優點,且檢測成本低廉,具有長期、動態監測微循環血流動力學狀態[72]和微循環障礙[73]的能力,且比LDF具有更好的重復性[69],被認為是記錄再灌注和血管形成過程的理想設備[74]。LSCI 技術的不足之處在于:(1)測量深度較LDF 更淺,約為300 μm,且對運動偽影敏感[66];(2)測量結果非定量,而是以光通量強度表示,并以空間、時間或時空散斑對比度的相對單位進行轉換,以形成研究區域的灌注圖像[68,73];(3)測量結果為相對流速,難以測量絕對流量[72]。
4 生理參數檢測法
4.1 經皮氧分壓測定法
經皮氧分壓(TcPO2)測定是一種測量組織微循環內氧分壓的非侵入性方法,其原理是通過對局部皮膚加熱,促進皮下微循環內氧分子析出,然后經氧電極檢測氧分子量,然后換算為組織氧分壓。該技術在臨床上用于檢測下肢皮膚的經皮氧分壓變化,用于LEAD 診斷。對下肢或足部連接氧分壓電極,可用于估計動脈血管可被誘導形成的最大舒張程度,預測足部缺血性潰瘍發生及愈合情況,可根據血管灌注情況決定是否行下肢血運重建治療。正常人足背TcPO2>40 mmHg;當TcPO2<30 mmHg時,提示下肢血運差,潰瘍發生機會大,潰瘍愈合的可能性很小;當TcPO2≤20 mmHg 時,潰瘍愈合無望,截肢風險很大[75]。TcPO2 測定對于評估嚴重肢體缺血最有幫助,但是由于皮膚氧供遠遠高于氧耗,TcPO2 對輕中度LEAD 相對不敏感,說明TcPO2測定并不擅長對LEAD 的早期診斷[76]。最近的文獻也證明,在LEAD 的診斷檢測中,TcPO2 的結果與ABI 不一致,二者不能互換[77]。此外,TcPO2 檢查需要較為先進的設備,檢測費用較昂貴。
4.2 分段肢體血壓測量法
分段肢體血壓測量(SLP)是一種通過比較肢體不同點位血壓梯度值直接定位嚴重肢體缺血(critical leg ischemia,CLI)部位、評估LEAD 嚴重程度的檢查方法[78]。該方法使用多普勒儀器或電子脈搏傳感器及血壓袖帶檢測肱動脈及下肢不同點(大腿上部和下部、腓腸肌上部、踝部和跖骨處)的血壓,如果相鄰節段間血壓梯度達20 mmHg 以上則預示明顯血管閉塞[79]。理論上袖帶寬度應該比所取下肢點直徑大20%,窄袖帶可能導致假性高壓現象不能精確定位病變[80]。SLP 可為多水平病變的患者提供信息并預測潰瘍預后、肢體存活或是否需要血運重建[81]。SLP 方法也存在若干局限性:(1)小的血壓梯度導致的單個輕度狹窄可能被漏診;(2)鈣化動脈會導致踝動脈壓假性升高;(3)對于多水平病變的患者,近端血壓降低可能掩蓋遠端梯度改變;(4)短段和長段病變之間或嚴重狹窄動脈和閉塞之間不適宜;(5)大腿動脈血壓減少通常指示主-髂動脈段閉塞,然而股動脈或股淺動脈和股深動脈的閉塞也會出現相似的現象[82]。
4.3 踝肱指數法
踝肱指數(ABI)又稱踝臂指數,是指人體仰臥休息5~10 分鐘后所測的下肢踝部收縮壓與上肢肱動脈收縮壓的比值,它反映了下肢血管硬化或狹窄的程度,具有價格低廉、無創、簡便易行的優點,廣泛用于動脈粥樣硬化和心血管疾病的危險評估[83]。LEAD 患者由于下肢動脈粥樣硬化導致外周動脈狹窄,踝部收縮壓降低,ABI 測量值小于正常值,其降低的程度與病變嚴重程度成比例[84]。ABI 的正常值為1.0~1.3,ABI 介于0.9~1.0 是臨界值,靜息下ABI≤0.9 診斷LEAD 的敏感性為90%,特異性為95%;0.4<ABI<0.9 則視為輕度至中度LEAD,ABI<0.40 則認為存在嚴重LEAD。當ABI>1.3 時,需加測趾臂指數(toe-brachial index,TBI),根據TBI 是否小于0.75 來判定LEAD 等級[85]。目前ADA、IWGDF 及中華醫學會糖尿病學分會的防治指南均推薦將ABI 檢查作為血管病變篩查及診斷標準之一[86]。
目前,大多數患者是通過踝臂指數檢測異常(ABI<0.9)而被確診[87]。通過同步測量四肢血壓,不僅能簡便地獲得ABI,還可以得到臂間血壓差異(inter-arm blood pressure difference,IAD)及踝間血壓差異( inter-ankle blood pressure difference,IAND)[88]。
然而,ABI 也存在若干局限性:(1)易出現假陰性:由于糖尿病下肢動脈多有內膜廣泛鈣化形成,限制了動脈內側層的可壓縮性,即使是中度主動脈狹窄或廣泛側支血管病變的患者中,鈣化的血管不能被膨脹的袖帶膨脹壓縮,ABI 值易出現假性升高,可能導致LEAD 篩查檢測的漏診[89],據統計由于內膜鈣化而出現的假陰性率高達35%[90]。(2)靈敏度和特異度變化范圍較大,診斷價值難以確定[91]:國內學者對ABI 預測LEAD 的價值做了對比研究,發現其靈敏度變化較大,分別為20.8%,25.49%,62.9%,91.18%到100%[92]。(3)無法提前預測病變,也不能精確定位病變部位:當檢測的ABI 值為陽性時,受試者實際上已經發生了較嚴重的動脈病變,也不能對病變部位進行精確定位[59]。據報道,在糖尿病患者中,ABI 用于LEAD 篩查的表現尤其不一致[93],美國預防服務工作組最新的建議也強調了缺乏證據支持ABI 用于篩查無癥狀成年人的LEAD 風險[94]。
4.4 脈搏波速度法
早期的研究認為,糖尿病LEAD 屬于大血管病變,其主要成因是動脈粥樣硬化(atherosclerosis,AS),因此檢測動脈硬度逐漸成為診斷LEAD 的重要方法。AS 目前比較明確的發生機制是糖基化終末產物(AGEs)生成增多、氧化應激、炎癥因子生成增多及脂代謝異常[11,95]。與非糖尿病患者相比,糖尿病患者會更早地發生動脈硬化,引起管腔壓力和切應力增加,產生內皮功能障礙,刺激動脈壁膠原過度生成和沉積,形成脂肪沉積或斑塊,促進AS 的形成[96]。研究表明,動脈硬度增加反映了AS 的狀態[97]。
脈搏波速度(PWV)是目前應用最廣泛的動脈硬度測量方法,它是指心臟泵血后引起的動脈搏動從心臟傳到目標動脈的速度,以兩個脈搏檢出點之間的距離除以兩點之間的傳播時間差來獲得,是經典的大動脈病變無創檢測指標[96]。PWV 的快慢能夠反應血管壁的結構狀況,當PWV 較慢的時候,反應動脈血管的僵硬度較低,血管壁的順應性好;當PWV 過快時,表明動脈血管的僵硬程度較高,血管壁的順應性變差。有研究發現,PWV 能夠發現早期動脈硬化,可作為大規模篩查亞臨床AS 或心血管疾病高危人群的有用工具[98]。在糖尿病患者中,PWV 被證明比踝肱指數(ABI)更可靠[42]。
目前最常用的PWV 參數是頸-股動脈脈搏波速度(carotid-femoral PWV,cfPWV)以及肱-踝動脈脈搏波速度(brachial-ankle PWV,baPWV),其中cfPWV 反映主動脈硬度,baPWV 反映大中動脈的硬度。cfPWV 被歐洲高血壓和心臟病學會以及美國心臟協會作為評估動脈硬化的金標準,但是cfPWV測量時需要患者暴露腹股溝部位,而且對操作人員的技術水平要求非常高[48]。baPWV 的最大優點是測量方法比cfPWV 更簡單,可重復性好[99]。日本高血壓治療指南建議將baPWV 的測量納入亞臨床靶器官損害的評估[100]。最近一項研究表明,baPWV 與頸動脈斑塊形成的風險獨立相關[96],證明其在AS 早期診斷中的應用潛力。
然而,PWV 檢測法用于糖尿病LEAD 的早期診斷還遠未成熟,主要缺陷表現在:(1)PWV 受年齡、動脈僵硬度、血壓、心率變異性和糖尿病病程等若干因素的影響,LEAD 不是唯一改變PWV 的因素,因此PWV 在評估下肢動脈硬化程度變化時可信性降低,在臨床和實驗室研究中觀察到了相互矛盾的結果[101-102];(2)baPWV 或cfPWV 作為一種大血管動脈的宏觀評價指標,本質上反映的是較長一段動脈的平均彈性特性,無法反映各個動脈局段的病變特點[103]。
上述各類LEAD 診斷方法的優缺點比較如表1所示。
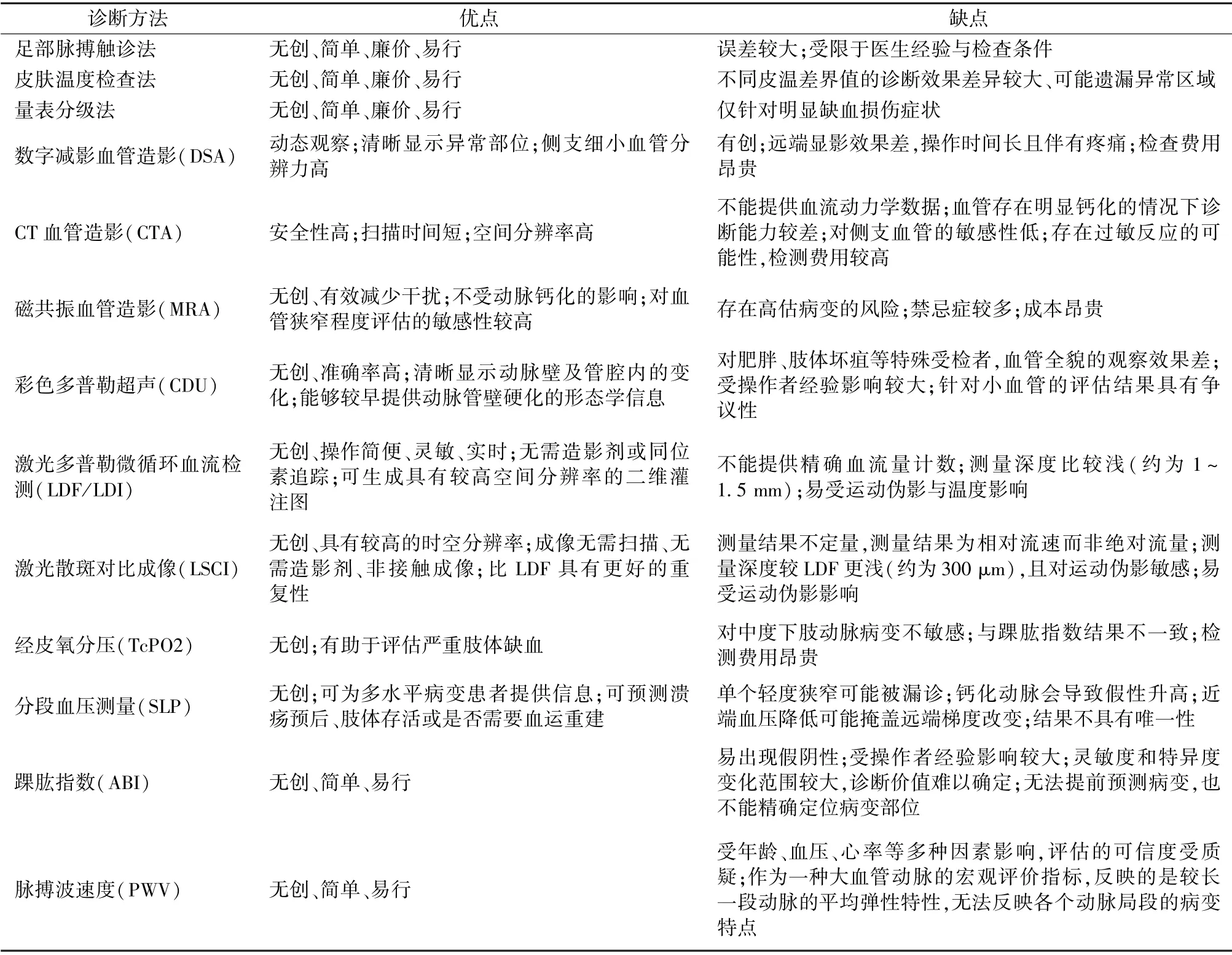
表1 下肢動脈病變(LEAD)診斷方法比較Tab.1 Comparison of diagnostic methods for lower extremity arterial disease (LEAD)
5 展望
綜上所述,目前LEAD 檢測及診斷方法尚無最佳方法,其早期診斷更是期待較好的解決方案。最新研究表明, 就血管病變而言, 微血管病變(microvascular disease,MVD)是引發LEAD 的最初期、更關鍵、且易忽視的源頭性因素,微血管病變及其引發的微循環障礙的長期累積,與引發大血管病變,特別是促使下肢動脈病變,有互為因果、交替影響的相互作用,對糖尿病足的發生發展具有關鍵性推動作用,這刷新了人們將LEAD 簡單歸類為大血管病變的認知。有研究表明,糖尿病患者下肢血管病變多源于且集中于中小動脈血管,而大血管受累較少,且程度較輕;而非糖尿病患者下肢血管病變情況與糖尿病患者相反,多源于且集中于大血管,小血管受累較少,且程度較輕[104-105]。Netivel 等[42]研究發現,大血管病變更多地與近端疾病有關,如心肌梗死、腦中風等;而MVD 則更多地與遠端疾病相關,如LEAD、下肢潰瘍或截肢等,可作為LEAD的獨立危險因素。Mohammedi 等[106]證實MVD 在LEAD 的發病機制中的扮演了更重要的角色,微循環障礙是誘發中小動脈病變的基礎;而在其另一項研究中[107],通過對10 624 名2 型糖尿病患者的跟蹤對比證實,MVD 對糖尿病患者的LEAD 有很強的預測作用,而大血管病變反而沒有預測能力。Beckman 等[108]通過對125 674 名退伍軍人長達11年的跟蹤研究表明,MVD 的存在會單獨增加截肢的風險,并協同增加罹患LEAD 的風險。Beckman等[109]隨后指出,微血管密度降低可作為腿部功能疾病的一種獨立風險因素,因此與動脈硬化相比,小腿肌肉微血管密度降低能更好地預測LEAD。陸冰等[110]也發現,糖尿病肌病是MVD 的主要表現。
糖尿病肌病在臨床上被認為是一種缺血性肌病,缺血與Beckman 認為的微血管密度降低相吻合,好發于下肢肌肉群,特別是小腿腓腸肌,臨床癥狀主要表現為肌無力、肌疼痛和肌肉萎縮,但因其癥狀不典型,又常與糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)的癥狀相似或相伴行而易被忽略。值得注意的是,DPN 已被證實與動脈內膜鈣化密切相關[111],Edmonds 等[112]研究發現,DPN 可以引起頸動脈形成鈣化和斑塊,這恰好可以解釋DPN 伴有糖尿病下肢動脈硬化的特點,由于DPN 時常伴有骨量的減少及血管平滑肌細胞的鈣化,從而導致下肢動脈鈣化的形成;楊光燃等[113]通過實驗發現,DPN 與LEAD 呈正相關。上述研究結果表明,采用DPN 與LEAD 聯合篩查對糖尿病患者的LEAD 早期診斷具有重要幫助。此外,Gotschy等[114]通過動物實驗證明,早期動脈粥樣硬化引起的動脈硬化在大血管路徑上分布不均,利用局部PWV 檢測來評估動脈硬度的異質性,比宏觀PWV檢測更敏感地識別早期動脈病變。
綜上所述,未來發展針對微血管病變及局部動脈PWV 的檢測技術,是糖尿病LEAD 早期診斷的突破口,有望實現對糖尿病這種隱匿性LEAD 的早期診斷,從而突破現有診斷方法的瓶頸。
研究顯示,新確診的糖尿病患者大多就已經存在慢性并發癥[6],但我國針對糖尿病患者的并發癥篩查率普遍偏低,其中LEAD 長期保持高發病率、高致殘率和高病死率,以及低診斷率、低治療率和低知曉率。早期診斷是降低糖尿病LEAD 患病率的關鍵,因此研究準確有效、安全快捷的LEAD 早期診斷方法已成為一項涉及數億糖尿病患者生存質量和生命安危的重大需求,可從根本上改善數以億計的糖尿病患者的生活質量,社會效益深遠。

