基于深度學(xué)習(xí)的肺炎圖像目標(biāo)檢測(cè)
何 迪 劉立新 劉玉杰 熊 豐 齊美捷 張周鋒
1(西安電子科技大學(xué)光電工程學(xué)院,西安 710071)
2(中國(guó)科學(xué)院西安精密機(jī)械研究所中國(guó)科學(xué)院光譜成像重點(diǎn)實(shí)驗(yàn)室, 西安 710119)
引言
肺炎是一種可能由細(xì)菌、病毒或真菌等病原體引起的肺部炎癥,在兒童與老人中的致死率極高,也是美國(guó)十大死亡原因之一[1]。2019年底新冠肺炎的出現(xiàn)以及隨后的全球爆發(fā)更是給人民生命安全和身體健康帶來(lái)了巨大威脅[2],因此肺炎的診斷和治療也日益受到人們的關(guān)注與重視。
肺部X 光片是肺炎診斷的重要方法之一。肺炎在X 光圖像上通常表現(xiàn)為肺部不透明度增加,然而肺部的其他疾病,如肺水腫、胸腔積液等,在X 光圖像上同樣呈現(xiàn)出不透明的區(qū)域,會(huì)對(duì)肺炎診斷造成干擾。所以,正確解釋影像信息始終是醫(yī)生面臨的主要挑戰(zhàn),需要有經(jīng)驗(yàn)的放射科醫(yī)生才能進(jìn)行診斷確認(rèn)。對(duì)于缺乏經(jīng)驗(yàn)的醫(yī)生,其決定存在相當(dāng)大的主觀不一致,還需要通過(guò)血液檢測(cè)、細(xì)菌分析等復(fù)雜檢測(cè)流程才能夠精確判定。在中國(guó),每年病理醫(yī)生人數(shù)的增長(zhǎng)速率僅為4%,專業(yè)放射科醫(yī)生增長(zhǎng)率更低。但是隨著近些年醫(yī)療數(shù)據(jù)的爆發(fā)式增長(zhǎng),專業(yè)放射科醫(yī)生的數(shù)量供不應(yīng)求,導(dǎo)致在診斷環(huán)節(jié)會(huì)造成病人診斷不及時(shí),誤診、漏診等問(wèn)題,耽誤患者治療的最佳時(shí)間。因此迫切需要研究并開(kāi)發(fā)新方法,幫助提供計(jì)算機(jī)輔助診斷,以提高肺炎診斷的準(zhǔn)確率并降低肺炎相關(guān)的死亡率。
深度學(xué)習(xí)[3]能夠模仿人腦的機(jī)制來(lái)解釋數(shù)據(jù),且在數(shù)據(jù)量龐大的情況下,可以有效解決傳統(tǒng)機(jī)器學(xué)習(xí)中算法準(zhǔn)確率低以及模型泛化能力差等問(wèn)題,因此在醫(yī)學(xué)圖像處理中得到了廣泛應(yīng)用。卷積神經(jīng)網(wǎng)絡(luò)(convolutional neural networks, CNNs)是深度學(xué)習(xí)中最為重要的模型之一,在肺炎圖像分類以及目標(biāo)檢測(cè)方面顯現(xiàn)出優(yōu)越的性能[4-8]。馬書(shū)浩等[6]提出了一種基于YOLOv3 改進(jìn)的多分枝YOLO 肺炎檢測(cè)算法。該算法在實(shí)驗(yàn)數(shù)據(jù)集上的檢測(cè)準(zhǔn)確率高于單發(fā)多框探測(cè)器(single shot multibox detector,SSD)、YOLOv3 及更快速區(qū)域卷積神經(jīng)網(wǎng)絡(luò)(faster region-based convolutional neural network, faster-RCNN)等算法,但還存在誤檢、漏檢、定位偏差大的問(wèn)題。Nurmaini 等[7]提出了具有Faster-RCNN 結(jié)構(gòu)的卷積神經(jīng)網(wǎng)絡(luò)來(lái)檢測(cè)新冠病毒(SARS-CoV-2)感染病灶,解決逆轉(zhuǎn)錄聚合酶鏈反應(yīng)檢測(cè)結(jié)果假陰性率高的問(wèn)題,提高了檢測(cè)靈敏度。Dharani 等[8]利用faster-RCNN 模型來(lái)輔助臨床醫(yī)生診斷肺炎,將樣本中不清楚或可能與其他疾病混淆的肺部X 光圖像進(jìn)行識(shí)別,以實(shí)現(xiàn)更好的診斷和降低錯(cuò)誤率;結(jié)果表明,faster-RCNN_inception_coco 模型相較于其他模型具有更高的預(yù)測(cè)精度,有助于分析和診斷肺炎。
本研究首先將SSD 和faster-RCNN 這兩種典型目標(biāo)檢測(cè)算法用于肺炎病灶區(qū)域檢測(cè);然后在原有faster-RCNN 的網(wǎng)絡(luò)結(jié)構(gòu)基礎(chǔ)上引入特征金子塔網(wǎng)絡(luò)(feature pyramid network, FPN),對(duì)faster-RCNN網(wǎng)絡(luò)模型進(jìn)行優(yōu)化,來(lái)更好地解決不同類型病灶區(qū)域識(shí)別的問(wèn)題。
1 材料與方法
1.1 實(shí)驗(yàn)環(huán)境與肺炎圖像數(shù)據(jù)集
實(shí)驗(yàn)中所使用硬件設(shè)備與軟件環(huán)境具體配置如表1 所示。硬件設(shè)備主要為Dell T3630 圖形工作站,其中處理器型號(hào)為i7-8700,它包含6 個(gè)內(nèi)核和12 個(gè)邏輯處理器,運(yùn)行內(nèi)存大小為32 GB;顯卡型號(hào)為RTX 2080。軟件環(huán)境主要為: 操作系統(tǒng)Windows10、 Anaconda 環(huán)境、谷歌開(kāi)源的Tensorflow[9-10]、Python 版本、顯卡驅(qū)動(dòng)庫(kù)CUDA 以及GPU 加速庫(kù)Cudnn。
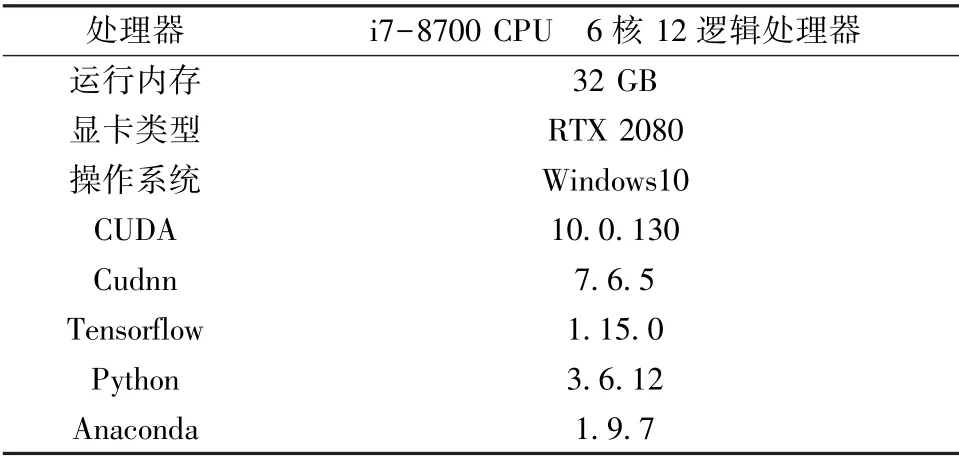
表1 實(shí)驗(yàn)環(huán)境配置Tab.1 Description of experimental environment
實(shí)驗(yàn)數(shù)據(jù)集由Kaggle 提供,來(lái)源于北美放射協(xié)會(huì)及醫(yī)療人工智能(artificial intelligence,AI)平臺(tái)合作開(kāi)發(fā)的26 684 張帶標(biāo)簽肺部X 光圖像,具體包括8 539 張患有肺炎的X 光圖像、10 407 張患有其他病癥的肺部X 光圖像,7 738 張正常肺部X 光圖像。圖1 所示為從數(shù)據(jù)集中隨機(jī)選取的肺部X 光圖像的例子,圖1(a)為沒(méi)有肺部疾病的正常X 光圖像,標(biāo)記為Normal;圖1(b)中的兩張X 光圖像患有肺部疾病,但是不屬于肺炎,標(biāo)記為No Lung;圖1(c)中的兩張X 光圖像來(lái)自肺炎患者,左圖具有單處病灶,右圖具有兩處病灶,標(biāo)記為L(zhǎng)ung。
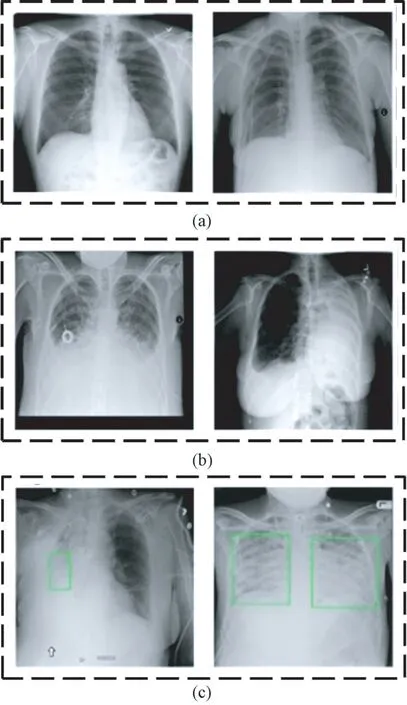
圖1 肺部X 光圖像。(a)正常肺部圖像;(b)肺部其他病癥圖像;(c)肺炎圖像Fig.1 Lung X-ray images. (a) Normal lung images;(b) Other lung disease images; (c) Pneumonia images
1.2 數(shù)據(jù)預(yù)處理
圖2 所示為基于深度學(xué)習(xí)的肺炎圖像目標(biāo)檢測(cè)數(shù)據(jù)處理流程,其中圖像預(yù)處理[[11]是圖像輸入模型訓(xùn)練前必不可少的一環(huán)。來(lái)自Kaggle 數(shù)據(jù)集的原始X 光圖像首先經(jīng)過(guò)圖像預(yù)處理操作,包括圖像縮放變換、線性變換以及對(duì)比度增強(qiáng)等步驟,轉(zhuǎn)換為具有合適尺寸和高對(duì)比度的圖像,然后輸入深度學(xué)習(xí)模型進(jìn)行分類及目標(biāo)檢測(cè)。圖2 中展示了原始X 光圖像依次經(jīng)過(guò)各步預(yù)處理后所對(duì)應(yīng)的輸出效果。
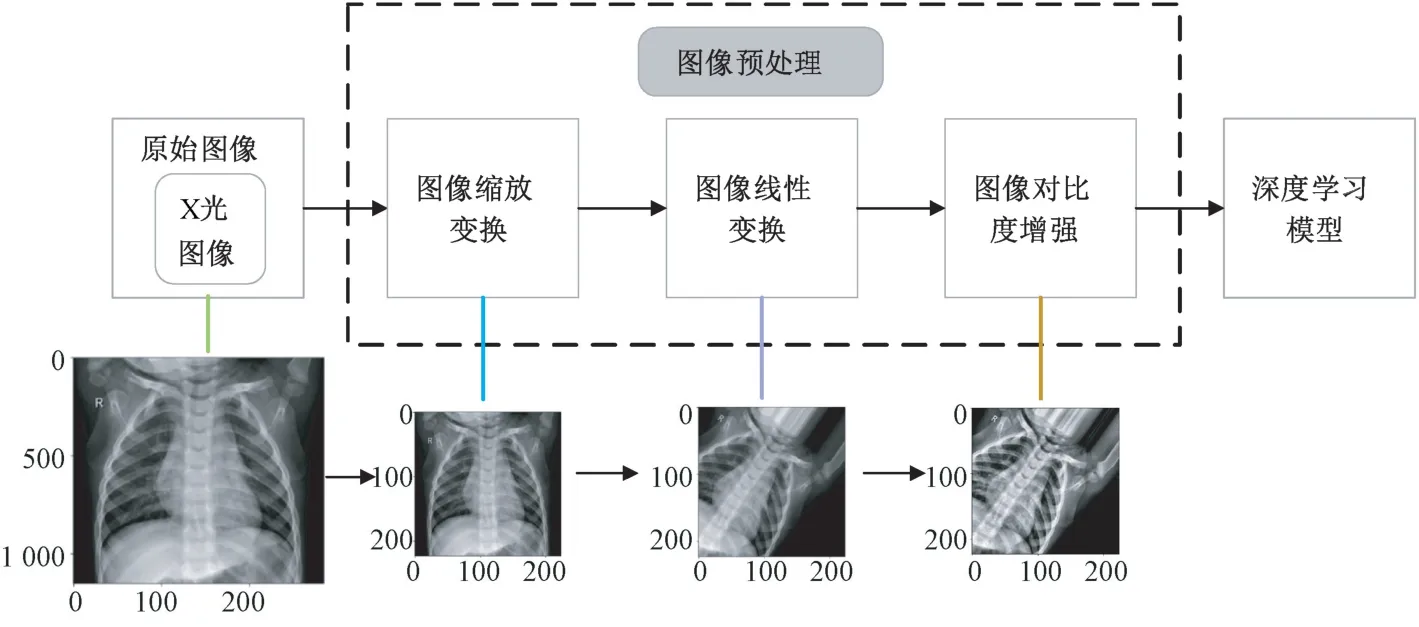
圖2 數(shù)據(jù)處理流程Fig.2 Flow chart of data processing
1)圖像縮放變換
肺部X 光圖像的分辨率在不同的數(shù)據(jù)集中大小并不統(tǒng)一。利用雙線性插值算法[12],對(duì)原始X 光圖像進(jìn)行縮放變換,以滿足深度學(xué)習(xí)模型中對(duì)于輸入圖像分辨率的要求。經(jīng)過(guò)處理后的圖像整體尺寸相對(duì)縮小,但保留了圖像的主要特征,同時(shí)縮短了模型的訓(xùn)練時(shí)間。所要使用的VGG 和ResNet 網(wǎng)絡(luò)要求的圖片輸入尺寸為224×224,因此原始X 光圖像經(jīng)過(guò)調(diào)整之后的尺寸均變成224×224。
2)圖像線性變換
圖像的線性變換操作通常包括平移和旋轉(zhuǎn)。旋轉(zhuǎn)是指將圖像以原點(diǎn)為中心軸旋轉(zhuǎn)若干角度。平移則是將圖像的所有像素沿X、Y 方向移動(dòng)若干距離。肺部X 光圖像經(jīng)過(guò)旋轉(zhuǎn)和平移操作后,可以增強(qiáng)深度學(xué)習(xí)模型對(duì)肺部圖像位置與方向的敏感程度。為了更好地實(shí)現(xiàn)數(shù)據(jù)增強(qiáng)效果,可通過(guò)設(shè)定隨機(jī)種子的方式對(duì)輸入的X 光圖像進(jìn)行旋轉(zhuǎn)和平移操作。
3)圖像對(duì)比度增強(qiáng)
圖像對(duì)比度增強(qiáng)[13-14]可以實(shí)現(xiàn)對(duì)肺炎病灶區(qū)域的特征增強(qiáng),提高模型對(duì)肺炎圖像的識(shí)別能力和檢測(cè)精度。采用限制對(duì)比度自適應(yīng)直方圖均衡(contrast limited adaptive histogram equalization,CLAHE)算法對(duì)經(jīng)圖像線性變換后的肺部X 光圖像進(jìn)行處理。CLAHE 算法通過(guò)限制局部直方圖的高度來(lái)限制局部對(duì)比度的增強(qiáng)幅度,從而限制噪聲的放大及局部對(duì)比度的過(guò)增強(qiáng),因此它不僅能夠更好地改善圖像對(duì)比度,而且解決了局部特征不夠清晰的問(wèn)題。由圖2 可見(jiàn),經(jīng)對(duì)比度增強(qiáng)處理后的肺部X 光圖像特征更加突出。
1.3 肺炎檢測(cè)卷積神經(jīng)網(wǎng)絡(luò)模型
1.3.1 目標(biāo)檢測(cè)模型
卷積神經(jīng)網(wǎng)絡(luò)廣泛應(yīng)用于醫(yī)學(xué)圖像中的分類或目標(biāo)檢測(cè)等問(wèn)題,在大規(guī)模圖像處理中具有出色的表現(xiàn)。目前目標(biāo)檢測(cè)算法模型主要分為兩種,即one-stage 和two-stage。
如圖3 所示,one-stage 目標(biāo)檢測(cè)算法流程較為簡(jiǎn)單,通過(guò)卷積神經(jīng)網(wǎng)絡(luò)對(duì)輸入的圖像直接進(jìn)行特征提取,而后基于回歸思想實(shí)現(xiàn)結(jié)果輸出。圖4 為two-stage 目標(biāo)檢測(cè)算法的工作原理流程。相對(duì)于圖3 而言,在輸入圖像完成卷積神經(jīng)網(wǎng)絡(luò)網(wǎng)絡(luò)特征提取后,又增加了一部分檢測(cè)流程,并且增加的部分與one-stage 過(guò)程類似,生成感興趣的區(qū)域(region of interest, ROI),其中包含預(yù)測(cè)的位置信息及前景的概率;然后對(duì)生成的感興趣的區(qū)域進(jìn)行進(jìn)一步位置的修正和物體所屬類別的概率值判定,完成最終的檢測(cè)。

圖3 One-stage 目標(biāo)檢測(cè)算法示意Fig.3 Schematic diagram of one-stage object detection algorithm
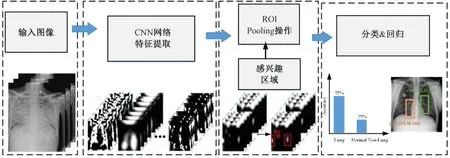
圖4 Two-stage 目標(biāo)檢測(cè)算法Fig.4 Schematic diagram of two-stage object detection algorithm
采用SSD[15-16]、faster-RCNN[17]和faster-RCNN優(yōu)化模型,對(duì)肺部X 光圖像實(shí)現(xiàn)肺炎病灶區(qū)域檢測(cè)。其中,SSD 為one-stage 算法,faster-RCNN 及其優(yōu)化模型為two-stage 算法。
1.3.2 特征提取網(wǎng)絡(luò)
VGG 和ResNet 是兩種常用的特征提取網(wǎng)絡(luò),它們都包含卷積、池化、全連接和SoftMax 操作。相較于VGG 而言,ResNet 增加了JumpPoint 操作。ResNet 網(wǎng)絡(luò)通過(guò)使用特殊的跳躍連接和大批量歸一化處理操作,具有更強(qiáng)的圖像特征抽象能力。SSD 模型和faster-RCNN 模型均采用VGG16 作為特征提取網(wǎng)絡(luò),而faster-RCNN 優(yōu)化模型則采用ResNet 網(wǎng)絡(luò),對(duì)肺部X 光圖像實(shí)現(xiàn)特征提取。
目標(biāo)檢測(cè)算法模型在對(duì)輸入圖像進(jìn)行特征選取時(shí)主要有四種思路,如圖5 所示。圖5(a)首先將輸入的肺部X 光圖像進(jìn)行不同尺度的縮放操作,然后分別進(jìn)行特征圖提取,最終對(duì)生成的特征圖像完成結(jié)果預(yù)測(cè)任務(wù)。該方式增加了目標(biāo)檢測(cè)模型的計(jì)算量,不符合實(shí)際生產(chǎn)中的要求。圖5(b)的特征提取思路與faster-RCNN 思路一致,整個(gè)特征提取網(wǎng)絡(luò)僅采用最后一層的輸出結(jié)果輸入到后續(xù)目標(biāo)檢測(cè)模型。圖5(c)與SSD 模型的設(shè)計(jì)一致,在特征提取網(wǎng)絡(luò)內(nèi)選取若干個(gè)不同大小的特征圖輸入到目標(biāo)檢測(cè)模型。
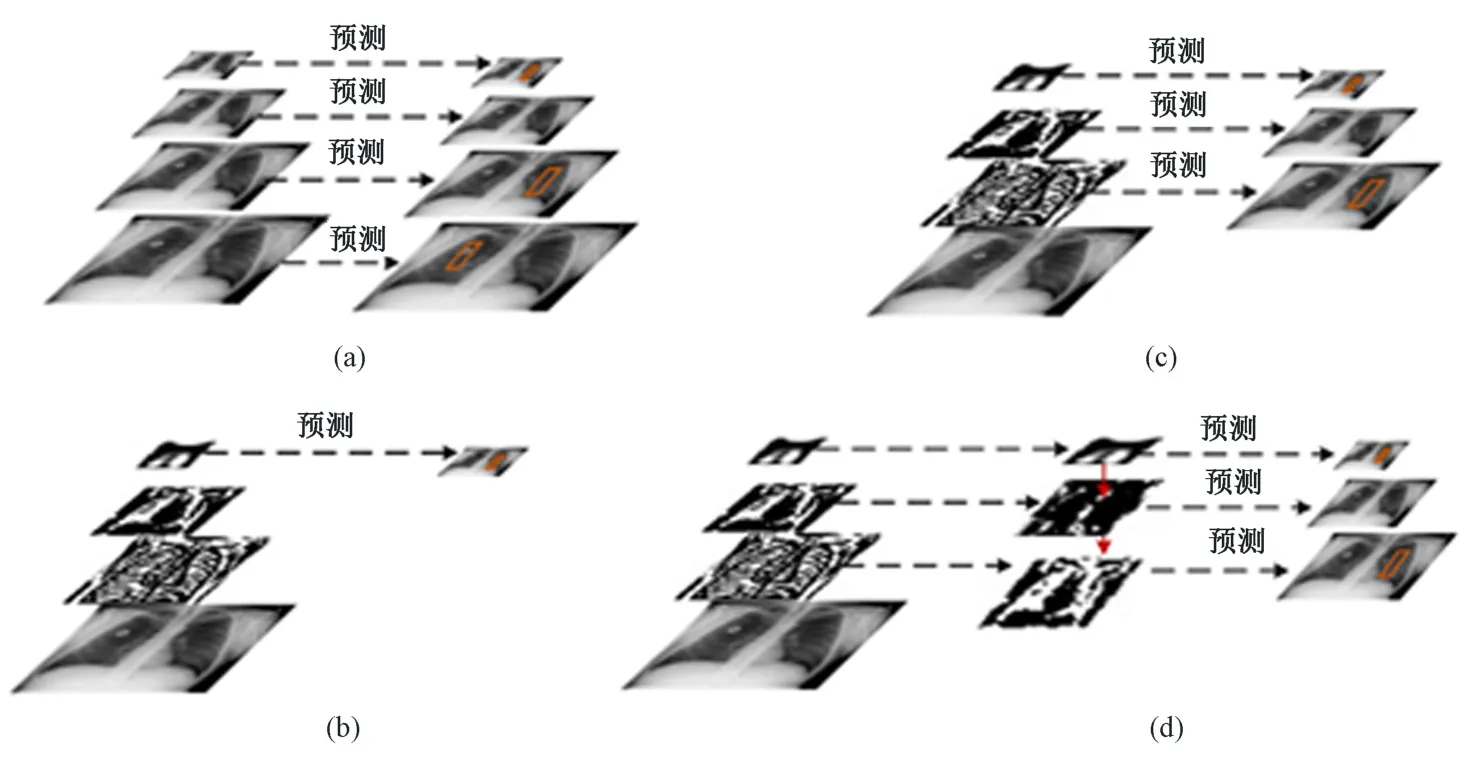
圖5 目標(biāo)檢測(cè)算法特征提取示意。(a) 多尺度圖像輸入;(b) 單一圖像特征輸入;(c) 多圖像特征輸入;(d) 多圖像特征融合輸入Fig.5 Schematic diagram of feature extraction of object detection algorithm. (a) Multi-scale image input; (b)Single image feature input; (c) Multiple image feature input; (d) Multiple image feature fusion input
綜合上述,3 種特征提取網(wǎng)絡(luò)的設(shè)計(jì)思路,利用上采樣操作,使相鄰的特征圖進(jìn)行融合,將高層特征與低層特征融合處理后輸入到后續(xù)模型,如圖5(d)所示。采用這種方式對(duì)原圖像進(jìn)行處理時(shí),更容易檢測(cè)到較小的區(qū)域,而且不增加計(jì)算復(fù)雜度。這種特征設(shè)計(jì)稱為特征金子塔網(wǎng)絡(luò)(feature pyramid network, FPN)[18-19]。Faster-RCNN 優(yōu)化模型即采用該設(shè)計(jì),同時(shí)在應(yīng)用FPN 網(wǎng)絡(luò)的基礎(chǔ)上,將faster-RCNN 中使用的VGG16 模型替換為ResNet 網(wǎng)絡(luò)。
2 結(jié)果
2.1 SSD 模型
在SSD 模型訓(xùn)練過(guò)程中,模型整體的損失值變化曲線如圖6 所示。曲線在繪制的過(guò)程中程序進(jìn)行了平滑處理,平滑率設(shè)定為0.2。由圖可見(jiàn),損失值開(kāi)始時(shí)驟然下降,而后緩慢下降。在迭代30 000 次后,損失值在4.5 上下波動(dòng),而后趨于平穩(wěn)。在迭代50 000 次時(shí),損失值接近4.0,損失函數(shù)曲線降到最低。該曲線表明,隨著訓(xùn)練次數(shù)的增加損失值整體呈下降趨勢(shì)。
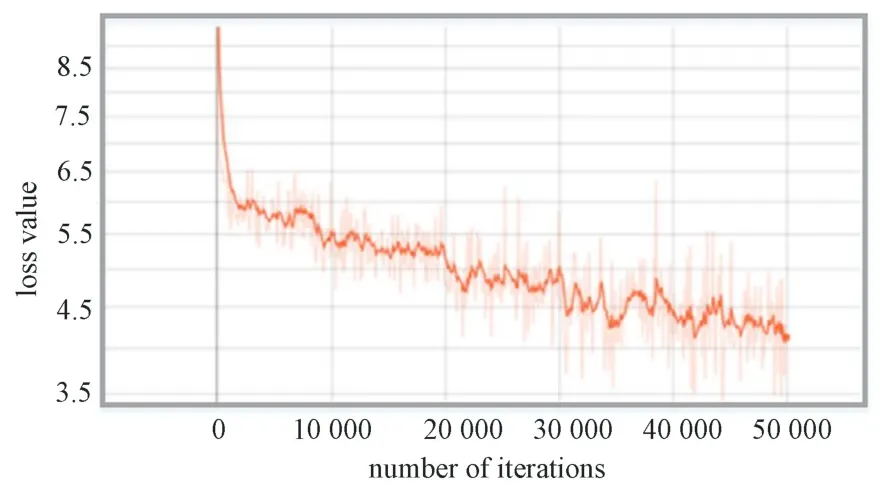
圖6 SSD 模型損失函數(shù)變化曲線Fig.6 Loss function change curve of SSD model
利用訓(xùn)練后的SSD 模型對(duì)抽取的肺炎X 光圖像進(jìn)行測(cè)試。由于樣本數(shù)據(jù)集中每張肺部X 光圖像可能存在的病灶區(qū)域不超過(guò)兩處,因此將從單處病灶區(qū)域的樣本數(shù)據(jù)和兩處病灶區(qū)域的樣本數(shù)據(jù)各抽取一張進(jìn)行測(cè)試,目標(biāo)檢測(cè)結(jié)果分別如圖7(a)和(b)所示。圖中左側(cè)為輸入的樣本圖像,右側(cè)為SSD模型輸出的目標(biāo)檢測(cè)結(jié)果,包括對(duì)于病灶區(qū)域的框定位置,以及框定區(qū)域所患肺炎的概率大小;并且通過(guò)預(yù)測(cè)位置與真實(shí)標(biāo)記位置,可以計(jì)算得到兩者交并比,記為回歸精度,如表2 所示。對(duì)于單處病灶檢測(cè),SSD 輸出的目標(biāo)檢測(cè)結(jié)果為85%的概率判定該處為病灶區(qū)域,預(yù)測(cè)位置與真實(shí)標(biāo)記位置的交并比為60.0%。對(duì)于兩處病灶檢測(cè),SSD 輸出的目標(biāo)檢測(cè)結(jié)果分別為88%和86%的概率判定該處為病灶區(qū)域,預(yù)測(cè)位置與真實(shí)標(biāo)記位置的交并比分別為68.5%和66.8%。
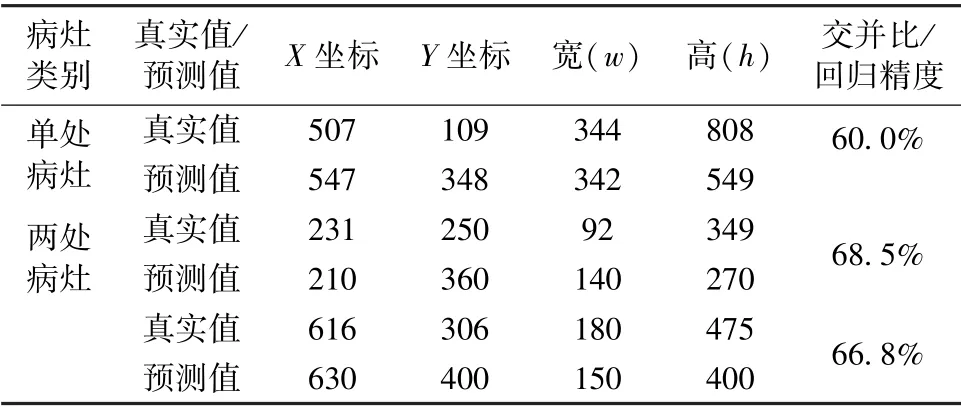
表2 SSD 模型預(yù)測(cè)病灶區(qū)域結(jié)果Tab.2 Results of the prediction position of lesion areas of SSD model
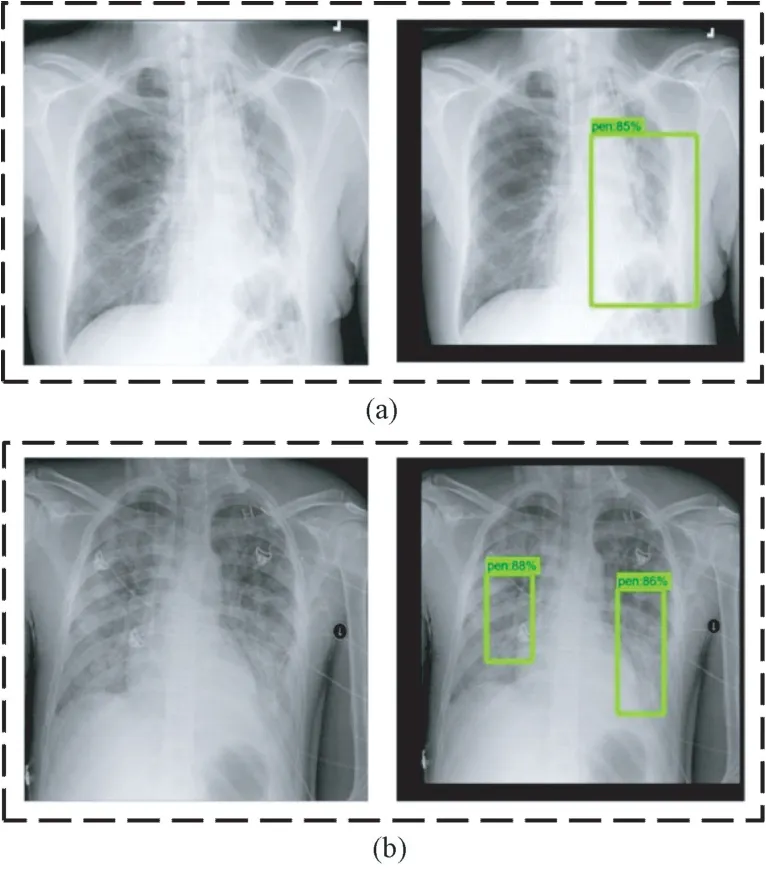
圖7 SSD 模型預(yù)測(cè)病灶區(qū)域結(jié)果(方框表示預(yù)測(cè)為病灶的區(qū)域)。(a)單處病灶;(b)兩處病灶Fig.7 The prediction results of lesion areas of SSD model (Boxes indicate areas predicted to be lesions.).(a) Single lesion area; (b) Two lesion areas
為了對(duì)模型性能進(jìn)行綜合評(píng)估,選取500 張肺部X 光圖像進(jìn)行測(cè)試,其中包括無(wú)病灶區(qū)域的X 光圖像50 張,單個(gè)病灶區(qū)域的X 光圖像150 張,兩處病灶區(qū)域的X 光圖像300 張。目標(biāo)檢測(cè)結(jié)果列于表3,可知SSD 模型的最高和最低分類準(zhǔn)確率分別為89.0%和79.0%,平均分類準(zhǔn)確率為86.6%;最高和最低回歸精度分別為70.4%和58.3%,平均回歸精度為67.4%。從這兩項(xiàng)指標(biāo)可以看出,SSD 雖然基本能夠完成對(duì)病灶區(qū)域進(jìn)行檢測(cè)的任務(wù),但是效果不太理想,誤檢病灶區(qū)域個(gè)數(shù)達(dá)到11 個(gè)。通過(guò)對(duì)誤檢病灶區(qū)域所在的圖像進(jìn)行分析,發(fā)現(xiàn)該11 處誤檢病灶區(qū)域均是未患有肺炎,但存在其他肺部疾病的肺部X 光圖像。該類圖像會(huì)對(duì)目標(biāo)檢測(cè)模型的檢測(cè)產(chǎn)生一定難度,因此可以把誤檢病灶區(qū)域數(shù)作為目標(biāo)檢測(cè)模型的一個(gè)評(píng)估指標(biāo),能夠更全面地評(píng)測(cè)該目標(biāo)檢測(cè)模型的好壞。

表3 SSD 模型性能評(píng)測(cè)Tab.3 Performance evaluation of SSD model
2.2 Faster-RCNN 模型
在faster-RCNN 模型訓(xùn)練過(guò)程中,模型整體的損失值變化曲線如圖8 所示。圖中損失值在開(kāi)始時(shí)波動(dòng)幅度較大,而后緩慢下降。在迭代10 000次后,損失值在1.0 上下波動(dòng),趨于平穩(wěn)。在迭代50 000次時(shí),損失函數(shù)曲線降到最低。該曲線表明,相比于SSD 模型,faster-RCNN 模型迭代較少的次數(shù)損失值便可趨于穩(wěn)定,且損失值較小。
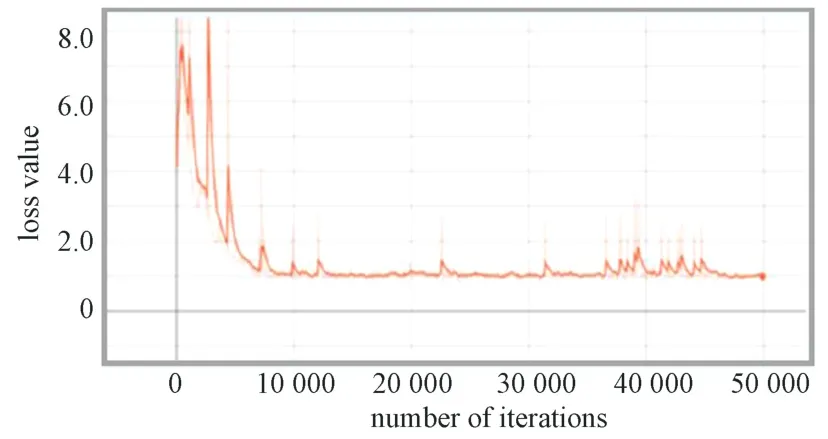
圖8 Faster-RCNN 模型損失函數(shù)變化曲線Fig.8 Loss function change curve of faster-RCNN model
利用訓(xùn)練后的faster-RCNN 模型對(duì)抽取的肺部X 光圖像進(jìn)行測(cè)試。單處病灶和兩處病灶樣本的目標(biāo)檢測(cè)結(jié)果分別如圖9(a)和(b)所示。在這兩種情況下,預(yù)測(cè)位置與真實(shí)標(biāo)記位置如表4 所示。對(duì)于單處病灶檢測(cè),faster-RCNN 輸出的目標(biāo)檢測(cè)結(jié)果為91%的概率判定該處為病灶區(qū)域,預(yù)測(cè)位置與真實(shí)標(biāo)記位置的交并比為72.9%。對(duì)于兩處病灶檢測(cè),faster-RCNN 輸出的目標(biāo)檢測(cè)結(jié)果分別為89%和92%的概率判定該處為病灶區(qū)域,預(yù)測(cè)位置與真實(shí)標(biāo)記位置的交并比分別為74.5%和74.3%。
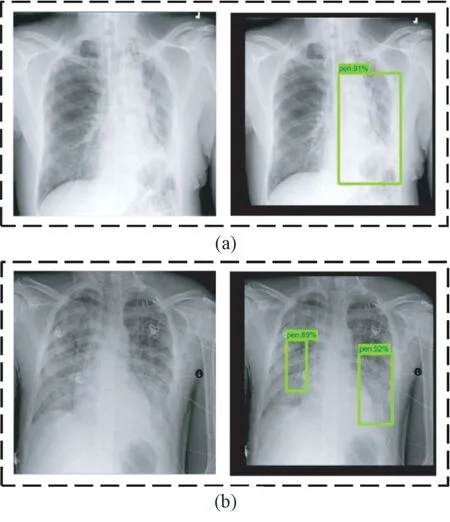
圖9 Faster-RCNN 模型預(yù)測(cè)病灶區(qū)域結(jié)果(方框表示預(yù)測(cè)為病灶的區(qū)域)。(a)單處病灶;(b)兩處病灶Fig.9 The prediction results of lesion areas of faster-RCNN model ( Boxes indicate areas predicted to be lesions.). (a) Single lesion area;(b) Two lesion areas
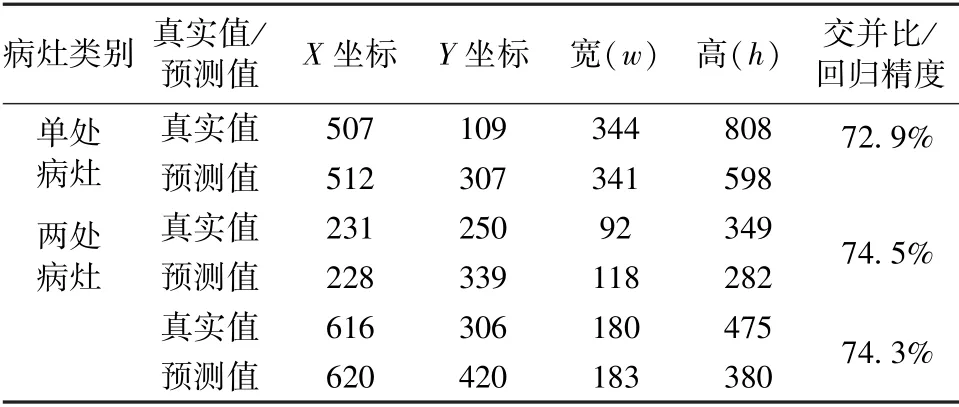
表4 Faster-RCNN 預(yù)測(cè)病灶區(qū)域結(jié)果Tab.4 Results of the prediction position of lesion areas of faster-RCNN model
選取同樣的500 張肺部X 光圖像,利用faster-RCNN 模型進(jìn)行測(cè)試。根據(jù)表5 所示結(jié)果可知,faster-RCNN 模型的最高和最低分類準(zhǔn)確率分別為92.0%和88.0%,平均分類準(zhǔn)確率為90.2%;最高和最低回歸精度分別為75.9%和70.3%,平均回歸精度為74.6%。從這兩項(xiàng)指標(biāo)可以看出,faster-RCNN能夠完成對(duì)病灶區(qū)域進(jìn)行檢測(cè)的任務(wù),各項(xiàng)指標(biāo)相對(duì)于SSD 模型而言均有所提升。此外,faster-RCNN誤檢病灶區(qū)域個(gè)數(shù)為3 個(gè),少于SSD 誤檢的數(shù)量。

表5 Faster-RCNN 模型性能評(píng)測(cè)Tab.5 Performance evaluation of faster-RCNN model
2.3 Faster-RCNN 優(yōu)化模型
在faster-RCNN 優(yōu)化模型訓(xùn)練過(guò)程中,模型整體的損失值變化曲線如圖10 所示。由圖可見(jiàn),從開(kāi)始到50 000 次的訓(xùn)練過(guò)程中,損失值一直在1.0 上下浮動(dòng),但是浮動(dòng)范圍上下沒(méi)有超過(guò)0.5。當(dāng)訓(xùn)練完畢時(shí),損失值接近1.0。該曲線表明該模型損失值在訓(xùn)練過(guò)程中能快速達(dá)到一個(gè)穩(wěn)定的狀態(tài)。
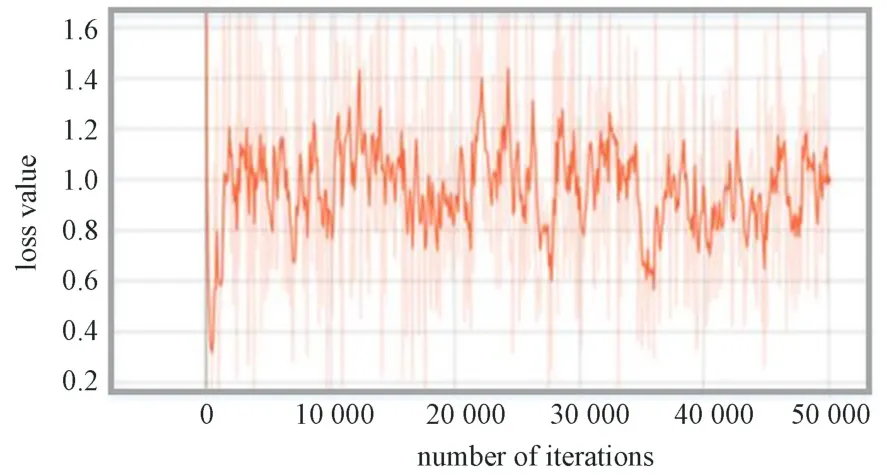
圖10 Faster-RCNN 優(yōu)化模型損失函數(shù)變化曲線Fig.10 Loss function change curve of faster-RCNN optimization model
利用訓(xùn)練后的faster-RCNN 優(yōu)化模型對(duì)抽取的肺炎X 光圖像進(jìn)行測(cè)試。單處病灶和兩處病灶樣本的目標(biāo)檢測(cè)結(jié)果分別如圖11(a)和(b)所示。在這兩種情況下,預(yù)測(cè)位置與真實(shí)標(biāo)記位置如表6所示。
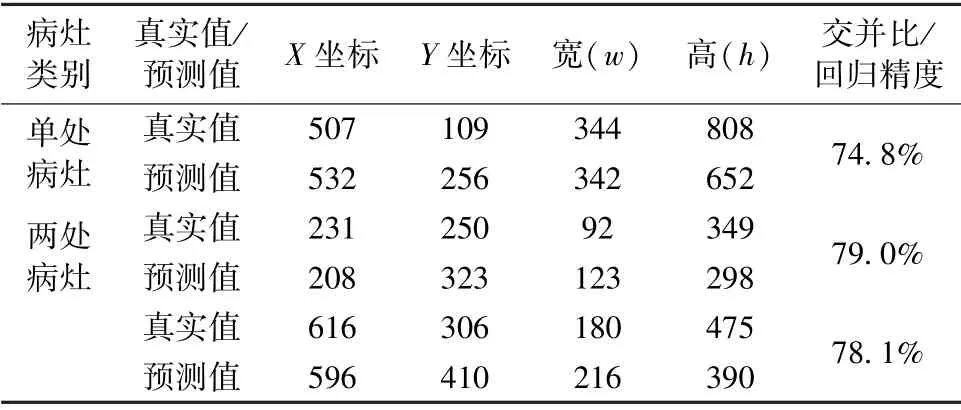
表6 Faster-RCNN 優(yōu)化模型預(yù)測(cè)病灶區(qū)域結(jié)果Tab.6 Results of the prediction position of lesion areas of Faster-RCNN optimization model
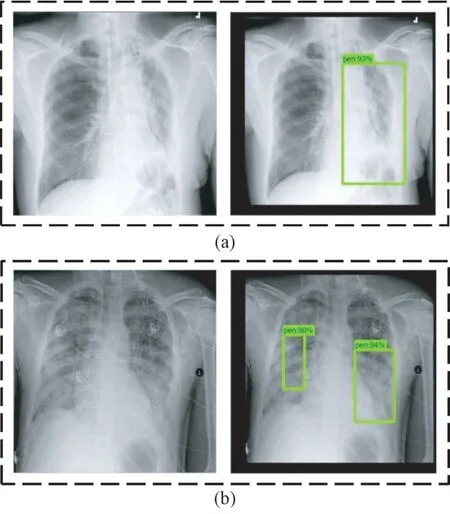
圖11 Faster-RCNN 優(yōu)化模型預(yù)測(cè)病灶區(qū)域結(jié)果(方框表示預(yù)測(cè)為病灶的區(qū)域)。(a)單處病灶;(b)兩處病灶Fig.11 The prediction results of lesion areas of faster-RCNN optimization model (Boxes indicate areas predicted to be lesions.). (a) Single lesion area; (b) Two lesion areas
對(duì)于單處病灶檢測(cè),faster-RCNN 優(yōu)化模型輸出的目標(biāo)檢測(cè)結(jié)果為93%的概率判定該處為病灶區(qū)域,預(yù)測(cè)位置與真實(shí)標(biāo)記位置的交并比為74.8%。對(duì)于兩處病灶檢測(cè),faster-RCNN 優(yōu)化模型輸出的目標(biāo)檢測(cè)結(jié)果分別為90%和94%的概率判定該處為病灶區(qū)域,預(yù)測(cè)位置與真實(shí)標(biāo)記位置的交并比分別為79.0%和78.1%。選取同樣的500 張肺部X 光圖像,利用faster-RCNN優(yōu)化模型進(jìn)行測(cè)試。根據(jù)表7 所示結(jié)果可知,faster-RCNN 優(yōu)化模型的最高和最低分類準(zhǔn)確率分別為96.0%和90.0%,平均分類準(zhǔn)確率為93.7%;最高和最低回歸精度分別為83.2%和74.5%,平均回歸精度為79.8%。從這兩項(xiàng)指標(biāo)可以看出,相對(duì)于另外兩個(gè)模型而言,faster-RCNN 優(yōu)化模型的目標(biāo)檢測(cè)效果有著顯著提升,并且誤檢病灶區(qū)域數(shù)為0,因此faster-RCNN 優(yōu)化模型可選用為肺炎圖像目標(biāo)檢測(cè)的應(yīng)用模型。

表7 Faster-RCNN 優(yōu)化模型性能評(píng)測(cè)Tab.7 Performance evaluation of faster-RCNN optimization model
此外,對(duì)該模型的運(yùn)行速度進(jìn)行了評(píng)測(cè)。通過(guò)對(duì)500 張測(cè)試圖像進(jìn)行檢測(cè),結(jié)果顯示平均每張測(cè)試圖像檢測(cè)用時(shí)約216 ms,可滿足實(shí)際應(yīng)用需求。
3 討論
SSD 和faster-RCNN 是近年來(lái)實(shí)現(xiàn)目標(biāo)檢測(cè)的常用CNN 模型[6-8,20-21]。SSD 基于MultiBox 的思想,在不同特征尺度上預(yù)測(cè)不同尺度的目標(biāo),可全面提升檢測(cè)精度[15]。Faster-RCNN 采用區(qū)域候選網(wǎng)絡(luò)(region proposal network, RPN)解決了目標(biāo)的區(qū)域推薦問(wèn)題,能極大提升檢測(cè)框的生成速度[17]。本研究構(gòu)建了3 種圖像目標(biāo)檢測(cè)模型,SSD、faster-RCNN和faster-RCNN 優(yōu)化模型,以實(shí)現(xiàn)對(duì)肺部X 光圖像的病灶區(qū)域檢測(cè)。其中faster-RCNN 優(yōu)化模型是在faster-RCNN 的網(wǎng)絡(luò)結(jié)構(gòu)基礎(chǔ)上引入FPN,并將特征提取網(wǎng)絡(luò)VGG16 替換為ResNet 網(wǎng)絡(luò)實(shí)現(xiàn)的。
肺炎的病灶大小、形狀和位置變化很大[22],邊界通常非常模糊,導(dǎo)致檢測(cè)難度很大,因此提高檢測(cè)精度是一個(gè)主要的研究問(wèn)題,這取決于數(shù)據(jù)預(yù)處理、模型選用、訓(xùn)練和測(cè)試等各個(gè)環(huán)節(jié),并通過(guò)多種性能指標(biāo),如損失函數(shù)、準(zhǔn)確率、回歸精度和誤檢病灶數(shù)等來(lái)綜合表征評(píng)定。在數(shù)據(jù)集的處理過(guò)程中,采用多種方法對(duì)原始肺部X 光圖像進(jìn)行數(shù)據(jù)增強(qiáng),主要包括圖像縮放變換、線性變換以及對(duì)比度增強(qiáng)等步驟,從而調(diào)整圖像尺寸,改善圖像效果,突出圖像特征,以增強(qiáng)深度學(xué)習(xí)模型的魯棒性和泛化能力,提高檢測(cè)精度。
損失函數(shù)有助于優(yōu)化神經(jīng)網(wǎng)絡(luò)的參數(shù)。本研究分析了3 種模型的損失函數(shù)隨模型訓(xùn)練次數(shù)的變化情況。由各模型的損失函數(shù)曲線可知,隨著訓(xùn)練次數(shù)的增加損失值均下降;Faster-RCNN 模型相比于SSD 模型損失值下降更快,迭代較少的次數(shù)便可趨于穩(wěn)定,且損失值較小;Faster-RCNN 優(yōu)化模型從開(kāi)始訓(xùn)練,損失值一直在1.0 上下浮動(dòng),可快速達(dá)到穩(wěn)定狀態(tài)。
為了評(píng)估深度學(xué)習(xí)模型的性能,首先分別利用訓(xùn)練后的3 種模型對(duì)抽取的肺炎X 光圖像進(jìn)行測(cè)試,得到了單處病灶和兩處病灶的框定位置及框定區(qū)域所患肺炎的概率大小,根據(jù)預(yù)測(cè)位置與真實(shí)標(biāo)記位置可以計(jì)算得到回歸精度。通過(guò)比較可知,無(wú)論對(duì)于單處病灶還是兩處病灶,faster-RCNN 優(yōu)化模型的回歸精度高于faster-RCNN 模型,且二者均高于SSD 模型。然后,分別利用3 種模型對(duì)選取的500張肺部X 光圖像進(jìn)行目標(biāo)檢測(cè),由所獲得的分類準(zhǔn)確率、回歸精度和誤檢病灶數(shù)結(jié)果可知,faster-RCNN 優(yōu)化模型的綜合性能均優(yōu)于另外兩種模型。此外,faster-RCNN 優(yōu)化模型對(duì)X 光圖像的測(cè)試速度很快,這表明了其在肺炎圖像目標(biāo)檢測(cè)實(shí)際應(yīng)用中的可行性和潛力。
本研究采取的深度學(xué)習(xí)方法框架并不僅限于肺部X 光圖像,未來(lái)可在其他疾病的目標(biāo)檢測(cè)研究中進(jìn)行嘗試,以驗(yàn)證其普適性;并期望進(jìn)一步提高模型的檢測(cè)精度和速度,將其應(yīng)用于臨床疾病的實(shí)時(shí)檢測(cè)和診斷。
4 結(jié)論
本研究使用SSD、faster-RCNN 和faster-RCNN優(yōu)化模型3 種目標(biāo)檢測(cè)模型完成對(duì)肺部X 光圖像的病灶區(qū)域檢測(cè)任務(wù),通過(guò)在損失函數(shù)、分類準(zhǔn)確率、回歸精度、誤檢病灶區(qū)域數(shù)等方面對(duì)模型性能進(jìn)行分析可知,faster-RCNN 優(yōu)化模型可快速達(dá)到穩(wěn)定,平均分類準(zhǔn)確率達(dá)到93.7%,平均回歸精度為79.8%,且誤檢病灶數(shù)為0,性能指標(biāo)均優(yōu)于其他兩種模型。因此faster-RCNN 優(yōu)化模型可幫助醫(yī)生進(jìn)行準(zhǔn)確高效的X 光圖像肺炎病灶檢測(cè),并有可能應(yīng)用于其他醫(yī)學(xué)圖像的目標(biāo)檢測(cè),在實(shí)際的醫(yī)療領(lǐng)域中具有廣泛的應(yīng)用前景。

