一株高效降解嘔吐毒素的德沃斯氏菌篩選鑒定及效果評價
孫 晶, 杜 穩, 趙程程, 常曉嬌, 趙一凡, 王 峻, 劉虎軍
(國家糧食和物資儲備局科學研究院,北京 100037)
脫氧雪腐鐮刀菌烯醇(Deoxynivalenol,DON),又名嘔吐毒素,20世紀70年代由Yoshizawa等在被鐮刀菌污染的小麥等谷物食品中發現并鑒定[1],DON屬于單端孢霉烯B族化合物,化學名稱為3ɑ,7ɑ,15-三羥基-12,13-環氧單端胞霉-9-烯-8-酮,分子式C15H20O6。DON污染在霉變的玉米、小麥等谷物中較為普遍,是導致食品安全問題的主要真菌毒素之一[2-4]。該毒素進入食物鏈后可引起人畜多種疾病,導致人和動物的細胞毒性[5,6]、免疫毒性[7,8]、腸道毒性[9,10]、神經毒性[11]和生殖遺傳毒性[12],禽畜采食污染的飼料后,會出現拒食、嘔吐和引發流產等嚴重后果[13]。2018年中國飼料原料及飼料霉菌毒素檢測報告顯示真菌毒素污染普遍存在,小麥及麩皮是DON污染最為嚴重的原料[14]。為了保護畜牧養殖業的健康發展和人類的健康消費,中國規定飼料原料或飼料中DON的含量最高為5 000 μg/kg,用于食品的谷物及谷物產品中DON的最大限量為1 000 μg/kg[15]。因此,如何有效控制和去除谷物、糧油副產品及飼料中的嘔吐毒素,對改善動物生產性能和提高人類的食品安全具有非常重要的意義。
目前去除DON方法有物理法、化學法和生物降解法[16]。研究表明,傳統的物理和化學法[17]脫除DON的技術存在不易操作、難以規模化應用,以及脫毒制品的營養成分損失大和制品適口性差等弊端。生物降解法因具有效率高、特異性強、環境無污染、不影響營養價值等優點,備受研究者的關注[18]。生物降解法是利用微生物或其產生的降解酶將嘔吐毒素分解或代謝為低毒或無毒產物[19]。2013年,以菌株BBSH797開發的產品百霉克被廣泛應用于畜禽養殖,實現了DON脫毒菌劑商業化,呈現出巨大的應用潛力[20]。如何篩選獲得高效降解菌,并解析其降解途徑是推進優良降解DON微生物菌株的前提和基礎[21,22]。本研究在前期研究基礎上,篩選獲得一株可高效降解DON的菌株,在完成菌株鑒定后,采用液質聯用(LC-HRMS)初步推測其降解機理,評估該菌株在糧食及其副產物中DON的脫毒效果,為在實際生產中應用于脫除糧食和飼料中DON的相關技術開發提供支撐。
1 材料與方法
1.1 材料與試劑
樣品:采集自吉林長春、河南鄭州和西藏拉薩等地區的土壤、河流污泥和動物糞便等共133份樣品,密封冷藏于實驗室備用。
培養基:無機鹽培養基(MSM)(g/L):(NH4)2SO40.5 g,MgSO4·7H2O 0.2 g,CaCl20.05 g,Na2HPO42.44 g,KH2PO41.52 g,加去離子水定容至1 000 mL,pH為6.8。在培養基中添加濃度為10 μg/mL的DON做為菌株定向篩選培養基。LB培養基(g/L):酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g,加去離子水定容至1 000 mL。固體培養基添加1.5%的瓊脂。
1.2 主要試劑及儀器
DON標準品為本實驗室制備提取[23];甲醇、乙腈均為色譜純級;嘔吐毒素免疫親和柱;酵母提取物等其他試劑均為分析級。
E2695高效液相色譜儀,waters xbridge C18色譜柱,C1000PCR儀, Gel Doc XR+凝膠成像儀。
1.3 實驗方法
1.3.1 DON降解菌篩選和分離
富集和初篩:取10 g樣品于100 mL MSM培養基中,DON濃度為10 mg/L,在30 ℃,220 r/min恒溫振蕩培養7 d,以10%接種量轉接3次,高效液相色譜(HPLC)檢測DON殘留量,選擇具有DON降解效果的樣品進行下一步實驗。
復篩:將初篩具有降解效果的樣品經過適當梯度稀釋后涂布于MSM平板上,挑取形態各異的單菌落接至含有10 mg/L DON的1 mL MSM培養液中,在30 ℃,220 r/min條件下培養7 d。檢測DON殘留量,挑選具有降解能力的單菌株。
1.3.2 降解菌活性物質的定位
挑取具有高效降解能力的單菌落接種于50 mL MSM培養液中,在30 ℃,220 r/min條件下培養72 h。發酵液在5 000 r/min離心5 min獲得發酵上清液(胞外液);發酵液離心后棄上清,菌體經等體積MSM培養液重懸后超聲破碎,5 000 r/min離心5 min,獲得發酵液破碎上清液(胞內液)。分別取胞外液和胞內液500 μL,加入含有10 mg/L DON的1 mL MSM培養基中,在30 ℃,220 r/min條件下培養12 h,以各自高溫滅活的上清液為對照,測定DON殘留量。
1.3.3 菌種鑒定
形態鑒定:將獲得的菌株在MSM培養基上劃線,30 ℃培養24~72 h,觀察菌落形態、大小、邊緣、表面隆起形狀、透明度等。對菌株進行革蘭氏染色,于顯微鏡下觀察細胞形態特征。
分子鑒定:對降解菌株進行16S rDNA或18S rDNA鑒定。按照細菌基因組DNA提取試劑盒操作說明提取基因組DNA作為模版進行PCR擴增。16S rDNA通用引物16SF:5’-AGAGTTTGATCCTGGCTCAG-3’,16SR:5’-GGTTACCTTGTTACGACTT-3’,18S rDNA通用引物18SF:5’-GTAGTCATATGCTT-3’,18SR:5’-ATTCCCCGTTACCCGTTG-3’進行PCR擴增。反應體系:模版1μL,Premix Taq 12.5 μL,16S/18S上下游引物引物各1 μL,雙蒸水10.5 μL。反應程序:94 ℃預變性5 min,94 ℃變性45 s,55 ℃退火45 s,72 ℃延伸2 min,30個循環,72 ℃延伸10 min。將PCR產物進行測序,將測序結果在NCBI中進行比對。
1.3.4 DON降解率測定
DON含量測定參考高效液相色譜法(GB 5009.111—2016)[24]。色譜柱:C18柱(250 mm×4.6 mm,5 μm);流動相:水/甲醇=80/20;流速1.0 mL/min;柱溫25 ℃;進樣量10 μL;紫外檢測器:激發波長(Ex)=218 nm。
DON降解率=降解后培養基中DON含量/原培養基中DON的含量×100%。
式中:原培養基中DON的含量為10 mg/L。
1.3.5 DON降解菌降解機理初步分析
降解曲線:DON降解菌接入含有10 mg/L DON的1 mL MSM培養液中,在30 ℃,220 r/min條件下培養5 d,每間隔24 h取樣,測定DON殘留量,繪制降解曲線。
質譜分析:DON含量測定參考高效液相色譜法。選取上述0~3 d樣品進行質譜分析。質譜分析方法:正離子模式,色譜柱:poreshell 120 EC-C18,(2.1 mm×100 mm);柱溫度:40 ℃;流動相:A:水/甲酸銨=99.9/0.1,B:甲醇/甲酸=99.9/0.1;梯度洗脫程序:0~1 min,10% B;1~1.5 min,45% B;1.5~8.5 min,B相由45%升至100%,保持1 min后回到初始流動相保持0.5 min,準備下一次進樣;流速:0.3 mL/min;進樣量:2 μL。
1.3.6 降解效果應用評價
生長曲線:挑取降解菌單菌落于LB培養基中,在30 ℃,220 r/min條件下培養60 h,每間隔4 h取樣測定OD值,以時間為橫坐標,OD600為縱坐標,繪制生長曲線。
脫毒應用:依據生長曲線實驗參數,挑取降解菌單菌落接種至LB培養基中,在30 ℃、220 r/min條件下培養至對數期作為種子液。以10%的接種量接入DON含量超標的小麥、DDGS和玉米稀漿培養基中,在30 ℃、220 r/min條件下培養18 h,取樣檢測物料中DON殘留量,分析降解效果,物料中DON提取方法參見國標法。
2 結果與分析
2.1 降解菌的分離和純化
根據1.3.1的方法對133份采集樣品進行特異性富集,以DON為唯一碳源,具有DON降解能力的富集液多達32份。在LB平板上對32組富集液進行涂布培養,挑取平板上長出的形態各異的單個菌落劃線純化,獲得單菌株14株,分別編號為D-1~D-14。單菌株分別接種到含10 mg/L DON的1 mL MSM培養液中,培養7 d,D-1、D-4、D-8和D-14具有明顯降解效果,降解率分別為67.07%、37.23%、98.40%和32.50%。不同來源的單菌株對DON降解效率差異較大,來源于河南省鄭州市高新區河流污泥樣品的菌株D-8培養第3 d降解率即可達98.4%,幾乎將10 μg DON消除,D-8較其他菌株降解能力更高效。選擇此菌株進行下一步研究。
2.2 降解菌的活性物質定位
菌株D-8發酵上清液和菌體破碎上清液各500 μL,加入含有10 mg/L DON的1 mL MSM培養基中,發酵上清液即為胞外液,菌體破碎后上清液即為胞內液,胞內液和胞外液對DON的降解率分別為83.48%和17.23%。同時,將獲得的上清液滅活處理幾乎沒有降解效果。Carere等[25]已從德沃斯氏菌株找到活性物質,本研究結果表明,菌株D-8對DON的降解不是菌體的吸附作用,而是菌體產生的某種可降解DON的活性物質,可能是一種菌體表達的酶蛋白[26]。
2.3 降解菌株鑒定
2.3.1 形態鑒定
菌株D-8在LB培養基上能較好生長,大部分菌落符合細菌特征,30 ℃,經3 d培養其菌落形態呈象牙白色、圓形且邊緣整齊,表面光滑且凸起,大小0.5~1.5 μm(圖1a);顯微鏡下的形態為細小棒狀,無孢子形成,為革蘭氏陰性菌(圖1b)。
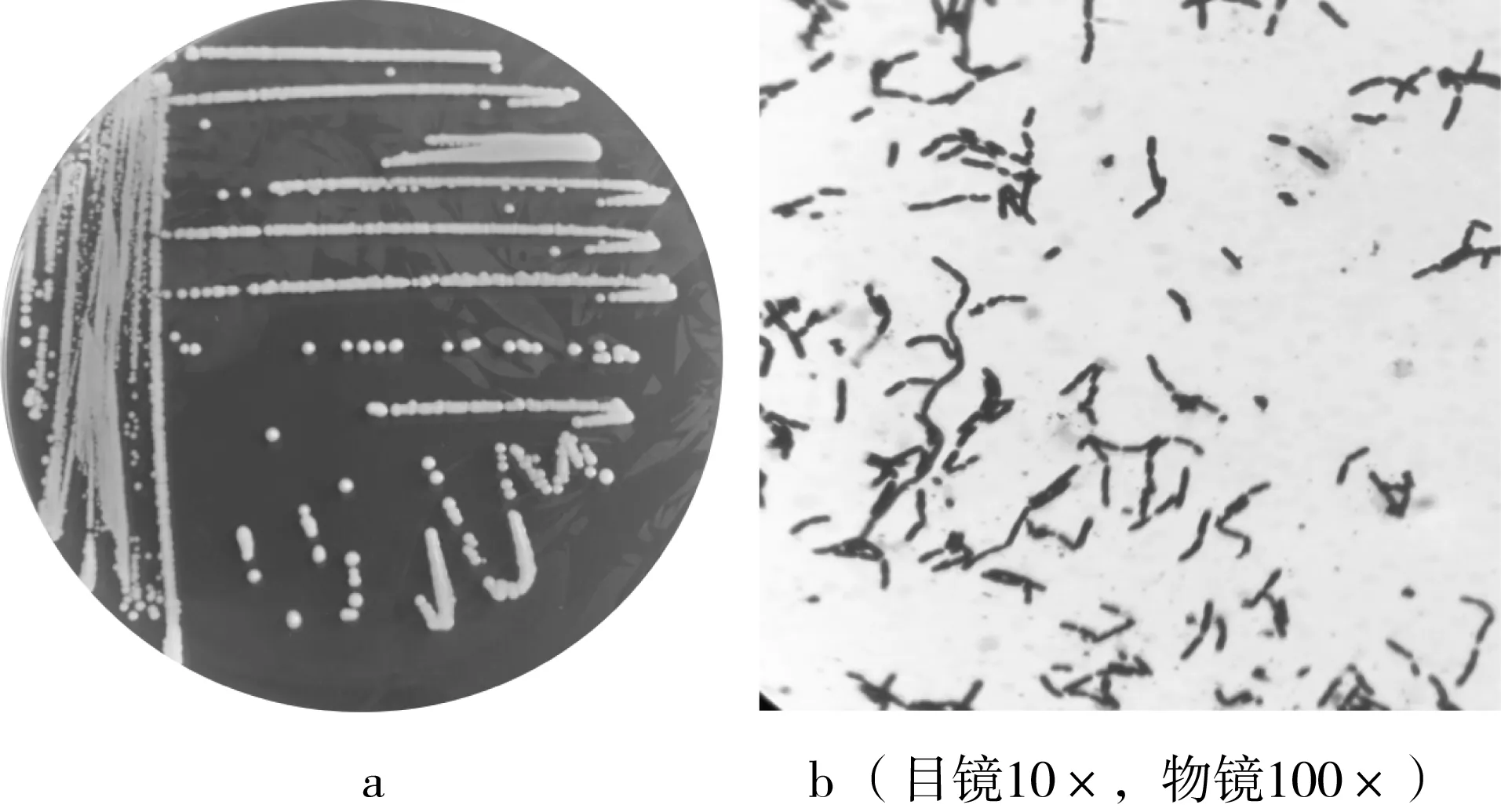
圖1 D-8的菌落圖(a)和顯微鏡檢圖(b)
2.3.2 分子鑒定
采用細菌16S rDNA通用引物擴增菌種的保守序列,將擴增產物進行測序,測序結果在NCBI Blast N中進行同源性比對。利用MEGE5.0軟件構建系統進化樹(圖2),菌株D-8和DevosialimiLMG 22951同源性高達97%。根據菌株16S rDNA的相似性、系統發育樹和菌落形態,初步鑒定D-8為德沃斯氏菌株。目前,已有學者開展DON降解菌劑應用于畜禽養殖研究。計成等[27]分離一株高效DON降解菌枯草芽孢桿菌ANSB471,對飼料中嘔吐毒素的降解率可達到97.34%。德沃斯氏菌株降解DON具有潛能,本研究篩選德沃斯氏菌可高效降解DON,在應用上可開展進一步深入研究。

圖2 菌株系統發育樹
2.4 菌株D-8降解機理初步分析
菌株D-8降解曲線表明,在MSM培養基中,該菌生長雖然緩慢,但對DON有較好的降解效果。從發酵第1 d開始降解速率明顯加快,培養3 d即可將培養液中DON毒素完全清除。菌株D-8與He等[28]篩選的德沃斯氏菌相似,均可高效降解DON,降解率90%以上,具有較好的應用前景。
菌株D-8降解產物質譜分析表明,降解過程提取EIC圖譜(圖3a),隨著發酵時間的增加,DON峰值降低,產物峰值逐漸增加。發酵1 d,DON含量即減少,在質荷比297.133 3分子質量下出現2個物質峰,相同分子質量的產物峰逐漸增多,發酵3 d,DON幾乎轉化為產物。對轉化產物進行質荷比分析(圖3b),質荷比為[M+H]+=297.134 3,表明菌株D-8產生的活性物質將DON轉化為分子質量相同的產物,此產物較穩定,不容易恢復成DON。目前,Hassan等[29]報道德沃斯氏菌株可將DON轉化為3-eip-DON。結合已有研究,菌株D-8轉化產物與Hassan等[29]報道一致,解析此代謝過程可能發生兩步反應,底物DON分子在降解菌的作用下,生成中間體3-酮基-DON(3-keto-DON),再經差向異構生成終產物3-eip-DON,3-eip-DON毒性低于DON,可作為DON脫毒有效降解途徑。
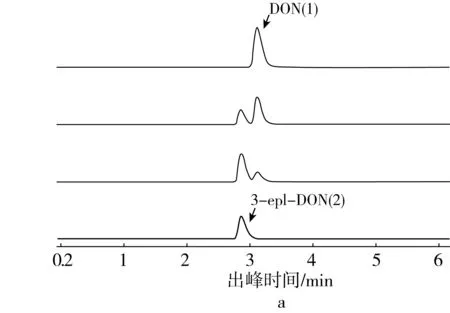
注:a:菌株D-8降解過程DON產物峰EIC圖譜(1:DON,2:3-epi-DON);b:D-8降解DON產物質荷比分析。圖3 菌株D-8降解產物質譜分析
2.5 降解菌降解效果評價
以時間為橫坐標,OD600為縱坐標,繪制菌株D-8生長曲線(圖4),D-8接種于LB培養基中,在30 ℃,220 r/min條件下培養,于18 h進入對數生長期,36 h進入穩定期。

圖4 菌株D-8生長曲線
谷物及其副產品在深加工過程中存在嘔吐毒素濃縮效應,從而導致部分副產物及噴漿飼料產品中嘔吐毒素含量明顯超標,本研究初步探索德沃斯氏菌D-8在玉米稀漿、DDGS等谷物及其副產物中DON脫毒初步應用。將D-8菌株以10%的接種量接種至各DON超標物料培養基中,培養18h,處理組經免疫親和柱凈化后,檢測DON的殘留量(圖5),小麥處理組脫毒效果相對最佳,可將小麥中DON質量分數由6 110.42 μg/kg降為115.41 μg/kg,降解率為98.11%;玉米稀漿次之,可由2 679.52 μg/kg降為995.60 μg/kg,降解率為62.84%;DDGS效果略差,僅由1 502.75 μg/kg降為864.31 μg/kg,降解率為42.5%。菌株D-8在3種原料中的降解能力為小麥>玉米稀漿>DDGS。分析其原因,3種物料脫毒差異性可能是各物料中pH值、營養物質含量及比例不同,小麥粉初始pH值偏中性,而DDGS和玉米稀漿偏酸性,小麥粉pH值適中,營養成分均衡,有助于菌株生長[30],脫毒效果較好;其次,玉米稀漿脫毒效果可能受無機鹽種類和含量的影響,脫毒效果次之;最后,DDGS物料中可能存在與菌株降解酶的輔酶具有競爭或者抑制作用的物質[31],從而導致其脫毒效果略差。目前,玉米稀漿、DDGS等深加工副產物脫毒應用技術難度大,鮮有報道。本研究利用生物降解法,初步實現同一菌株在不同物料中的脫毒應用研究,經菌株發酵處理后不同物料中DON含量均可低于國家限定標準。同時,這也表明德沃斯氏菌D-8具有可研制成真菌毒素生物脫毒菌劑的潛力,可為為副產物高值化利用提供菌株資源。
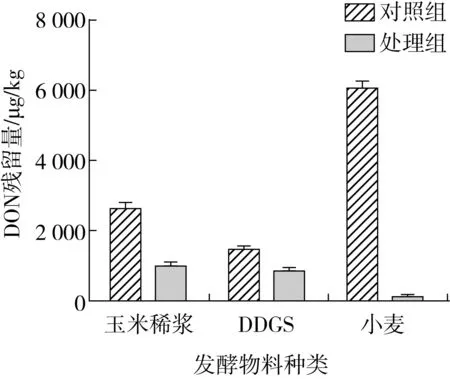
圖5 菌株降解3種原料中DON的情況
3 結論
本研究分離獲得一株高效降解DON的微生物菌株。經形態學和分子生物學手段相結合,初步鑒定為德沃斯氏菌(命名D-8)。D-8菌株在MSM培養基中3 d內可將10 μg DON幾乎完全降解,降解率達98.4%。
采用質譜分析表明,D-8菌株可通過兩步反應將DON轉化為質荷比為297.134 3的產物,經過分析推導為3-epi-DON,根據已有報道,3-eip-DON為DON的同分異構體,且毒性低于DON,可作為DON脫毒有效降解途徑[32]。本研究利用生物降解法,初步實現同一菌株在不同物料中的脫毒應用研究,以谷物及其副產物為原料,以D-8為發酵菌株,經過18 h發酵,小麥、玉米稀漿、酒糟蛋白(DDGS)中的DON降解率分別為98.11%、62.84%和42.5%。發酵小麥中的DON初始質量分數由6 110.42 μg/kg降解至115.41 μg/kg,脫毒效果相對最佳。經菌株D-8發酵處理后不同物料中DON含量均低于國家限定標準。該研究的結果可為DON污染糧食及其制品的脫毒應用提供可行的處理途徑。后續實驗將深入全面開展降解菌D-8穩定性、耐酸耐高溫定向誘變育種、飼用安全性和有效性等多方面研究,力求將其開發成一種高效、安全的能夠應用于飼料和食品中的DON生物脫毒菌制劑。

