AG490改善缺血性腦卒中后神經功能的機制研究
張薇,辛靈,閻濤,2
(天津醫科大學總醫院1.神經病學研究所;2.神經內科,天津 300052)
腦卒中是導致全球患者死亡和殘疾的主要病因,顯著增加了患者家庭和社會的經濟負擔。缺血性腦卒中是最常見的卒中亞型,缺血性腦卒中誘導損傷相關分子模式(damage-associated molecular pattern molecules,DAMPs)的激活,在損傷的大腦區域引發局部炎癥,這種局灶性炎癥進一步加劇血腦屏障損傷、微血管衰竭、腦水腫和氧化應激并直接誘導神經元死亡,加重腦損傷[1]。目前對急性缺血性腦卒中最有效的治療主要是組織纖溶酶原激活物溶栓治療或血管內機械再通治療[2-3]。然而,相當部分患者到達醫院時已錯過最佳的治療時間窗,導致不同程度的神經功能障礙。許多分子靶點的藥物在減輕卒中動物模型的神經損傷方面顯示出巨大的潛力,但大多在臨床試驗中失敗。因此,尋找缺血性腦卒中治療的新靶點來改善治療效果至關重要。Janus激酶2(Janus kinase2,JAK2)是蛋白酪氨酸激酶家族成員之一,調節下游信號轉導與轉錄激活因子(STAT1、STAT3和STAT5)等信號分子的激活[4]。JAK2/STAT3是JAK-STAT信號轉導途徑家族中最重要的途徑,通過多種生長因子和細胞因子的信號級聯反應,參與調控細胞存活、增殖和分化的病理生理過程。AG490是一種酪氨酸激酶抑制劑,應用于抑制JAK1、2。在腦缺血大鼠模型中,AG490治療可改善卒中后腦水腫、氧化應激、炎癥水平[5]。有研究報道,自噬相關信號通路的激活參與卒中的病理生理變化過程,并發揮神經保護作用[6]。然而AG490能否通過抑制JAK2/STAT3降低卒中后炎性反應、調節自噬減輕血腦屏障損傷、改善神經功能損傷尚缺乏相關研究。本研究旨在探討AG490對缺血性腦卒中后小鼠神經功能改善的機制,為JAK1/2抑制劑成為未來缺血性腦卒中新的治療藥物奠定理論基礎。
1 材料與方法
1.1 實驗動物及分組 成年雄性C57BL/6J小鼠,20~22 g,6~8周齡,購買自北京維通利華實驗動物技術有限公司[許可證號:SCXK(京)2016-0006,批號:110011200109844553]。造模后隨機分為Control組、Stroke組、DMSO組、AG490組(AG490,JAK1/2抑制劑,購自美國MCE公司),每組18只。Control組為正常對照組,Stroke組不給予任何治療,DMSO組注射等量的DMSO溶劑,AG490組在造模后1 h、24 h及48 h腹腔注射AG490(5 mg/kg,溶解于5%DMSO+40%PEG300+55%NaCl)。所有小鼠提供充足的食物和水,并維持晝夜節律的穩定。
1.2 方法
1.2.1 缺血性腦卒中模型及動物處理 采用光化學法誘導局灶性大腦皮層缺血性腦卒中模型。主要步驟:稱重小鼠,在術前5 min腹腔注射玫瑰紅染料(50 mg/kg,0.9%生理鹽水溶解)。腹腔注射5%水合氯醛(70 μL/10 g)麻醉小鼠,之后將麻醉的小鼠固定于立體定位儀上,放置小鼠體溫維持板以維持體溫。沿顱骨中縫切開小鼠顱骨表面皮膚,約1 cm,暴露并標記梗塞部位的顱骨外骨膜。將綠光源的光纖探頭固定于標記部位,開啟綠光光源照射25 min,注意監測小鼠生命體征。結束照射后縫合切口,碘伏再次對縫合傷口消毒,維持小鼠體溫至徹底清醒,恢復自由進食水。造模成功率:95%,造模成功標準:小鼠造模后前肢和后肢屈曲,不能正常走直線,頭部在30 s內偏離垂直軸>10°,向輕癱側傾倒。
1.2.2 神經功能評估 采用足錯步實驗評價其運動功能,判斷缺血性腦損傷后損傷程度和恢復情況。在完成造模后第1、3、7、14天的固定時間,讓小鼠在不規則的鐵網上行走,記錄小鼠行走100步中偏癱側掉落網格的數目,對掉落網格的比例進行統計,結果表示為(錯步/總步)%。
1.2.3 RT-PCR檢測 目的基因的表達在造模后72 h處死小鼠,取新鮮腦組織,加入TRIzol裂解液,研碎充分,制備RNA,使用逆轉錄試劑盒將RNA逆轉錄成cDNA。20 μL的反應體系由2.5 μL的cDNA、1.25 μL的正向引物、1.25 μL的反向引物、5.0 μL的無酶水和10 μL的SYBR green PCR Master Mix組成。通過RT-PCR檢測目的基因的表達水平。通過與內參基因Ct值之間的差值來計算基因表達差異,即2-△△Ct。引物序列見表1。

表1 引物序列Tab 1 primer sequences
1.2.4 蛋白質免疫印跡檢測 目的蛋白的表達在造模后72 h處死小鼠,收集缺血側皮質組織,稱重后放入加有裂解液的研磨管勻漿,勻漿后的組織裂解物脈沖超聲處理30 s,然后以13 000 r/min 4℃離心15 min。收獲上清液并用Nanodrop測定蛋白質濃度。提取的蛋白質在10% SDS-PAGE凝膠上進行電泳,隨后轉移到PVDF膜上,用含有5% BSA的0.1% Tween-TBS封閉膜,一抗[Claudin5(1∶1 000)、ZO-1(1∶1 000)、Occludin(1∶1 000)、LC3Ⅱ/Ⅰ(1∶1 000)、P62/SQSTM1(1∶1 000)、Beclin-1(1∶1 000)]4℃過夜孵育,抗小鼠GAPDH用作對照。用發光試劑盒檢測二抗結合的一抗。使用ImageJ軟件掃描和量化免疫反應條帶。目的蛋白的相對表達量=目的條帶的灰度值/內參的灰度值。
1.3 統計學處理 利用Graphpad Prism9.0進行統計分析,符合正態分布數據以±sx表示。多組間比較采用單因素方差分析,組內進一步兩兩比較采用Bonferroni檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 AG490改善小鼠缺血性腦卒中后的神經功能如圖1所示,與Control相比,DMSO組和Stroke組的錯步/總步比例在卒中后各時間點顯著增加,而在第3天、7天和14天,AG490組小鼠比DMSO組和Stroke組的錯步/總步比例降低(F=3.704、9.199、10.83,均P<0.05)。
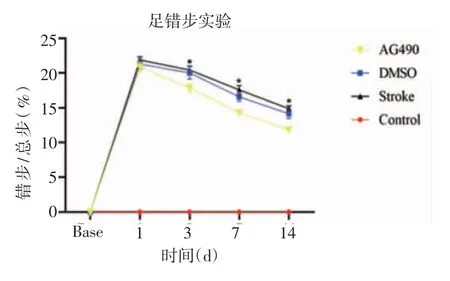
圖1 AG490改善小鼠缺血性腦卒中后的神經功能Fig 1 AG490 improves neurological function after ischemic stroke in mice
2.2 AG490抑制JAK2-STAT3的表達 如圖2所示,與Control相比,DMSO組和Stroke組小鼠腦組織中的JAK2、STAT3的mRNA表達水平上調(F=8.718、12.12,均P<0.05),而與DMSO組和Stroke組相比,AG490組小鼠JAK2和STAT3的mRNA水平表達下調(F=6.331、7.168,均P<0.05)。
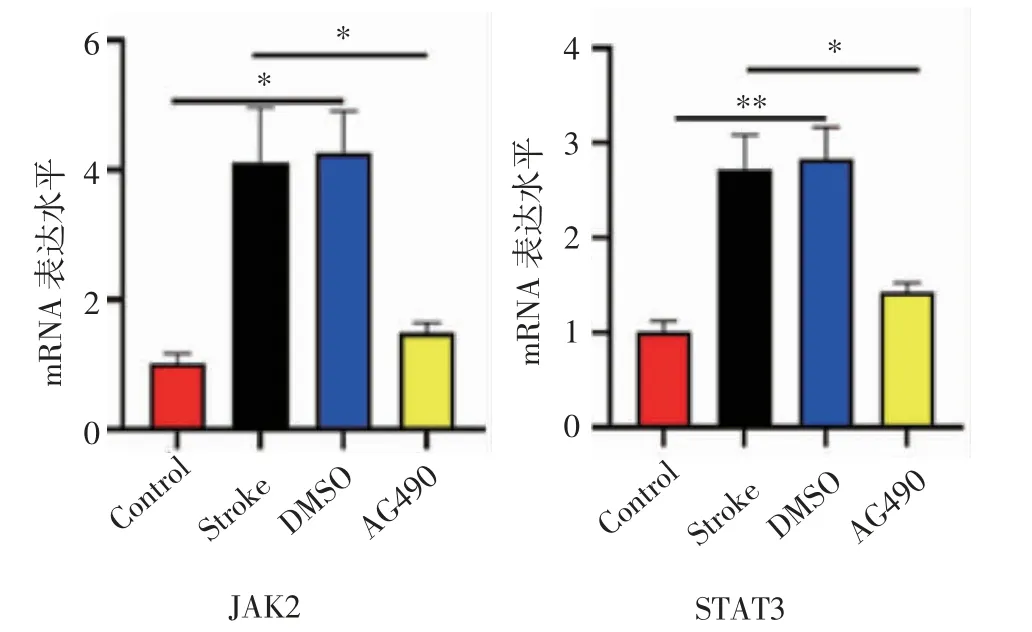
圖2 AG490抑制JAK2-STAT3的表達Fig 2 AG490 inhibits the expression of JAK2-STAT3
2.3 AG490改善小鼠缺血性腦卒中后的血腦屏障圖3A~3C顯示,與Control組相比,DMSO組和Stroke組小鼠腦組織中的Occludin、Claudin5和ZO-1的mRNA表 達 明 顯 降 低(F=29.83、25.22、20.49,均P<0.05),而MMP-9的mRNA表達明顯升高(F=17.06,P<0.05),而與DMSO組和Stroke組小鼠相比,AG490組小鼠腦組織中的Occludin、Claudin5和ZO-1的mRNA表達明顯上調(F=7.648、29.83、25.08,均P<0.05),同時MMP-9的mRNA表達明顯降低(F=9.790,P<0.01)。圖3F~3H結果顯示,與Control組相比,DMSO組和Stroke組小鼠腦組織中的Occludin、Claudin5和ZO-1的蛋白表達明顯降低(F=14.05、57.83、22.75,均P<0.05),而與DMSO組和Stroke組小鼠比較,AG490組小鼠腦組織中的Occludin、Claudin5和ZO-1的蛋白表達明顯上調(F=12.42、10.88、14.32,均P<0.05)。
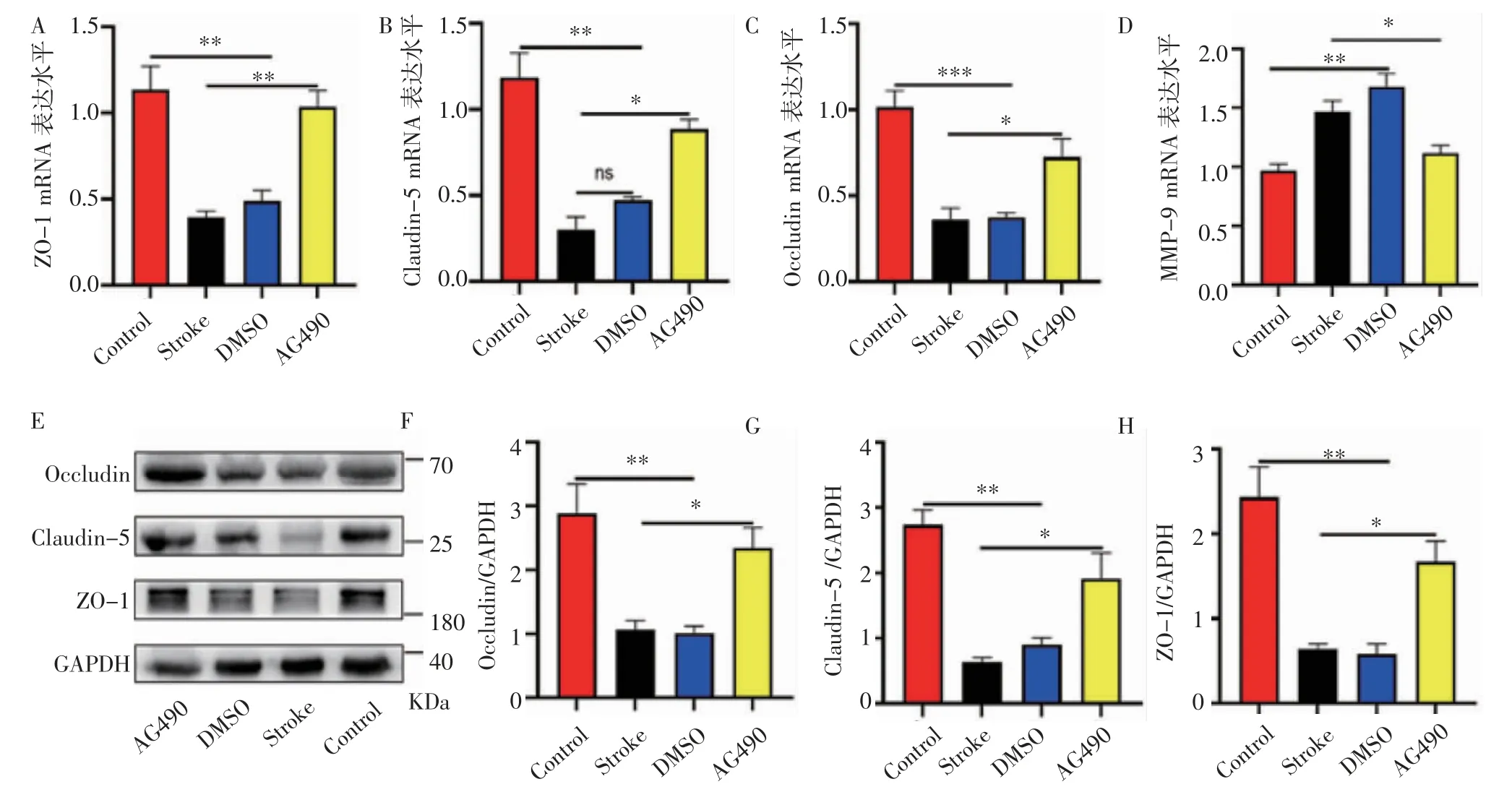
圖3 AG490改善小鼠缺血性卒中后的血腦屏障損傷Fig 3 AG490 ameliorates blood-brain barrier disruption after ischemic stroke
2.4 AG490降低缺血性腦卒中后炎癥因子的表達水平 圖4顯示,與Control組相比,DMSO組和Stroke組小鼠IL-1α、MCP-1和C1q的水平升高(F=8.451、18.55、6.380,均P<0.05),而與DMSO組和Stroke組相比,AG490組小鼠IL-1α、MCP-1和C1q的水平顯著降低(F=5.486、5.455、4.862,均P<0.05)。
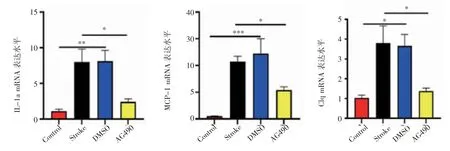
圖4 AG490降低缺血性腦卒中后炎癥因子的表達水平Fig 4 AG490 reduces the expression levels of inflammatory factors after ischemic stroke
2.5 AG490促進缺血性腦卒中小鼠的自噬 如圖5所示,與Control組相比,DMSO和Stroke組腦組織中的LC3Ⅱ/LC3Ⅰ和Beclin-1輕度增加(F=95.85、20.07,均P<0.05),而P62/SQSTM1降低(F=6.322,P<0.05),與DMSO和Stroke組相比,AG490組LC3Ⅱ/LC3Ⅰ和Beclin-1的表達水平增加(F=6.092、15.52,均P<0.05),而P62/SQSTM1的表達降低(F=8.143,P<0.05)。
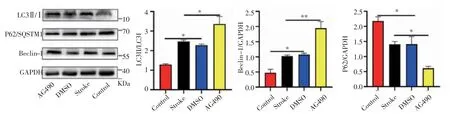
圖5 AG490促進缺血性腦卒中小鼠的自噬Fig 5 AG490 promotes autophagy in ischemic stroke mice
3 討論
質膜中的STAT3在各種細胞因子和生長因子刺激下被JAK2磷酸化,二聚化后移位入細胞核中,結合RelA/p65促進核因子-κB的激活,參與免疫細胞的分化并介導炎性因子產生,進一步傳播和放大炎性損傷過程[7]。研究表明,腦卒中患者循環中JAK2、STAT3顯著上調[8],STAT3基因敲除的卒中小鼠表現出較小的梗死面積、較輕的神經功能缺損[9]。在過氧化氫誘導的細胞氧化應激模型中,AG490的使用改善了細胞氧化損傷,同時下調了p-JAK2和p-STAT3的表達[10]。針對JAK2-STAT3信號通路的抗神經元凋亡療法可以增加卒中小鼠的存活率[11]。本研究通過光化學法誘導局灶性大腦皮層缺血性腦卒中模型,應用AG490治療腦卒中小鼠,結果顯示AG490顯著改善小鼠卒中后神經功能并同時降低卒中小鼠JAK2和STAT3表達水平。
缺血性腦卒中后,神經血管單元的損傷導致血腦屏障破壞以及炎癥細胞和炎癥因子從體循環中流入,導致腦水腫和神經元損傷并促進出血轉化,最終增加死亡率。同時,腦損傷激活的內皮細胞通過分泌MMPs介導緊密連接蛋白(tight junction,TJs)的降解導致血腦屏障進一步破壞,促進白細胞募集到缺血后腦組織中增強神經炎癥反應,進一步加速腦損傷[12]。在膠質母細胞瘤模型中,IL-6誘導的JAK/STAT3通路激活降低了TJs的表達,而AG490的治療恢復了血腦屏障的功能[13]。在本研究中,缺血性腦卒中導致小鼠的Occludin、Claudin-5和ZO-1的降解,而AG490治療逆轉了Occludin、Claudin-5和ZO-1的表達。同時,卒中后MMP-9表達上調,MMP-9可通過增加卒中后血腦屏障的開放增加出血轉化風險,而AG490可部分抑制MMP-9的表達,進一步表明AG490可通過改善血腦屏障介導部分神經保護作用。
卒中后神經損傷激活損傷相關的分子模式,導致小膠質細胞激活以及中性粒細胞浸潤,釋放促炎細胞因子以及趨化因子[14]。研究表明,IL-1α、MCP-1、C1q等炎癥因子參與腦損傷的病理進展并與預后相關[15-17]。IL-1α可促進腦內巨噬細胞的活化,在缺血24 h后,IL-1α的表達與局灶性血腦屏障破壞和神經元死亡密切相關[15]。MCP-1參與卒中后錐體神經元延遲性死亡的病理過程,并促進卒中的復發事件[16]。而腦損傷后C1q的表達通過促進小膠質細胞突觸吞噬和突觸丟失顯著增加了小鼠的神經系統損傷[17]。本研究發現,IL-1α、MCP-1和C1q在卒中后腦組織中表達上調,而IL-1α、MCP-1和C1q的水平在AG490治療顯著降低。表明AG490可通過降低卒中后炎癥因子的表達介導神經保護作用。
自噬是細胞在應激或損傷狀態下通過清除導致細胞功能障礙的受損細胞成分維持細胞穩態的生物過程。卒中可影響自噬的轉錄調控機制誘導自噬發生,抑制細胞凋亡、增加卒中后神經元的活力[6,18]。自噬受損會導致銜接蛋白p62積累,促進TRAF6寡聚化激活轉錄因子NF-κB[19],調節炎癥的發生。研究表明,抑制JAK2/STAT3的激活可促進小鼠腹主動脈瘤形成過程中的自噬[20]。此外,細胞質STAT3通過與PKR結合抑制自噬[21]。本研究發現,LC3-Ⅱ/Ⅰ作為自噬激活的標志物在卒中后輕度增加,p62的表達在卒中后降低,而AG490的治療上調了LC3-Ⅱ/Ⅰ、Beclin-1的表達,降低了P62的表達,表明AG490促進卒中后的自噬。而AG490可以抑制JAK2-STAT3的表達,表明AG490通過抑制JAK2-STAT3的表達促進卒中后的自噬過程。此外,相關研究發現抑制自噬會加劇缺血/再灌注(ischemia/reperfusion,I/R)誘導的血腦屏障損傷,而在激活自噬后可通過促進ZO-1在細胞膜上的重新定位顯著逆轉I/R后的ZO-1的表達[22]。本研究發現,AG490可促進自噬的發生并逆轉緊密連接蛋白的表達,表明AG490可能間接影響卒中后的自噬過程,抑制緊密連接蛋白的降解來改善血腦屏障功能障礙。綜上所述,AG490可通過促進自噬間接調控神經炎癥、改善血腦屏障功能障礙來介導卒中后的神經保護作用。
總之,本研究表明,AG490抑制JAK2/STAT3通路激活,對腦缺血性損傷具有神經保護作用,這可能是由減輕神經炎癥、促進卒中后的自噬以及改善血腦屏障損傷介導的。JAK2/STAT3通路介導卒中后神經損傷機制的研究為腦缺血提供了新的見解和治療靶點,未來應關注JAK2/STAT3作為缺血性腦卒中治療靶點的進一步研究和臨床轉化。

