HDAC1、MAPK水平與慢性鼻-鼻竇炎伴鼻息肉患者糖皮質激素抵抗的關系
劉春苗,牛春生,楊強
(天津醫科大學寶坻臨床學院,天津市寶坻區人民醫院耳鼻喉科,天津 301800)
慢性鼻-鼻竇炎(CRS)是一種發生于鼻腔及鼻竇黏膜的慢性炎癥疾病,慢性鼻-鼻竇炎伴鼻息肉(CRSwNP)是CRS較為嚴重的一種,可引發嚴重的頭痛、流涕、嗅覺喪失、鼻塞等癥狀,對患者生活質量和身體健康具有較大影響[1]。糖皮質激素(GC)是臨床治療CRSwNP的首選抗炎藥物,對改善患者臨床癥狀療效較好,但部分患者對GC治療不敏感,臨床稱之為GC抵抗,GC抵抗的發生會直接影響GC的治療效果,因此,了解影響GC抵抗發生的危險因素具有重要臨床意義[2-3]。組蛋白去乙酰化酶(HDACs)屬于去乙酰化酶超家族,組蛋白去乙酰化酶1(HDAC1)是HDACs中研究較多的一種,其水平的高低可反映組蛋白乙酰轉移酶(HAT)和HDAC的動態平衡,HDACs主要分布于細胞核中,參與機體炎癥,可通過調節核因子(NF)-κB信號通路、Toll樣受體4(TLR4)-MyD88信號通路發揮抗炎作用,其中組蛋白修飾是重要組成成分,組蛋白乙酰化/去乙酰化與基因活化密切相關[4]。絲裂原活化蛋白激酶(MAPK)是一類絲氨酸/蘇氨酸蛋白激酶,主要包括細胞外信號調節蛋白激酶(ERK)、c-Jun N末端蛋白激酶(JNK)、p38MAPK 3個亞型,其信號通路主要存在于細胞內,可將細胞外的刺激信號轉導至細胞核,參與細胞炎癥、增殖、轉化、分化及凋亡等多種生物學反應[5]。段甦等[6]通過RT-PCR及免疫組化染色檢查發現HDAC1 mRNA及蛋白表達在鼻竇炎伴鼻息肉患者鼻息肉中表達上調。同時王彤等[7]對單純CRS及CRSwNP患者MAPK信號通路進行檢測,顯示MAPK通路對鼻黏膜上皮細胞增殖作用在CRS中減弱。近年來有研究指出,HDAC1和MAPK在臨床中存在一定相關性[8],因此筆者探討HDAC1、MAPK信號傳導通路中ERK、JNK、p38MAPK水平在預測CRSwNP患者GC抵抗中的價值。
1 對象與方法
1.1 一般資料 選取2018年10月—2020年10月收治的CRSwNP患者60例,根據患者是否存在GC抵抗分為GC抵抗組(n=22)和GC敏感組(n=38),其中GC抵抗組男12例,女10例;年齡25~69歲,平均年齡(38.45±2.31)歲;體重指數(BMI)為19~26 kg/m2,平均BMI(23.56±2.10)kg/m2;GC敏感組男21例,女17例;年齡25~68歲,平均年齡(38.15±2.05)歲;BMI為19~26 kg/m2,平均BMI(23.91±2.34)kg/m2。性別、年齡、BMI兩組比較差異無統計學意義(P>0.05)。已獲院醫學倫理委員會批準(2018-7號)。診斷標準:符合《慢性鼻-鼻竇炎診斷治療指南》[9]中CRSwNP診斷標準。入選標準:(1)符合CRSwNP診斷標準。(2)年齡≥18歲。(3)入組前3個月未接受GC治療。(4)簽署知情同意書。排除標準:(1)變應性鼻炎。(2)免疫缺陷者。(3)合并嚴重肝、肺、腎及心血管疾病。
1.2 方法(1)GC抵抗標準:鼻內鏡下鉗夾活檢法取治療前組織標本。給予甲潑尼龍(天津天藥藥業股份有限公司,國藥準字:H20020224)口服,劑量為24 mg/次,1次/d,持續治療1周后取鼻息肉組織作為GC治療后的樣本。對比治療前后樣本,采用鼻內鏡下息肉Lured-Kennedy改良鼻內鏡評分[8]評估患者對GC治療的反應,Lured-Kennedy共評估6項,每項0~2分,總分為12分,其中Lured-Kennedy評分改善≥1分為GC敏感,否則為GC抵抗。(2)mRNA檢測:常規Trizol(購自美國Invitrogen公司)提取總細胞中RNA,以熒光實時定量反轉錄聚合酶鏈反應(VQ-RT-PCR)逆轉錄cDNA測定HDAC1 mRNA。VQ-RT-PCR反應體系:5×定量PCR緩沖液10 μL,上游引物、下游引物、熒光探針各(10 pmol/μL)1 μL,ddH2O 30 μL,cDNA 5 μL,Taq酶(2 U/μL)1.5 μL,總體積:50 μL。反應條件:3 min 93℃,45 s 93℃,45 s 55℃,共40個循環。反應結束后由計算機對熒光信號進行處理并繪制標準曲線,樣本結果以相對循環閾值法由計算機讀出。VQ-RT-PCR試劑盒由德國Qiagen公司提供,以Primer Premier 5.0軟件設計引物,采用β-actin和GA PDH進行雙內參校正。HDAC1引物和探針由美國ABI公司設計合成,治療前后測定。MAPK相關指標測定:取GC治療前、后的鼻息肉組織,采用VQ-RT-PCR檢測p38MAPK mRNA、ERK mRNA、JNK mRNA表達量,測定流程同HDAC1 mRNA。VQ-RT-PCR引物序列表見表1。

表1 VQ-RT-PCR引物序列表Tab 1 VQ-RT-PCR primer sequence list
1.3 統計學處理 選用SPSS 22.0軟件對數據進行統計學分析,計量資料采用Kolmogorov-Smirnov法檢驗正態性,正態分布資料按±s表示,兩兩比較行t檢驗;偏態分布資料采用中位數[M(Q1~Q3)]表示,兩兩比較行秩和檢驗;計數資料以(%)表示,組間行χ2檢驗;利用受試者工作特征(ROC)曲線分析HDAC1 mRNA、p38MAPK mRNA、ERK mRNA、JNK mRNA對CRSwNP患者GC抵抗發生的預測價值,多因素分析采取非條件Logistic逐步回歸分析,P<0.05為差異有統計學意義。
2 結果
2.1 兩組HDAC1、p38MAPK、ERK、JNK mRNA水平比較 治療前兩組各指標水平比較差異無統計學意義(均P>0.05)。治療后GC抵抗組HDAC1 mRNA表達量顯著低于GC敏感組,p38MAPK、ERK、JNK mRNA表達量顯著高于GC敏感組(均P<0.05),見表2。
表2 兩組HDAC1、p38MAPK、ERK、JNK mRNA比較(±s)Tab 2 Comparison of HDAC1 mRNA,p38MAPK mRNA,ERK mRNA and JNK mRNA between the two groups(±s)
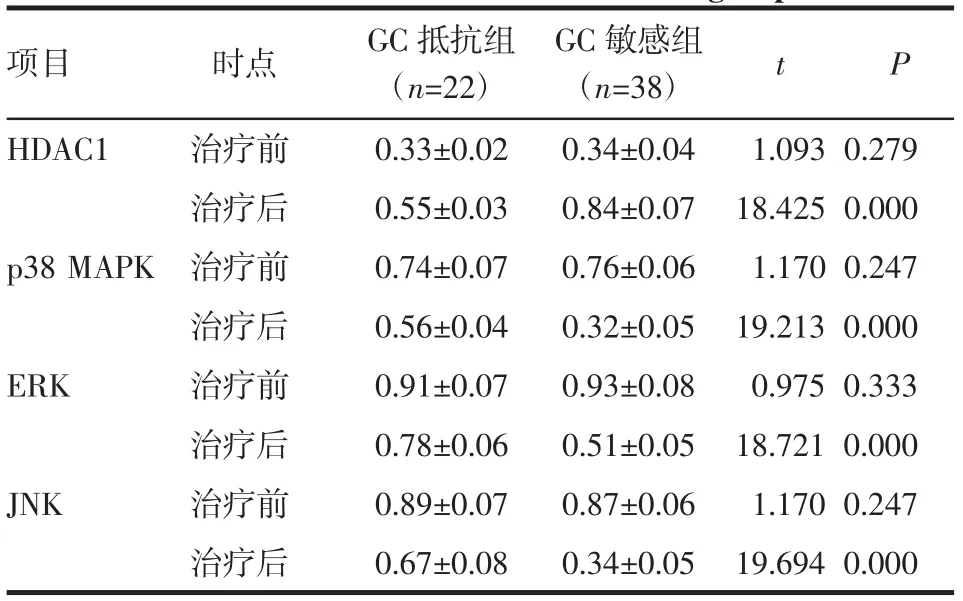
表2 兩組HDAC1、p38MAPK、ERK、JNK mRNA比較(±s)Tab 2 Comparison of HDAC1 mRNA,p38MAPK mRNA,ERK mRNA and JNK mRNA between the two groups(±s)
注:GC:糖皮質激素;HDAC1:組蛋白去乙酰化酶1;p38 MAPK:p38絲裂原活化蛋白激酶;ERK:細胞外信號調節蛋白激酶;JNK:c-Jun N末端蛋白激酶
GC敏感組(n=38)HDAC1 治療前 0.33±0.02 0.34±0.04治療后 0.55±0.03 0.84±0.07 p38 MAPK治療前 0.74±0.07 0.76±0.06項目 時點 GC抵抗組(n=22)t P 0.279 0.000 0.247治療后 0.56±0.04 0.32±0.05 19.213 0.000 ERK 治療前 0.91±0.07 0.93±0.08 0.975 0.333治療后 0.78±0.06 0.51±0.05 18.721 0.000 JNK 治療前 0.89±0.07 0.87±0.06 1.170 0.247治療后 0.67±0.08 0.34±0.05 19.694 0.000 1.093 18.425 1.170
2.2 HDAC1 mRNA、p38MAPK mRNA、ERK mRNA、JNK mRNA預測CRSwNP患者GC抵抗發生的ROC曲線分析 經ROC曲線分析,HDAC1 mRNA、p38MAPK mRNA、ERK mRNA、JNK mRNA預 測CRSwNP患者GC抵抗發生的曲線下面積分別為0.715、0.917、0.863、0.885,均P<0.05,見表3。HDAC1 mRNA、p38MAPK mRNA、ERK mRNA、JNK mRNA預測CRSwNP患者GC抵抗發生的ROC曲線見圖1。
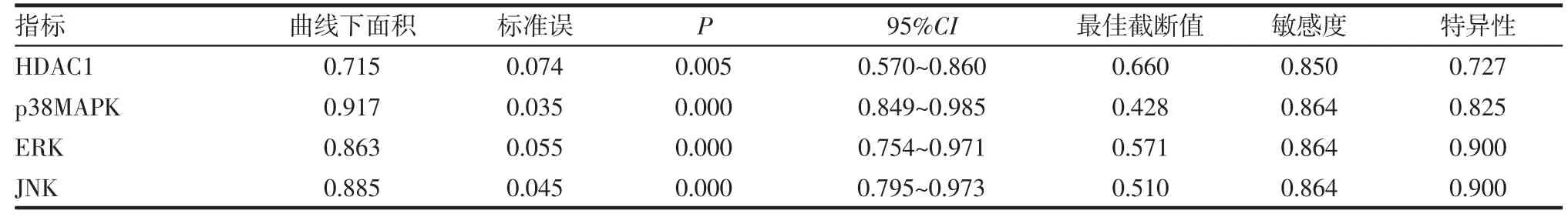
表3 HDAC1 mRNA、p38MAPK mRNA、ERK mRNA、JNK mRNA預測CRSwNP患者GC抵抗發生的ROC分析Tab 3 ROC analysis of HDAC1 mRNA,p38MAPK mRNA,ERK mRNA and JNK mRNA predicting the occurrence of GC resistance in patients with CRSwNP
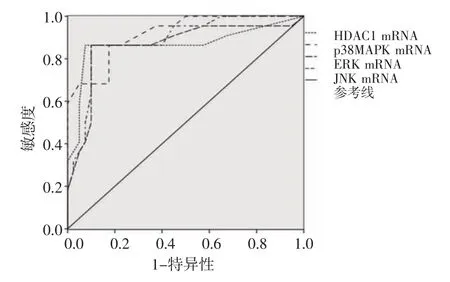
圖1 HDAC1、p38MAPK、ERK、JNK mRNA預測CRSwNP患者GC抵抗發生的ROC曲線Fig 1 ROC curve of HDAC1 mRNA,p38MAPK mRNA,ERK mRNA and JNK mRNA predicting the occurrence of GC resistance in patients with CRSwNP
2.3 CRSwNP患者GC抵抗發生的多因素Logistic回歸分析 將有差異的單因素納入Logistic模型,行量化賦值,因變量為是否發生GC抵抗(是=1,否=0),自變量為HDAC1 mRNA(<0.660=1,≥0.660=0)、p38MAPK mRNA(≥0.428=1,<0.428=0)、ERK mRNA(≥0.571=1,<0.571=0)、JNK mRNA(≥0.510=1,<0.510=0)。經多因素Logistic回歸分析證實,HDAC1 mRNA<0.660、p38MAPK mRNA≥0.428、ERK mRNA≥0.571、JNK mRNA≥0.510是CRSwNP患者GC抵抗發生的危險因素,均P<0.05,見表4。
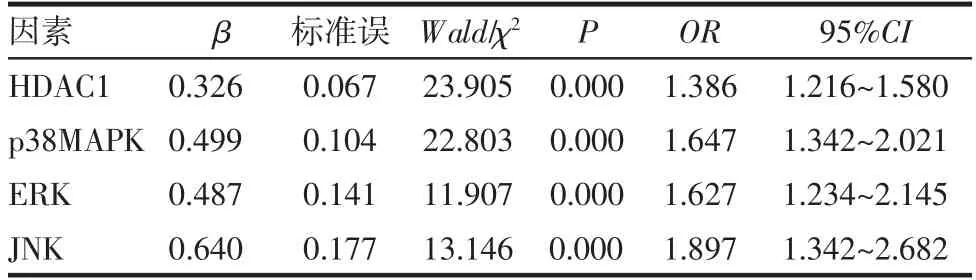
表4 CRSwNP患者GC抵抗發生的多因素Logistic回歸分析Tab 4 Multivariate Logistic regression analysis of GC resistance in patients with CRSwNP
3 討論
GC的抗炎效果由糖皮質激素受體(GR)介導,GR主要有GRα和GRβ兩種亞型,GRα含量在鼻黏膜中遠大于GRβ,其中GRα活化后可與GC結合產生GR-GC復合物,復合物轉移至細胞核中以同源二聚體形式與靶基因中GC反應元件結合,在其他輔助因子參與下改變靶基因染色體,使其發生重構并激活靶基因轉錄來發揮抗感染、抗炎、抑制免疫等生物學效應[10-11]。而GRβ無法與GC結合,但可競爭性與GRα結合生成異源二聚體來減少GR-GC復合物的產生,同時抑制GRα活性,以此降低GC的抗炎效果,因此,GRα/GRβ比值降低是GC抵抗發生的重要原因[12]。另外,GR可與其他轉錄因子如NF-κB、活化蛋白1(AP-1)相互作用,抑制炎性基因轉錄,從而抑制炎癥因子產生[13]。
本研究中,GC抵抗組HDAC1 mRNA顯著低于GC敏感組,p38MAPK、ERK、JNK mRNA表達量顯著高于GC敏感組,提示上述因素可能是導致CRSwNP患者GC抵抗發生的影響因素。組蛋白乙酰化由HAT和HDAC共同調節,當機體HDAC1表達量下降,HAT和HDAC動態平衡被打破,組蛋白過乙酰化,致使細胞內炎癥相關基因轉錄增多,炎癥蛋白合成增加,阻斷了GC抗炎效果[14-15];HDAC1表達量下降還可使去乙酰化的NF-κB乙酰化,激發NF-κB活性,導致活化的GC與GRα結合的反應元件能力下降,使GC抗炎作用下降,從而引發GC抵抗[16-17]。
MAPK信號通路可參與上游信號轉導途徑,參與GR亞型的合成,使GRα/GRβ比值發生改變,促使GC抵抗發生[18]。同時MAPK信號通路被不同的細胞外和細胞內刺激激活,如氧化應激、內質網應激等,因此MAPK信號通路可以此調節細胞炎癥、應激、分化、生長等病理和生理過程[19]。MAPK信號通路可被細菌病原體、促炎因子等激活,激活后的MAPK信號通路可從脂質進入細胞核,促使NF-KB活化,并調節相關基因表達來參與機體炎癥反應,促使促炎因子如白介素、腫瘤壞死因子α等產生,誘發GC抵抗[20]。
經多因素Logistic回歸分析及ROC分析證實,HDAC1 mRNA<0.660、p38MAPK mRNA≥0.428、ERK mRNA≥0.571、JNK mRNA≥0.510是CRSwNP患者GC抵抗發生的危險因素。因此,采用GC對CRSwNP患者進行治療時,臨床需對上述因素予以關注,異常者及時采取相應措施,降低GC抵抗發生。
綜上,CRSwNP患者GC抵抗發生的機制較為復雜,HDAC1及MAPK可直接或間接參與機體許多生理反應過程,在GC抵抗發生中起重要作用。

