法螺G型溶菌酶重組蛋白的原核表達及抑菌活性探究
賈慧霞, 張 華, 張成龍, 何毛賢, 劉文廣
法螺G型溶菌酶重組蛋白的原核表達及抑菌活性探究
賈慧霞1, 2, 張 華1, 3, 張成龍4, 何毛賢1, 3, 劉文廣1, 3
(1. 中國科學院熱帶海洋生物資源與生態重點實驗室, 廣東省應用海洋生物學重點實驗室, 中國科學院南海海洋研究所, 廣東 廣州 510301; 2. 中國科學院大學, 北京 100049; 3. 南方海洋科學與工程廣東省實驗室(廣州), 廣東 廣州 511458; 4. 三沙市海洋和漁業局, 海南 三沙 573199)
G型溶菌酶(G-type lysozyme,)是一種富含半胱氨酸的天然免疫因子, 在無脊椎動物的免疫防御過程中起重要作用。本研究旨在通過揭示法螺() G型溶菌酶()重組蛋白的抑菌功能, 為進一步認識法螺的分子免疫機理及病害防治提供新思路。首先對序列進行了分析, 利用實時熒光定量PCR檢測的組織分布, 然后以pGEX-4T-1為表達載體, 構建重組質粒pGEX-4T-1-, 進行重組蛋白表達, 并檢測了重組蛋白的抑菌活性。結果顯示: 1)cDNA的5′非翻譯區(UTR)為66 bp, 3′UTR為186 bp, 開放閱讀框為789 bp, 編碼262個氨基酸, 有1個可溶性轉糖苷酶(SLT)結構域(72~255 aa), 包含6個半胱氨酸殘基和3個酶活性催化位點(Glu72、Asp85、Asp96); 2) 多序列比對及系統發育分析表明,與親緣關系較近的福壽螺G型溶菌酶氨基酸的同源性最高; 3)在所有被檢測組織中均表達, 其中在肝臟、外套膜表達量較高; 4) 16 ℃, 0.5 mmol/L IPTG誘導表達10 h后, 重組蛋白在上清液和包涵體均表達分子量約為51.91 kDa, 純化后得到濃度為1.2 mg/mL的重組蛋白; 5) 抑菌實驗表明, 重組蛋白pGEX-4T-1-具有抗金黃色葡萄球菌、藤黃微球菌、施羅氏弧菌的活性, 對革蘭氏陽性細菌的抑菌作用大于革蘭氏陰性細菌。研究結果為進一步解析法螺免疫防御的分子機理提供了參考數據和科學依據。
法螺; G型溶菌酶; 原核表達; 抑菌活性
溶菌酶是生物體內重要的非特異性免疫因子, 與抵御細菌感染的免疫功能密切相關[1]。在水產動物抵抗外來病原細菌、真菌或病毒入侵時, 溶菌酶能增強其他免疫因子的抗菌活性, 并協同抵制病原菌的入侵[2-3]。溶菌酶是一種天然的堿性抗菌蛋白, 通過水解肽聚糖β-1, 4糖苷鍵發揮溶菌功能[4-5]。根據來源、免疫特性、結構及催化特征的不同, 動物體內的溶菌酶主要分為G型、C型和I型, 廣泛存在于免疫器官和細胞中[6]。C型溶菌酶主要存在于脊椎動物中; I型溶菌酶主要分布在無脊椎動物中; G型溶菌酶最早因從鵝蛋清(goose egg-white)中分離、鑒定而得名, 主要存在于鳥類、魚類及無脊椎的雙殼軟體動物中[7]。近年來, 關于水生動物G型溶菌酶的報道日漸增多, 如長牡蠣[8]()、櫛孔扇貝[9]()、紫貽貝[10]()和膨腹海馬[7]()等中發現G型溶菌酶在不同組織中發揮一定的免疫防御作用。然而, 其在腹足綱軟體動物法螺()中的作用還未見有報道。
法螺()隸屬于嵌線螺科(Rane-llidae)、法螺屬[11](Charonia)。法螺的殼有美麗的花紋, 具有重要的經濟價值[12-13]。法螺是珊瑚礁敵害生物——長棘海星的天然捕食者, 是珊瑚礁的衛士, 在維持珊瑚礁生態系統平衡中具有重要作用。近年來, 法螺自然資源由于環境污染和過度捕撈被嚴重破壞[14-15], 在中國南海海域面臨滅絕的危險, 被列為國家二級保護動物[16], 因此亟需開展相關研究。在前期工作中, 團隊在陸上水泥池對中法螺進行了養殖實驗, 在2020年6—7月, 法螺發生病害, 死亡嚴重。在感染初期, 我們對法螺足、外套膜、腮等組織進行了細菌檢測, 結果鑒定出的病原菌主要包括弧菌和葡萄球菌。由此, 我們推測法螺在飼養過程中出現的病害可能是細菌感染引起的。因此, 本研究通過分析法螺溶菌酶基因的結構, 鑒定其為G型溶菌酶。同時, 應用實時熒光定量PCR分析在法螺不同組織中的表達情況, 并通過構建原核表達載體誘導表達法螺G型溶菌酶重組蛋白、分析重組蛋白的抑菌功能, 為認識法螺的免疫機理和病害防控提供資料。
1 材料與方法
1.1 實驗材料
法螺組織: 法螺收集于南海海域, 暫養在廣東省雷州市養殖基地。取3只大小一致、生長狀況良好個體, 剖取其外套膜、足、觸手、長鼻、唾液腺、腸及肝臟組織立即于液氮速凍, 然后保存于–80 ℃超低溫冰箱。
菌株, 質粒和試劑: 大腸桿菌DH5α和pGEX-4T-1載體由本實驗室保存; 大腸桿菌(BL21)購自北京全式金生物技術有限公司; 藤黃微球菌、腸炎沙門氏菌、溶藻弧菌、施羅氏弧菌由中國科學院南海海洋研究所宋永相老師惠贈; 金黃色葡萄球菌由中國科學院南海海洋研究所向志明老師惠贈。總RNA提取試劑盒購自Magen公司; 反轉錄試劑盒購自Toyobo公司; T4 DNA連接酶、DNA限制性內切酶EcoRI和NotI均購自TaKaRa公司; genefist三色預染蛋白marker 10-180KD(protein marker)購自廣州捷承科技有限公司。
1.2 生物信息學分析及所用軟件
使用ORF Finder (https://www.ncbi.nlm.nih.gov/ orffinder/)查找開放閱讀框(ORF); 利用ClustalX及CLC Main Workbench 6.0軟件進行多序列比對; 氨基酸結構域分析使用SMART(http:// smart.embl-heidelberg.de/)。通過ProtParam(https:// web.expasy.org/protparam/)分析氨基酸序列各項理化性質; 通過SignalP5.0(http://www.cbs.dtu.dk/services/ SignalP/)預測是否含有信號肽; 利用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)預測跨膜結構域; 通過MEGA 6.0軟件, 用循環鄰接法Nei-ghbor joining構系統發育樹, 置信度檢驗1 000次。
1.3 RNA提取、cDNA合成及實時熒光定量PCR
采用通用型RNA提取試劑盒(Magen)提取組織RNA, 用紫外可見光譜儀測定其濃度, 瓊脂糖凝膠檢測RNA條帶完整性。然后, 使用去除gDNA的逆轉錄試劑盒(Toyobo)進行cDNA第一鏈合成。用384孔板配置反應, 每孔總反應體系為10 μL, 包括: 5 μL qPCR反應酶(Toyobo)、0.3 μL正向引物和0.3 μL反向引物(序列見表1)、3.4 μL雙蒸水及用雙蒸水稀釋的1 μL模板cDNA。反應程序設置為94 ℃預變性3 min, 98 ℃變性10 s, 退火溫度根據引物TM值設置為59 ℃、25 s, 預變性循環1次, 變性退火延伸循環45次; 18S為內參基因, 重復3次。根據2?ΔΔCt法計算的表達量, 用Prism 8.0的T檢驗進行統計分析,0.05具有統計學意義。
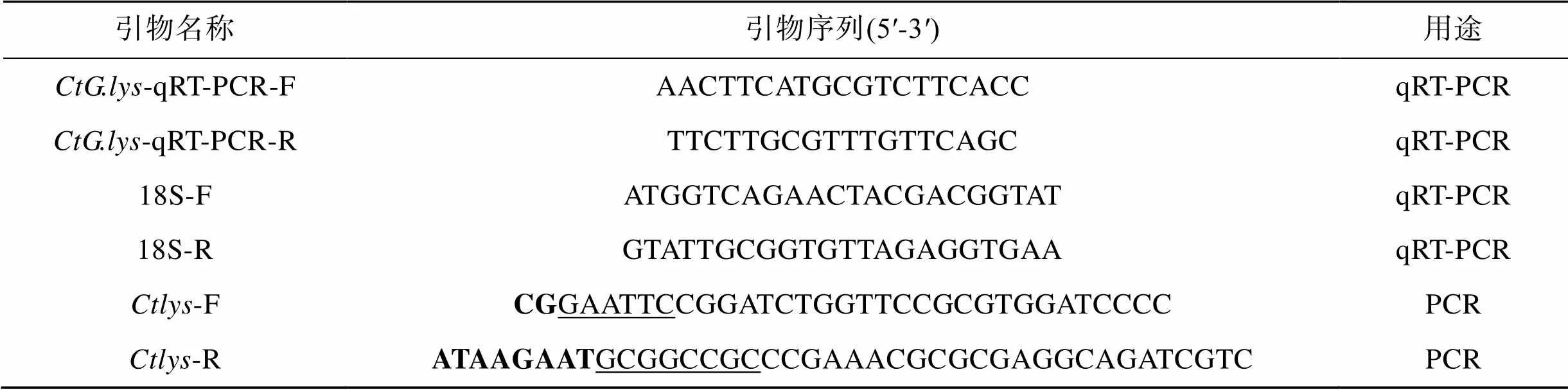
表1 本研究中所用引物
1.4 重組表達菌株的誘導表達與可溶性檢測
1.4.1 重組質粒pGEX-4T-1-的構建及誘導表達
PCR反應擴增(引物序列見表1, 下劃線堿基為EcoRI, NotI酶切位點, 粗體堿基為保護基團), 擴增體系25 μL: 引物0.5 μL, 模板cDNA 1 μL, Ex Taq 保真酶12.5 μL, ddH2O 10.5 μL。循環參數: 95 ℃預變性5 min; 95 ℃、15 s, 58 ℃ 15 s, 72 ℃、1 min, 32個循環, 72 ℃終延伸1 min。將目的基因PCR產物和表達載體pGEX-4T-1經限制性內切酶EcoRI, NotI(TaKaRa 1611, 1623)進行雙酶切反應, 后用T4 DNA酶(TaKaRa 2011A)低溫連接, 按1∶20比例將構建好的重組質粒轉化至大腸桿菌DH5α感受態細胞。次日挑取單菌落至LB(含氨芐)液體培養基, 經菌落PCR測定后送華大基因測序鑒定, 重組質粒命名為pGEX-4T-1-。將測序正確的pGEX-4T-1-轉化到表達宿主菌BL21感受態細胞中。取50 μL已轉化的重組質粒菌株接種于含100 mg/mL氨芐青霉素的LB固體培養基中, 次日挑取單菌落至5 mL LB(含氨芐)液體培養基37 ℃, 200 r/min振蕩培養至OD600值為0.5~0.6; 加入IPTG至終物質的量濃度1.0 mmol/L, 37 ℃, 200 r/min誘導表達4 h后收菌。以未經誘導的重組質粒作為對照, SDS-PAGE法檢測全菌中目的蛋白表達情況。
1.4.2 重組蛋白的可溶性檢測
取3管20 mL OD600=0.4~0.6的pGEX-4T-1-菌液分別加入0.5 mmol/L IPTG(以未誘導菌液為對照)。分別在20 ℃、16 ℃誘導10 h后各收集5 mL菌液, 用PBS緩沖液重懸菌液并超聲破碎, 4 ℃, 6 000 g離心10 min, 分別收集上清和沉淀, 分別取100 μL上清液和沉淀高溫變性。SDS-PAGE電泳檢測破碎上清液(可溶性)和沉淀(包涵體)中重組蛋白表達情況。
1.5 重組蛋白的純化
收集400 mL誘導后的菌液, 用PBS洗滌菌體, 按1∶20比例重懸菌體, 冰浴超聲波破碎, 離心收集上清液。利用GST標簽蛋白純化試劑盒(碧云天生物技術公司P2262), 按產品說明書純化重組蛋白。收集的洗脫液即為純化的蛋白樣品, SDS-PAGE電泳檢測純化后的重組蛋白。取純化后的蛋白樣品, 按5倍比例稀釋后用BCA法(BCA蛋白定量試劑盒上海雅酶生物科技有限公司ZJ101)測定純化后的蛋白濃度。樣品設置5個重復, 以牛血清白蛋白BSA, 用PBS稀釋至終質量濃度為2 mg/mL作為標準品繪制標準曲線, 用酶標儀(Tecan infinite 200Pro)測定562 nm處標準品和純化重組蛋白的吸光度值, 繪制標準曲線, 計算樣品中的蛋白濃度。
1.6 重組蛋白的抑菌活性鑒定
選取革蘭氏陽性細菌金黃色葡萄球菌、藤黃微球菌和革蘭氏陰性細菌腸炎沙門氏菌、溶藻弧菌及施羅氏弧菌劃線活化, 挑取活化后的單菌落過夜培養, 次日按10%的接種量加到LB液體(弧菌另加2.5%海鹽)培養基中發酵至OD600為0.5備用。采用平板涂布法[17-19], 以1∶100(V∶V)與純化后的重組蛋白混合, 按各菌株的培養條件, 培養2 h后取100 μL涂布于LB(或含2.5%海鹽)平板, 以不加重組蛋白、用純化時收集的pGEX-4T-1-流穿液涂布作為對照。
采用液體生長抑制法[20], 用無菌的PBS溶液將純化后的法螺溶菌酶重組蛋白稀釋至終濃度為120、140、204、220 μg/mL, 各取100 μL培養至OD600為0.5的金黃色葡萄球菌、藤黃微球菌、腸炎沙門氏菌、溶藻弧菌及施羅氏弧菌菌液備用, 與各取100 μL稀釋至所需濃度的重組蛋白混合均勻, 加入至96孔板中, 重復3次, 以不加重組蛋白用PBS代替的孔作為對照, 37 ℃、28 ℃過夜培養, 用酶標儀測定OD600, 根據實驗孔與對照孔中各菌株的生長情況判斷, 當菌液吸光值沒有明顯增加且肉眼觀察無明顯細菌增長時[21], 該孔對應的蛋白濃度即為最低抑菌濃度。
2 結果分析
2.1 法螺溶菌酶基因CtG.lys序列特征
全長cDNA編碼1 041 bp cDNA, 855 bp CDS序列, 其中5′UTR為66 bp, 3′UTR為186 bp, ORF為789 bp, 編碼262個氨基酸。ProtParam預測其蛋白質分子式C1098H1703N333O354S21, 相對分子質量25.91 kDa, 理論等電點(PI)是7.95; 氨基酸含量較高的有: Gly(14.3%)、Ser(9.4%)、Ala(9.0%)、Asn(6.9%)、Leu(5.3%); 含16個帶負電氨基酸(Asp + Glu)、含18個帶正電氨基酸(Arg + Lys); 脂肪系數60.20, 總平均親水性為–0.372, 屬于親水性蛋白。
SignaIP 5.0分析結果表明該蛋白有信號肽存在, 且位于17與18位氨基酸之間, 該蛋白為分泌蛋白。SMART分析表明該成熟肽有1個轉糖苷酶(SLT)結構域, 位于72~255 aa; TMHMM預測結果顯示該蛋白不存在跨膜結構。利用SWISS-MODEL對氨基酸序列進行三維結構預測, 用同源建模法進行模型創建, 非洲鴕鳥()(GenBank No.: 3wyh_A)為模板。建模的結果如圖1所示: 預測的三維結構符合G型溶菌酶蛋白結構, 包含7個α螺旋,的催化位點氨基酸殘基(Glu72、Asp85、Asp96)與模板蛋白(Glu73、Asp86、Asp97)的空間位置幾乎一致, 含有6個半胱氨酸殘基。
2.2 法螺溶菌酶CtG.lys系統進化
NCBI氨基酸一致性分析顯示法螺氨基酸序列與海蝸牛(登錄號: XP_012944836.1)、福壽螺(登錄號: XP_025083688.1)氨基酸一致性較高, 分別為45.11%和45.95%。與斑馬魚(登錄號: NP_001076289.1)和原雞(登錄號: XP_040517238.1)的一致性較低, 分別為39.67%和32.43%; 多序列比對顯示,與海蝸牛同源性較為一致(圖2)。不同物種系統發育分析結果顯示, 福壽螺和海蝸牛首先聚為一支, 其次與法螺聚為一支, 表明法螺與福壽螺和海蝸牛親緣關系最近(圖3)。

圖1 法螺CtG.lys(紅色)與非洲鴕鳥的溶菌酶G.lys (綠色)三維結構

圖2 法螺CtG.lys與多物種同源蛋白序列比對
注: 黑色背景堿基保守性≥50%, 灰色代表堿基相似

圖3 法螺CtG.lys與其他物種溶菌酶G.lys的鄰接法(N-J)系統進化分析(置信度檢驗1 000次)
2.3 法螺CtG.lys基因在不同組織表達分析
qRT-PCR檢測在法螺不同組織中的表達模式。結果顯示表達具有明顯的組織差異性, 在肝臟表達量最高, 外套膜、唾液腺、腸次之, 與其他組織相比差異顯著(圖4)。

圖4 法螺CtG.lys在不同組織的表達
注: 各組間含有不同字母表示差異顯著(0.05), 含相同字母表示無差異
2.4 重組蛋白pGEX-4T-1-CtG.lys原核表達及可溶性檢測
重組工程菌大腸桿菌BL21-pGEX-4T-1-經IPTG誘導后表達出相對分子質量約為51.91 kDa的融合蛋白, 以蛋白分子量10~180 kDa Maker(Genefist GF6616)為參考, 而對照組未誘導的DE3-pGEX- 4T-1-(圖5泳道1)則無此特異性條帶。由于法螺溶菌酶的蛋白分子量約為25.91 kDa, 且pGEX-4T-1包含的GST標簽蛋白分子量約為26 kDa, 故全菌中重組蛋白大小約為51.91 kDa(圖5泳道2~9), 說明增加的蛋白條帶就是重組菌株被誘導表達的融合蛋白產物。

圖5 pGEX-4T-1-CtG.lys重組質粒在大腸桿菌BL21中的IPTG誘導表達
注: 1: 未經IPTG誘導的BL21(pGEX-4T-1-)全菌蛋白; 2~9: IPTG誘導的BL21(pGEX-4T-1-)全菌蛋白; M: 蛋白質分子質量標準Marker; 箭頭指示條帶為重組蛋白
重組工程菌大腸桿菌BL21-pGEX-4T-1-經20 ℃、16 ℃, 0.5 mmol/L IPTG濃度誘導培養10 h后, 收集菌體, PBS洗滌重懸。經超聲波破碎后, 離心收集上清液和包涵體沉淀。將蛋白分子量10~180 kDa Maker(Genefist GF6616)、破碎上清液和沉淀進行SDS-PAGE電泳, 檢測pGEX-4T-1-重組蛋白的可溶性。結果顯示, 20 ℃, 0.5 mmol/L誘導10 h重組蛋白只以包涵體的形式存在(圖6a泳道6), 而16 ℃, 0.5 mmol/L誘導10 h時重組蛋白同時在上清(圖6b泳道5~8)和包涵體中表達(圖6b泳道1~4)。
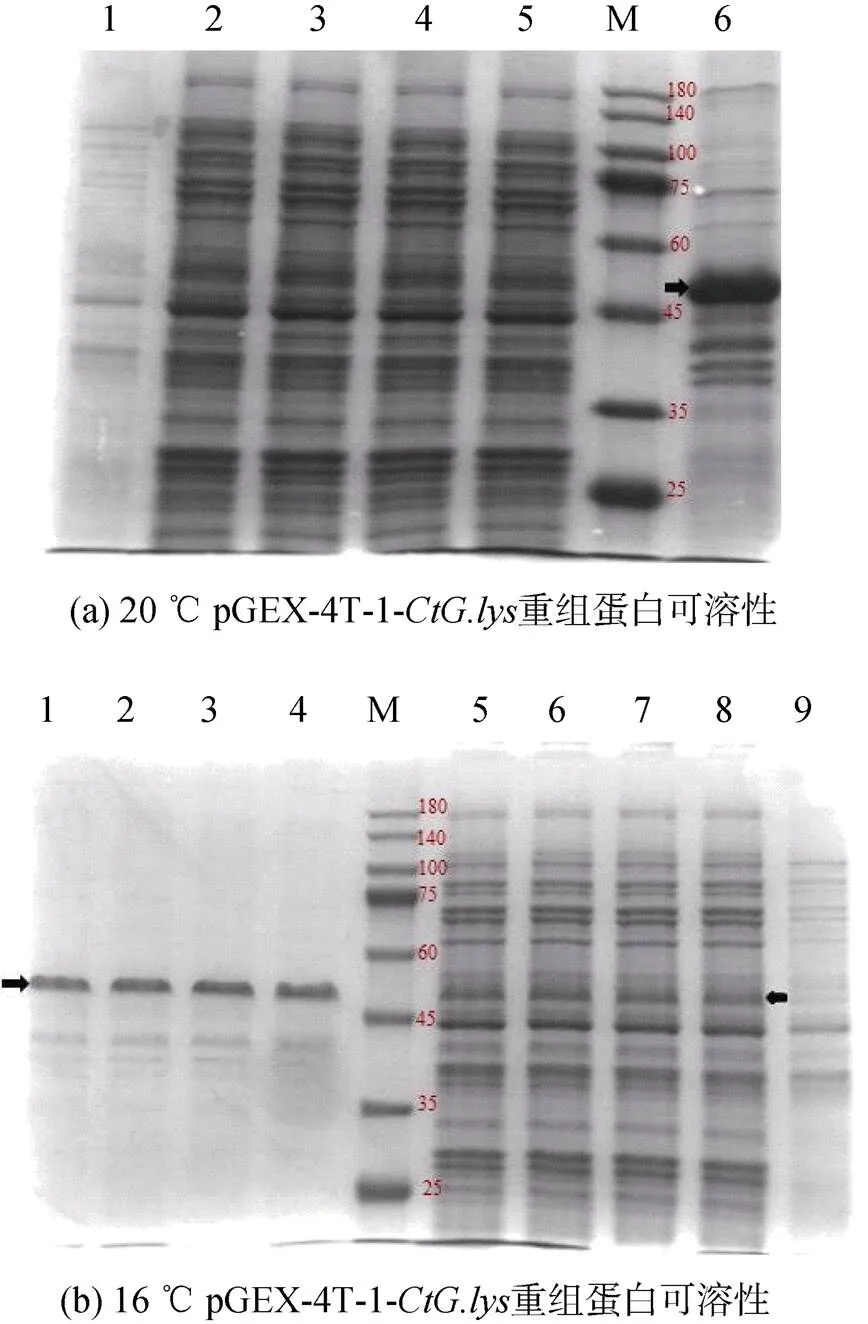
圖6 pGEX-4T-1-CtG.lys重組蛋白可溶性SDS-PAGE分析
注: a: 1. 未經IPTG誘導的BL21(pGEX-4T-1-)全菌蛋白; 2~5. IPTG誘導的BL21(pGEX-4T-1-)上清液; 6. IPTG誘導的BL21(pGEX-4T-1-)包涵體; M. 蛋白質分子質量標準Marker; 箭頭指示條帶為重組蛋白; b: 1~4. IPTG誘導的BL21(pGEX-4T-1-)包涵體; 5~8. IPTG誘導的BL21 (pGEX-4T-1-)上清液; 9. 未經IPTG誘導的BL21 (pGEX-4T-1-)全菌蛋白; M. 蛋白質分子質量標準Marker; 箭頭指示條帶為重組蛋白
2.5 重組蛋白pGEX-4T-1-CtG.lys的純化
通過親和層析柱去除未結合的蛋白, 收集此時的流穿液。用裂解液洗脫親和層析柱, 收集洗脫液; 再用含GST的洗脫緩沖液, 將GST融合蛋白從樹脂上洗脫下來, 即得到純化的融合蛋白。將蛋白分子量10~180 kDa Maker(Genefist GF6616)、流穿液(圖7a泳道1)、洗脫液(圖7a泳道2~3)、純化的融合蛋白變性后進行SDS-PAGE鑒定, 均可見到明顯的目的蛋白, 表示純化成功結果見(圖7a 泳道4~10)。測定純化重組蛋白濃度繪制BSA標準曲線如圖7b。

圖7 pGEX-4T-1-CtG.lys重組蛋白SDS-PAGE純化分析及BSA標準曲線
注: M: 蛋白分子量標準; 1. 上樣流穿液; 2~3. 洗滌液; 4~10. 洗脫純化后的蛋白; 箭頭指示條帶為純化后的重組蛋白
2.6 重組蛋白pGEX-4T-1-CtG.lys的抑菌活性
平板涂布法的抑菌活性測定結果顯示, 純化后的重組蛋白(圖8實驗組)與革蘭氏陽性細菌金黃色葡萄球菌、藤黃微球菌; 革蘭氏陰性細菌腸炎沙門氏菌、溶藻弧菌及施羅氏弧菌作用后, 菌落數明顯少于對照組(圖8對照組)。其中法螺溶菌酶重組蛋白作用后金黃色葡萄球菌、藤黃微球菌、施羅氏弧菌與對照組相比菌落數明顯減少; 腸炎沙門氏菌、溶藻弧菌的菌落數與對照組相比數量較少不明顯(圖8)。這表明法螺溶菌酶重組蛋白對革蘭氏陽性細菌的抑菌作用大于革蘭氏陰性細菌。采用液體生長抑制法測定重組蛋白對金黃色葡萄球菌、藤黃微球菌、施羅氏弧菌的最小抑菌濃度, 結果表明, 重組蛋白對金黃色葡萄球菌的最小抑菌質量濃度為70 μg/mL; 對藤黃微球菌的最小抑菌質量濃度為104 μg/mL; 對施羅氏弧菌的最小抑菌質量濃度為110 μg/mL。
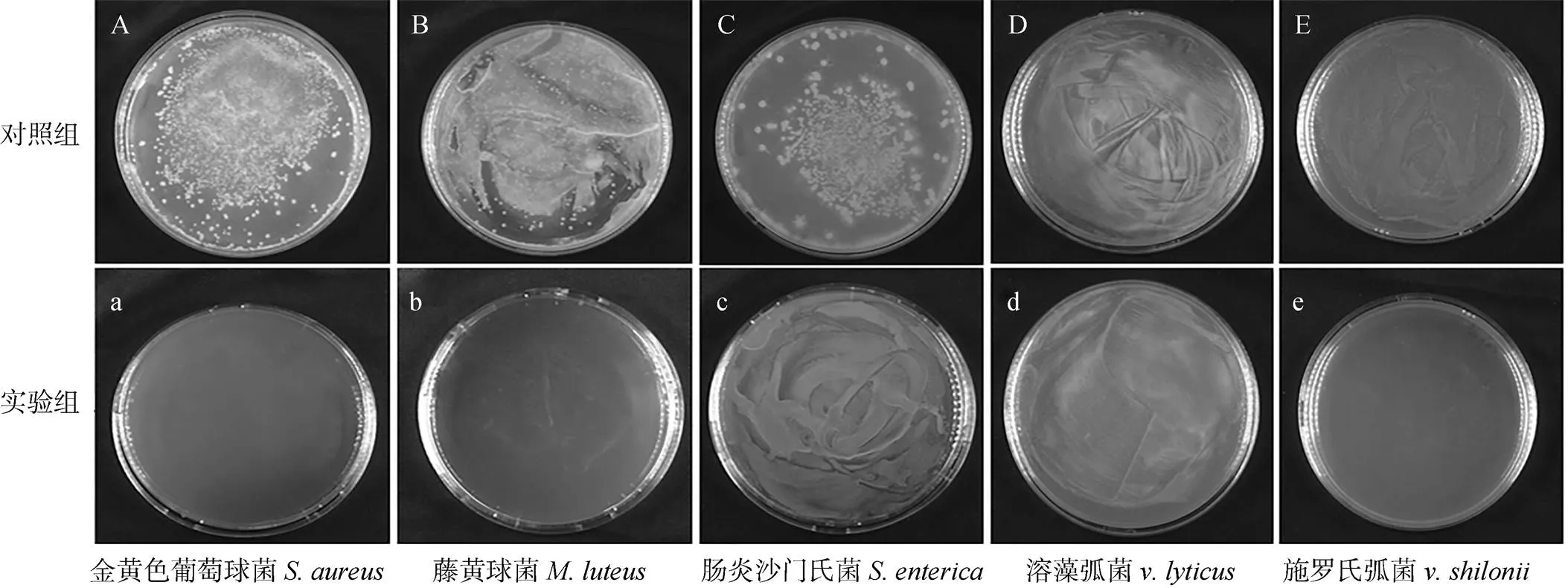
圖8 法螺G型溶菌酶重組蛋白的抑菌效果
3 討論
溶菌酶能誘導非特異性免疫應答, 具有抗菌、抗炎癥特性[22], 是一種天然的內源性抗生素[23]。水生動物溶菌酶較陸生動物溶菌酶具有更廣的抗菌譜, 能溶解革蘭氏陽性菌和革蘭氏陰性菌[24], 使其在病害防治中有很好的應用前景。本研究利用同源建模法構建的蛋白三維結構表明, 法螺的SLT結構域含有3個酶活性催化位點, 即: Glu72、Asp85、Asp96。這與G型溶菌酶的典型代表-鵝蛋清溶菌酶[25](goose egg-white lysozyme)中的催化位點略有差異。據報道, 斑馬魚[26]、大黃魚和金魚[27]等G型溶菌酶的酶活性催化位點與鵝蛋清溶菌酶相比也存在位置差異情況[28]。在魚類G型溶菌酶中, 第1位Glu和第3位Asp殘基是其發揮抗菌作用的關鍵位點[29]。由此推測, 法螺G型溶菌酶發揮抑菌活性的關鍵可能是Glu和Asp殘基與細菌細胞壁肽聚糖底物結合[30], 從而破壞N-乙酰葡糖胺和乙酰胞壁酸之間的糖苷鍵。
半胱氨酸是形成二硫鍵的前提, 二硫鍵的存在可使溶菌酶蛋白結構更穩定, 從而有助于增強水生動物對環境變化的適應性及在高滲透條件下的穩定性[31]。但是, G型溶菌酶的二硫鍵數目因物種不同存在較大的變化[32]。大西洋鮭魚G型溶菌酶中存在3個半胱氨酸殘基[6], 鯉魚和條石鯛中不存在半胱氨酸殘基[33-34]。本研究中, 法螺G型溶菌酶蛋白含有6個半胱氨酸殘基, 能形成三對二硫鍵使其空間結構更緊密, 推測其可能在抵御細菌感染時能更穩定與細菌細胞壁肽聚糖底物相結合。溶菌酶的組織分布與其功能密切相關, 如魚類中發揮免疫功能的G型溶菌酶基因, 在免疫組織脾臟中的表達量較高[3, 35]。本研究中, 法螺基因被檢測到在肝臟和外套膜中高表達。外套膜能分泌具有抑菌和殺菌作用的黏液, 是軟體動物免疫防御的第一道防線[1, 36]; 肝臟作為主要的解毒器官也參與免疫反應[37]。由此推斷, 法螺基因在其免疫防御中發揮了一定的作用。
原核重組表達菌株經低溫誘導能有效地增加可溶性蛋白的比例, 提高可溶性蛋白的表達量。葉星等[35]采用原核表達系統成功表達出草魚G型溶菌酶; 楊梅等[4]利用原核表達系統經低溫誘導獲得小菜娥溶菌酶重組蛋白, 且表達產物對革蘭氏陽性細菌的抑菌活性強于革蘭氏陰性細菌; 王秀霞及徐永平等[38-39]在大腸桿菌中對刺參溶菌酶進行了表達, 表達產物對多種海洋致病菌均具有抑菌活性是表達譜很廣的免疫效應分子。本研究中, 純化后的法螺G型重組蛋白對革蘭氏陽性細菌有較強的抑菌活性, 對革蘭氏陰性細菌的抑菌作用較弱, 這可能與不同細菌的細胞壁組成成分有關[19, 40]。革蘭氏陽性菌細胞壁組分主要是肽聚糖, 對溶菌酶敏感度高易被水解; 革蘭氏陰性菌細胞壁的肽聚糖含量較低, 且位于內層對溶菌酶的敏感度低不易被水解[41-42]。
4 結論
本研究中法螺溶菌酶基因與其他腹足綱雙殼軟體動物的G型溶菌酶序列同源性最高、結構特征最為相似, 據此判定法螺中溶菌酶基因類型為G型。另外, 成功誘導表達出法螺G型溶菌酶重組蛋白, 純化后的重組蛋白具有廣譜的抑菌活性, 能明顯抑制革蘭氏陽性細菌和革蘭氏陰性細菌的活性。這將為深入研究由細菌感染引起的法螺病害防治及免疫防御機制提供參考依據。
[1] 張潔, 王國棟. 雜色鮑C型溶菌酶基因的克隆及表達分析[J]. 集美大學學報(自然科學版), 2020, 25(5): 328-335.
ZHANG Jie, WANG Guodong. Molecular cloning and expression analysis of c-type lysozyme gene in[J]. Journal of Jimei University (Natural Science), 2020, 25(5): 328-335.
[2] 鄭清梅, 吳銳全, 葉星. 水生動物溶菌酶的研究進展[J].上海水產大學學報, 2006(4): 483-487.
ZHENG Qingmei, WU Ruiquan, YE Xing. The resear-ch advance of lysozyme in aquatic animals[J]. Journal of Shanghai Fisheries University, 2006(4): 483-487.
[3] 魏世娜, 秦啟偉. 魚類溶菌酶和組織蛋白酶研究進展[J].廣西科學, 2018, 25(1): 32-35.
WEI Shina, QIN Qiwei. Adcance on lysozyme and ca-thepsin of fish[J]. Guangxi Sciences, 2018, 25(1): 32-35.
[4] 寧燕夏, 蘇月華, 楊梅. 小菜蛾溶菌酶的基因克隆及其重組蛋白的抗菌活性分析[J]. 昆蟲學報, 2021, 64(7): 781-789.
NING Yanxia, SU Yuehua, YANG Mei. cDNA cloning of lysozymeof(:)and the analysis of antibacterial activity of its recombinant protein[J]. Acta entomologica sinica, 2021, 64(7): 781-789.
[5] 顏倩倩, 陶妍, 李雯, 等. 鯉魚C型溶菌酶在畢赤酵母中的重組表達及其抑菌活性[J]. 農業生物技術學報, 2019, 27(11): 1912-1922.
YAN Qianqian, TAO Yan, LI Wen, et al. Recombinant expression of common carp()c-type lyso-zyme in pichia pastoris and its antibacterial activi-ty[J]. Journal of Agricultural Biotechnology, 2019, 27(11): 1912-1922.
[6] 邱本丹. 大黃魚溶菌酶對鰻弧菌脅迫的響應研究[D]. 舟山: 浙江海洋大學, 2016.
QIU Bendan. 2016. The response of c-type and g-type lysozyme in large yellow croaker() to[D]. Zhoushan: Zhejiang Ocean University.
[7] 岳志遠, 張儀, 郭云海, 等. 福壽螺感染廣州管圓線蟲后G型溶菌酶基因差異表達分析[J]. 中國寄生蟲學與寄生蟲病雜志, 2019, 37(3): 326-331.
YUE Zhiyuan, ZHANG Yi, GUO Yunhai, et al. Effect of angiostrongylus cantonensis infection on the expression of g-type lysozyme in[J]. Chinese Journal Parasitol Parasit Diseases, 2019, 37(3): 326-331.
[8] LABREUCHE Y, LAMBERT C, SOUDANT P, et al. Cellular and molecular hemocyte responses of the Pacific oyster,, following bacterial infection withs strain 01/32[J]. Microbes and Infection, 2006, 8(12/13): 2715-2724.
[9] ZHAO J M, SONG L S, LI C H, et al. Molecular cloning of an invertebrate goose-type lysozyme gene from, and lytic activity of the recombinant protein[J]. Molecular Immunology, 2007, 44(6): 1198- 1208.
[10] 趙建民, 吳惠豐, 王清, 等. 一種紫貽貝G型溶菌酶基因及其重組蛋白和應用: CN201110420479.0[P]. 2013- 06-19.
ZHAO Jianmin, WU Huifeng, WANG Qing, et al. A kind ofg-type lysozyme gene and its recom-binant protein and application: CN201110420479.0[P]. 2013-06-19.
[11] HALL M R, KOCOT K M, BAUGHMAN K W, et al. Thegenome as a guide for bio-control of thispest[J]. Nature, 2017, 544(7649): 231-234.
[12] ZHANG L P, XIA J J, PENG P F, et al. Characterization of embryogenesis and early larval development in the Pacific triton,()[J]. Invertebrate Reproduction & Development, 2013, 57(3): 237-246.
[13] ZHANG G G, XU M, ZHANG C L, et al. Comparative transcriptomic and expression profiles between the foot muscle and mantletissues in the giant triton snail[J]. Frontiers in Physiology, 2021, 12: 632518.
[14] ANTONELLI P L, KAZARINOFF N D. Starfish predation of a growing coral reef community[J]. Journal of Theoretical Biology, 1984, 107(4): 667-684.
[15] BELLWOOD D R, HUGHES T P, FOLKE C. Confron-ting the coral reef criss[J]. Nature, 2004, 429(6994): 827-833.
[16] 蔡巖, 周永燦, 馮永勤, 等. 法螺()染色體核型分析[J]. 海洋與湖沼, 2014, 45(6): 1324- 1329.
CAI Yan, ZHOU Yongcan, FENG Yongqin, et al. Chro-mosome karyotype of[J]. Oceanologia et Limnologia Sinica, 2014, 45(6): 1324-1329.
[17] 馮付靄, 趙震, 陶妍, 等. 青蛤I 型溶菌酶在畢赤酵母中的重組DNA表達[J]. 水產科學, 2022, 41(5): 836-843.
FENG Fuai, ZHAO Zhen, TAO Yan, et al. Recombinant DNA Expression of I-type Lysozyme of Clamin Yeast[J]. Fisheries Science, 2022, 41(5): 836-843.
[18] 劉益麗, 鄧霄禹, 江明鋒. 溶菌酶抑菌活性及檢測方法研究進展[J]. 中國畜牧獸醫, 2013, 40(8): 189-194.
LIU Yili, DENG Xiaoyu, JIANG Mingfeng. Research progress on function of non-structural proteins of classical swine fever virus[J]. China Animal Husbandry and Veterinary Medicine, 2013, 40(8): 189-194.
[19] 張煒, 杭柏林, 司素錦, 等. 抗菌肽BSN-37的抑菌活性及其穩定性分析[J]. 中國畜牧獸醫, 2019, 46(1): 287-295.
ZHANG Wei, HANG Bailin, SI Sujin, et al. Bacteriostatic activity and stability analysis of antimicrobial peptide BSN-37[J]. China Animal Husbandry and Veterinary Medicine, 2019, 46(1): 287-295.
[20] 李勇. 小萊娥抗菌肽moricins基因克的隆及功能鑒定[D].福州: 福建農林大學, 2016.
LI Yong. Cloning and functional identification of mori-cins from the Diamondback Moth,[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016.
[21] 金虹, 李海帥, 帖金鳳, 等. 應用微量稀釋法測定消毒劑最小抑菌濃度方法的建立[J]. 中國消毒學雜志, 2018, 35(11): 801-804.
JIN Hong, LI Haishuai, TIE Jinfeng, et al. Establishment of a broth micro dilution MIC testing method for disinfectants[J]. Chinese Journal of Disinfection, 2018, 35(11): 801-804.
[22] 趙榮文, 譚麗萍, 劉同軍. 溶菌酶及其應用研究進展[J]. 齊魯工業大學學報, 2021, 35(1): 12-18.
ZHAO Rongwen, TAN Liping, LIU Tongjun. Research progress of lysozyme and its application[J]. Journal of Qilu University of Technology, 2021, 35(1): 12-18.
[23] SHAKOORI M, HOSEINIFAR S H, PAKNEJAD H, et al. Enrichment of rainbow trout () fingerlings diet with microbial lysozyme: Effects on growth performance, serum and skin mucus immune parameters[J]. Fish & Shellfish Immunology, 2019, 86: 480-485.
[24] 朱站英. 草魚免疫細胞和免疫相關基因研究: 自然殺傷細胞殺傷活性和溶菌酶mRNA的表達[D]. 上海: 上海海洋大學, 2012.
ZHU Zhanying. Research on immune cells and immune genes of grass carp: Natural killer cell activities and the mRNA expression of lysozyme genes[D]. Shanghai: Shanghai Ocean University, 2012.
[25] 楊勇, 黃貝, 黃文樹, 等. 日本鰻鱺的C型和G型溶菌酶研究[J]. 水生生物學報, 2017, 41(4): 807-818.
YANG Yong, HUANG Bei, HUANG Wenshu, et al. Chicken and goose-type lysozyme genes in the japanese eel[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 807-818.
[26] 陳華, 林晨韜, 陳曦, 等. 斑馬魚G型溶菌酶基因序列分析及其原核表達[J]. 南方農業學報, 2022, 53(1): 229-237.
CHEN Hua, LIN Chentao, CHEN Xi, et al. Sequence analysis and prokaryotic expression ofg-type lysozyme gene[J]. Journal of Southern Agriculture, 2022, 53(1): 229-237.
[27] 王美娟, 劉丹丹, 喬丹, 等. 魚類G型和C型溶菌酶及其在漁業生產上的應用[J]. 水產科學, 2014, 33(3): 195-200.
WANG Meijuan, LIU Dandan, QIAO Dan, et al. The g-type and c-type lysozymes in fish and application in fisheries[J]. Fisheries Science, 2014, 33(3): 195-200.
[28] 章瓊, 孫盛明, 李冰, 等. 團頭魴G型溶菌酶基因全長cDNA的克隆與表達分析[J]. 南方水產科學, 2015, 11(2): 41-49.
ZHANG Qiong, SUN Shengming, LI Bing, et al. Molecular cloning and expression analysis of g-type lyso-zy-me gene from blout snout bream()[J]. South China Fisheries Science, 2015, 11(2): 41-49.
[29] HELLAND R, LARSEN R L, FINSTAD S, et al. Crystal structures of g-type lysozyme fromshed new light on substrate binding and the catalytic mechanism[J]. Cellular and Molecular Life Sciences, 2009, 66(15): 2585-2598.
[30] YU L P, SUN B G, LI J, et al. Characterization of a c-type lysozyme of: expression, activity, and antibacterial effect[J]. Fish & Shellfish Immunology, 2013, 34(1): 46-54.
[31] 趙建民. 扇貝大防御素和G型溶菌酶的基因克隆與重組表達[D]. 青島: 中國科學院研究生院(海洋研究所), 2006.
ZHAO Jianmin. Molecular expression of big defensin and g-type lysozyme genes from, and antimi crobial activity of the recombinant proteins[D]. Qingdao: Graduate University of Chinese Academy of Sciences (Institute of Oceanology), 2006.
[32] ZHANG S C, XU N. Advance in study of animal lysozymes[J]. Periodical of Ocean University of China, 2014, 44(6): 46-51.
[33] SAVAN R, AMAN A, SAKAI M. Molecular cloning of g type lysozyme cdna in common carp ()[J]. Fish & Shellfish Immunology, 2003, 15(3): 263-268.
[34] WHANG I, LEE Y, LEE S, et al. Characterization and expression analysis of a goose-type lysozyme from the rock bream, and antimicrobial activity of its recombinant protein[J]. Fish & Shellfish Immunology, 2011, 30(2): 532-542.
[35] YE X, ZHANG L L, TIAN Y Y, et al. Identification and expression analysis of the g-type and c-type lysozymes in grass carp[J]. Developmen-tal and Comparative Immunology, 2010, 34(5): 501-509.
[36] NILSEN I W, MYRNES B. The gene of, a marine invertebrate-type lysozyme, is organized similar to vertebrate but different from invertebrate chicken- type lysozyme genes[J]. Gene, 2001, 269(1/2): 27-32.
[37] ZHANG H, YI X J, GUAN Y Y, et al. The role of the chondroitin sulfate synthase-1 gene in the immune response of the pearl oyster[J]. Fisheries Science, 2020, 86(3): 487-494.
[38] 王秀霞, 叢麗娜, 王丹, 等. 海刺參I型溶菌酶基因的重組表達及抑菌譜分析[J]. 生物工程學報, 2009, 25(2): 189-194.
WANG Xiuxia, CONG Lina, WANG Dan, et al. Recombinant expression and antibacterial activity of i-type lysozyme from sea cucumber[J]. Chinese Journal of Bioengineering, 2009, 25(2): 189-194.
[39] 徐永平, 汪婷婷, 孫永欣, 等. 水產動物溶菌酶研究的最新進展[J]. 水產科學, 2011, 30(5): 307-310.
XU Yongping, WANG Tingting, SUN Yongxin, et al. Current research on function and application of aquatic animal lysozyme[J]. Fisheries Science, 2011, 30(5): 307-310.
[40] 鄧霄禹, 胡明軍, 江明鋒. 反芻動物胃溶菌酶的研究進展[J]. 中國畜牧獸醫, 2012, 39(9): 143-147.
DENG Xiaoyu, HU Mingjun, JIANG Mingfeng. research progress of gastric lysozyme in ruminants[J]. China Animal Husbandry and Veterinary Medicine, 2012, 39(9): 143-147.
[41] CALLEWAERT L, MICHIELS C W. Lysozymes in the animal kingdom[J]. Journal of Biosciences, 2010, 35(1): 127-160.
[42] VOCADLO D J, DAVIES G J, LAINE R, et al. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate[J]. Nature, 2001, 412(6849): 835-838.
G-type lysozyme prokaryotic expression and antibacterial activity of therecombinant protein
JIA Hui-xia1, 2, ZHANG Hua1, 3, ZHANG Cheng-long4, HE Mao-xian1, 3, LIU Wen-guang1, 3
(1. Key Laboratory of Tropical Marine Biological Resources and Ecology, Chinese Academy of Sciences, Guangdong Key Laboratory of Applied Marine Biology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China; 4. Sansha Marine and Fisheries Bureau, Sansha 573199, China)
G-type lysozyme (is a natural immune factor with rich cysteine content, which plays an important role in invertebrate immune defense. This study aimed to further understand the molecular immune mechanism ofand to provide new ideas for preventing disease inby studying the antibacterial function of recombinant protein G-type lysozyme in()The sequence characteristics ofwere analyzed, and real-time fluorescent quantitative polymerase chain reaction analysis was used to detect thetissue distribution. Next, the pGEX-4T-1-CtG.lys recombinant plasmid was constructed using the pGEX-4T-1 expression vector to express the recombinant protein and detect its antibacterial activity. The results showed: 1) The 5′ untranslated region (UTR) was 66 bp, the 3′ UTR was 186 bp ofthecDNA; the open reading frame was 789 bp and encoded 262 amino acids;contained one soluble transglycosidase (SLT) domain (72–255 aa), six cysteine residues, and three enzyme active catalytic sites (Glu72, Asp85, and Asp96); 2) multiple sequence alignment and phylogenetic analyses showed that theamino acids had the highest homology with a closely related G-type lysozyme; 3)was expressed in all tissues tested and was highly expressed in the liver and mantle; 4) after 10 hours of induced expression with 0.5 mM IPTG at 16℃, the average molecular weight of the recombinant protein expressed in the supernatant and inclusion bodies was 51.91 kDa. A1.2 mg/mL recombinant protein concentration was obtained after purification; 5) the antibacterial activity test showed that the pGEX-4T-1-CtG.lys recombinant protein hadantibacterial activities against,, and, and the bacteriostatic effect on the Gram-positive bacteria was greater than that of Gram-negative bacteria. The results of the study will provide a reference and a scientific basis for further analysis of the molecular mechanism of immune defense in.
; G-type lysozyme; prokaryotic expression; antibacterial activity
Sep. 26, 2021
S968
A
1000-3096(2022)10-0032-11
10.11759/hykx20210926001
2021-09-26;
2021-11-22
國家自然科學基金項目(42176129); 中國科學院戰略性先導研究項目(XDA13020206); 南方海洋科學與工程廣東省實驗室(廣州)人才團隊引進重大專項(GML2019ZD0402)
[National Natural Science Foundation of China, No. 42176129; Strategic Priority Research Program of the Chinese Academy of Sciences, No. XDA13020206; Key Special Project for Introduced Talents Team of Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), No. GML2019ZD0402]
賈慧霞(1994—), 女, 河南省開封市人, 碩士研究生, 主要從事貝類遺傳與育種, E-mail: jiahuixia19@mails.ucas.ac.cn; 劉文廣(1978—),通信作者, 副研究員, 碩士生導師, 研究方向為貝類遺傳與育種, 電話: 020-89023144, E-mail: lwg@scsio.ac.cn
(本文編輯: 楊 悅)

