FAT1轉基因系祖公牛選育及其擴繁研究
白春玲,楊磊,蘇廣華,魏著英,王學僑,朱琳,周新宇,海超,吳迪,劉雪霏,武云喜,張立,李光鵬
(內蒙古大學生命科學學院,省部共建草原家畜生殖調控與繁育國家重點實驗室,呼和浩特 010071)
研究表明,一些低等物種,如線蟲、真菌和藻類,在合成LC-PUFA方面表現出良好的能力,許多研究者致力于培育新的或改良的物種,以將其作為合成LC-PUFAs和通過分子克隆進一步開發轉基因動植物的來源[14-16]。在秀麗隱桿線蟲中發現的FAT1基因編碼脂肪酸脫氫酶,能夠通過在甲基末端的第3個碳上添加1個雙鍵而將n-6 PUFAs催化至n-3 PUFAs,在哺乳動物細胞中尚未發現此類酶。為提高n-3 PUFAs含量,研究者們嘗試通過轉基因方法生產富含n-3 PUFAs的家畜動物,迄今已獲得了轉FAT1基因豬[17-23]、牛[14-26]和羊[27-28],且經檢測,在轉基因動物中n-3 PUFAs水平明顯升高,n-6/n-3 PUFAs比值明顯下降,說明FAT1轉基因促進了n-6 PUFAs向n-3 PUFAs的合成,而且FAT1轉基因通過上調參與多不飽和脂肪酸合成途徑的酶基因表達,增強了n-3PUFAs的合成。
本實驗室自2008年開始,以線蟲來源的FAT1基因為靶標,在奶牛、肉牛和綿羊中開展轉基因研究[24,27],并于2009年成功培育出世界首例FAT1轉基因奶牛,經檢測轉基因牛體細胞與奶汁中的n-3 PUFAs含量顯著高于普通奶牛,n-6/n-3比值接近于1.0,而且奶牛的繁殖能力未受到明顯影響[24]。同時用FAT1轉基因牛的奶飼喂小鼠表明,轉基因牛奶對小鼠的生理反應、生長繁殖能力以及肝臟和腎臟代謝均無不良影響[29]。本研究利用超數排卵與胚胎移植技術(multisuperovulation and embryo transfer,MOET)對 原 代FAT1轉基因牛進行擴繁,獲得F1代轉基因牛;在F1代牛中,選育出可用于品系培育的系祖公牛;利用系祖公牛生產F2代轉基因牛,分別對F1和F2代牛遺傳穩定性、生長指標與血液生理生化指標進行分析,旨在獲得FAT1轉基因牛育種基礎數據,以期為優質肉牛生物育種并為大眾提供健康牛肉奠定基礎。
1 材料與方法
1.1 飼養管理
轉基因牛由原代轉基因克隆牛[24]擴繁而來,同野生型牛一并養殖于內蒙古內大圣牧高科牧業有限公司牧場,全舍飼散養,用全混合日糧(total mixed rations,TMR)飼喂,每天7:00和17:00分別飼喂1次。TMR組成比例:青貯玉米62%、燕麥草2%、壓片玉米2%、棉籽3%、高產精補料16%、圍產料2%、中產精補料11%、苜蓿2%。
1.2 超數排卵與胚胎移植
以養殖于內蒙古內大圣牧高科牧業有限公司牧場的原代FAT1轉基因牛ZK002為供體(已獲批開展中間試驗,備案報告號:農基安辦報告字〔2020〕第220號),用于超數排卵。將投放牛用孕酮陰道栓(1.9 g·支-1,新西蘭DEC國際有限公司)當天定為發情第0天,并在第9天開始超數排卵,采用連續4 d注射促卵泡激素(FOLLTROPINV,700 IU·瓶-1,加拿大Vetoquinol公司)進行超排處理,并在注射卵泡激素第3天同時注射氯前列醇鈉注射液(獸藥字110252207,10 mL·支-1,寧波第二激素廠),注射完最后1針后取出牛用孕酮陰道栓,第13天根據發情情況進行人工授精,所用精液為本牧場養殖公牛精液。在發情后的第7天采用非手術法沖胚,每個子宮角反復沖3~4次,鏡檢回收胚胎,并將回收胚胎移植于受體牛子宮中,發情開始后第60天進行妊娠檢查。
1.3 轉基因鑒定
提取待檢牛血液基因組DNA進行PCR鑒定。設計合成FAT1基因PCR擴增引物,F1代鑒定:正向引物序列為5’-TCCAGCACTTTCTTCACGC-3’,反向引物序列為5’-TCAACGCCAACACCAAGC-3’,產物大小為942 bp;F2代鑒定:正向引物序列為5’-AACTTGGATCCCTGGTTATTGTGCTGTCTCAT-3’,反向引物序列為5’-AACTTGCGGCCGCCTCATCACT TGGCCTTGG-3’,產物大小為1 258 bp。PCR反應程序:94℃5 min;94℃30 s,60℃30 s,72℃1 min,30個循環;72℃7 min,擴增產物于1%瓊脂糖凝膠電泳中進行檢測。
1.4 血液脂肪酸分析
取1 mL血清加入3 mL氯仿-甲醇溶液(體積比為2∶1),混勻,室溫過夜;1 500 r·min-1離心5min,取上清,氮氣吹干;正已烷500μL溶解,振蕩2 min;加入1 mL KOH-甲醇飽和溶液(35.5 g·L-1),劇烈振蕩后,室溫靜置過夜;1 000 r·min-1離心10 min,取上清,加入小玻璃瓶中,采用氣象質譜儀(GCMS-QP2010 ultra,日本島津公司)檢測脂肪酸各組分的相對含量。
1.5 外源基因的組織表達檢測
屠宰1頭原代成年FAT1轉基因母牛,分別取其心、肝、脾、肺、腎、肌肉、脂肪和腦等組織,以βactin為內參,分別檢測各組織中FAT1基因的RNA表達情況。提取不同組織總RNA,反轉錄獲得cDNA。反應體系為20μL:cDNA 2μL,SYBR PremixExTaq10μL,正反向引物(10μmol·L-1)各0.8μL,H2O 16.4μL。PCR反應程序:95℃30 s;95℃5 s,60℃34 s,40個循環;95℃15 s,60℃1 min,95℃30 s,60℃15 s。
2019年,智慧建筑專委會將著重加強組織建設工作,深入了解會員單位、緊密團結核心會員單位、搭建會員單位有效溝通平臺;繼續圍繞標準工作穩步推進,充分發揮標準對行業的發展支撐作用;積極推動課題項目落地成熟,以問題為導向, 推動國密算法、節能技術在智能建筑領域的應用。
1.6 組織的脂肪酸分析
采用氣相質譜儀分別分析了轉基因牛肺、肝、心、脾、脂肪、腦、腎和肌肉組織中37種脂肪酸的含量,同時選取野生型牛相應組織作為對照。分別稱取各組織0.5 g,置于F6/10-6G勻漿器(德國弗魯克公司)中,加入3 mL氯仿-甲醇溶液(體積比為2∶1),研磨勻漿液,靜置至分層為止;收集上清液4℃保存,向剩余混濁液體加入2 mL氯仿-甲醇溶液(體積比為2∶1),混合均勻,室溫靜置過夜;收集上清液,與第1次的上清液混合,在TTLDCII氮氣吹干儀(北京同泰聯科技)上吹干。收集沉淀,加入2 mL正己烷,完全溶解后加入400μL KOH-甲醇飽和溶液(35.5 g·L-1),劇烈振蕩混勻2 min,靜置10 min,取上清液-20℃保存。取700μL液體于上樣瓶中,進行氣相質譜分析。
1.7 生長指標測量
分別在轉基因牛出生0、3、6、9、12、15、18月齡時測定生長性狀指標,包括體質量、體高、十字部寬、胸圍等,其中體高是指由肩胛骨凸起處到地面的相對高度,十字部寬是指兩腰角間的水平距離,胸圍是指肩胛骨處垂直周長。F1代FAT1轉基因牛(公牛2頭、母牛6頭,轉基因組)與野生型牛(公牛3頭、母牛8頭,對照組)比較;F2代FAT1轉基因牛(母牛6頭、公牛6頭,轉基因組)與野生型牛(公牛4頭、母牛7頭,對照組)比較。
1.8 繁殖能力分析
①母牛繁殖能力分析:觀察母牛初情期、性成熟期、發情周期及發情表現,并通過超數排卵的方式分析其對激素的反應能力,方法同1.2。②公牛精液品質分析:采用假陰道法采集成年健康轉基因公牛ZK005精液,將稀釋到合適密度的精液取10μL填充到通道載玻片上,然后放于Ni-U顯微鏡下(日本尼康公司),操作臺恒溫37℃。選擇3個不同區域采用MICROPTIC精子分析儀(法國卡蘇公司)分析精子活力,用Digitcool程序化自動冷凍儀(法國卡蘇公司)冷凍精液,解凍時將細管冷精液從液氮罐里取出,置于室溫10 s,之后將細管放于37℃恒溫水浴鍋中解凍10~15 s,待解凍后用酒精棉球擦拭細管,再用剪子剪開細管,將精液吹入含5 mL BO(Bracket and Oliphant)液的15 mL玻璃管中(BO液提前預熱至少1 h),取10μL填充到通道載玻片上,放于顯微鏡下分析精子活力。
1.9 血液生化指標的測定
分別采集轉基因牛和野生型牛頸部靜脈血13 mL,3 000 r·min-1離心10 min,將獲得的血清用C311生化分析儀(德國羅氏公司)測定血液生化指標,取300μL放入1.5 mL離心管中,置于分析儀樣品轉盤,用儀器自動分析輸出數據。測定指標包括葡萄糖、肝功指標(堿性磷酸酶、谷氨酰轉移酶、天冬氨酸氨基轉移酶、丙氨酸氨基轉移酶、總膽紅素、總蛋白、白蛋白、膽堿脂酶、肌酸激酶)、脂代謝相關指標(膽固醇、高密度脂蛋白、低密度脂蛋白、甘油三酯、脂肪酶)、腎功能指標(尿素、肌酐)及血液α-淀粉酶、乳酸和乳酸脫氫酶等。
1.10 數據分析
采用Microsoft Excel 2010進行數據處理和圖形繪制,采用SPSS19.0軟件進行顯著性差異分析,數據采用平均值±標準差(xˉ±SD)表示。
2 結果與分析
2.1 F1代FAT1轉基因牛生產效率
以FAT1轉基因牛ZK002為供體,通過超數排卵與人工輸精生產胚胎,再經胚胎移植獲得胚胎23枚,移植入18頭西門塔爾受體牛子宮;60 d妊娠檢查時,有14頭妊娠,妊娠率為77.8%;發育到期后,產下14頭犢牛,產犢率為100%。經DNA鑒定,在14頭犢牛中有8頭為FAT1轉基因牛(圖1),陽性率為57.1%,其中2頭公牛(ZK004、ZK005)和6頭母牛(FD001、FD002、FD003、FD004、FD005、FD006)。
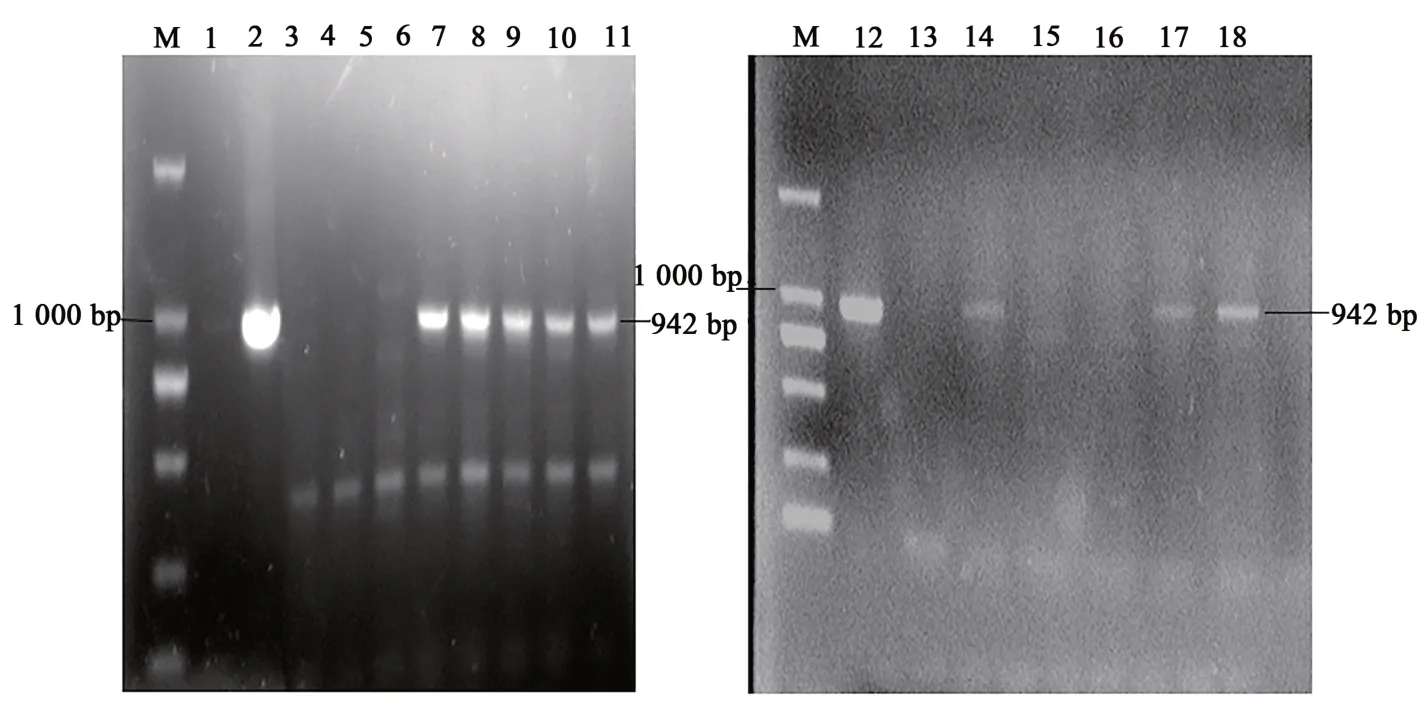
圖1 F1代轉基因牛FAT-1基因整合的PCR鑒定Fig.1 PCR identification of FAT-1 gene integration in F1 transgenic cattle
2.2 血液中不同脂肪酸水平比較
由表1可知,F1代FAT1轉基因牛血液中n-3 PUFAs含量明顯高于轉基因陰性牛和野生型對照牛,n-6/n-3 PUFAs平均值顯著低于轉基因陰性牛和野生型對照牛(P<0.01)。結果表明,外源FAT1基因在牛體內發揮生物學功能,可將n-6 PUFAs有效地轉化為n-3 PUFAs。
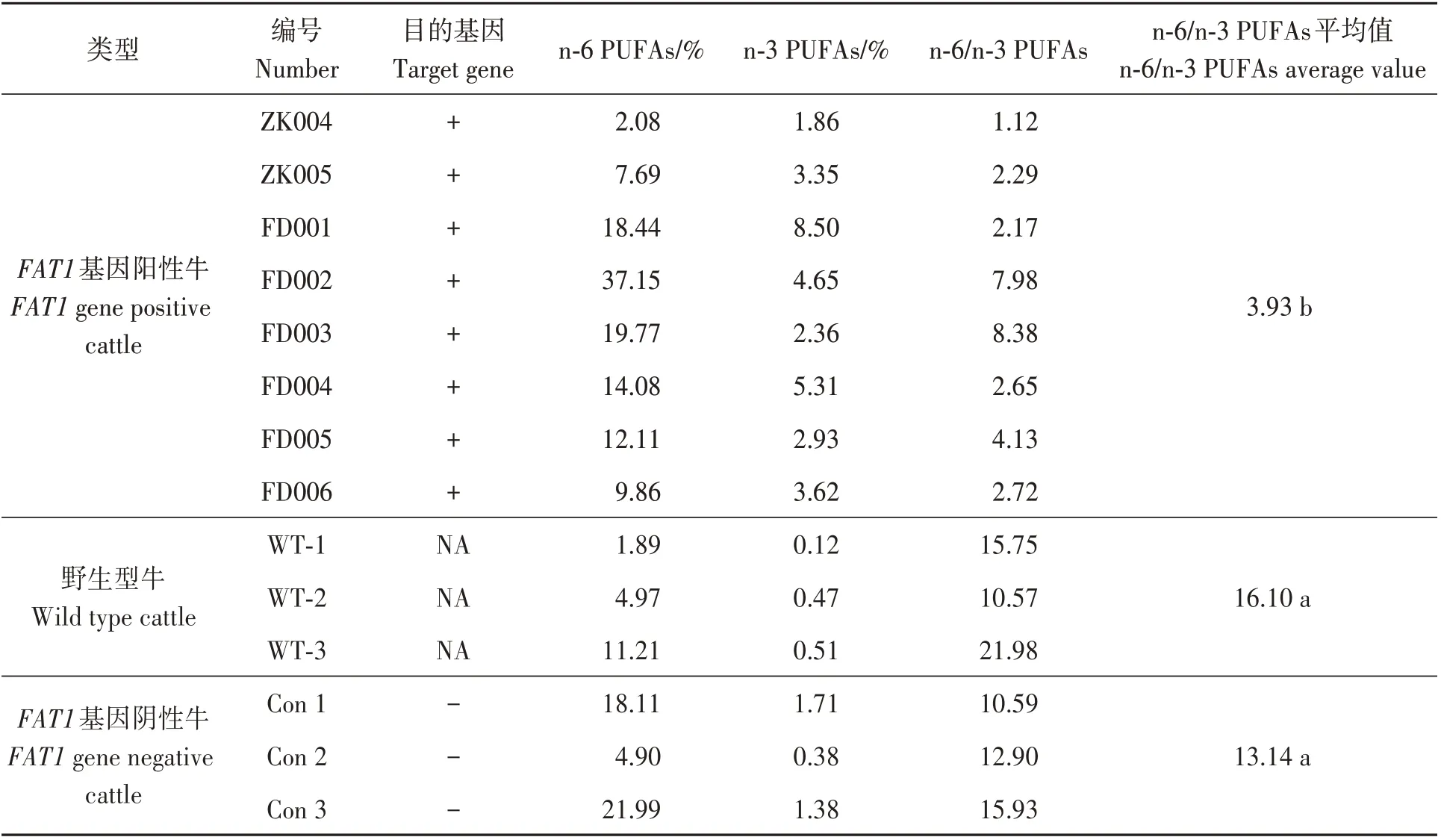
表1 F1代FAT1轉基因牛血液中脂肪酸組成Table1 Fatty acids composition in blood of FAT1 transgenic cattle in F1 generation
2.3 轉基因牛不同組織中FAT1基因的表達和脂肪酸含量比較
分別檢測了原代轉基因牛各組織中FAT1基因的RNA表達情況,結果(圖2)顯示,FAT1基因在肺中表達最低,將其設定為1,依次分別計算出其他組織相對于肺組織的表達量,FAT1基因的RNA表達量由低到高依次為肺、肝、心、脾臟、脂肪、腦、腎臟和肌肉,其中肌肉中表達量是肺組織表達量的36.60倍。對各種組織的脂肪酸含量進行分析(表2)顯示,與野生型牛相比,轉基因牛各組織n-6/n-3 PUFAs比值均下降,表明FAT1在轉基因牛體內能夠表達并合成脂肪酸脫氫酶,有效地將n-6 PUFAs轉化為n-3 PUFAs。
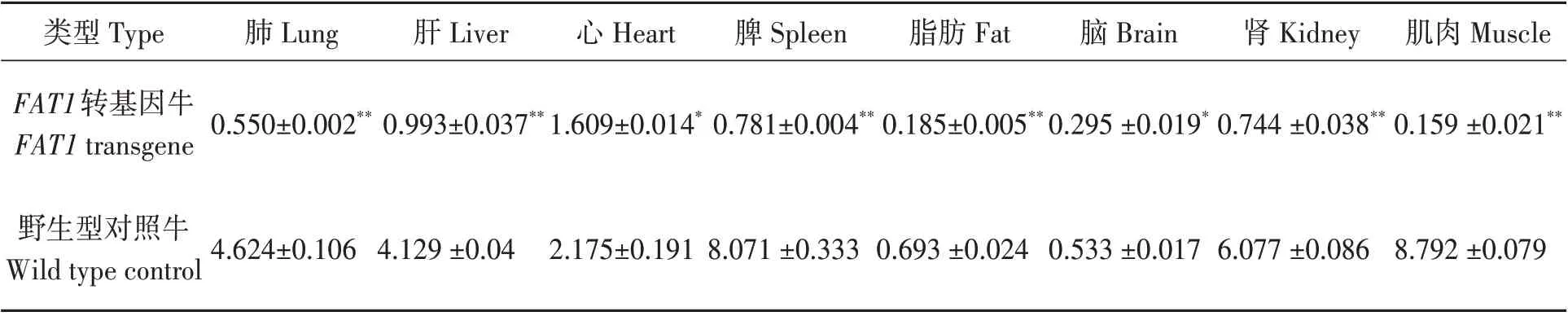
表2 不同組織中n-6/n-3PUFAs比值Table2 n-6/n-3PUFAsratioindifferenttissues
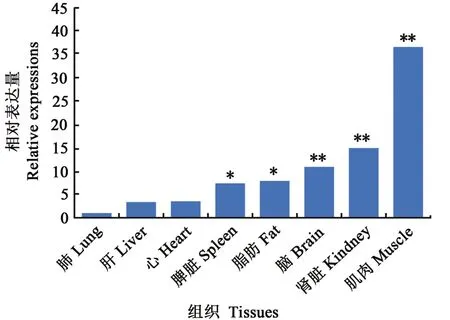
圖2 FAT1在不同器官組織中的表達情況Fig.2 E xpression of FAT1 in different tissues
2.4 F1代FAT1轉基因牛生長發育情況
對F1代轉基因牛生長發育指標進行測量顯示(表3),轉基因組公牛和母牛0~18月齡體質量、體高、十字部寬和胸圍與對照組牛差異均不顯著(P>0.05)。說明轉FAT1基因后不影響宿主牛的正常生長發育。
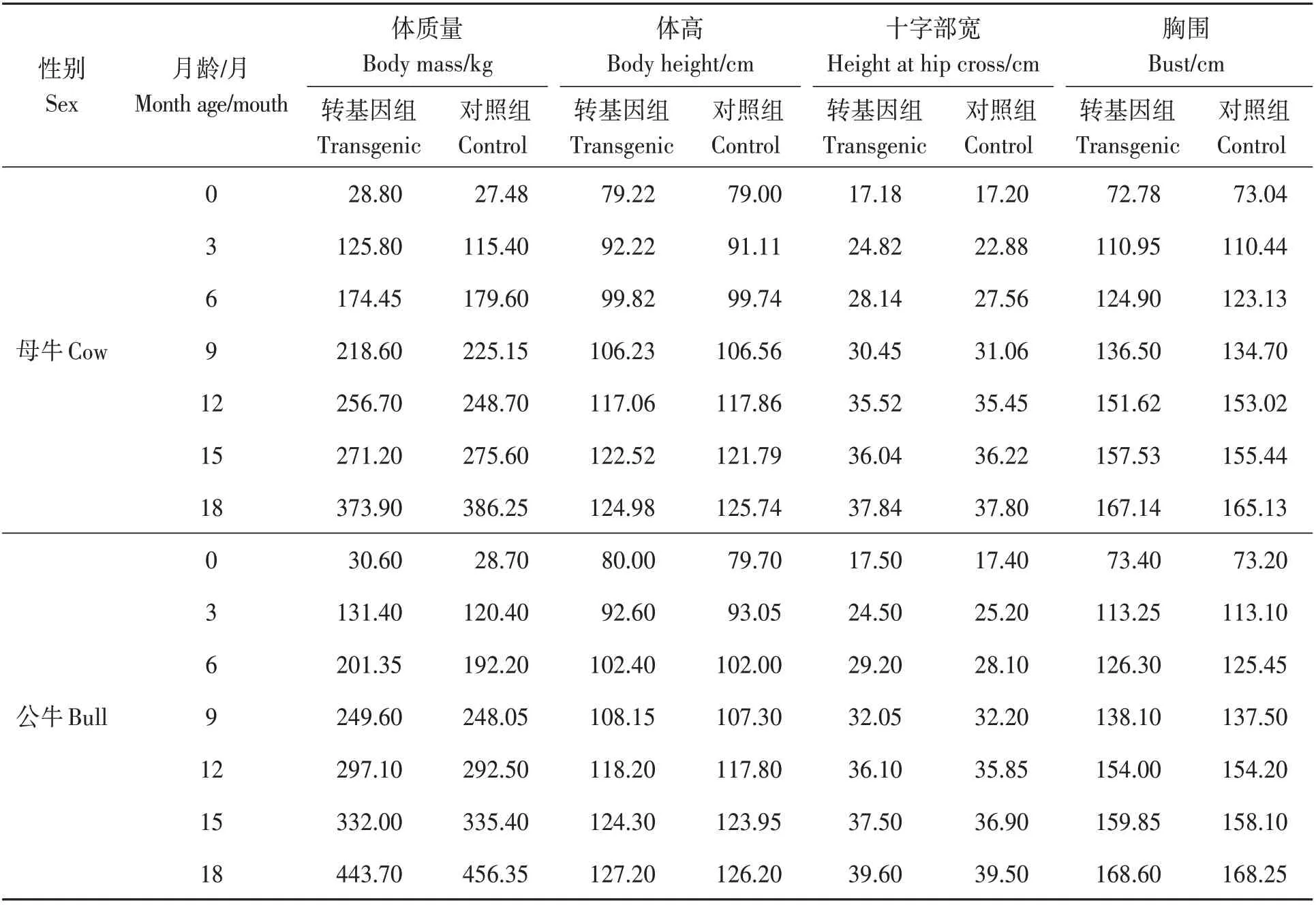
表3 F1代FAT1轉基因牛與野生型對照牛主要生長指標比較Table3 ComparisonofthemaingrowthindexesbetweenFAT1transgenicF1generationcattleandwildtypecontrolcattle
2.5 F1代FAT1轉基因母牛繁殖能力
本研究先后獲得F1代FAT1轉基因母牛6頭,觀察發現轉基因母牛初情期出現在10~13月齡,性成熟期為14~16個月,發情周期為21.0~22.5 d,發情表現為外陰部腫脹、黏膜充血、排黏液、接受爬跨或爬跨。母牛成年后,對其進行集中超數排卵、人工授精以生產胚胎。結果顯示,在6頭母牛中,其中1頭連續同期處理2次均未表現明顯的發情,也沒有獲得可利用的胚胎;1頭母牛對激素非常敏感,同等劑量的激素會引發其卵巢水腫,每次超排能夠獲得5~6枚胚胎,但僅有3枚可用,其余2~3枚卵子均沒有受精;另外4頭牛發情效果與對照組無明顯差異,平均每頭獲得良好胚胎6.5枚,其中有2頭表現最好,每次均可得10枚以上的優質胚胎。比較發現,F1代FAT1轉基因母牛的卵泡發育、排卵行為、受精能力、胚胎發育能力等均與野生型牛無明顯差異。
2.6 F1代FAT1轉基因公牛繁殖能力
分別將2頭F1代FAT1轉基因公牛命名為ZK004和ZK005,ZK004體況較弱,ZK005生長發育良好。ZK005公牛在13月齡時出現雄性表現,活躍興奮,爬跨其他牛;在16月齡時,開始對其采精訓練;到20月齡時,正式采精與凍精。精液分析表明,精液密度平均1.36×109·mL-1,鮮精活力為60%~70%,凍后活力為40%,各項指標均高于野生型公牛。
利用ZK005的精液分別與西門塔爾牛與魯西黃牛進行配種,生產F2代FAT1轉基因牛,獲得17頭犢牛,其中15頭存活至周歲,存活率為88.2%。分別從F2代FAT1轉基因牛的背最長肌采集肌肉組織,提取總RNA,進行RT-PCR檢測。結果(圖3)表明,在存活的15頭牛中,FAT1轉基因陽性牛12頭(編號:190220、190221、1904051、1904052、190427、190429、190505、190506、190510、190623、190624和190630),陽性率為80%(12/15)。FAT1基因在12頭牛的肌肉中均檢測到目的條帶,PCR產物大小為1258bp。說明FAT1基因在這些個體中均可以正常轉錄為mRNA。
圖3 RT-PCR檢測轉基因F2代FAT1轉基因牛組織中外源基因FAT1的表達Fig.3 RT-PCRdetection of the expression of FAT1 gene in transgenic F2 generation cattle
分別提取12頭F2代FAT1轉基因牛及ZK005的肌肉組織蛋白,通過Western blotting的方法檢測蛋白表達情況。結果(圖4)顯示,所有組織樣品中均可以檢測到FAT1蛋白,說明FAT1基因在轉基因牛中均可以穩定表達。
圖4 FAT1轉基因牛的Western blotting檢測Fig.4 Western blotting detection of the FAT1 gene expression
2.7 F2代FAT1轉基因牛的生長發育
對F2代FAT1轉基因牛生長指標進行測量顯示(表4),在同等飼養管理條件下,0~18月齡F2代FAT1轉基因牛的體質量、體高、十字部寬、胸圍等主要生長指標與對照組差異不顯著(P>0.05)。說明FAT1轉基因對后代的生長發育不會產生顯著影響。
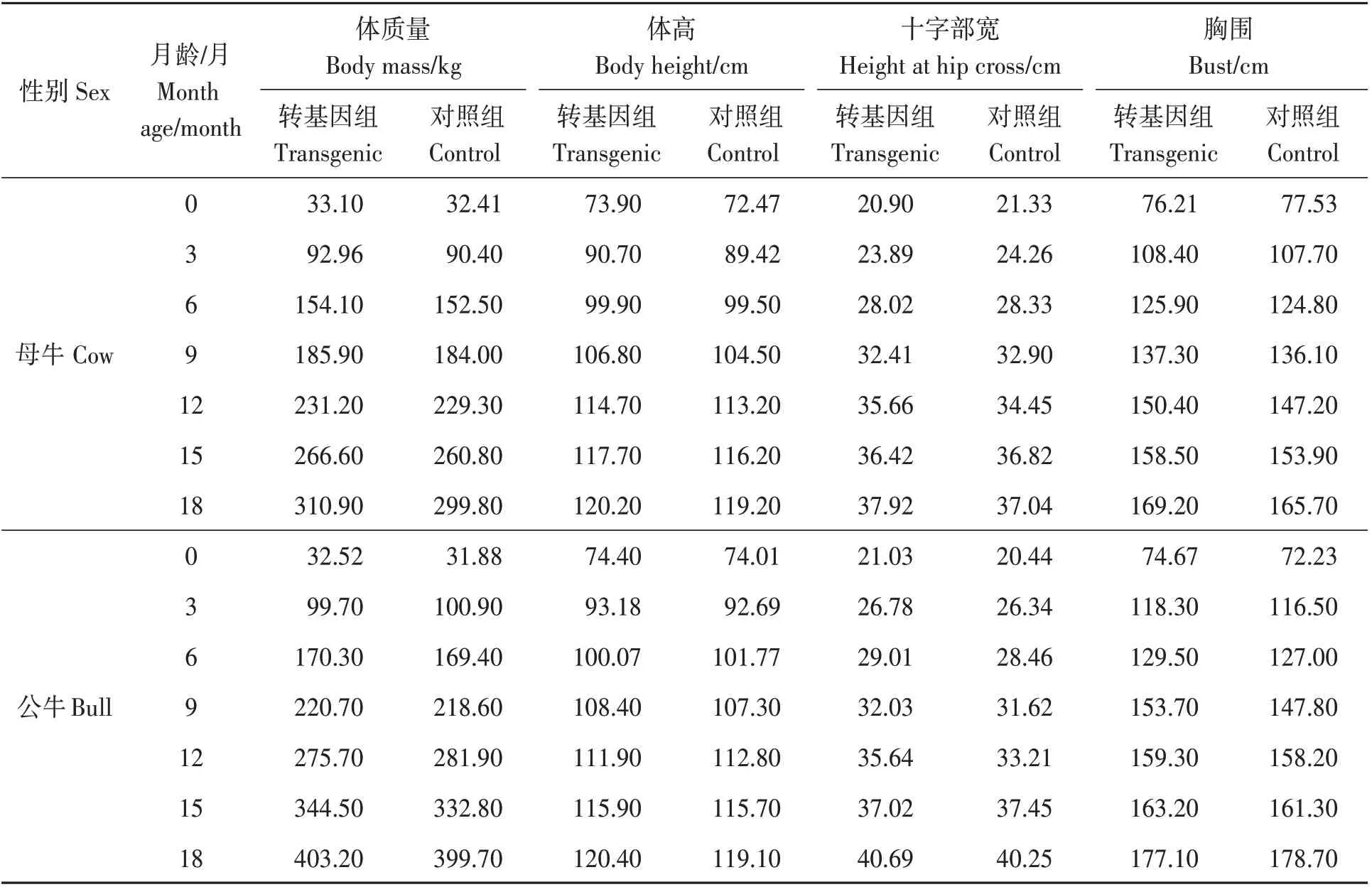
表4 F2代FAT1轉基因牛與野生型對照牛主要生長指標比較Table 4 Comparison of the main growth indexes between FAT1 transgenic F2 generation cattle and wild type control cattle
2.8 F2代FAT1轉基因牛與野生型牛的血液生理生化指標
對獲得的F2代FAT1轉基因牛(轉基因組)分別進行血液生理生化指標檢測,并與野生型牛(對照組)的血液生理生化指標進行比較,由表5可知,轉基因組牛除了個別時期個別指標出現差異外,在生產發育過程中血糖、肝功能、總蛋白、白蛋白、膽堿酯酶、肌酸激酶等指標均與對照組無顯著差異(P>0.05),但整體呈現略低于對照組的現象。脂代謝指標中,高密度脂蛋白膽固醇水平高于對照組牛(P<0.05),而低密度脂蛋白膽固醇水平低于對照組牛(P<0.05),總膽固醇水平低于對照組牛(P<0.05),甘油三酯僅在15月齡顯著高于對照組牛(P<0.05),其他時期無顯著差異(P>0.05)。其他血液學指標中,轉基因組牛肌酐、α-淀粉酶水平均低于對照組牛,乳酸脫氫酶水平均高于對照組牛,乳酸含量均低于對照組牛。以上結果表明,FAT1轉基因牛對牛血糖、肝功能未產生顯著影響,但影響了宿主牛的脂代謝,一些關鍵指標呈下降趨勢,但均在正常參考值范圍內,說明FAT1轉基因對宿主健康方面未造成顯著影響。
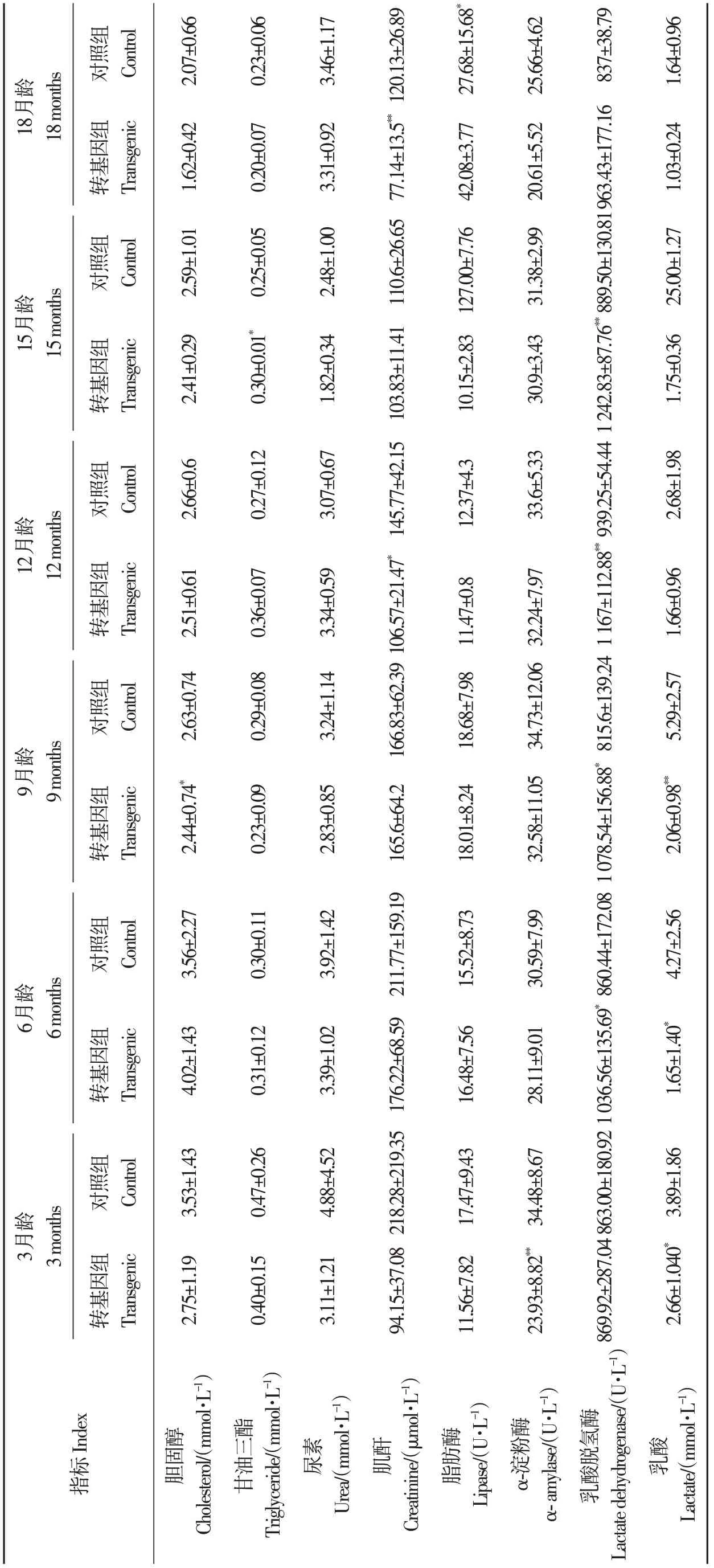
表5 F2代FAT1 轉基因牛與野生型牛血液生化指標比較Table5 Comparison of blood biochemical indexes between FAT1 transgenic F2 generation cattle and wild type cattle 續表 Continued
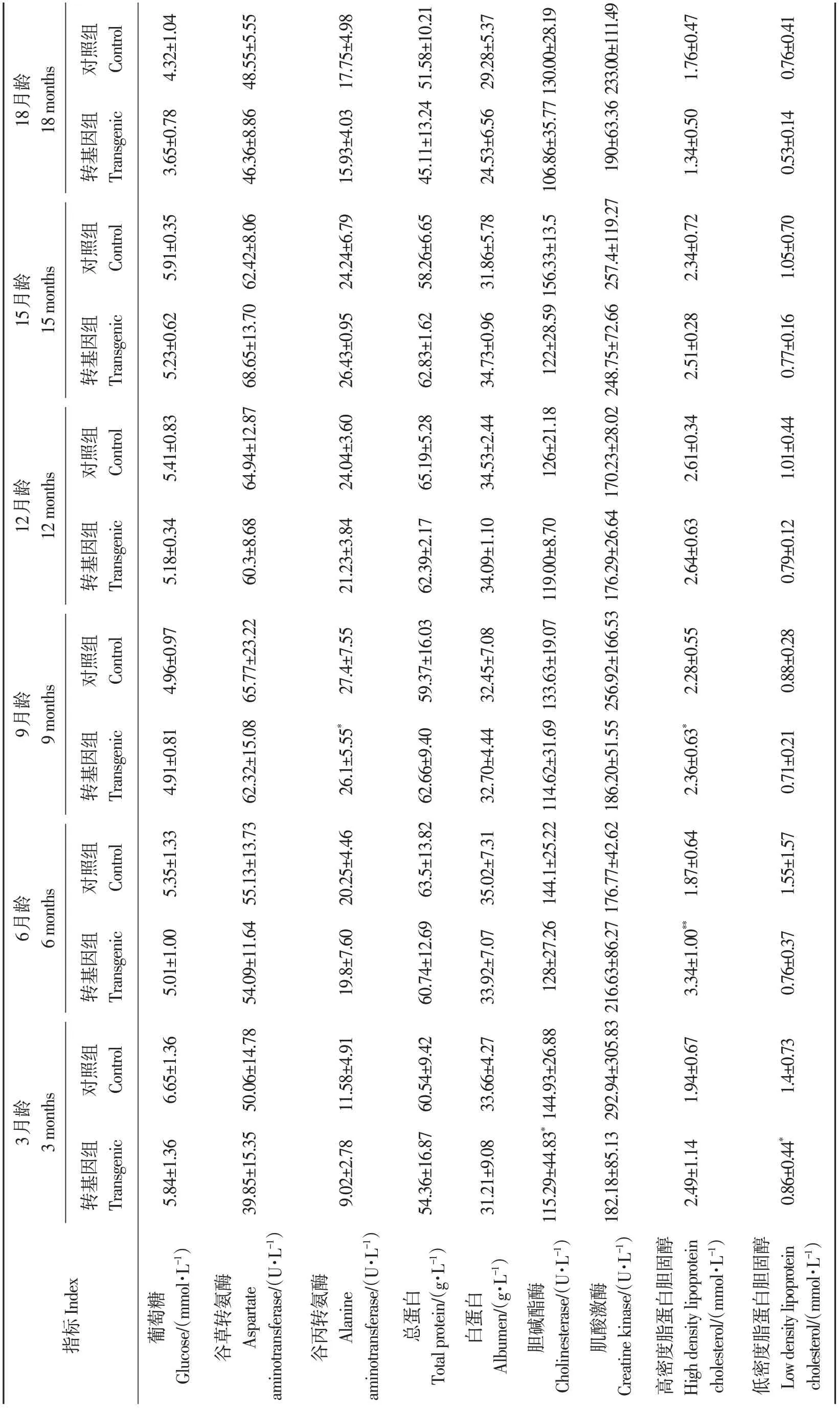
表5 F2代FAT1 轉基因牛與野生型牛血液生化指標比較Table5 Comparison of blood biochemical indexes between FAT1 transgenic F2 generation cattle and wild type cattle
3 討論
現代生物育種技術包括轉基因技術,能夠加速育種進程,以達到精準育種的目的,培育滿足不同需求的品種[30]。n-3 PUFAs與人類健康關系密切,利用轉基因技術可將外源FAT1基因轉入哺乳動物基因組,再通過轉基因的動物性食品提供給人類必需的n-3 PUFAs。在前期工作中,本課題組獲得了FAT1轉基因牛并對其進行了功能性分析[24],本研究則對其進一步擴繁,對F1代進行評價并從中選育系祖公牛以進行品系培育。
外源基因的穩定遺傳和表達是轉基因動物制備成功的重要指標[31]。本研究從原代牛經過MOET技術獲得的F1代牛中,n-3 PUFAs顯著升高,n-6/n-3 PUFAs比值由野生型的10.59~21.98降至8.38~1.12;組織表達檢測顯示,FAT1在各種可食用組織中均有表達,其中肺部表達量最低,肌肉中表達量最高,其脂肪酸表達也呈相同趨勢,脂肪酸中n-3 PUFAs所占比例提高,n-6/n-3 PUEAs比值下降,表明F1代牛中FAT1基因仍在穩定發揮生物學功能。外源基因的穩定遺傳和表達與插入位點密切相關,本課題組在前期工作中已鑒定出原代牛FAT1基因插入到6號染色體NCAPG和LCORL之間的基因空白區域[32]。本研究獲得的轉基因牛后代性狀表現良好,繁殖性能正常,遺傳穩定性較好,表明這個區域是適合轉基因的安全位點。
由于本研究前期獲得的原代牛為母牛,為了品系培育考慮,如果要快速擴大核心群體,需要再選育性狀優良的公牛作為系祖。系祖公牛要求有優良的性狀、其后代要能穩定遺傳優良性狀。本研究中F1代公牛ZK005經基因組水平檢測、功能鑒定和生長性狀測定,表現出良好的性狀,遺傳穩定,功能表現良好,繁殖能力較好,且其后代遺傳穩定性也較好,因此本研究將ZK005作為備用系祖公牛,用以進一步培育FAT1轉基因牛。
本研究采用ZK005精液配種獲得了F2代牛12頭,FAT1基因穩定遺傳并有效表達,通過生長指標測量和血液生化分析對其生長發育和健康狀況進行評估。生長指標是品種培育的基本要求,FAT1轉基因牛的生長發育與野生型牛一致,無顯著差異,表明外源基因的轉入沒有影響生長進程。血液生理生化指標與動物健康狀況密切關聯,動物血液生理生化參數主要由動物自身的遺傳因素與環境因素決定與控制。華文君等[33]對轉sFat1-基因豬進行研究發現,轉基因豬生理生化指標、繁殖性能、血液學指標均在正常范圍內。本研究中,血糖水平在FAT1轉基因牛與野生型牛中差異不顯著,但是在生長過程中略低于野生型牛。機體中的血糖可以反映動物能量代謝水平,已有研究表明,飲食中如果缺乏n-3 PUFAs會增加機體患Ⅱ型糖尿病的風險[34],n-3 PUFA通過影響細胞的胰島素敏感性,增加葡萄糖轉運體基因Glut4的表達,促進細胞吸收血液中的葡萄糖[35]。研究表明低n-6/n-3 PUFAs比值可以降低糖尿病患者胰島素抵抗來改善糖代謝[36]。有研究者對FAT1轉基因小鼠進行分析發現,FAT1表達引起n-3 PUFAs升高使血糖水平降低[37]。本研究中FAT1轉基因牛能夠改善糖代謝,與前人研究結果一致。生化指標可以反映機體的肝臟功能的變化情況,如果超出正常生理水平范圍,則說明肝臟受到一定損傷的潛在可能。有研究者對FAT1轉基因小鼠經高脂飲食誘導為脂肪肝進行研究發現,其肝臟的脂肪變性較野生型小鼠輕,對肝細胞的充氣和纖維化癥狀有緩解作用,表明n-3 PUFAs對脂肪肝疾病的發生有保護作用[38]。本研究中,轉基因牛肝功指標與野生型牛差異不顯著,反映肝損傷的谷草轉氨酶和谷丙轉氨酶雖然有個別時期出現了差異,但是不具有損傷性;且轉基因牛中代表肝臟合成功能的總蛋白、白蛋白水平未發生明顯變化,表明肝臟功能未受轉基因的影響。血脂指標是衡量動物體健康的另一項重要指標,過高的血液膽固醇、甘油三酯和低密度脂蛋白膽固醇會導致動脈硬化等疾病的發生,而高密度脂蛋白膽固醇則能防止動脈硬化的發生,降低心血管疾病風險。研究表明,n-3 PUFAs可以促進膽固醇代謝為膽酸和中性固醇,形成膽汁后經糞便排出,因此能夠有效降低膽固醇的水平[39-40],n-3 PUFAs還能降低甘油三脂和低密度脂蛋白膽固醇的水平[41-42]。本研究中轉基因牛血脂指標總體來說與野生牛無顯著差異,只是在個別時期出現差異,但這些差異均是有益的變化,如膽固醇、甘油三酯、低密度脂蛋白膽固醇降低而高密度脂蛋白膽固醇升高。表明FAT1基因的轉入與功能發揮對健康無不利影響。乳酸脫氫酶是糖酵解途徑中的氧化還原酶,催化乳酸氧化為丙酮酸,引起乳酸脫氧酶升高的原因較多,如心肌梗死、急性肝炎/肝硬化等肝臟疾病、血液病、骨骼肌損傷等。本研究中,FAT1轉基因牛與野生型牛相比,在部分生長階段中血清乳酸脫氫酶水平升高,相應的乳酸水平降低,但均在參考值范圍內[43]。
綜上所述,FAT1基因的轉入不影響牛的繁殖能力,后代牛能穩定遺傳外源基因并發揮功能,健康狀況未受顯著影響;由系祖公牛繁殖的轉基因牛后代的各項指標均符合品系培育預期,因而利用系祖法培育FAT1轉基因新品系或新品種具有可行性。本研究為培育優質肉牛奠定了基礎,有望在將來為大眾提供高營養價值牛肉。

