尿感方對膀胱上皮屏障及關鍵連接蛋白表達的影響
朱盼盼, 蔣 健, 陳君灝, 喬 昀, 元唯安, 梁群梅, 賀 敏
(上海中醫藥大學附屬曙光醫院,上海 201203)
尿路感染是病原體入侵泌尿系統引起的感染性疾病,尿道致病性大腸桿菌是導致尿路感染發生的主要病原體[1-3]。膀胱上皮細胞通過連接復合體將相鄰的上皮細胞緊密相連,共同構成膀胱上皮屏障,其在防御病原體中發揮著重要作用,上皮屏障受損是尿路感染的主要病理特征之一[3-7]。上皮屏障的結構和功能與連接復合體中的關鍵連接蛋白閉鎖小帶蛋白-1(ZO-1)、閉鎖蛋白(Occludin)、E-鈣黏蛋白(E-cadherin)關系密切,尿路感染時,上皮細胞ZO-1、Occludin、E-cadherin表達下調,上皮屏障受損[4,7]。
尿感方(授權專利號ZL200910201845.6)由馬齒莧、蒲公英組成,具有抗菌、抗炎、免疫調節等多種藥理作用[8-12],是治療尿路感染的有效方劑[13]。膀胱上皮細胞與致病菌共存于尿液環境中,尿液中藥物的作用對于尿路感染的研究更為直接,課題組前期研究發現,尿感方含藥尿液具有免疫調節的作用[14-16],但其對膀胱上皮屏障的影響尚不清楚。因此,本研究利用Transwell小室建立單層膀胱上皮細胞尿道致病性大腸桿菌感染模型,通過菌落檢出數量化穿過單層細胞的細菌數和酚紅透過率的方法,觀察尿感方對膀胱上皮屏障完整性和通透性的影響,并從對關鍵連接蛋白表達影響的角度探討其作用機理。
1 材料
1.1 動物和細胞株 SD大鼠,SPF級,雌雄各半,體質量(250±10)g,購于上海斯萊克實驗動物有限責任公司,實驗動物生產許可證號SCXK(滬)2017-0005,飼養于上海中醫藥大學實驗動物中心。人膀胱癌HTB-9細胞,目錄號TCHu1,購于中國科學院細胞庫。
1.2 藥物 馬齒莧(配方顆粒,批號20020481,每袋1.5 g,相當于飲片15 g)、蒲公英(配方顆粒,批號20041181,每袋2 g,相當于飲片15 g),均由江陰天江藥業有限公司生產。
1.3 菌株 尿道致病性大腸桿菌J96(編號ATCC700336)購自上海北諾生物科技有限公司,接種于盧里亞-貝爾塔尼培養基,37 ℃培養24 h后用PBS配制成細菌懸液備用,實驗前通過細菌比濁儀估算細菌濃度。
1.4 試劑 盧里亞-貝爾塔尼瓊脂平板,購自上海科瑪嘉微生物技術有限公司;RPMI-1640培養基,購自美國Thermo Scientific公司;胎牛血清、0.25%胰酶,購自美國Gibco公司;PBS、酚紅、慶大霉素,購自生工生物工程(上海)股份有限公司;CCK-8細胞活性計數試劑盒,購自蘇州宇恒生物科技有限公司;ZO-1兔抗IgG、Occludin兔抗IgG、E-cadherin兔抗IgG、β-actin鼠抗IgG、BCA蛋白定量檢測試劑盒、SDS-PAGE凝膠制備試劑盒、RIPA裂解液(強)、封閉液、一抗稀釋液、二抗稀釋液、顯影定影試劑,購自武漢賽維爾生物科技有限公司;PVDF膜,購自美國Millipore公司。
1.5 儀器 細菌比濁儀(法國BioMerieux公司);SpectraMaxi3x多功能酶標(美國Molecular Devices公司);普通倒置顯微鏡(日本Olympus公司);超凈工作臺、CO2培養箱(美國Thermo Scientific公司);Western Blot電泳系統、轉膜儀(美國Bio-Rad公司);低溫離心機(德國Eppendorf公司);Odyssey雙色紅外激光成像系統(美國LI-COR公司)。
2 方法
2.1 含藥尿液制備 尿感方飲片劑量(馬齒莧70 g、蒲公英55 g)換算為配方顆粒劑量,按課題組前期的方法[14-16]制備大鼠空白尿液和含藥尿液,大鼠(生藥25.0 g/kg)按“3D-2T-1H”法給藥,即每天灌胃給藥2次,連續3 d,次日早晨再灌胃給藥1次,收集末次給藥后3 h內尿液,4 000 r/min離心15 min,56 ℃水浴滅活30 min,0.22 μm濾膜過濾,于-80 ℃保存備用。
2.2 藥物毒性實驗 含藥尿液及空白尿液的安全范圍采用CCK-8法確定,按試劑盒說明書操作。
2.3 細胞培養 HTB-9細胞用含10% FBS的RPMI-1640培養基,于37 ℃、5% CO2培養箱中培養,培養瓶內細胞長至70%~80%時,用0.25%胰酶消化后傳代或種板。
2.4 細胞分組及給藥 HTB-9細胞分為正常組,模型組,10%、5%大鼠含藥尿液組及10%、5%大鼠空白尿液組。各尿液組用含10% FBS的RPMI-1640培養基稀釋尿液至終體積分數為5%、10%,然后與細胞共同培養;模型組和正常組用含10% FBS的RPMI-1640培養基與細胞共同培養,培養12 h。
2.5 造模 HTB-9細胞接種在Transwell小室上室中,隔天按“2.4”項下方法分組和給藥,培養結束后,用PBS洗滌3次,下室加入培養基,上室除正常組外,均加入細菌/細胞比例(MOI)為100的尿道致病性大腸桿菌J96,培養造模2 h[17]。
2.6 酚紅透過率實驗 按“2.5”項下方法造模結束后,采用慶大霉素保護法清除胞外細菌,用PBS洗滌后,棄去洗液并吸干殘液,上室加入含酚紅(15 mg/L)的培養基(不含FBS),下室加入PBS,37 ℃、5% CO2孵箱中培養4 h,分別取上、下室溶液,酶標儀于570 nm波長處檢測光密度(OD)值[18-19]。相對酚紅透過率=[(OD實驗組下室溶液/OD實驗組上室溶液)/(OD正常組下室溶液/OD正常組上室溶液)]×100%。
2.7 測定穿過單層細胞的細菌數 采用平板菌落計數法對菌落進行計數以量化穿過單層細胞的細菌數,以模型組細菌數的均值歸一化計算各組的相對菌落計數。參考文獻[17]方法,按照“2.5”項下造模結束后,用移液器從下室取出100 μL培養液,倍比稀釋并涂于盧里亞-貝爾塔尼瓊脂平板,37 ℃培養過夜后計數。
2.8 Western blot法檢測ZO-1、Occludin、E-cadherin蛋白表達 細胞接種于6孔板,按“2.4”項下方法分組和給藥,培養結束后,用PBS洗滌3次,除正常組外加入MOI為100的尿道致病性大腸桿菌J96,正常組加入培養基,培養造模2 h。采用慶大霉素保護法清除胞外細菌后,加入RIPA裂解液提取總蛋白,以BCA法檢測蛋白濃度。蛋白樣本電泳分離并轉移至PVDF膜,封閉1 h,加入一抗工作液4 ℃孵育過夜,TBST洗滌3次,加入二抗工作液室溫孵育1 h,TBST洗滌3次,ECL法發光,凝膠成像系統觀察蛋白條帶,用AlphaEase FC軟件分析灰度值,計算目標蛋白與β-actin(內參)的灰度值比例。各實驗均重復3次。
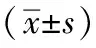
3 結果
3.1 藥物毒性實驗 經10%大鼠含藥尿液或10%大鼠空白尿液預處理24 h的細胞存活率均大于90%,提示10%及以下濃度的含藥尿液和空白尿液對HTB-9細胞無明顯毒性。
3.2 尿感方對細胞間通透性的影響 如圖1所示,與正常組比較,模型組酚紅透過率增加(P<0.01),提示尿道致病性大腸桿菌損傷了細胞屏障,使細胞之間的間隙增大;與模型組比較,5%、10%大鼠空白尿液組酚紅透過率均無明顯變化(P>0.05),提示大鼠空白尿液對尿道致病性大腸桿菌所損傷的細胞間隙沒有明顯影響;與5%、10%大鼠空白尿液組比較,5%、10%大鼠含藥尿液組酚紅透過率均降低(P<0.05),提示尿感方含藥尿液對尿道致病性大腸桿菌所損傷的細胞間隙具有一定的修復作用。
3.3 尿感方對穿過單層細胞細菌數的影響 如圖2所示,模型組有大量細菌穿過單層細胞;與模型組比較,5%、10%大鼠空白尿液組穿過單層細胞的細菌數均無明顯變化(P>0.05),提示大鼠空白尿液對尿道致病性大腸桿菌所損傷的細胞屏障沒有明顯影響;與10%大鼠空白尿液組比較,10%大鼠含藥尿液組穿過單層細胞的細菌數減少(P<0.05),提示尿感方含藥尿液對尿道致病性大腸桿菌所損傷的細胞屏障具有一定的修復作用。
3.4 尿感方對尿道致病性大腸桿菌感染膀胱上皮細胞關鍵連接蛋白表達的影響 如圖3所示,與正常組比較,模型組上皮細胞ZO-1、Occludin和E-cadherin蛋白表達均降低(P<0.01),提示尿道致病性大腸桿菌影響了HTB-9細胞ZO-1、Occludin和E-cadherin蛋白表達;與模型組比較,5%、10%大鼠空白尿液組ZO-1、Occludin和E-cadherin蛋白表達均無明顯變化(P>0.05),提示空白尿液對尿道致病性大腸桿菌所致的HTB-9細胞ZO-1、Occludin和E-cadherin蛋白表達下調無明顯影響;與10%大鼠空白尿液組比較,10%大鼠含藥尿液組 ZO-1、Occludin和E-cadherin蛋白表達升高(P<0.05);與5%大鼠空白尿液組比較,5%大鼠含藥尿液組 ZO-1和E-cadherin蛋白表達升高(P<0.05),提示尿感方含藥尿液能夠逆轉尿道致病性大腸桿菌所致的HTB-9細胞ZO-1、Occludin和E-cadherin蛋白表達下調。
4 討論
膀胱上皮屏障是抵御病原體入侵的重要防線,膀胱上皮細胞之間互相接觸,通過連接復合體特化加固上皮細胞結構的細胞連接方式構成了膀胱上皮屏障[3-5]。連接復合體參與調節上皮細胞之間的粘附和細胞旁路運輸,其對上皮屏障功能的正常發揮起著重要作用。正常生理情況下,膀胱上皮屏障只允許小分子物質通過屏障;當尿道致病性大腸桿菌感染時,尿道致病性大腸桿菌可通過直接和間接的方式作用于連接復合體,影響連接復合體中連接蛋白ZO-1、Occludin、E-cadherin等的表達,導致細胞連接結構受損、屏障功能異常,進而膀胱腔內的病原體、有害物質等從上皮屏障侵入深層組織,引起一系列病理生理的改變(疾病發生或加重)[4-6]。因此,保護膀胱上皮屏障為臨床防治尿路感染提供了新的思路[7]。
通過測定酚紅從Transwell小室上室滲透至下室的量,可以評價細胞間隙的通透性和單細胞層的完整性[18-19];另外,測定病原體從上室穿過單細胞層至下室的數量也是評價單細胞層完整性的良好方法[17]。本研究結果顯示,尿感方含藥尿液中的藥物能修復尿道致病性大腸桿菌所損傷的細胞間隙,降低細胞間的通透性,使從細胞間隙透出的酚紅量減少,穿過單層細胞的細菌數量減少。
ZO-1、Occludin和E-cadherin是膀胱上皮屏障連接復合體中的關鍵連接蛋白,其對屏障結構和功能的維持有重要作用。ZO-1位于細胞質內膜,是連接復合體中最重要的緊密連接蛋白,它是細胞間緊密連接結構的支架,將跨膜蛋白與骨架蛋白相連,并通過跨膜信號通路調節細胞屏障的功能[20-21]。ZO-1表達的下降會影響細胞間緊密連接結構的穩定和屏障功能的發揮,它是評價細胞緊密連接屏障完整性的主要指標[20-23]。Occludin是連接復合體中重要的跨膜蛋白,它通過自身的4個跨膜區將相鄰細胞以拉鏈方式相結合,從而實現細胞旁封閉[24]。Occludin的羧基端通過ZO-1與骨架蛋白相連,與ZO-1共同調節緊密連接結構的變化[24-25]。Occludin表達或活性降低,都會導致細胞間隙通透性的增加[24-25]。E-cadherin是上皮細胞的標志物,也是連接復合體中最重要的跨膜粘附連接蛋白之一,它位于細胞緊密連接處,主要介導和調節細胞與細胞之間、細胞與基質之間的粘附反應,直接影響著緊密連接結構的穩定性。E-cadherin能跨越細胞間隔,粘附連接對側的相鄰細胞,在細胞之間形成粘附帶[26-27]。E-cadherin表達的下調會影響上皮細胞間的粘附水平和緊密連接結構的完整性,導致屏障受損[26-28]。
本研究結果顯示,模型組ZO-1、Occludin和E-cadherin的蛋白表達較正常組顯著降低,與文獻報道一致。本研究結果還顯示,大鼠空白尿液對尿道致病性大腸桿菌所致的ZO-1、Occludin和E-cadherin蛋白表達下調沒有明顯影響,但尿感方含藥尿液中的藥物能逆轉尿道致病性大腸桿菌所致的ZO-1、Occludin和E-cadherin蛋白表達下調。
綜上所述,尿感方對尿道致病性大腸桿菌所致的膀胱上皮屏障損傷有一定的修復作用,其作用機制與關鍵連接蛋白表達有關。

