國產注射劑中注射用輔料使用現狀及問題分析
王 萍, 陳新國, 高正松, 王保成, 宋民憲*, 張海燕*
(1.江西中醫藥大學現代中藥制劑教育部重點實驗室,江西 南昌 330004;2.南京威爾藥業集團股份有限公司,江蘇 南京 210009)
藥智網(https://www.yaozh.com/)統計結果表明,國產注射劑中使用輔料約300種。本文對注射用輔料在2020年版《中國藥典》和國家藥品監督管理局藥品審評中心藥用輔料備案平臺(https://www.cde.org.cn/)中的收載情況,以及國產注射劑有使用但無注射用標準的輔料品種進行歸納梳理,指出目前注射劑藥品說明書中輔料標注存在的不足以及注射用輔料需要解決的問題,并針對這些問題依照相關法律法規要求提出思考與建議,以期促進注射用輔料行業的持續健康發展。
1 國產注射劑中使用輔料標準收載情況
1.1 2020年版《中國藥典》收載的注射用輔料 2020年版《中國藥典》四部收載藥用輔料共335種,其中注射用輔料品種共13個,包括注明為“供注射用”的12個品種,分別為大豆油、大豆磷脂、甘油、丙二醇、丙交酯乙交酯共聚物(5050)、丙交酯乙交酯共聚物(7525)、丙交酯乙交酯共聚物(8515)、活性炭、蛋黃卵磷脂、氯化鈉、聚乙二醇300、聚乙二醇400,名稱未標注“供注射用”字樣的聚山梨酯80(Ⅱ),也為注射級輔料,與2015年版《中國藥典》收載的聚山梨酯80(供注射用)僅名稱書寫上的區別。
1.2 輔料備案平臺收載的注射用輔料 截至2021年8月15日,在國家藥品監督管理局藥品審評中心藥用輔料備案平臺中查詢到已登記注明為供注射用的輔料信息173條,品種總數共60種,參考輔料工具書[1-2]和文獻[3-7]報道,將其按照藥劑學用途進行歸納分類,結果見表1。
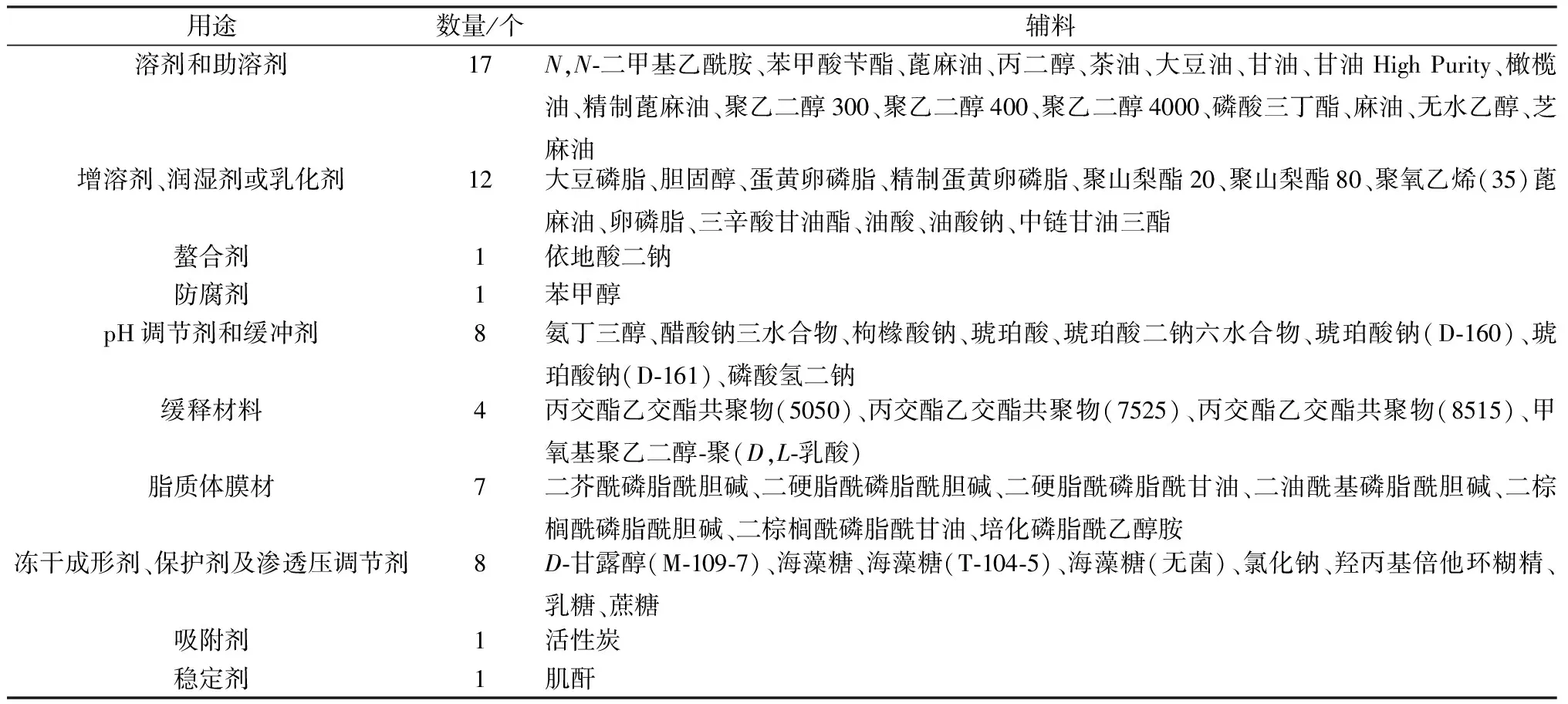
表1 備案注射用輔料信息
1.3 國產注射劑有使用但無注射用標準的輔料 將藥智網上查詢到的國產注射劑中使用的輔料,與藥品審評中心輔料備案平臺上已備案的注射用輔料以及2020年版《中國藥典》中收載的注射用輔料進行對比分析,得到國產注射劑中有使用,但沒有備案且藥典未收載的輔料有170個,結果見表2。
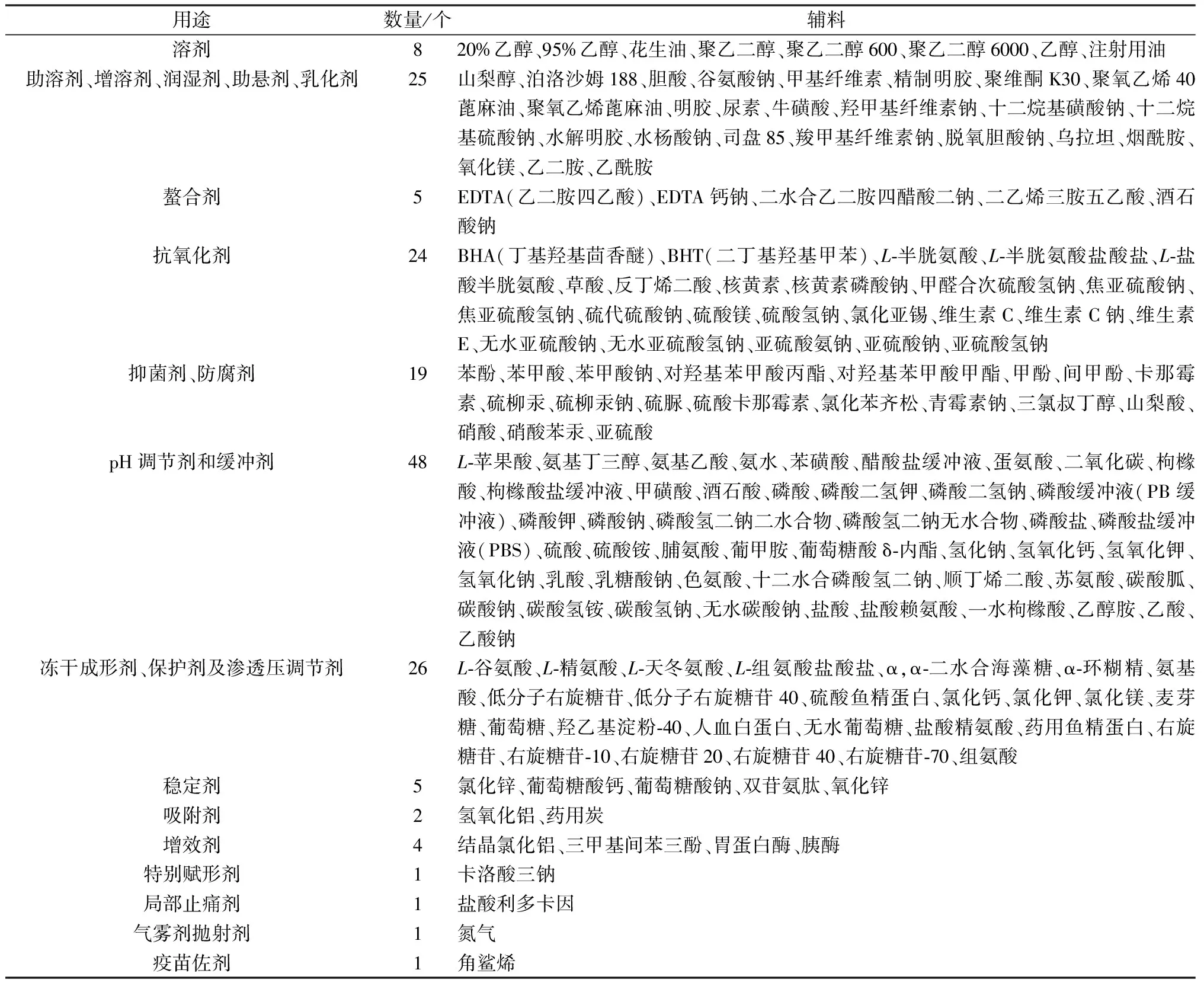
表2 國產注射劑有使用但無注射用標準的輔料
2 注射劑藥品說明書輔料標注存在的問題
2.1 未反映出所使用輔料的級別 2020年版《中國藥典》藥用輔料通則[8]規定,《中國藥典》收載的藥用輔料標準是對其質量控制的基本標準,對于聲稱符合《中國藥典》的藥用輔料必須執行《中國藥典》的相應標準。原國家食品藥品監督管理局2008年1月發布的《化學藥品注射劑基本技術要求(試行)》(國食藥監注[2008]7號)[9]關于上市后藥品改變輔料要求“注射劑經批準上市后,如需更改輔料的相關內容,例如生產商或質量標準等,應按補充申請進行申報”。藥智網上查詢到注射劑的藥品說明書中,除注射用水以外,其他輔料幾乎均未標明為注射用,例如依達拉奉注射液[海南先聲藥業有限公司(輔料為丙二醇,焦亞硫酸鈉)]。2020年版《中國藥典》及輔料備案平臺上的名稱為丙二醇(供注射用),而說明書為丙二醇,且在藥品審評中也未查到輔料變更的補充申請。
既然有注射用的標準,就應當將非注射級的丙二醇變更為注射級,且注明為供注射用,才能體現注射用標準的意義。
2.2 同一品種輔料處方不同 同一注射劑品種不同企業所用輔料配方不同的情況普遍存在。如注射用水溶性維生素,20家生產企業中,有14家所用輔料為甘氨酸、乙二胺四醋酸二鈉、對羥基苯甲酸甲酯,4家為甘氨酸、乙二胺四醋酸二鈉,1家為鹽酸半胱氨酸、甘氨酸、乙二胺四醋酸二鈉、對羥基苯甲酸甲酯,1家為乙醇、甘露醇、聚山梨酯80。又如依達拉奉注射液,有34份批文,涉及藥品上市許可持有人32個,檢索到的藥品說明書來自于17個藥品上市許可持有人。除海南先聲藥業有限公司的依達拉奉注射液說明書中標注使用丙二醇,其他企業均未使用丙二醇,如吉林省博大制藥股份有限公司,輔料為焦亞硫酸鈉、鹽酸半胱氨酸,無丙二醇,并且依達拉奉注射液原研廠是日本,輔料中也未使用丙二醇。按照《化學藥品注射劑基本技術要求》關于輔料選用的基本原則為①應采用符合注射用要求的輔料;②在滿足需要的前提下,注射劑所用輔料的種類及用量應盡可能少;③應盡可能采用注射劑常用輔料[9]。因此,海南先聲藥業有限公司在依達拉奉注射液中使用丙二醇的作用和依據理應說明。
2.3 未使用2020年版《中國藥典》名稱 許多藥品說明書中標注的輔料名稱未按2020年版《中國藥典》名稱統一規范化書寫。如注射用水溶性維生素藥品說明書中所示輔料乙二胺四醋酸二鈉、對羥基苯甲酸甲酯,均未使用2020年版《中國藥典》名稱,應修改為對應的通用名依地酸二鈉[10]、羥苯甲酯[11]。
2.4 未反映出質量區別 注射用水溶性維生素藥品說明書中所用輔料聚山梨酯80,可分為聚山梨酯80和聚山梨酯80(Ⅱ),2020年版《中國藥典》已明確區別,聚山梨酯80是以油酸山梨坦為原料合成,含油酸應不低于58.0%,含肉豆蔻酸、棕櫚酸、棕櫚油酸、硬脂酸、亞油酸、亞麻酸分別不得過5.0%、16.0%、8.0%、6.0%、18.0%、4.0%,無“細菌內毒素”檢查項;而聚山梨酯80(Ⅱ)(2020年版《中國藥典》)即為聚山梨酯80(供注射用)(2015年版《中國藥典》)的更名,是以植物來源油酸山梨坦為原料合成,含油酸應不低于98.0%,含肉豆蔻酸、棕櫚酸、棕櫚油酸、硬脂酸、亞油酸、亞麻酸均不得超過0.5%,有“細菌內毒素”檢查項,依法檢查(通則1143),每l mg聚山梨酯80中含內毒素的量應小于0.012 EU[12]。在注射用水溶性維生素藥品說明書中聚山梨酯80和聚山梨酯80(Ⅱ)未對作進行區分,沒有反映出質量區別。
2.5 未標注輔料用量 大部分國產注射劑說明書中未注明輔料的用量。如注射用氯諾昔康,國產注射用氯諾昔康說明書中輔料為甘露醇、氨丁三醇、依地酸二鈉,進口注射用氯諾昔康說明書中輔料為100 mg甘露醇、12 mg氨基丁三醇、0.2 mg乙二胺四乙酸鈉。注明輔料的用量能更好的保障藥品在臨床使用的安全性。研究發現,過度注射含有丙二醇的注射劑會致使丙二醇蓄積,導致患者出現急性中毒及死亡[13]。所以藥用輔料的使用量和濃度,不良反應和使用禁忌有必要在說明書中體現。
2.6 未對輔料不良反應予以警示 部分注射劑說明書未對輔料的不良反應予以警示。國家食品藥品監督管理局令第24號《藥品說明書和標簽管理規定》[14]中第11條規定“藥品處方中含有可能引起嚴重不良反應的成分或者輔料的,應當予以說明”。如注射用水溶性維生素,輔料為甘氨酸、依地酸二鈉(乙二胺四醋酸二鈉)、羥苯甲酯(對羥基苯甲酸甲酯)、鹽酸半胱氨酸,說明書中警示內容為對本品中任何成分過敏的患者,使用時均可能發生過敏反應。又如復方鹽酸阿替卡因注射液、阿替卡因腎上腺素注射液、鹽酸甲哌卡因腎上腺素注射液中均使用相同的輔料焦亞硫酸鈉,說明書中不良反應均指明,本品含有的焦亞硫酸鹽可能引起過敏反應或加重過敏反應。
3 注射用輔料需要提高和解決的問題
3.1 進一步明確注射用輔料的要求 2020年版《中國藥典》四部注射劑通則要求檢查項包括“可見異物”“不溶性微粒”“無菌”“細菌內毒素”“熱原”等[15],但關于注射用輔料的標準并不系統,如藥用輔料通則中僅寫道“藥用輔料的殘留溶劑應符合要求”“藥用輔料的微生物限度應符合要求”“用于無除菌工藝的無菌制劑的藥用輔料應符合無菌要求(通則1101)”“用于靜脈用注射劑、沖洗劑等的藥用輔料照細菌內毒素檢查法(通則1143)或熱原檢查法(通則1142)檢查,應符合規定”。各注射用輔料標注的檢查項不相同,如聚山梨酯80(Ⅱ)中有細菌內毒素檢查,無微生物限度檢查;而蛋黃卵磷脂(供注射用)中既有細菌內毒素檢查(每1 g中含內毒素的量應小于2.0 EU),也有微生物限度檢查(每1 g供試品中需氧菌總數不得過102 cfu,霉菌和酵母菌總數不得過102 cfu,不得檢出大腸埃希菌;每10 g供試品中不得檢出沙門菌)[16]。蛋黃卵磷脂需要做微生物限度檢查的原因是其易產生細菌,而例如氯化鈉等無機物類輔料,不易產生細菌,則只需做重金屬及有害元素殘留量等檢查。考慮到注射用輔料的特殊性和復雜性,應針對注射用輔料單獨列1個通則,進一步明確注射用輔料的要求,注明哪些輔料需要進行哪類檢查項目。
3.2 有注射用國家標準的必須使用,有備案的有條件使用 必須使用注射用輔料的條件為有藥品標準、有備案信息且對備案企業審計符合要求。按《藥品管理法》第45條[17]規定“生產藥品所需的原料、輔料,應當符合藥用要求、藥品生產質量管理規范的有關要求。生產藥品應當按照規定對供應原料、輔料等的供應商進行審核,保證購進、使用的原料、輔料等符合前款規定要求”。另外,《化學藥品注射劑基本技術要求》[9]中規定“使用已批準上市的注射用輔料,應提供輔料來源及質量控制的詳細資料,包括生產企業、執行的質量標準、檢驗報告、購買發票、供貨協議等”。故并非備案,就一定要使用,還需進行供應商審核,生產條件、質量保證、產能保證也是必不可少的。
3.3 提高純度、降低雜質 《化學藥品注射劑基本技術要求》[9]中規定“對于注射劑中有使用依據,但尚無符合注射用標準產品生產或進口的輔料,可對非注射途經輔料進行精制使其符合注射用要求,并制定內控標準。申報資料中應提供詳細的精制工藝及其選擇依據、內控標準的制定依據。必要時還應進行相關的安全性試驗研究”。例如氫氧化鈉,在注射劑有使用但尚無注射用標準,作為常用的pH調節劑,其氯化物檢查要求過高,“取本品0.50 g,依法檢查(通則0801),與標準氯化鈉溶液2.5 mL制成的對照液比較,不得更濃(0.005%)”[18],但一般藥廠不具備該技術,難以純化,對于酸堿這種難處理的無機物,是否可以考慮使用分析純或化學純作為輔料使用。
3.4 依法公開注射劑藥品說明書 按照《藥品說明書和標簽管理規定》(局令第24號)[14]第11條中規定“藥品說明書應當列出全部活性成分或者組方中的全部中藥藥味。注射劑和非處方藥還應當列出所用的全部輔料名稱。藥品處方中含有可能引起嚴重不良反應的成分或者輔料的,應當予以說明”。
3.5 簡化已上市注射劑使用注射級輔料的變更 現有管理制度下,注射用輔料的補充和變更的要求不夠清晰,應盡快完善藥用輔料變更相關管理制度,以促進制藥企業的工藝優化[19]。對于已證明可行且處方一樣的情況,如有注射用標準也被激活,在注射劑中有應用的輔料,可以簡化輔料變更相關流程,提高企業改良的積極性,有利于促進輔料和制劑行業持續健康發展。
4 總結
目前,已有國家標準、備案的注射用輔料占國產注射劑中已經使用的輔料的比例不高,注射劑藥品說明書中輔料標注也存在不足,包括未反映出所使用輔料的級別,同一品種輔料處方不同,未使用2020年版《中國藥典》名稱,未反映出質量區別,未標注輔料用量,未對輔料不良反應予以警示等。因此,需進一步加強注射用輔料的管理,明確注射用輔料的要求,依法公開注射劑藥品說明書,簡化已上市注射劑使用注射級輔料的變更,鼓勵企業快速使用注射級輔料,形成全行業良性循環的發展態勢。

