兼容性Cu2+溶液改性EP 基材催化銅導電線路沉積
王躍峰,洪 延,冀林仙,張 存,馬紫微*
(1. 運城學院物理與電子工程系 山西 運城 044000;2. 電子科技大學材料與能源學院 成都 610054)
印制電路板(printed circuit board, PCB)廣泛存在于各種電子產品中,用于電子元器件的安裝和互連。隨著電子信息技術的飛速發展及生產方式的綠色轉型,PCB 的制造越來越受到關注[1-3]。目前,傳統的蝕刻工藝在PCB 制作中仍占據主導地位,但這種方法存在工藝復雜、銅箔浪費和環境污染等缺點[4-5]。因此,研究工藝簡單、不產生任何材料浪費的加成工藝是PCB 制作未來的發展方向。
選擇性化學鍍銅法能在樹脂基材表面直接沉積銅導電線路,屬于加成工藝制作PCB 的一種常用方法[6]。然而樹脂自身的惰性使其不能催化銅沉積,同時樹脂低的表面能使其難于固定催化劑[7]。針對樹脂的惰性和低表面能,大量文獻研究了使用表面粗糙化、共價接枝、膠粘材料、激光處理等方法對樹脂基材表面改性并固定催化劑[8-11]。尤其,樹脂基材表面共價接枝改性層,借助改性層吸附催化劑是目前的研究熱點。文獻[12]在樹脂基材表面聚合一層聚多巴胺,聚多巴胺自身具有吸附和還原Ag+的能力,通過選擇性化學鍍銅法制作了性能優異的導電線路。文獻[13]在樹脂基材表面共價接枝含特殊官能團的聚合物,借助聚合物表面的特殊官能團吸附催化劑前驅體Pd2+,通過可控的選擇性化學鍍銅法沉積性能優異的導電線路和器件。共價接枝上述改性層雖然能夠催化銅導電線路在樹脂基材表面沉積,但通常改性層與樹脂基材的物理和化學性質不同,電子元器件產生的熱量會導致改性層與樹脂基材之間產生應力,影響銅線路與樹脂基材之間的結合力。
雙酚A 二縮水甘油醚(bisphenol A diglycidyl ether, BADGE)是環氧樹脂(epoxy resin, EP)的一種預聚體,本研究選用BADGE、固化劑593、硫脲、乙酸銅和丙二醇甲醚為原料,設計了一種基于EP 兼容的Cu2+溶液。
1 實 驗
1.1 理論計算
選用量子化學計算模擬硫脲分子與Cu2+的吸附位點,分析不同比例硫脲分子與Cu2+形成絡合物的穩定性,為兼容性Cu2+溶液的配制提供理論指導。兼容性Cu2+溶液中硫脲分子與Cu2+之間的絡合反應,選用密度泛函B3LYP 方法進行模擬[14-16]。硫脲分子與Cu2+形成絡合物的結構優化,選用6-311G+ (d, p)基組對H、C、N 和S 元素進行計算,選用LANL2DZ 基組對Cu 元素進行計算[17]。
絡合物中硫脲分子與Cu2+之間的鍵能為[15]:
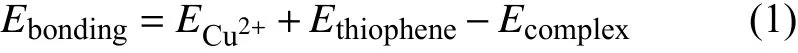
式中 ,ECu2+是 Cu2+的能量;Ethiophene是硫脲分子的能量;Ecomplex是硫脲分子與Cu2+形成絡合物的總能量。
1.2 兼容性Cu2+溶液制備
丙二醇甲醚(C4H10O2, 99.5%)購買于上海麥克林生化科技有限公司;BADGE(C21H24O4)購買于西格瑪奧德里奇(上海)貿易有限公司;硫脲(CH4N2S, 99.0%)、乙酸銅(C4H6CuO4·H2O,99.0%)購買于成都市科龍化工試劑廠;固化劑593(C11H27N3O)購買于鄭州祥之達化工有限公司。兼容性Cu2+溶液制備過程如下:首先,將硫脲(0.004 mol)和丙二醇甲醚(10 mL)依次加入玻璃樣品瓶(15 mL),磁力攪拌(室溫,200 rpm)10 min 得到無色透明溶液;然后,往玻璃樣品瓶中加入乙酸銅(0.002 mol),繼續磁力攪拌直到乙酸銅完全溶解得到藍色透明溶液;接著,往玻璃樣品瓶中加入BADGE(0.02 mol),保持磁力攪拌30 min 得到藍色透明溶液;最后,往玻璃樣品瓶中加入固化劑593(0.004 mol),繼續磁力攪拌30 min 得到藍色透明的兼容性Cu2+溶液。
1.3 銅導電線路制備
圖1 為兼容性Cu2+溶液改性EP 基材催化銅導電線路沉積的工藝流程圖。分為4 個步驟:1)表面清洗:室溫下把EP 基材浸入盛有乙醇的燒杯中,用超聲波清洗儀(CPX2800H-C)處理5 min,然后用去離子水沖洗3 遍,接著放入烘箱中(80 °C)干燥30 min 后得到表面干凈的EP 基材。2)表面改性:借助噴墨打印機把插圖中的兼容性Cu2+溶液印刷在干凈的EP 基材表面形成預設電路圖形,待兼容性Cu2+溶液形成的預設電路圖形固化后轉變為改性層。3)活化:把改性后的EP 基材放入空氣等離子體(220 V, 40 kHz, 150 W)處理15 min,使改性層中的Cu2+被還原為具有催化活性的Cu 納米顆粒。4)化學鍍銅:選用先前工作使用的化學鍍銅液配方和工藝[18],把活化后的EP 基材浸入到化學鍍銅液中進行選擇性化學沉銅,得到所需的銅導電線路。
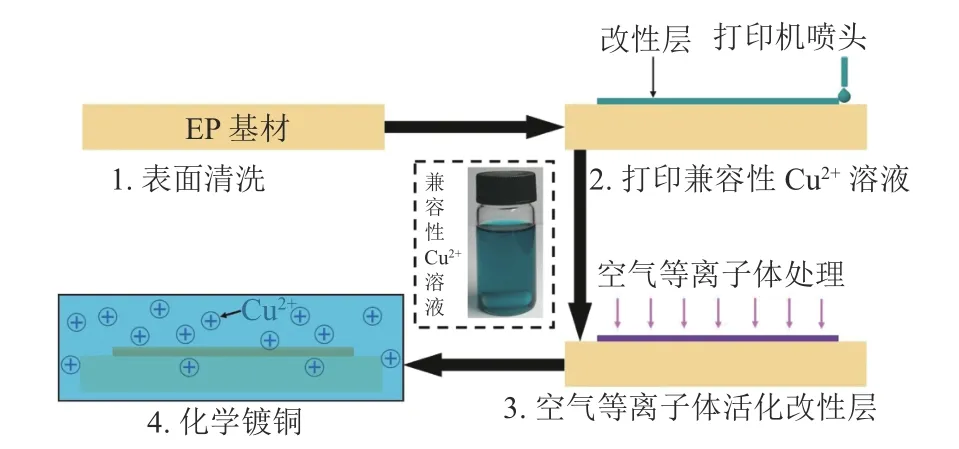
圖1 選擇性化學鍍沉積銅導電線路工藝流程圖
1.4 實驗表征
紅外光譜儀(thermo fisher scientific)和拉曼光譜儀(Horiba iHR550)測試兼容性Cu2+溶液中特殊官能團的變化;改性層中銅元素化合價借助X 射線光電子能譜儀(X-ray photoelectron spectroscopy,XPS, THERMO ESCALAB 250XI )進行表征;選用百格測試法評估銅導電線路與EP 基材之間的結合力;原子力顯微鏡(atomic force microscopy, AFM,dimension ICON)測試EP 基材表面粗糙度;X 射線衍射儀(PHILIPS X’PERT MPD)表征化學沉積層的成分和結晶度;掃描電子顯微鏡(scanning electron microscopy, SEM, HIEACHI S3400)表征改性層和銅線路的表面形貌;臺階儀(Dektak XT)測量銅導電線路的厚度;多功能電表(Keithley 2400)測試銅導電線路的電阻。
2 結果與討論
2.1 吸附位點研究
硫脲分子中的N 和S 原子核外具有孤對電子[19],兼容性Cu2+溶液中的Cu2+理論上優先被吸附在硫脲分子中的N 或S 原子位置。借助量子化學計算模擬硫脲分子與Cu2+的吸附位點,圖2 為硫脲分子與Cu2+可能形成的4 種絡合物結構、最高占據分子軌道(high occupied molecular orbital, HOMO)和最低未占據分子軌道(lowest unoccupied molecular,LUMO)。根據前線分子軌道理論[20-21],分子的HOMO 容易給予電子與陽離子形成絡合物;分子的LUMO 優先從電子給予體獲得電子發生化學反應。根據圖2 可知,4 種絡合物的HOMO 都可以繼續給予電子與Cu2+形成新的絡合物;同時4 種絡合物的LUMO 也可能繼續從硫脲分子獲得電子形成新的絡合物。絡合物中硫脲分子與Cu2+之間的鍵能通過式(1)進行計算。4 種絡合物中硫脲分子與Cu2+之間的鍵能分別為65.726 kJ/mol、87.582 kJ/mol、71.459 kJ/mol 和93.465 kJ/mol。計算結果表明,圖2 中最后一排硫脲分子與Cu2+之間的鍵能最大,可能是(N-S)協同作用的結果,Cu2+優先被吸附在N 和S 原子之間。
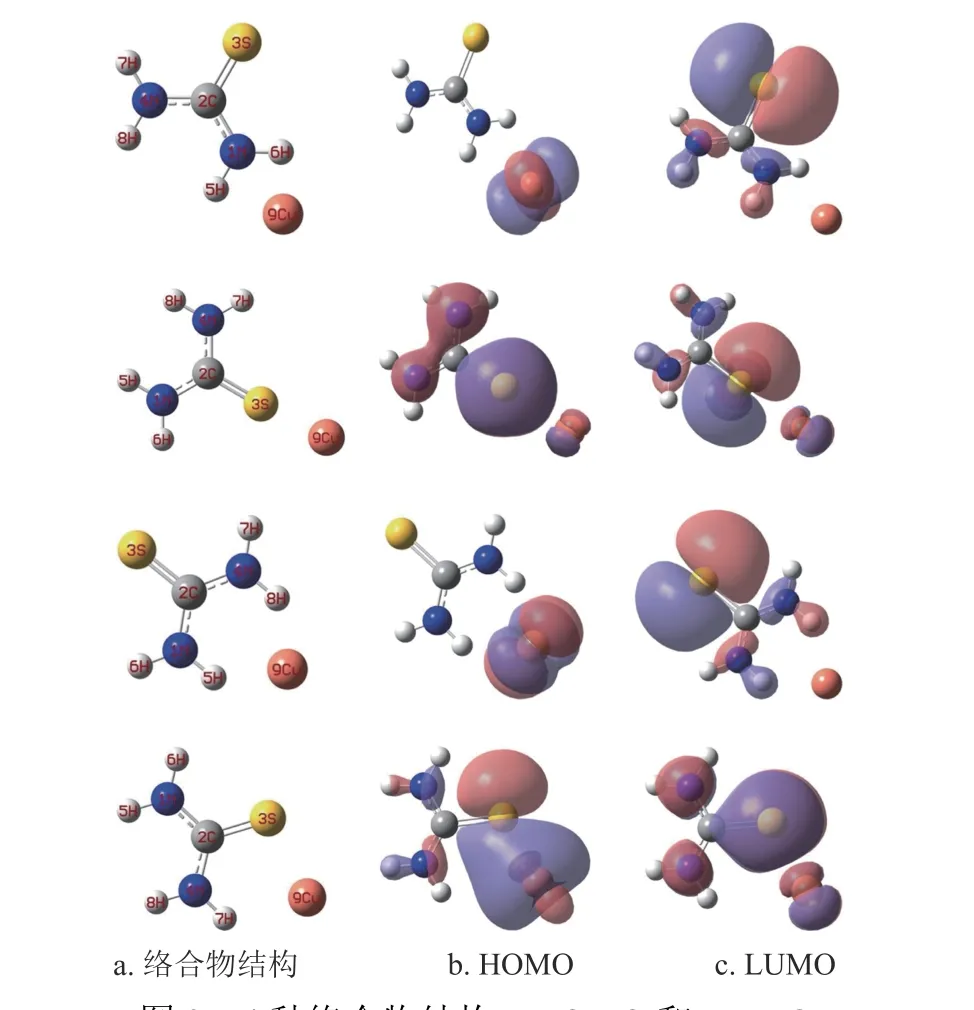
圖2 4 種絡合物結構、HOMO 和LUMO
2.2 絡合物穩定性研究
根據量子化學計算可知,當n(硫脲):n(Cu2+)=1:1 時,Cu2+優先被吸附在硫脲分子中N 和S 原子之間,且絡合物可以進一步與硫脲分子或Cu2+形成新的絡合物,結構最穩定的絡合物才能在兼容性Cu2+溶液中穩定存在。不同比例硫脲分子與Cu2+形成絡合物的結構穩定性采用密度泛函理論進行模擬計算,絡合物的能隙根據公式ΔE=ELUMO-EHOMO進行計算,其能隙ΔE越大表明絡合物結構越穩定[22-23]。圖3 為不同比例硫脲分子與Cu2+形成的4種結構優化的絡合物前線分子軌道能量示意圖,從圖中可以看出,4 種絡合物能隙ΔE分別為2.957 eV(1:2)、4.031 eV(1:1)、5.016 eV(2:1)和4.509 eV(3:1)。因此,n(硫脲):n(Cu2+)=2:1 時,形成的絡合物具有最穩定的結構,可以在兼容性Cu2+溶液中穩定存在。
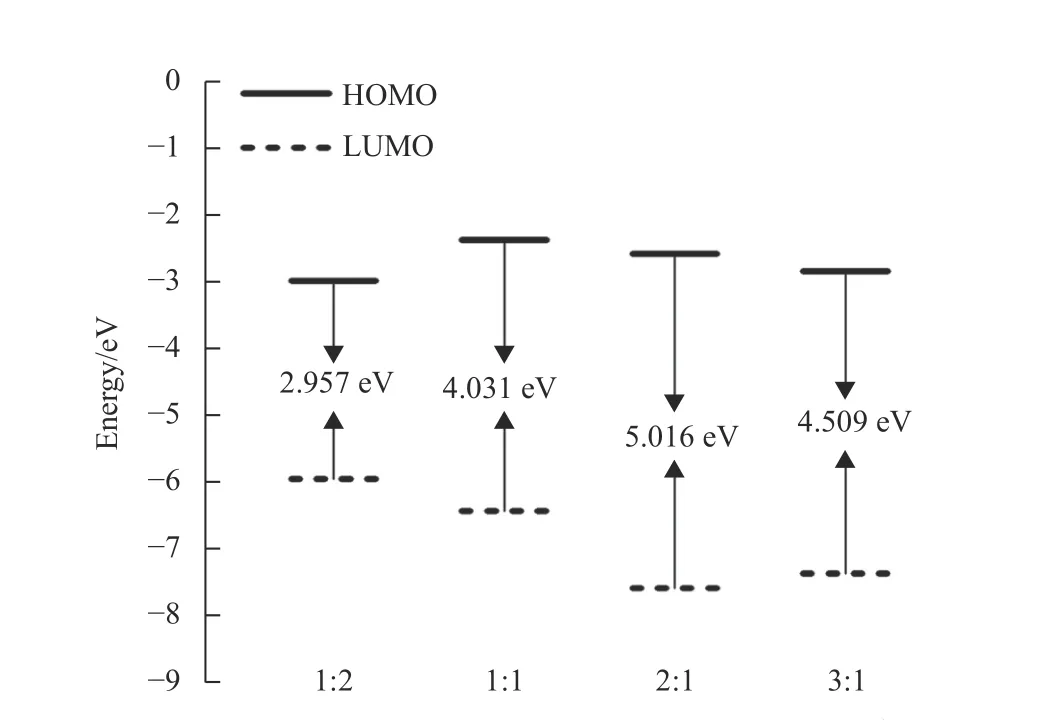
圖3 4 種結構優化的絡合物前線分子軌道能量示意圖
2.3 兼容性Cu2+溶液表征
為了研究兼容性Cu2+溶液中各種試劑之間是否發生化學反應,表1 按照兼容性Cu2+溶液制備流程列出了不同試劑在丙二醇甲醚中的含量,選用紅外光譜法表征兼容性Cu2+溶液中特殊官能團的變化。圖4 中4 條曲線分別對應表1 中溶液A、B、C 和D 的紅外吸收光譜圖。其中,曲線1 中1 100 cm-1處的峰值對應丙二醇甲醚中醚鍵(C-O-C)的伸縮振動[24-25],734 cm-1、1 625 cm-1處的兩個峰值分別對應(C=S)的伸縮振動和氨基(-NH2)的彎曲振動[26],兩個特征官能團(C=S)和氨基(-NH2)說明硫脲溶解于丙二醇甲醚中能夠穩定存在。曲線2 與曲線1 相比幾乎沒有變化,僅有734 cm-1處的峰值移動到723 cm-1處,這種現象可能是(C=S)基團自發吸附Cu2+后,導致其能量降低而產生紅移。曲線3 和曲線4 是一組對比實驗,830 cm-1、1 245 cm-1、1 509 cm-1處的3 個峰值分別對應BADGE 中環氧基團(-CH (O)CH-)的伸縮振動、醚鍵(C-O-C)的伸縮振動和苯環中(C-C)的伸縮振動[27];1 670 cm-1處的峰值對應亞胺基團(-NH-)的伸縮振動僅出現在曲線4 中,同時1 625 cm-1處的峰值對應氨基(-NH2)的彎曲振動在曲線4 中消失[28]。因此,根據文獻[29]報道推斷,硫脲分子中的氨基(-NH2)和BADGE 中環氧基團(-CH(O)CH-)發生化學反應,氨基(-NH2)轉化為亞胺基團(-NH-)。
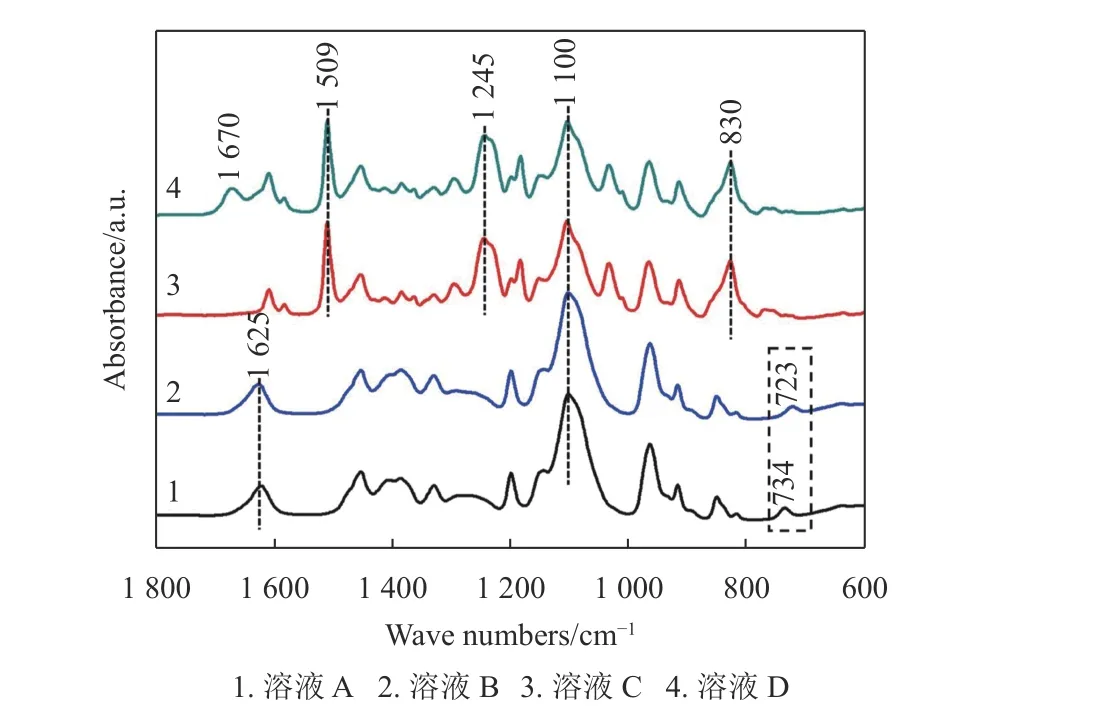
圖4 紅外光譜圖
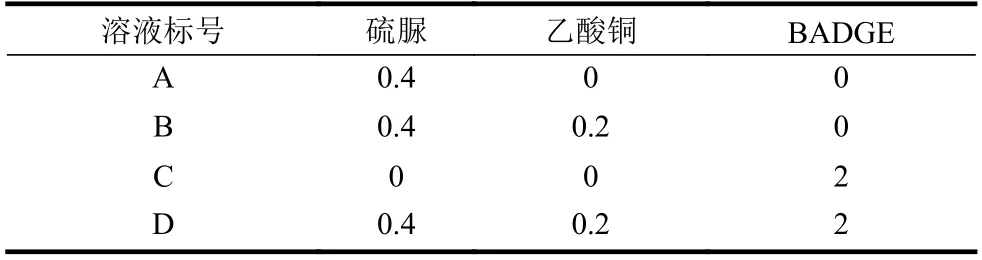
表1 不同試劑在丙二醇甲醚中的含量 mol·L-1
曲線4 中,723 cm-1處的峰值對應(C=S)伸縮振動峰消失,可能是(C=S)在溶液D 中與BADGE發生化學反應。拉曼光譜法被用來進一步研究溶液D 中官能團的變化。圖5 為溶液D 揮發掉溶劑丙二醇甲醚得到藍色沉淀的拉曼光譜圖,1 607 cm-1處對應苯環中(C=C)的伸縮振動峰,1 252 cm-1處對應環氧基團(-CH(O)CH-)彎曲振動峰,1 185 cm-1處對應苯環中(C-H)的伸縮振動峰,1 109 cm-1處對應醚鍵(C-O-C)伸縮振動峰,915 cm-1處對應環氧基團中(C-O)的伸縮振動峰,807 cm-1處對應(CH2)伸縮振動峰,這6 個代表性的振動峰表明藍色沉淀中含有BADGE[30-32]。另外,1 102 cm-1處沒有檢測到(C=S)伸縮振動峰,而638 cm-1處出現一個新的拉曼光譜峰(C-S-C,伸縮振動)[30,33]。結合文獻[34]報道推論,硫脲分子中的(C=S)與BADGE 中的環氧基團(-CH(O)CH-)發生反應生成C-S-C。

圖5 拉曼光譜圖
根據上述紅外光譜和拉曼光譜的分析結果可知,硫脲分子中的氨基(-NH2)、(C=S)能夠與BADGE 中的環氧基團(-CH(O)CH-)發生反應,分別生成亞胺基團(-NH-)和C-S-C。因此,硫脲分子通過共價鍵與BADGE 結合,同時N 和S原子核外的孤對電子能夠絡合吸附Cu2+,使Cu2+被固定在BADGE 上。
2.4 XPS 分析
圖6a 為樣品A1(EP 基材)和A2(兼容性Cu2+溶液固化后的EP 基材)的XPS 全譜圖,從樣品A1 的XPS 譜圖中可以看出,EP 基材元素主要包括O 1s (533.85 eV)、N 1s (402.55 eV)和C 1s(286.85 eV)[35],說明實驗選用的是固化劑為胺類的常用EP 基材。樣品A2 放入超聲水浴中處理10 min 后做XPS 測試,仍在樣品A2 中檢測到Cu 2p(933.75 eV 和953.59 eV)、O 1s (533.85 eV)、N 1s(402.55 eV)、C 1s (286.85 eV)、S 2s (229.65 eV)和S 2p (165.95 eV)[11,36]。根據圖6a 的XPS 全譜圖對比分析表明,兼容性Cu2+溶液固化后形成的改性層能夠與EP 基材牢固結合,其作為橋接層有利于提高EP 基材與銅導電線路之間的結合力。
圖6b 為樣品A2 中Cu 2p 的XPS 譜圖,用來表征改性層中銅元素的化合價態。曲線B1 是等離子處理前的XPS 譜圖,兩個峰的位置分別在953.59 eV 和933.75 eV 附近[36]。曲線B2 是空氣等離子體處理15 min 后的XPS 譜圖,兩個峰的位置分別在952.53 eV 和932.65 eV 附近[37-38]。根據圖6b的結果可知,空氣等離子體處理15 min 后可以把改性層中的Cu2+還原為金屬Cu,將其轉化為具有啟動化學鍍銅的活化層。
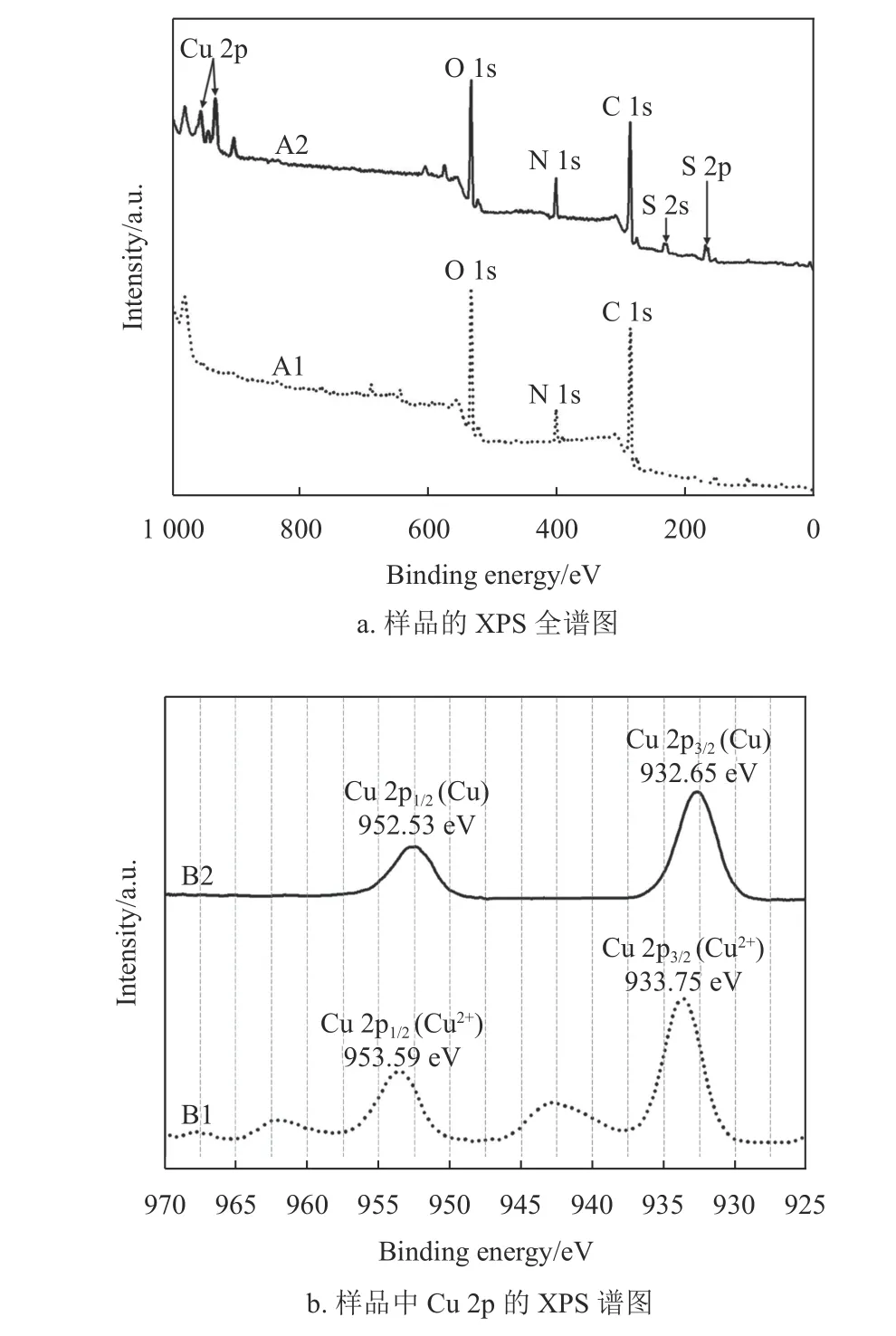
圖6 樣品的XPS 測試圖
2.5 導電性能分析
PCB 中銅線路用于電子元器件的互連,其導電性能是重要的參考指標之一。圖7a 為沉積40 min銅線路的光學圖像,可以看出銅線路線寬約為550 μm,線路邊緣光滑且沒有出現滲鍍,說明該方法能夠在EP 基材表面制作線寬均勻的銅線路。圖7b 為沉積40 min 銅線路的XRD 譜圖,3 個布拉格衍射峰的位置在2θ 角4.34°、50.7°和74.2°附近,其分別對應面心立方結構Cu 的(111)、(200)和(220)晶面[39]。另外,3 個尖銳的特征衍射峰表明,銅晶粒結晶度良好,能夠有效減小銅的本征電阻,提高銅線路的電導率。圖7c 為改性層(空氣等離子體處理15 min)表面的mapping 測試圖,可以看出作為催化活性中心的銅納米顆粒(藍點)均勻分布在改性層表面,這有利于銅晶粒均勻沉積。圖7d 為沉積40 min 后銅線路表面的SEM 形貌圖,可以看出沉積的銅晶粒結晶均勻,尺寸約為500 nm,晶粒之間結晶致密且沒有孔隙,有利于減小銅線路中晶粒間的接觸電阻。
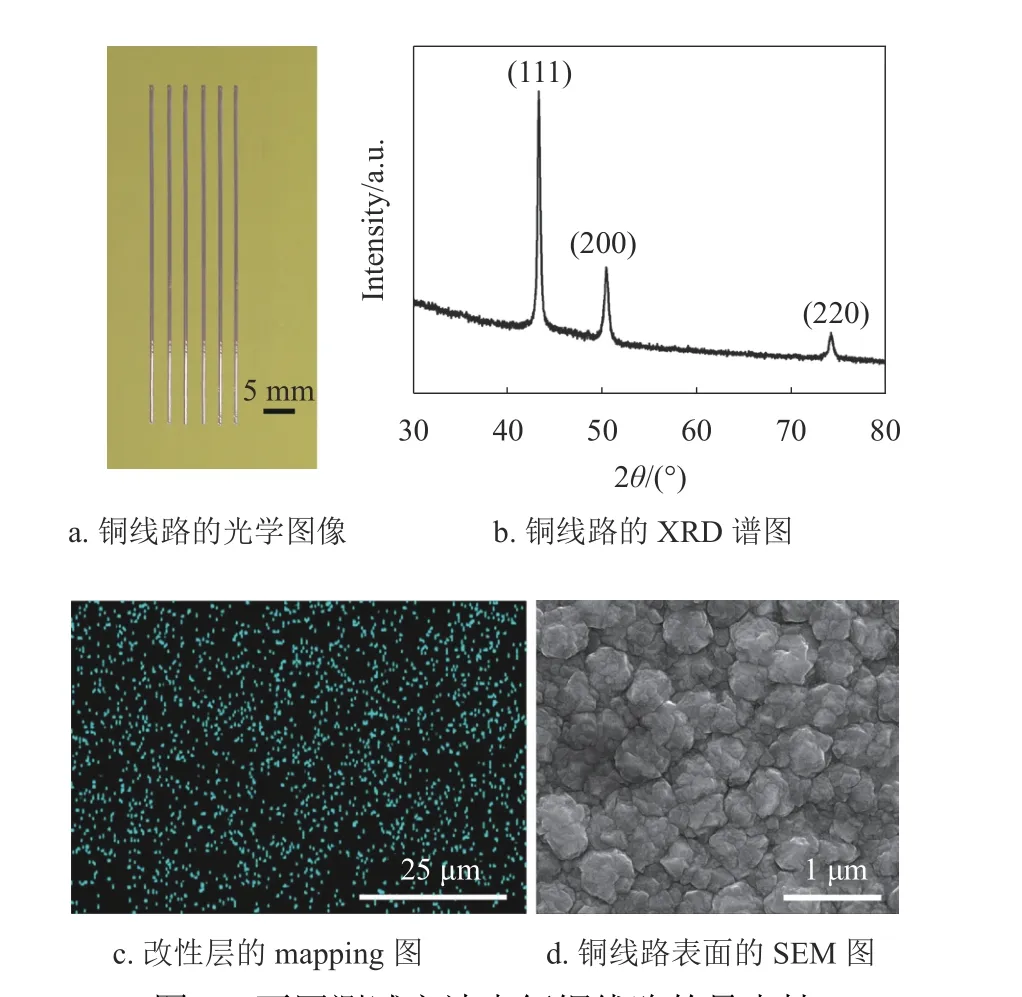
圖7 不同測試方法表征銅線路的導電性


表2 沉積40 min 銅線路不同參數的測量值
2.6 結合力分析
銅導電線路與EP 基材之間的結合力是決定PCB 使用壽命的一個重要指標。百格測試法用來表征銅線路與EP 基材之間的結合力,圖8a 為3M 膠帶測試前的光學圖像,可以看出百格刀切割后的銅層邊緣光滑且平整;圖8b 為3M 膠帶測試后的光學圖像,可以看出沒有銅層從EP 基材表面脫落。百格測試結果證明,根據ASTM D3359 標準,銅線路與EP 基材之間的結合力達到5B 等級,表明采用該方法制備的銅導電線路與EP 基材之間具有強的結合力。
圖8c 為用AFM 測試EP 基材表面的粗糙度,結果表明EP 基材的面粗糙度(Sa)約為75 nm,說明EP 基材表面非常光滑,其很難與改性層之間形成機械鎖扣。然而,百格測試結果表明,銅導電線路與EP 基材之間具有強結合力,說明改性層與EP 基材之間的結合并不是一種簡單的物理結合。圖8d 為EP 基材的紅外吸收光譜圖,830 cm-1、1 245 cm-1、1 509 cm-1和2 970 cm-1處的4 個峰值分別對應環氧基團(-CH(O)CH-)的伸縮振動、醚鍵(C-O-C)的伸縮振動、苯環中(C-C)的伸縮振動、羥基(-OH)的伸縮振動[11]。紅外測試結果表明,EP 基材表面有大量的環氧基團(-CH(O)CH-)和羥基(-OH)。值得注意的是,EP 基材表面的環氧基團能夠與兼容性Cu2+溶液中環氧基團和固化劑593 中的氨基(-NH2)發生反應式(2)[29];同時EP基材表面的羥基能夠與兼容性Cu2+溶液中的環氧基團發生反應式(3)[40]。因此,改性層與EP 基材之間通過化學反應式(2)和式(3)生成的共價鍵牢固地結合在一起。
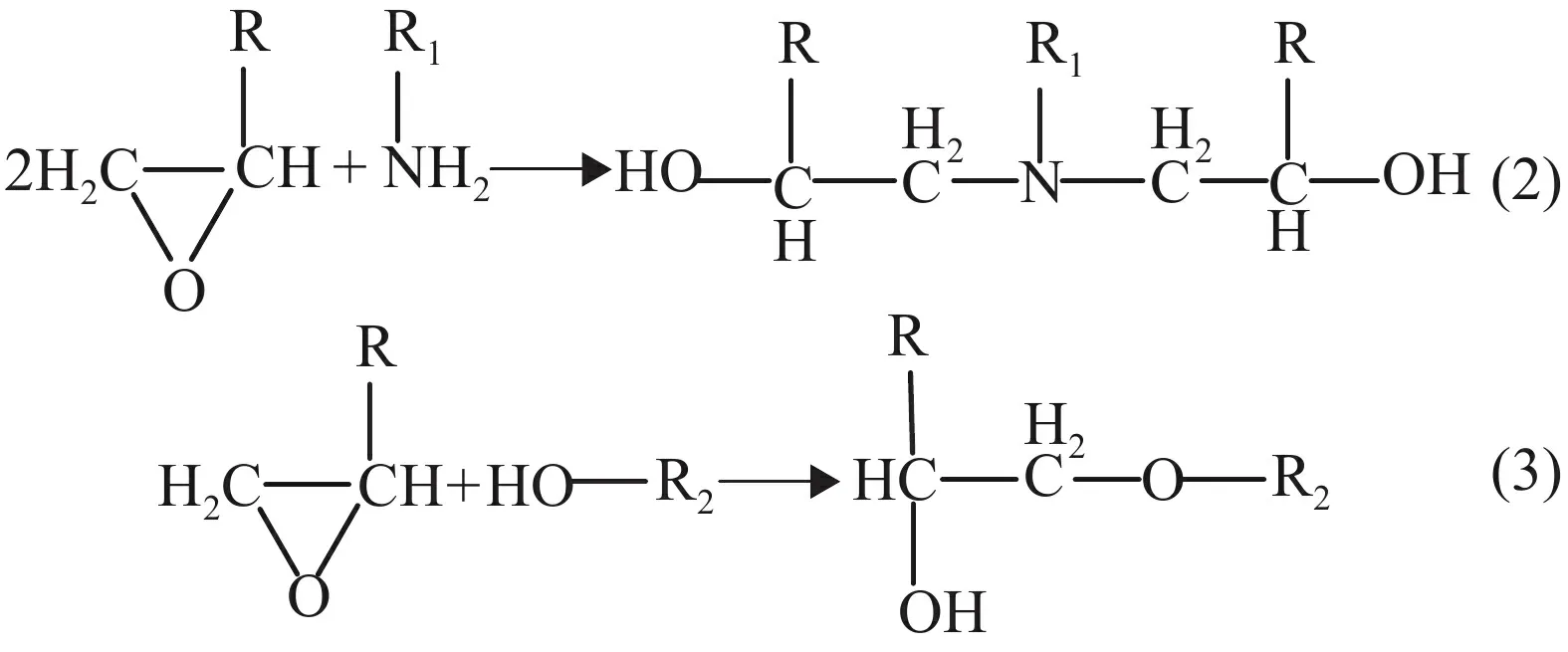
圖8e 中插圖是改性層(空氣等離子體處理前)表面的SEM 圖,能夠看出改性層表面比較光滑,圖8e 為經空氣等離子處理15 min 后改性層表面的SEM 圖,可以看出其表面變得凹凸不平,這樣沉積的銅層就能夠與改性層形成機械鎖扣提高結合力[41]。另外,結合圖6b 的XPS 分析結果可知,空氣等離子體處理后能夠把改性層中的Cu2+還原為具有催化活性的金屬銅,沉積的銅層會與改性層表面的銅納米顆粒形成金屬鍵。因此,改性層與銅層通過機械鎖扣和金屬鍵牢固地結合在一起。
根據圖8b、8c 和8d 的分析結果可知,改性層作為橋接層通過物理機械鎖扣和金屬鍵把EP 基材與銅層牢固地結合在一起,分析結果與圖8a 的百格測試結果一致。
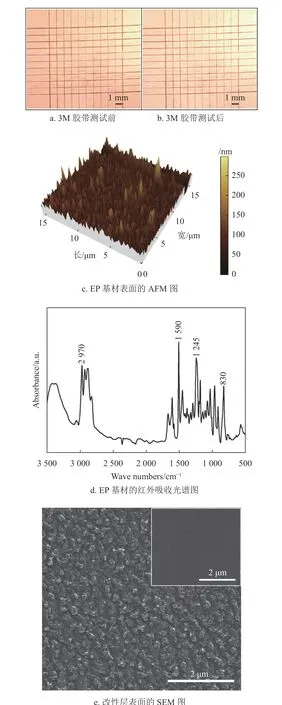
圖8 不同測試方法表征銅線路與EP 基材之間的結合力
3 結 束 語
本文設計出一種基于EP 基材兼容的Cu2+溶液,采用選擇性化學鍍銅法制備了性能優異的銅導電線路。主要結論如下:1)量子化學計算結果表明,改性溶液中n(硫脲):n(Cu2+)=2:1 時,形成的絡合物結構最穩定;2) XPS 測試結果證明,空氣等離子處理15 min 后,改性層中的Cu2+被還原為金屬Cu;3)導電性能分析結果表明,化鍍40 min 后銅線路電阻率低至2.62×10-6Ω·cm;4)結合力分析結果表明,改性層通過物理機械鎖扣和金屬鍵把銅線路與EP 基材牢固地結合在一起,使結合力達到5B等級。總之,EP 基材兼容性改性催化銅導電線路沉積工藝簡單、滿足綠色生產,制備的銅線路性能優異,對其他常用樹脂基材表面兼容性改性加成制備PCB 具有一定的參考價值。
本文研究工作得到運城學院博士科研啟動項目(YQ-2021009)和運城學院學科建設經費的支持,在此表示感謝。

