微生物發酵技術對粉葛化學成分的影響
楊金梅,李冠文,王輝敏,張娜郡,陳 超,孫 杰,秦 楠
(山西中醫藥大學中藥與食品工程學院,山西 晉中 030619)
粉葛為豆科植物甘葛藤Pueraria thomsoniiBenth.的干燥塊根,具有營養獨特、藥食兼優的特點,是國家衛生健康委員會收納的藥食同源類中藥[1-2]。粉葛具有抗心肌缺血、降血糖、降血脂、解熱、抗病毒等多種藥理作用,其發揮藥效的主要成分是異黃酮類化合物,如葛根素[3-6]。粉葛早期因與野葛在功效、主治上皆相同,故統稱作葛根。但隨著研究的不斷深入,粉葛被證明在植物形態、成分種類及含量上均與野葛存在較大差異,如葛根素的含量是葛根的1/8[6-8]。因此,2005 版中華人民共和國藥典將粉葛與野葛以來源進行區分,形成粉葛多食用、野葛多藥用的現狀[9]。
微生物發酵是一種傳統的中藥炮制方法,能夠對中藥的性味功效、化學成分及藥理作用產生影響,具有改變中藥原有性能、增強或產生新的功效、降低毒性等作用[10-11]。經微生物發酵炮制的中藥種類繁多,廣泛用于多種疾病的治療。Cao 等[12]通過發酵方法降低劇毒類生物堿類化合物的含量以生產華豐丹藥木;張紅艷等[13]將中藥復方經微生物發酵后,其活性成分得到增加;Wang 等[14]利用鼠李糖乳桿菌217-1 發酵使得葛根中葛根素和異黃酮的含量均得到增加;陳艷艷[15]利用釀酒酵母固體粉末發酵葛根,使葛根黃酮的含量升高41.2%。
目前微生物發酵技術已廣泛應用于各研究領域中,但尚未見粉葛微生物發酵相關文章的報道。因此,本實驗選用碳水化合物代謝作用較強的嗜酸乳桿菌為發酵菌種,首次對淀粉含量頗高的藥食同源中藥粉葛進行微生物發酵研究。借助響應曲面設計法優化粉葛的發酵工藝,并對其發酵前后主要成分進行含量測定和比較,以探討微生物發酵技術對粉葛中活性成分的作用。進一步分析微生物發酵技術用于增加粉葛活性成分的可行性,為粉葛資源的充分利用提供理論依據和實踐基礎。
1 材料與方法
1.1 材料與儀器
粉葛 購自山西國泰中藥股份有限公司,粉碎,過40 目篩,備用;嗜酸乳桿菌 保藏于山西中醫藥大學食品工藝發酵實驗室,經液態培養基培養后,總活菌數為3×107CFU/mL 的菌液,于4 ℃冰箱中保藏,備用;葛根素標準品 成都格利普生物科技有限公司,批號18082401;大豆苷元標準品(批號5160)、大豆苷標準品(批號5901) 購自上海詩丹德標準技術服務有限公司;直鏈淀粉標準品 北京北方偉業計量技術研究院,批號20210910;支鏈淀粉標準品(批號A01N11L129489)、葡萄糖標準品(批號S22J12 H137237) 購自上海源葉生物有限公司;色譜級甲醇(批號204135)、乙腈(批號201343) 購自賽默飛世爾科技(中國)有限公司;牛肉膏、蛋白胨 購自北京奧博星生物技術有限責任公司;其余試劑均國產分析純。
BSP-250 生化培養箱、YXQ-LS-75SII 立式壓力蒸汽滅菌鍋 上海博迅實業有限公司醫療設備廠;SW-CJ-2F 雙人雙面凈化工作臺 上海書培實驗設備有限公司;L-3000 高效液相色譜儀、Ultra-3660 紫外分光光度計 北京普源精電科技有限公司;BSA-224S-CW 電子天平 賽多利斯科學儀器有限公司;SZF-06C 脂肪測定儀 濟南精密科學儀器儀表有限公司。
1.2 實驗方法
1.2.1 粉葛發酵工藝流程及操作要點
粉葛飲片→粉碎→過篩(40 目)→加超純水→高壓滅菌→接入嗜酸乳桿菌菌液→靜置發酵→干燥(70℃)→粉葛發酵品
操作要點:菌液制備:按牛肉膏3.0 g,蛋白胨10.0 g,氯化鈉5.0 g,水1000 mL 配制液體培養基,121 ℃高壓滅菌20 min,冷卻,無菌條件下接入已活化的嗜酸乳桿菌,37 ℃,150 r/min 培養24 h,即得嗜酸乳桿菌菌液,計數得總活菌數為3×107CFU/mL。
粉碎、過篩:將藥材全部粉碎過篩,40 目,以增加代表性。
接菌:在無菌條件下按比例接入嗜酸乳桿菌菌液,搖勻。
1.2.2 單因素實驗
1.2.2.1 接種量對葛根素含量的影響 固定料(粉葛粉末)液(蒸餾水)比1:4 g/mL,發酵溫度31 ℃,發酵時間36 h,以葛根素含量為指標,考察不同接種量(4%、6%、8%、10%、12%)對發酵的影響。
1.2.2.2 料液比對葛根素含量的影響 固定接種量8%,溫度31 ℃,時間36 h,以葛根素含量為指標,考察不同料液比(1:2、1:3、1:4、1:5、1:6 g/mL)對發酵的影響。
1.2.2.3 發酵溫度對葛根素含量的影響 固定接種量8%,料液比1:4 g/mL,時間36 h,以葛根素含量為指標,考察不同發酵溫度(27、29、31、33、35 ℃)對發酵的影響。
1.2.2.4 發酵時間對葛根素含量的影響 固定接種量8%,料液比1:4 g/mL,溫度31 ℃,以葛根素含量為指標,考察不同發酵時間(12、24、36、48、60 h)對發酵的影響。
1.2.3 響應曲面試驗設計 在單因素實驗的基礎上,以Box-Behnken 為原理,葛根素含量為響應值,接種量、料液比、發酵時間為影響因素,進行三因素三水平的響應曲面設計,因素及水平見表1。
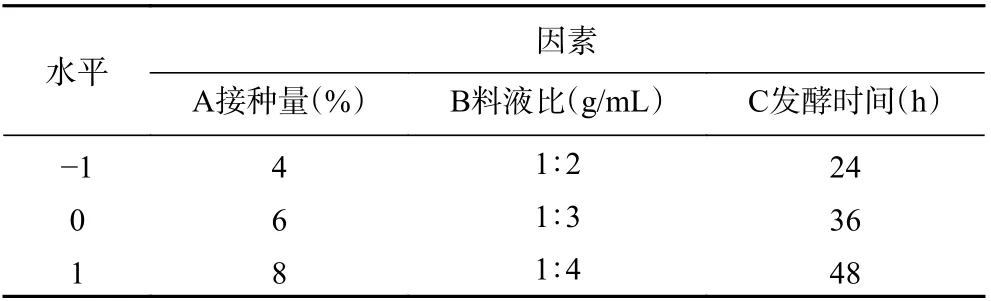
表1 響應面因素和水平設計Table 1 Response surface factor and level design
1.2.4 粉葛發酵前后水分、灰分測定 水分含量測定參照GB 5009.3-2016 食品中水分的測定;灰分含量測定參照GB 5009.4-2016 食品中灰分的測定。
1.2.5 粉葛發酵前后葛根素、大豆苷元、大豆苷含量測定
1.2.5.1 色譜條件 Compass C18(2)(250×4.6 mm,5 μm)色譜柱,流動相為甲醇(A)-水(B),梯度洗脫(0~30 min,24% A;30~60 min,60% A)。檢測波長250 nm,流速1.0 mL/min,柱溫25 ℃,檢測時間60 min[16]。
1.2.5.2 標準溶液制備及標準曲線繪制 精密稱取葛根素、大豆苷、大豆苷元標準品適量,50%乙醇溶解,得0.2 mg/mL 大豆苷、大豆苷元標準溶液,0.4 mg/mL 葛根素標準溶液。精密移取各標準溶液稀釋制得系列標準工作液,0.45 μm 微孔濾器過濾,參照1.2.5.1 色譜條件。分別以濃度為橫坐標,峰面積為縱坐標,得葛根素線性回歸方程:y=31848x-129.83(R2=0.9992),大豆苷元線性回歸方程:y=49.71x-49.798(R2=0.9994),大豆苷線性回歸方程:y=32.096x-149.36(R2=0.9993),表明葛根素在0.1~0.22 mg/mL、大豆苷元在4~64 μg/mL、大豆苷在8~80 μg/mL 范圍內線性關系均良好。
1.2.5.3 供試品溶液制備 精密稱取樣品粉末0.5 g(40 目),加20 mL 50%乙醇,稱重,70 ℃加熱提取50 min,冷卻,稱重,補足減失重量,搖勻,過濾,0.45 μm微孔濾器過濾,即得供試品溶液。
1.2.6 總異黃酮含量測定
1.2.6.1 標準溶液制備及標準曲線繪制 葛根素標準溶液制備同1.2.5.2,稀釋得系列標準工作液。以50%乙醇為空白溶液,250 nm 處測定吸光度[17]。以濃度為橫坐標,吸光度值為縱坐標,得線性回歸方程:y=0.0382x+0.1101(R2=0.9995),表明葛根素在2~20 μg/mL 范圍內線性關系良好。
1.2.6.2 供試品溶液制備 供試品溶液制備同1.2.5.3。
1.2.7 可溶性多糖含量測定
1.2.7.1 葡萄糖標準溶液制備及標準曲線繪制 精密稱取適量葡萄糖標準品,以水配制0.5 g/mL 標準溶液,稀釋得系列標準工作液。采用苯酚-濃硫酸法顯色[18],于490 nm 處測定吸光度。以濃度為橫坐標,吸光度值為縱坐標,得線性回歸方程:y=0.0376x+0.0948(R2=0.9992),表明葡萄糖在2.5~15 μg/mL 范圍內線性關系良好。
1.2.7.2 供試品溶液制備 精密稱取樣品粉末各2.0 g,加80 mL 水,80 ℃超聲提取30 min,共兩次,過濾,合并濾液,濃縮,按體積1:3 加95%乙醇,低溫靜置24 h,離心,沉淀加水復溶,過濾,50 mL 容量瓶定容,即得供試品溶液。
1.2.8 總淀粉含量測定
1.2.8.1 標準溶液制備 分別精密稱取直鏈、支鏈淀粉標準品適量,10 mL 1 mol/L 氫氧化鉀溶液沸水浴溶解,冷卻,超純水定容,得1 mg/mL 標準溶液。
1.2.8.2 選擇測定波長和參比波長 精密移取2 mL直鏈淀粉標準溶液、5 mL 支鏈淀粉標準溶液分別于50 mL 容量瓶中,參照崔晉和趙璇等[19-20]方法測定直鏈和支淀粉吸收曲線。根據等吸收點作圖法,確定直鏈淀粉的測定波長和參照波長;支鏈淀粉的測定波長和參照波長。
1.2.8.3 標準曲線繪制 參照1.2.8.2 稀釋各標準溶液得各系列標準工作液,以超純水為空白溶液,于λ1和λ2測定直鏈淀粉吸光度值A1和A2;λ3和λ4測定支鏈淀粉吸光度值A3和A4。以直鏈淀粉濃度為橫坐標,A1-A2為縱坐標,得線性回歸方程為:y=0.0061x-0.0779(R2=0.9992),表明直鏈淀粉在60~120 μg/mL 范圍內線性關系良好。以支鏈淀粉濃度為橫坐標,A3-A4為縱坐標,得線性回歸方程為:y=0.0018x+0.0458(R2=0.999),表明支鏈淀粉在80~140 μg/mL 范圍內線性關系良好。
1.2.8.4 供試品溶液制備 精密稱取樣品粉末各3.0 g,干燥至恒重,計算含水量W1。干燥后的樣品,以80 mL 石油醚為溶劑,加熱回流4 h,以85%乙醇為溶劑,繼續回流4 h,干燥至恒重,計算糖脂比W2。精密稱取脫脂脫糖樣品0.1 g,參照1.2.8.1 制備供試品溶液。
1.3 數據處理
利用SPSS 26.0 分析數據,Graphpad prism v6.01作圖。Design-Expert.V8.0.6 進行響應曲面設計及繪圖。每組實驗重復三次,結果以平均值加減標準差(±s)表示。
2 結果與分析
2.1 單因素實驗結果
2.1.1 接種量對葛根素含量的影響 接種量與發酵基質中菌種的繁殖速度密切相關,適宜接種量不僅可以縮短發酵時間,提高發酵速率,而且對于發酵基質的狀態及營養物質含量存在調控作用[21]。如圖1 所示,隨著接種量的增大,葛根素含量先上升后下降,于6%時達到最大值,為5.75 mg/g。當其他因素固定時,菌種接入比例增大,會使發酵基質中營養物質含量減少。當接種量大于6%時,發酵基質中營養物質匱乏,菌株之間接觸抑制增強,不利于葛根素生成[15]。對數據進行顯著性分析,與其他組相比,當接種量為6%時,葛根素含量變化具有顯著性(P<0.05)。因此,選擇最適接種量為6%。
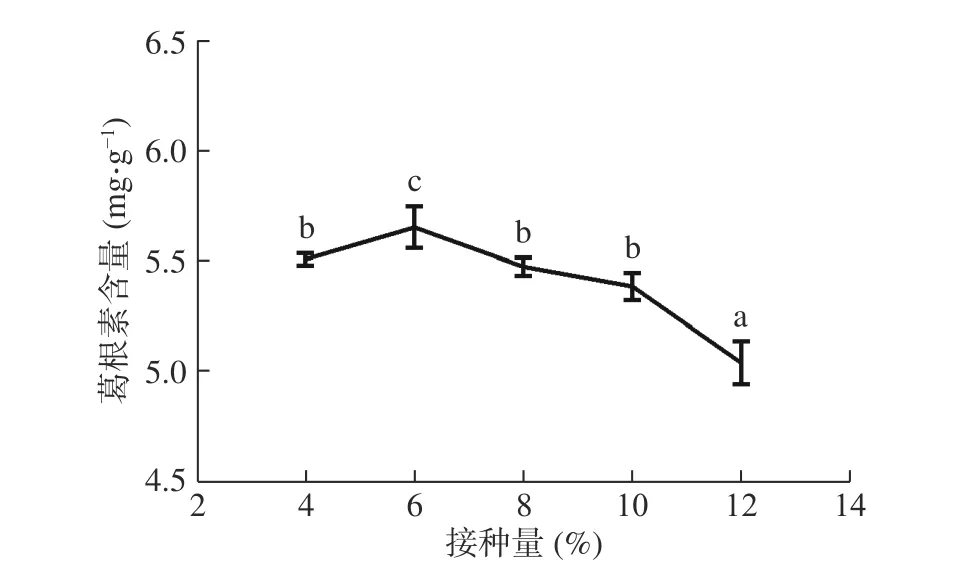
圖1 接種量對葛根素含量的影響Fig.1 Effect of inoculation amount on puerarin content
2.1.2 料液比對葛根素含量的影響 料液比會對發酵底物濃度產生影響,進而影響發酵效率[22]。如圖2 所示,隨著料液比的增大,葛根素的含量先上升后下降,于1:3 g/mL 時達到最大值,為5.38 mg/g。水量增加能促進營養物質溶出,有助于菌種生長繁殖。但水量持續增加會稀釋營養物質,不利于菌種吸收利用,減慢代謝產物積累。對數據進行顯著性分析,與其他組相比,當料液比為1:3 g/mL 時,葛根素含量變化具有顯著性(P<0.05)。因此,選擇最適料液比為1:3 g/mL。

圖2 料液比對葛根素含量的影響Fig.2 Effect of solid-liquid ratio on puerarin content
2.1.3 發酵溫度對葛根素含量的影響 發酵溫度對菌種的活性具有不同程度的影響作用。溫度偏高或偏低均不利于菌種生長[23]。如圖3 所示,隨著溫度的升高,葛根素含量先上升后下降,29 ℃時達到最大值(為5.51 mg/g),與宋艷秋等[24]微生物轉化葛根素的溫度(28 ℃)相接近。對數據進行顯著性分析,與31 ℃、33 ℃發酵條件相比,當發酵溫度為29 ℃時,葛根素含量變化不具有顯著性(P>0.05)。因此,固定發酵粉葛的最適溫度為29 ℃,響應曲面設計中不做考察。
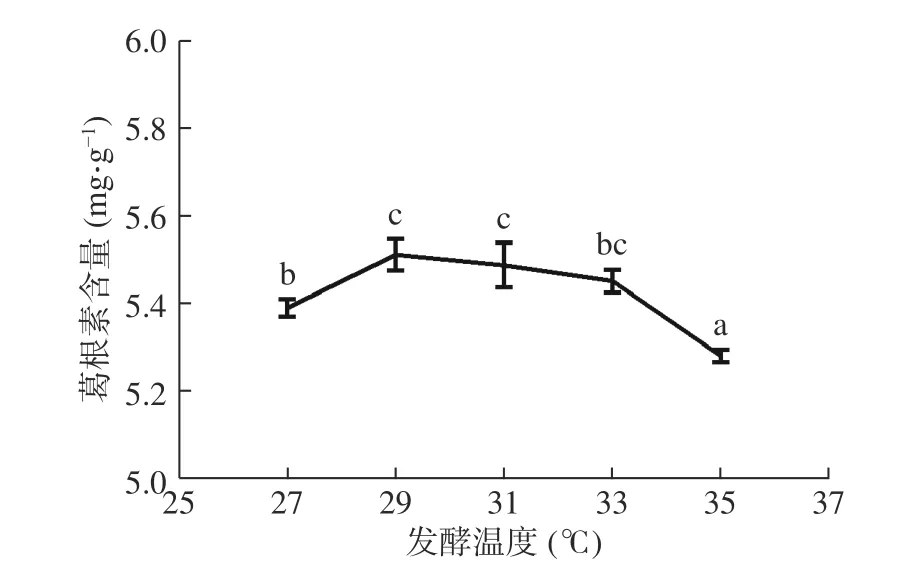
圖3 發酵溫度對葛根素含量的影響Fig.3 Effect of fermentation temperature on puerarin content
2.1.4 發酵時間對葛根素含量的影響 發酵時間對葛根素含量的影響如圖4 所示。在12~36 h 發酵時間內,葛根素含量呈現上升趨勢,且于36 h 時達到最大值,為5.78 mg/g。之后隨發酵時間延長,發酵基質中有限的營養物質可能限制菌種生長和代謝,不利于葛根素生成,使葛根素含量下降。對數據進行顯著性分析,與其他組相比,當發酵時間為36 h 時,葛根素含量變化具有顯著性(P<0.05)。因此,選擇最適發酵時間為36 h,與倪以宇等[25]利用混合乳酸菌發酵葛根-枳椇子藥對的時間相一致。
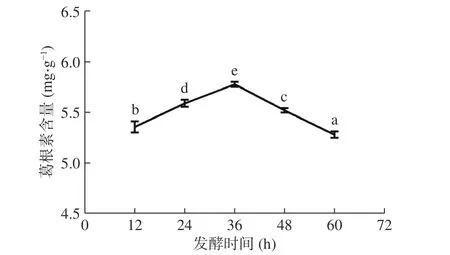
圖4 發酵時間對葛根素含量的影響Fig.4 Effect of fermentation time on puerarin content
2.2 響應面試驗結果
2.2.1 回歸模型及方差分析 通過對響應面試驗結果(表2)進行方差分析及回歸模型預測,得葛根素的含量(y)與接菌量(A)、料液比(B)、發酵時間(C)的二次回歸模型:
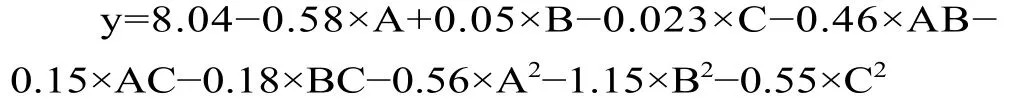
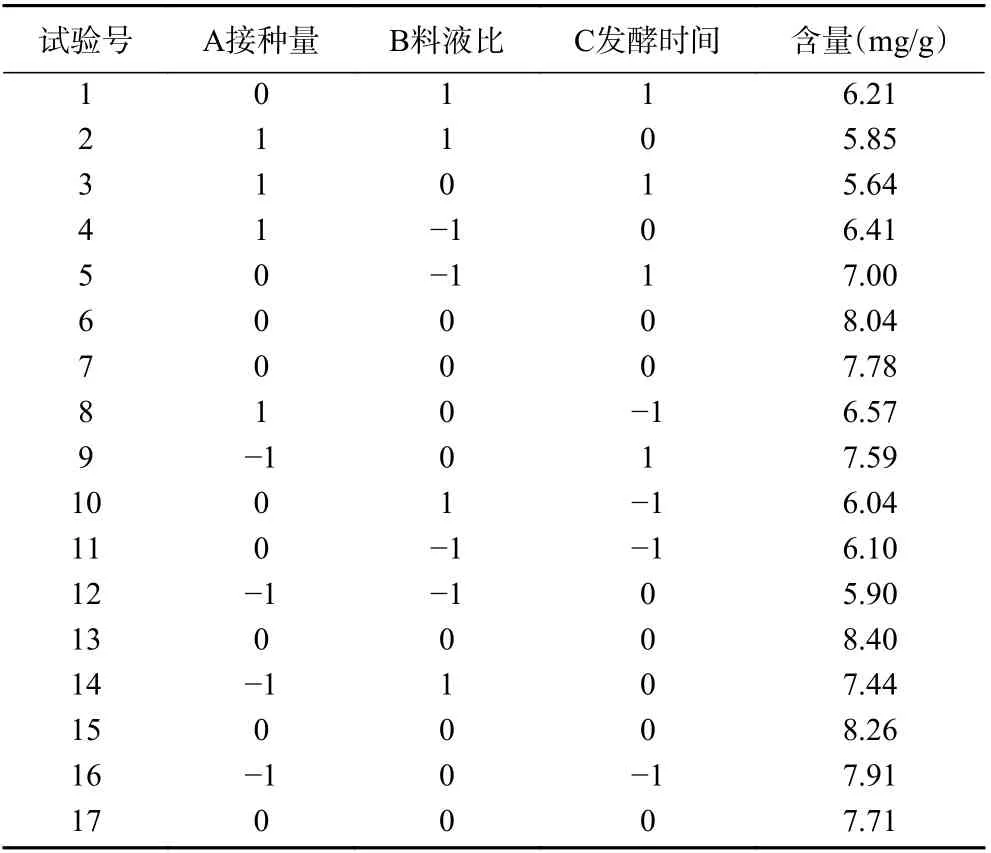
表2 響應面設計及結果Table 2 Response surface design and result
如表3 所示,模型P=0.0250,<0.05,差異顯著,失擬項P=0.0528,>0.05,差異不顯著性,模型相關系數R2=0.8612,均表明模型可靠,與實際情況擬合度良好,可以用來描述各因素與葛根素含量之間的關系。各因素對葛根素含量的影響順序:A>B>C,即接種量>料液比>發酵時間,其中接種量對葛根素含量的影響作用具有顯著性(P<0.05)。
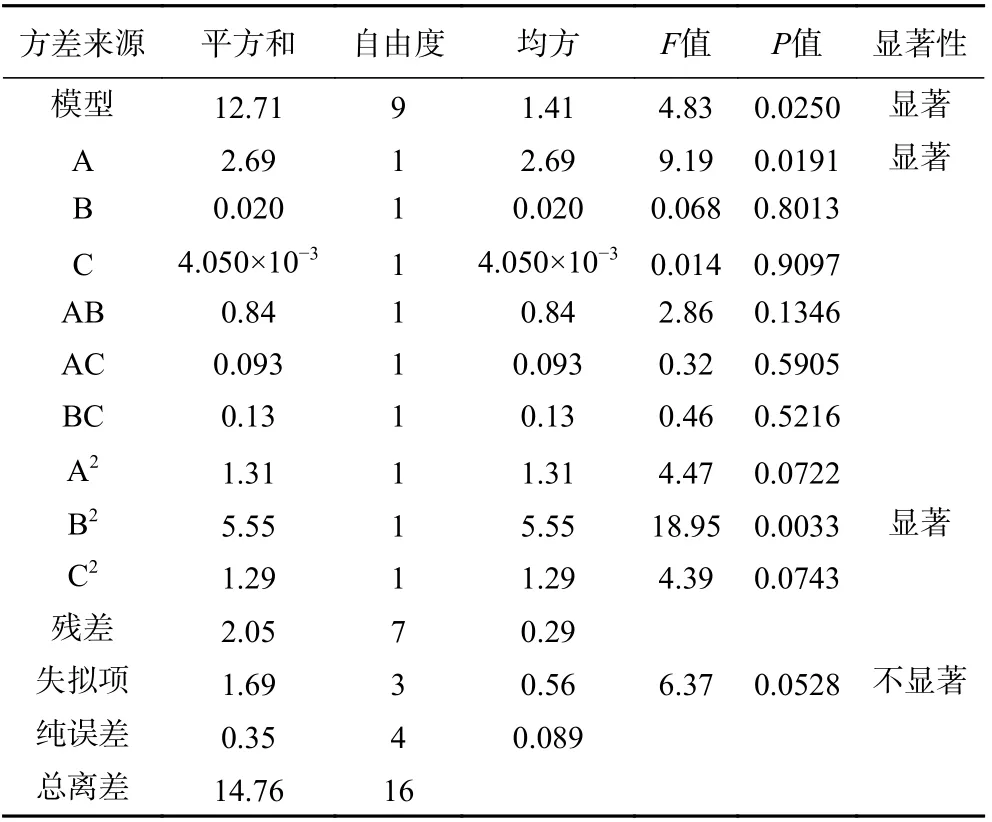
表3 回歸模型方差分析表Table 3 Regression model variance analysis table
2.2.2 響應曲面圖和等高線圖 為進一步確定接種量、料液比、發酵時間對葛根素含量的影響,固定其中任一因素的水平為零,通過回歸方程分析,得另外兩因素交互作用的響應曲面圖及等高線圖[26]。響應曲面坡度越陡,等高線越趨于橢圓形、密度越大,說明兩個因素的交互作用越明顯[20]。如圖5 所示,接種量與料液比、發酵時間與接種量、料液比與發酵時間之間對葛根素含量均存在一定交互作用,且葛根素含量在各因素的水平范圍內均存在最大值。但等高線圖密度均不大,影響不具顯著性(P<0.05)[27]。
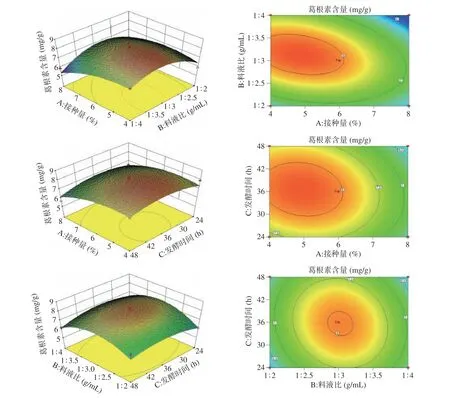
圖5 接種量、料液比、發酵時間對葛根素含量的響應曲面圖及等高線圖Fig.5 Response surface and contour plots of inoculation amount, solid-liquid ratio and fermentation time on puerarin content
2.2.3 優化及驗證 粉葛發酵的最優工藝:接種量4.84%(V/V),料液比1:3.14 g/mL,發酵時間36.44 h,葛根素含量的預測值為8.2092 mg/g。為方便實驗室操作,將發酵條件調整為:接種量5%,料液比1:3 g/mL,發酵時間為36 h。在此條件下進行三次平行驗證試驗,得到葛根素含量為8.1854±0.02 mg/g,與預測值的相對誤差僅為0.29%,表明優化結果穩定可靠,可行性高。如圖6 所示,同等條件下,發酵后粉葛顏色較發酵前深,顆粒感明顯。

圖6 發酵前、后粉葛粉末Fig.6 Puerariae thomsonii powder before and after fermentation
2.3 成品主要指標測定結果
2.3.1 水分、灰分 2020 版《中國藥典》中規定粉葛及其炮制品的水分含量不得超過12.0%,灰分含量不得超過5.0%。如表4 所示,發酵前、后粉葛中水分和灰分的含量均符合規定。

表4 發酵前、后粉葛中水分、灰分測定結果(n=3)Table 4 Determination results of moisture and ash in Pueraria thomsonii before and after fermentation (n=3)
2.3.2 葛根素、大豆苷、大豆苷元 如圖7 色譜圖和表5 所示,與發酵前粉葛相比,發酵后粉葛中大豆苷元、大豆苷、葛根素含量均增加,且分別為發酵前粉葛的1.727 倍、1.726 倍、1.685 倍,差異均具有顯著性(P<0.05)。葛根素的增加倍數與杜靜等[28]利用冠突散囊菌雙向發酵葛根之結果(1.6 倍)接近。其中大豆苷元的含量增加較多,可能是因為大豆苷元屬于異黃酮苷元,在發酵過程中優先生成,異黃酮苷(大豆苷、葛根素)后生成。大豆苷的生成量大于葛根素,可能是因為葡萄糖與苯環上的羥基脫水縮合的作用大于苯環上的氫鍵[29-30]。
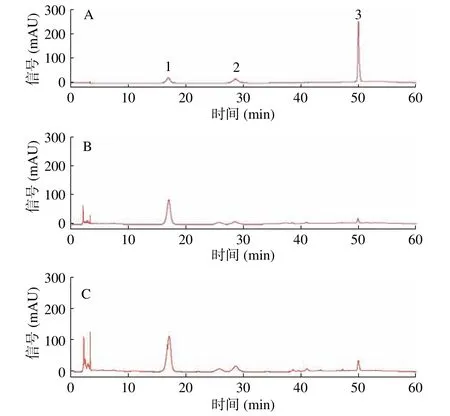
圖7 發酵前、后粉葛中異黃酮類成分HPLC 圖Fig.7 HPLC diagrams of isoflavones in Puerariae thomsonii before and after fermentation
2.3.3 總異黃酮 如表5 所示,與發酵前粉葛相比,發酵后粉葛中總異黃酮含量增至33.26 mg/g,是發酵前粉葛的1.295 倍,差異具有顯著性(P<0.01)。這與倪以宇等[25]利用植物乳桿菌和副干酪乳桿菌混合發酵葛根-枳椇子藥對時異黃酮含量顯著增多之結果相一致。
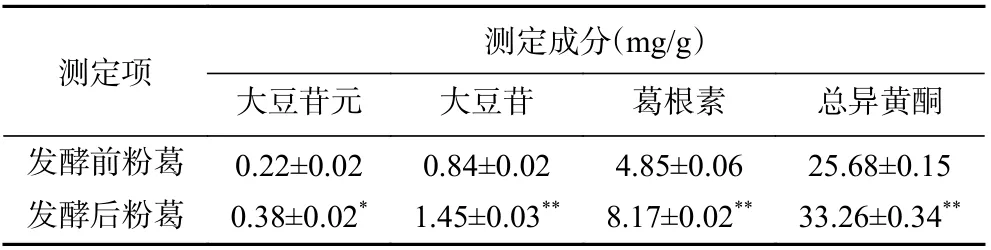
表5 發酵前、后粉葛中異黃酮類成分含量測定結果(n=3)Table 5 Determination results of isoflavone content in Puerariae thomsonii before and after fermentation (n=3)
2.3.4 可溶性多糖 如表6 所示,與發酵前相比,發酵后粉葛中可溶性多糖含量增至12.6%,是發酵前粉葛的5.101 倍,差異具有顯著性(P<0.01),與柴小濤[31]利用食藥性真菌-金耳雙向發酵葛根得葛根多糖含量下降之結果相反。可能是因為乳酸桿菌是一類碳水化合物代謝作用較強的益生菌,在發酵過程中以淀粉為碳源,代謝產生游離葡萄糖或小分子葡萄糖聚合物,增加了可溶性多糖的含量[32-33]。

表6 粉葛發酵前、后可溶性多糖及淀粉含量測定結果(n=3)Table 6 Determination results of soluble polysaccharides and starch contents in Puerariae thomsonii before and after fermentation (n=3)
2.3.5 總淀粉 如圖8 所示,直鏈淀粉的測定波長λ1=600 nm,參照波長λ2=422 nm;支鏈淀粉的測定波長λ3=536 nm,參照波長λ4=700 nm。測得結果如表6 所示,與發酵前相比發酵后粉葛中直鏈淀粉和總淀粉含量均減少,減至6.44%、7.42%,分別減少至0.778 倍、0.896 倍,差異具有顯著性(P<0.01)。發酵前粉葛中支鏈淀粉的含量可能受到高含量直鏈淀粉影響而不利于檢出[34],推測其含量可能未達到團體標準T/GXAS 222-2021 中檢出限(0.1 g/100 g)。發酵后粉葛中支鏈淀粉的含量增至0.98%,可能是直鏈淀粉在嗜酸乳桿菌的作用下轉化為支鏈淀粉,使其含量增加。通過數據分析發現,總淀粉含量與可溶性多糖含量呈現負相關,此結論與岳世彥等[35]和張應等[36]的研究結果相一致。
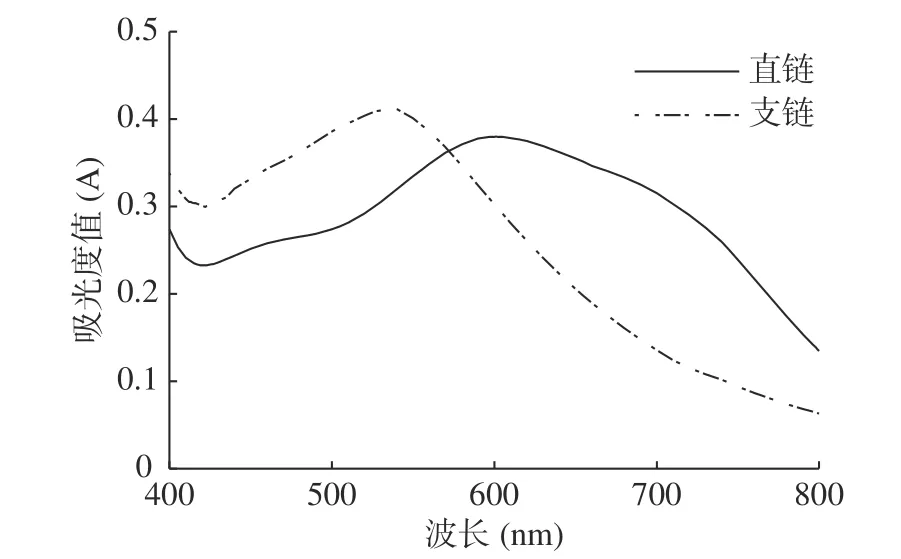
圖8 直鏈、支鏈淀粉紫外吸收光譜圖Fig.8 UV absorption spectra of amylose and amylopectin
3 結論
通過微生物發酵技術可提高粉葛中活性成分含量,發酵最優工藝為:接種量5%,料液比1:3 g/mL,發酵時間36 h,發酵溫度29 ℃。在此發酵條件下所得粉葛中大豆苷元、大豆苷、葛根素、總異黃酮、可溶性多糖、總淀粉含量分別為0.38 mg/g、1.45 mg/g、8.17 mg/g、33.26 mg/g、12.6%、7.42%,是發酵前(0.22 mg/g、0.84 mg/g、4.85 mg/g、25.68 mg/g、2.47%、8.28% )的1.727、1.726、1.685、1.295、5.101、0.896倍。借助微生物發酵技術可不同程度增加粉葛中活性成分含量,這與陳艷艷[15]、宋艷秋等[24]、倪以宇等[25]發酵葛根的結果趨于一致,表明利用微生物發酵粉葛提高活性成分含量具有一定可行性。粉葛中異黃酮等活性成分含量增加,可開拓粉葛相關功能性產品及保健品市場,促進粉葛產業發展。本實驗在粉葛發酵工藝研究過程中,僅選用一種益生菌(嗜酸乳桿菌),并未考慮菌種篩選及菌種間復配對發酵結果的影響,可能沒有最大程度增加粉葛中活性成分含量。因此,實驗后期將對粉葛發酵菌種進行篩選,并進行優勢菌種復配實驗,選擇最優菌種、最佳復配比發酵粉葛,以期更大程度增加粉葛中活性成分含量。

