抑制miR-204表達對宮內發育遲緩新生大鼠學習記憶能力的影響及相關機制
朱棟梁 顏紅霞 岳健軍 劉劍鋒 李增波 宋靜芳
(南華大學衡陽醫學院附屬第二醫院兒科,湖南 衡陽 421001)
宮內發育遲緩(intrauterine growth restriction,IUGR)是指多數孕婦由于孕期營養不良,造成胎兒發育受損,導致新生兒出現極低出生體重,同時影響其認知和神經發育,導致學習記憶能力下降[1]。目前針對IUGR的臨床治療,多以預防為主,無法從本質上改善。海馬組織作為學習和記憶的關鍵部位,有豐富的神經元,其中腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)及其受體酪氨酸激酶B(tyrosine kinase B,TrkB)在海馬組織中含量最高,具有神經營養作用,可影響與學習和記憶能力相關的神經系統[2]。miRNA是一種非編碼RNA分子,在神經疾病的發病機制中發揮重要作用,可參與神經元的增殖和凋亡[3-4]。多項研究表明,在多種因素所致學習記憶功能障礙模型動物海馬組織中miR-204呈現高表達[4-5],然而下調miR-204表達可抑制神經炎癥,改善學習記憶功能[6-7]。Chen等[8]通過miRNA微陣列分析正常新生大鼠和IUGR新生大鼠海馬組織中差異表達的miRNA,結果顯示miR-204在IUGR新生大鼠海馬組織中高表達。然而miR-204高表達是否影響IUGR新生大鼠學習記憶能力目前尚不知曉。為此,本研究通過建立IUGR大鼠模型,探討miR-204對IUGR新生大鼠遠期學習記憶能力的影響,并初步闡明其作用機制,旨在為預防和治療IUGR相關認知功能障礙提供理論基礎。
1 材料與方法
1.1 實驗動物
SPF級SD大鼠90只(雌性30只,雄性60只),10周齡,購自廣州銳格生物科技有限公司,動物生產許可證號:SCXK(粵)2021-0059。在無特定病原體條件下飼養,溫度23~25℃,相對濕度50%~57%,自由采食飲水。適應性飼養3 d。
1.2 實驗試劑及儀器
標準飼料(熱卡量約為1 558 kJ/100 g,蛋白質含量約為16%)和低蛋白飼料(熱卡量約為1 558 kJ/100 g,蛋白質含量約為8%)購自北京華阜康生物科技股份有限公司;miR-204拮抗劑(miR-204 antagomir)及拮 抗 劑對 照(antagomir-NC)、miR-204 mimic及mimic NC均購自廣州銳博生物科技有限公司;BDNF抗體、TrkB抗體、磷酸化TrkB(p-TrkB、Tyr706/707)抗體、cAMP反應元件結合蛋白(cAMP response element binding protein,CREB)抗體、磷酸化CREB(p-CREB,Ser133)抗體和GAPDH抗體購自美國CST公司;SYBR FAST qPCR Master Mix、SYBR Green PCR試劑盒購自美國KAPA Biosystems公司;PrimeScriptⅡRTase、逆轉錄試劑盒購自日本TAKARA公司;Luciferase熒光素酶報告檢測試劑盒購自美國Biovision公司;電泳儀(型號:164-5056)美國BIO-RAD公司;PCR儀(型號:7500)購自美國ABI公司;正置顯微鏡(型號:CX23)購自日本Olympus公司;Morris水迷宮裝置(型號:63034)購自深圳瑞沃德生命科技有限公司;全功能酶標儀(型號:Synergy H4)購自美國BioTek公司。
1.3 實驗方法
1.3.1 IUGR模型構建90只SD大鼠按照雌雄比1∶2于18時進行合籠,次日9時檢查雌鼠陰栓,共計受孕25只,記為妊娠第0天。25只孕鼠單只單籠飼養,采用隨機數字表法分為正常飲食組(n=10)和低蛋白飲食組(n=15):正常飲食組孕鼠孕期全程給予標準飼料;低蛋白飲食組孕鼠孕期全程給予低蛋白飼料。幼鼠出生12 h后稱重,低蛋白飲食組幼鼠體重低于正常飲食組幼鼠2個標準差,表示IUGR建模成功[9]。幼鼠均由母鼠母乳喂養,低蛋白飲食組母鼠繼續給予低蛋白飼料,正常飲食組母鼠繼續給予標準飼料。
1.3.2 動物分組及干預實驗一:取25只正常幼鼠設為正常組,25只IUGR幼鼠設為IUGR組,分別于出生后第0、7、14、21、28天[9]各取5只幼鼠進行稱重并頸椎脫臼法處死,取海馬組織凍存,采用qRT-PCR檢測各時間點幼鼠海馬組織中miR-204表達水平。實驗二:取10只正常幼鼠設為對照組,30只IUGR幼鼠分別設為模型組、miRNA拮抗劑對照組(antagomir-NC組)和miR-204拮抗劑組(antagomir組),每組10只。于出生后第3天,antagomir-NC組幼鼠腹腔注射antagomir-NC,antagomir組幼鼠腹腔注射miR-204 antagomir,5 nmol/次,對照組和模型組幼鼠注射0.9%氯化鈉溶液,每隔3 d注射1次,共7次。
1.3.3 Morris水迷宮實驗實驗二各組每只大鼠于30日齡時進行Morris水迷宮實驗,該實驗包括定位航行實驗和空間探索實驗。定位航行實驗:實驗前,站臺放置于第四象限,將大鼠置于站臺上適應10 s,隨后大鼠從不同象限面朝池壁入水,記錄大鼠120 s內登上站臺的時間(逃避潛伏期),若大鼠在120 s內未找到站臺,實驗者將其引上站臺適應10 s,記錄逃避潛伏期為120 s。按照上述進行操作,每天4次,每次間隔1 h,訓練4 d。空間探索實驗:定位航行實驗結束24 h后,撤除站臺,將大鼠面朝池壁放入第一象限相同入水點,記錄120 s內跨越原站臺的次數。
1.3.4 qRT-PCR實驗實驗二各組每只大鼠于36日齡時取右側海馬組織凍存。實驗一各時間點各組取5個樣本及實驗二各組取10個樣本,按照TRIzol試劑說明書提取總RNA,分光光度計測定總RNA濃度及純度。將總RNA逆轉錄成cDNA,取1 μL cDNA進行PCR擴增。PCR反應程序:預變性95℃3 min,95℃5 s,56℃10 s,72℃25 s,共39個循環;65℃5 s;95℃50 s。miR-204以U6作為內參基因,BDNF以GAPDH作為內參基因,通過2-ΔΔCt方法計算實驗一中各時間點miR-204和實驗二中miR-204、BDNF mRNA的相對表達量[10]。引物序列見表1。
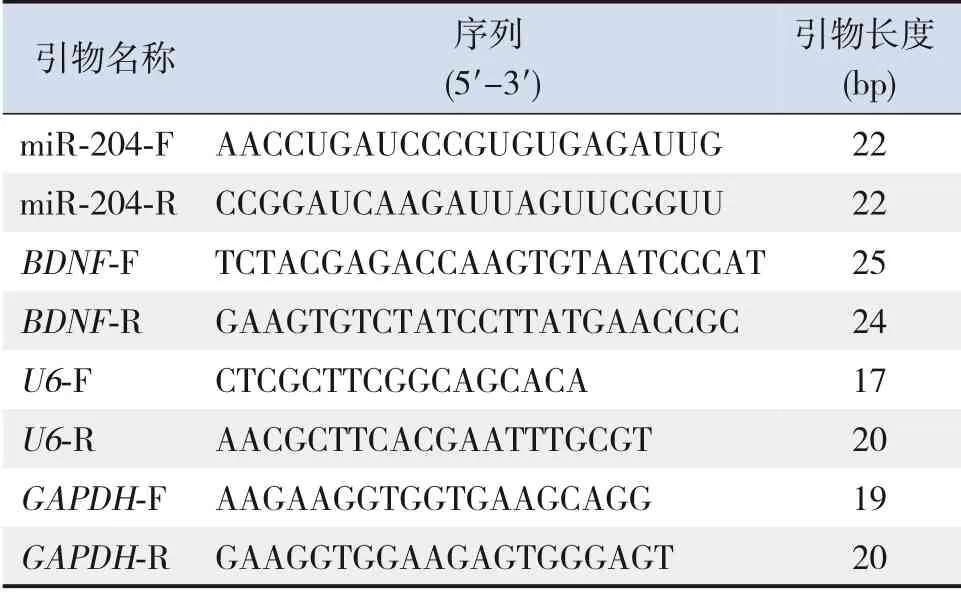
表1 引物設計
1.3.5 尼氏染色將實驗二各組每只大鼠于36日齡時取左側海馬組織采用4%多聚甲醛固定,將固定24 h的海馬組織取出常規脫蠟至水,行冠狀切面,制備石蠟切片(厚度4 μm)。然后石蠟切片置于60℃溫箱中使用1%甲苯胺藍染色40 min,蒸餾水沖洗后,分別置于由低到高(70%、80%、95%和100%)的乙醇中脫水,二甲苯再次透明,最后中性樹膠封片。在顯微鏡下觀察海馬CA1區病理變化,并隨機選取3個視野統計尼氏小體數量,取其平均值[11]。
1.3.6 Tunel檢測海馬組織細胞凋亡水平將已脫蠟水化后的石蠟切片用蛋白酶K工作液于37℃中孵育15 min。然后加入50 μL Tunel反應混合液,在濕盒、暗室中加蓋37℃孵育60 min。用PBS沖洗3次。加入50 μL轉化POD,在濕盒中37℃孵育30 min。用PBS沖洗3次。加入100 μL DAB底物于室溫孵育10 min。用PBS沖洗3次。蘇木精復染,脫水,透明。封片后在顯微鏡下觀察海馬CA1區細胞凋亡水平,隨機選取3個視野計數陽性細胞數(棕色),計算細胞凋亡率=凋亡細胞數/總細胞數[12]。
1.3.7 Western blot檢測相關蛋白表達取30 μg蛋白與上樣緩沖液混合,沸水浴10 min使蛋白變性后離心取上清上樣,SDS凝膠電泳2 h分離蛋白,濕轉PVDF膜,5%脫脂奶粉室溫封閉2 h,依次加入BDNF(1∶1 000)、TrkB(1∶1 000)、p-TrkB(1∶1 000)、CREB(1∶1 000)、p-CREB(1∶1 000)及內參GAPDH(1∶1 000)抗體,室溫孵育1 h。PBST清洗3次,加入按照1∶10 000稀釋的HRP標記的二抗室溫孵育1 h,PBST清洗3次,進行ECL化學發光檢測。以GAPDH作為內參進行條帶分析,計算目的蛋白BDNF、TrkB、p-TrkB、CREB及p-CREB相對表達量[13]。
1.3.8 雙熒光素酶報告基因實驗使用TargetScanHuman7.2在 線 數 據 庫(http://www.targetscan.org/vert_72/)預 測miR-204和BDNF的 靶向結合位點。設計BDNF-3'-UTR野生型(BDNFWT)及BDNF-3'-UTR突變型(BDNF-MUT)片段序列,通過PCR擴增、回收、酶切和純化后構建熒光素酶報告載體。采用Lipofectamine 3000試劑分別 將miR-204 mimic和mimic NC與BDNF-WT或BDNF-MUT共同轉染至293T細胞中。轉染48 h后,按照熒光素酶報告檢測試劑盒說明書進行操作,并使用酶標儀進行測定螢火蟲和海腎熒光素酶活性,相對熒光素酶活性=螢火蟲熒光素酶活性/海腎熒光素酶活性。
1.4 統計學分析
應用SPSS 20.0軟件對數據進行統計學分析,計量資料以均值±標準差(±s)表示,兩組間比較采用兩樣本t檢驗,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 IUGR幼鼠體重和miR-204水平變化
與正常組比較,IUGR組出生后第0、7、14、21、28天幼鼠體重降低(表2),而海馬組織中miR-204表達水平升高(表3),差異均有統計學意義(P<0.001)。體重是臨床評估IUGR的診斷標準,體重結果表明本研究已成功構建IUGR大鼠模型。IUGR幼鼠海馬組織中miR-204含量呈時間依賴性,即隨著時間的增長miR-204含量升高(F=43.444,P<0.001),而正常幼鼠miR-204含量無變化(F=0.252,P=0.905),提示miR-204可能參與IUGR病程。
表2 兩組幼鼠不同時間點體重比較(±s,g;n=25)
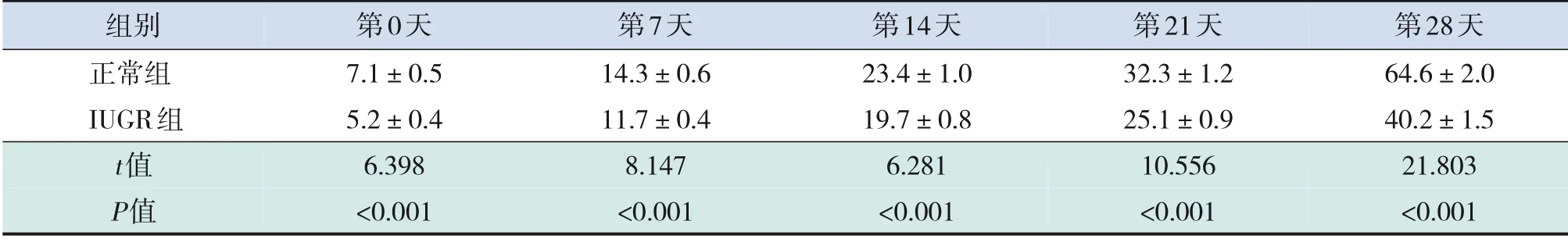
表2 兩組幼鼠不同時間點體重比較(±s,g;n=25)
注:[IUGR]宮內發育遲緩。
組別正常組IUGR組t值P值第0天7.1±0.5 5.2±0.4 6.398<0.001第7天14.3±0.6 11.7±0.4 8.147<0.001第14天23.4±1.0 19.7±0.8 6.281<0.001第21天32.3±1.2 25.1±0.9 10.556<0.001第28天64.6±2.0 40.2±1.5 21.803<0.001
表3 兩組幼鼠不同時間點海馬組織中miR-204 mRNA相對表達比較(±s,n=25)
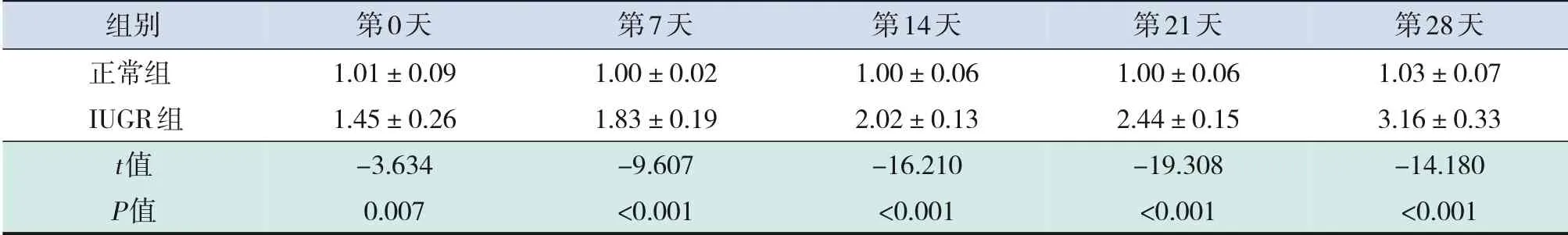
表3 兩組幼鼠不同時間點海馬組織中miR-204 mRNA相對表達比較(±s,n=25)
注:[IUGR]宮內發育遲緩。
組別正常組IUGR組t值P值第0天1.01±0.09 1.45±0.26-3.634 0.007第7天1.00±0.02 1.83±0.19-9.607<0.001第14天1.00±0.06 2.02±0.13-16.210<0.001第21天1.00±0.06 2.44±0.15-19.308<0.001第28天1.03±0.07 3.16±0.33-14.180<0.001
2.2 各組大鼠學習與記憶能力比較
與對照組比較,模型組大鼠逃避潛伏期增加,跨臺次數減少,差異均有統計學意義(P<0.001);與模型組比較,antagomir組大鼠逃避潛伏期減少,跨臺次數增加,差異均有統計學意義(P<0.001),而antagomir-NC組逃避潛伏期、跨臺次數與模型組比較差異無統計學意義(P>0.05)。提示IUGR會引起學習與記憶能力障礙;抑制miR-204表達后,學習與記憶能力得到改善。見表4。
表4 各組大鼠水迷宮實驗數據比較(±s,n=10)

表4 各組大鼠水迷宮實驗數據比較(±s,n=10)
注:a與對照組相比,P<0.001;b與模型組相比,P<0.001。
組別對照組模型組antagomir-NC組antagomir組F值P值逃避潛伏期(s)14.0±1.6 28.0±2.0a 28.0±1.9 20.0±1.9b 68.642<0.001跨臺次數(次)8.0±0.7 5.4±0.5a 5.8±0.4 7.2±0.4b 24.444<0.001
2.3 各組大鼠海馬組織中miR-204和BDNF mRNA表達水平比較
與對照組比較,模型組miR-204表達水平升高,BDNF mRNA表達水平降低,差異均有統計學意義(P<0.001);與模型組比較,antagomir組miR-204表達水平降低,BDNF mRNA表達水平升高,差異均有統計學意義(P<0.001),而antagomir-NC組與模型組比較差異無統計學意義(P>0.05)。提示IUGR會引起海馬組織中miR-204高表達,BDNF低表達;抑制miR-204表達后,海馬組織中BDNF表達升高,推測miR-204可能調控BDNF。見表5。
表5 各組大鼠海馬組織中miR-204和BDNF mRNA表達水平比較(±s,n=10)
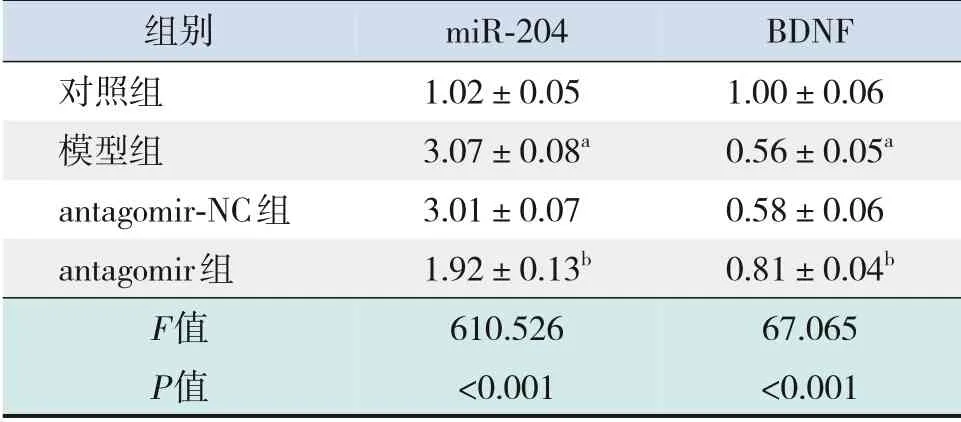
表5 各組大鼠海馬組織中miR-204和BDNF mRNA表達水平比較(±s,n=10)
注:a與對照組相比,P<0.001;b與模型組相比,P<0.001。[BDNF]腦源性神經營養因子。
組別對照組模型組antagomir-NC組antagomir組F值P值miR-204 1.02±0.05 3.07±0.08a 3.01±0.07 1.92±0.13b 610.526<0.001 BDNF 1.00±0.06 0.56±0.05a 0.58±0.06 0.81±0.04b 67.065<0.001
2.4 各組大鼠海馬神經元損傷情況
如圖1所示,對照組大鼠海馬CA1區細胞排列整齊,胞漿均勻且有大量淡藍色尼氏小體。模型組和antagomir-NC組海馬CA1區細胞排列紊亂,部分錐體細胞胞核固縮,呈三角形,胞漿染色變淺且尼氏小體大量減少。antagomir組海馬CA1區細胞排列較整齊,錐體細胞胞核固縮現象明顯減少,尼氏小體數量有所恢復。選取36日齡大鼠,每組10只,對照組、模型組、antagomir-NC組和antagomir組海馬CA1區尼氏小體數量分別為(60.1±2.9)個、(30.3±3.6)個、(31.0±3.6)個和(49.4±3.2)個。與對照組比較,模型組海馬CA1區尼氏小體數量減少,差異有統計學意義(t=13.170,P<0.001);與模型組比較,antagomir組海馬CA1區尼氏小體數量增加,差異有統計學意義(t=8.434,P<0.001),而antagomir-NC組尼氏小體數量無變化,差異無統計學意義(t=1.185,P>0.05)。提示IUGR可引起海馬神經元損傷;抑制miR-204表達后,海馬神經元受損現象得到改善。
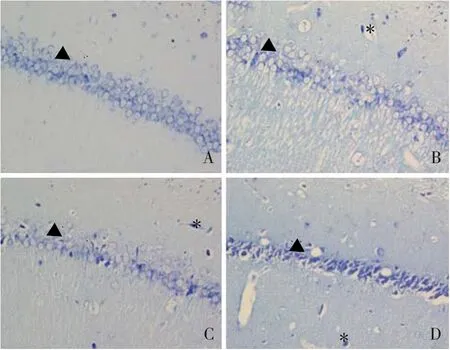
圖1 海馬組織CA1區病理變化(尼氏染色,×400)A:對照組;B:模型組;C:antagomir-NC組;D:antagomir組。注:▲表示尼氏小體,*表示變形錐體細胞。
2.5 各組大鼠海馬組織細胞凋亡水平比較
對照組、模型組、antagomir-NC組和antagomir組海馬CA1區細胞凋亡率分別為(4.7±0.9)%、(64.4±2.4)%、(62.8±2.6)%和(26.3±1.5)%。與對照組比較,模型組海馬CA1區細胞凋亡率升高,差異有統計學意義(t=48.524,P<0.001);與模型組比較,antagomir組海馬CA1區細胞凋亡率降低,差異有統計學意義(t=30.982,P<0.001),而antagomir-NC組細胞凋亡率無變化,差異無統計學意義(t=1.350,P>0.05)。見圖2。
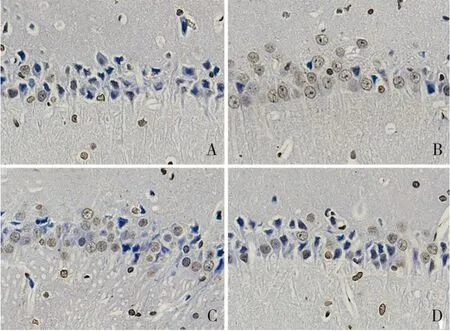
圖2 海馬組織CA1區細胞凋亡變化(Tunel染色,×400) A:對照組;B:模型組;C:antagomir-NC組;D:antagomir組。
2.6 各組大鼠海馬組織BDNF/TrkB信號通路活化情況
與對照組比較,模型組大鼠海馬中BDNF、p-TrkB和p-CREB蛋白水平降低,差異有統計學意義(t=9.861、3.976、9.295,P<0.001)。模 型組TrkB和CREB蛋白水平與對照組比較,差異無統計學意義(t=1.102、0.556,P>0.05)。與模型組比較,antagomir組大鼠海馬中BDNF、p-TrkB和p-CREB蛋白水平升高,差異有統計學意義(t=19.152、9.286、13.553,P<0.001);而antagomir組TrkB和CREB蛋白水平與模型組比較,差異無統計學意義(t=1.837、1.892,P>0.05),而antagomir-NC組以上所有指標蛋白水平與模型組比較,差異無統 計 學 意 義(t=0.489、0.262、0.667、0.835、0.060,P>0.05)。提示IUGR可引起大鼠海馬組織BDNF/TrkB信號通路的失活;抑制miR-204表達后,海馬組織BDNF/TrkB信號通路被激活。見表6和圖3。
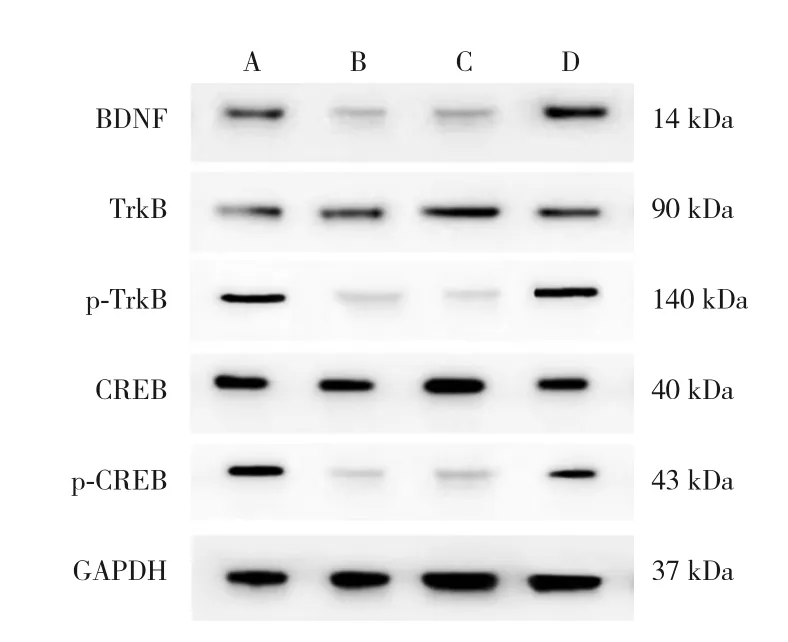
圖3 各組大鼠海馬組織BDNF/TrkB信號通路相關蛋白表達水平 A:對照組;B:模型組;C:antagomir-NC組;D:antagomir組。
表6 各組大鼠海馬組織中BDNF/TrkB信號通路相關蛋白表達水平比較(±s,n=10)
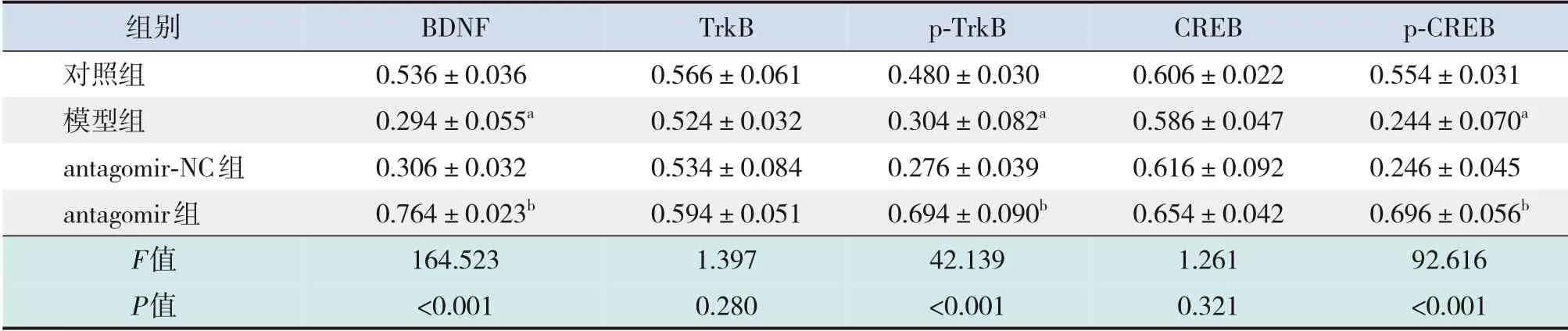
表6 各組大鼠海馬組織中BDNF/TrkB信號通路相關蛋白表達水平比較(±s,n=10)
注:a與對照組相比,P<0.001;b與模型組相比,P<0.001。[BDNF]腦源性神經營養因子;[TrkB]酪氨酸激酶B;[p-TrkB]磷酸化酪氨酸激酶B;[CREB]cAMP反應元件結合蛋白;[p-CREB]磷酸化cAMP反應元件結合蛋白。
組別對照組模型組antagomir-NC組antagomir組F值P值BDNF 0.536±0.036 0.294±0.055a 0.306±0.032 0.764±0.023b 164.523<0.001 TrkB 0.566±0.061 0.524±0.032 0.534±0.084 0.594±0.051 1.397 0.280 p-TrkB 0.480±0.030 0.304±0.082a 0.276±0.039 0.694±0.090b 42.139<0.001 CREB 0.606±0.022 0.586±0.047 0.616±0.092 0.654±0.042 1.261 0.321 p-CREB 0.554±0.031 0.244±0.070a 0.246±0.045 0.696±0.056b 92.616<0.001
2.7 miR-204與BDNF的靶向作用關系
如圖4所示,通過TargetScan在線數據庫顯示,miR-204與BDNF-3'-UTR之間存在潛在的互補序列,miR-204基因序列中UUCCCUU堿基與BDNF基因序列中AAGGGAA堿基配對,形成沉默復合體,阻止BDNF基因轉錄翻譯,減低BDNF蛋白表達水平。提示miR-204可靶向調控BDNF。雙熒光素酶報告基因實驗結果顯示,在轉染BDNF-WT質粒的細胞中,與共轉染mimic NC比較,共轉染miR-204 mimic可降低細胞熒光素酶活性,差異有統計學意義(1.00±0.05 vs 0.47±0.04,t=18.009,P<0.001);在轉染BDNF-MUT質粒的細胞中,與共轉染mimic NC比較,共轉染miR-204 mimic不能降低細胞熒光素酶活性,差異無統計學意義(1.01±0.07 vs 0.98±0.06,t=0.343,P>0.05)。
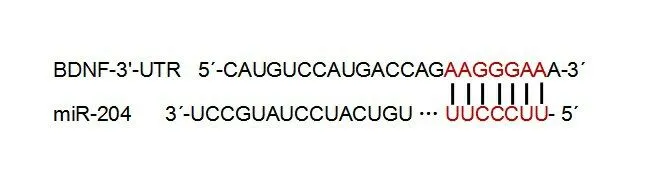
圖4 BDNF-3'-UTR預測的miR-204結合位點
3 討論
IUGR可引起胎兒發育不勻稱和神經系統發育障礙,導致學習和記憶能力下降。海馬組織主要負責學習和記憶,而IUGR中缺血和營養不良等因素會引起海馬組織尼氏小體銳減,尼氏小體作為神經元功能狀態的標志,出現數量減少時,會引起神經元受損,損傷海馬組織,導致學習和記憶能力衰退[14-15]。本研究采用低蛋白飲食法建立IUGR大鼠模型,結果顯示IUGR幼鼠體重顯著低于正常幼鼠,并表現出明顯的學習和記憶能力障礙,與Chen等[16]研究結果一致,提示IUGR大鼠模型構建成功。本研究還發現,隨著飼養時間的延長,IUGR幼鼠海馬組織中miR-204含量逐漸升高,而正常組幼鼠海馬組織中miR-204含量無變化,提示miR-204可能參與IUGR。
在IUGR研究中,miRNAs一直保持敏感性水平。miR-204作為miRNAs中的一員,已證實其參與神經系統的調控,但暫無與IUGR相關的研究。Hung等[17]研究發現miR-204-5p下調可導致BDNF/TrkB過表達和AKT/mTOR/Rac1信號通路激活,使海馬中的激素和神經元得到調節,緩解精神壓力。Zhang等[18]研 究 表 明,抑 制miR-204通過阻斷BRUCE與STX17的相互作用來預防阿爾茨海默病中海馬神經軸突營養不良,治療記憶障礙。本研究結果顯示,IUGR大鼠海馬組織中miR-204含量升高,尼氏小體數量降低,細胞凋亡率升高,且出現明顯的學習和記憶能力障礙;miR-204拮抗劑干預后,IUGR大鼠海馬組織中miR-204表達被抑制,海馬神經元及學習和記憶能力有所改善。提示miR-204可能改善IUGR大鼠學習和記憶能力。本研究還發現,IUGR大鼠海馬組織出現BDNF表達降低,而抑制miR-204表達后,BDNF表達上升,說明miR-204可能調控BDNF。
BDNF/TrkB信號通路可增強IUGR患兒神經元突觸聯系和可塑性,影響學習記憶功能[19]。研究[20]顯示,BDNF被激活后,在軸突末端與TrkB受體結合,促使TrkB受體內酪氨酸殘基自身磷酸化,使p-TrkB水平升高,進而促使ras-MAPK通路活化,激活CREB,并使CREB磷酸化,p-CREB水平增加(圖5)。甘世明等[21]研究顯示,激活BDNF/TrkB信號通路可使前體細胞和樹突進行分化和連接,從而保護神經。Ge等[22]研究顯示,miR-204和BDNF/TrkB信號通路可能參與胚胎期及成年期氟鋁暴露引起的子代大鼠空間學習記憶障礙,而抑制miR-204表達可激活BDNF/TrkB通路從而改善空間學習記憶障礙。本研究結果顯示,IUGR大鼠海馬組織中miR-204高表達,BDNF、p-TrkB及p-CREB水平降低,BDNF/TrkB信號通路活化被抑制,而抑制miR-204表達后,海馬組織中BDNF、p-TrkB及p-CREB水平升高;p-TrkB和p-CREB都是TrkB和CREB的活化形式,各組大鼠海馬組織內TrkB和CREB表達均無明顯變化。為了進一步探討miR-204與BDNF的關系,本研究進行雙熒光素酶報告基因檢測結果顯示miR-204是BDNF負調控分子。提示抑制miR-204表達可引起BDNF的高表達,從而激活BDNF/TrkB信號通路,保護海馬神經元,改善IUGR大鼠學習及記憶能力。但本研究未設置miR-204表達促進組,因此無法完全確定機制,只能提出miR-204的作用機制可能是與靶向調控靶向BDNF/TrkB信號通路有關。
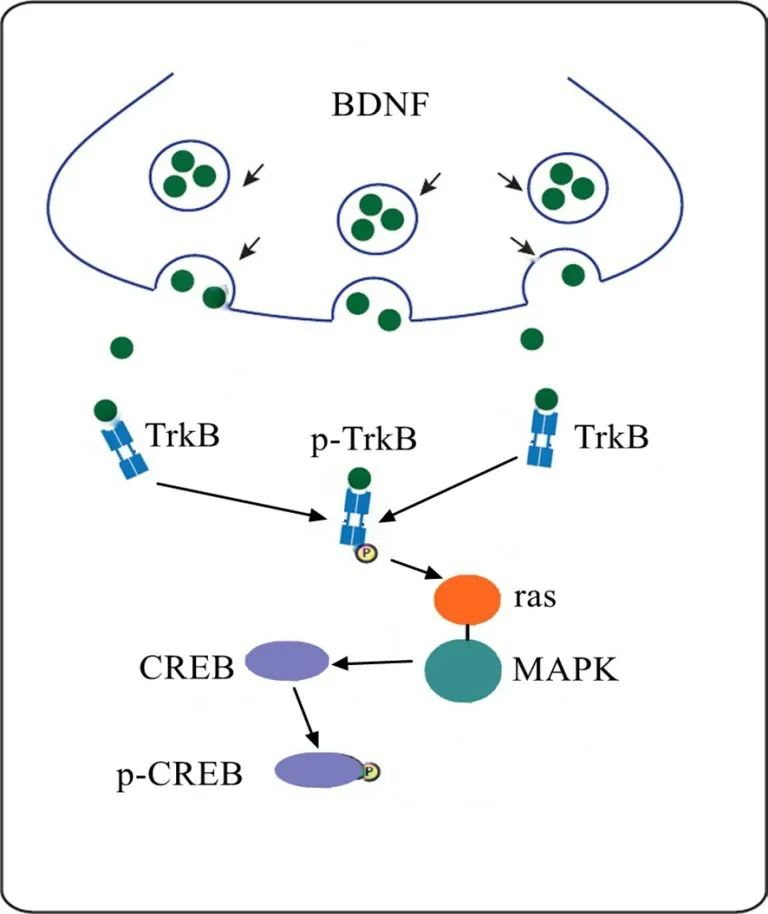
圖5 BDNF/TrkB信號通路活化機制圖
綜上所述,抑制miR-204可改善IUGR新生大鼠學習及記憶功能,其作用機制可能與靶向激活BDNF/TrkB信號通路有關,本研究為miR-204可能作為IUGR的潛在標志物或者治療靶點提供了一個強有力的依據。

