牛冠狀病毒N蛋白抗體庫構建與單鏈抗體篩選
肖麗榮,李 彬,王家偉,成 杰,別鵬飛,史秋梅
(1. 河北科技師范學院 河北省預防獸醫學重點實驗室,河北 秦皇島 066604;2.秦皇島市撫寧區農業農村局留守營動物防疫監督站,河北 撫寧 066301 ; 3. 中國農業大學動物醫學院,北京 海淀 100193)
牛冠狀病毒病是世界范圍內的重要牛病,其病原牛冠狀病毒(Bovine coronavirus,BCoV)是引起新生犢牛腹瀉和成年牛冬痢、呼吸道疾病最主要的病原體之一,臨床上主要表現為新生犢牛腹瀉、拉血樣糞便、成年牛冬季嚴重水樣腹瀉(有時伴有血和黏液)等特征,給我國乃至全世界養牛業帶來了巨大的經濟損失[1]。BCoV是一種有囊膜的單股正鏈RNA病毒,其基因組主要編碼5種蛋白,其中N蛋白是BCoV的核衣殼蛋白,具有高度的保守性,常被用于病毒的檢測和鑒定[2-3]。目前,臨床上BCoV疑似病例確診方法主要通過病毒分離鑒定、反轉錄PCR和ELISA抗體檢測技術,且需要在專業實驗室內操作完成,現場應用極為不便。
噬菌體展示抗體庫技術是將外源基因通過基因工程方法插入噬菌體基因組中,外源肽隨噬菌體蛋白的表達而呈現在噬菌體表面。該技術自首次闡述以來已經發展成為抗體獲取的強大工具,用于開發新型藥物、疫苗和診斷試劑等。將抗體庫基因通過隨機組合拼接后,插入噬菌體外殼蛋白基因中,并融合表達在噬菌體的表面來特異性淘選獲得特異性單鏈抗體,不僅可以省去繁瑣復雜的雜交瘤細胞制備過程,直接從被免疫的動物中獲取基因抗體,節約時間且特異性強,而且能夠進行大規模生產[4-5]。
本試驗以重組的BCoV N蛋白為抗原,利用噬菌體展示技術構建BCoV N蛋白鼠源噬菌體抗體庫,篩選到具有結合活性的特異性單鏈抗體,以期用于BCoV新型快速檢測方法的研制。
1 材料與方法
1.1 主要材料 噬菌粒載體Phagemid、輔助噬菌體M13K07、Pfu DNA聚合酶、反轉錄試劑盒、PCR Mix、DNA Marker、EcoR I和XbaI限制性內切酶,均購自TaKaRa公司。BALB/c小鼠,購自北京維通利華實驗動物有限公司,生產許可證號:SCXK(京)2021—0006。電穿孔儀GenePulser Xcell,購自美國Bio-Rad公司。
1.2 方法
1.2.1 重組N蛋白的表達與純化 將已構建成功的pET28a-N重組質粒轉化至大腸桿菌BL21中,37 ℃、200 r/min培養菌液至對數期,加入終濃度為1 mmol/L的IPTG,37 ℃誘導表達8 h。取誘導后的菌液超聲破碎離心,分別取上清和沉淀經SDS-PAGE鑒定目的蛋白的表達情況。將可溶性表達的N重組蛋白經鎳柱親和層析純化,獲得的目的蛋白進行SDS-PAGE鑒定并測定濃度,用于小鼠免疫和后期抗體篩選。
1.2.2 小鼠免疫及小鼠脾細胞總RNA提取 將重組的N蛋白免疫BALB/c小鼠,首次免疫使用完全佐劑與抗原(100 μg/只)混合乳化,之后2次使用不完全佐劑與抗原(50 μg/只)混合乳化,頸背部皮下多點注射。首免與二免間隔18 d,二免與三免間隔15 d,免疫3次后第7天小鼠眼球取血,分離血清,摘取脾臟,分離脾臟淋巴細胞并從中提取總RNA,使用微量紫外可見分光光度計測定RNA質量濃度,并用10 g/L瓊脂糖凝膠電泳鑒定其完整性。
1.2.3 抗體可變區基因重鏈可變區(VH)、輕鏈可變區(VL)的擴增及單鏈抗體(scFv)拼接 以小鼠總RNA為模板,按照試劑盒說明書反轉錄cDNA,-80 ℃凍存備用。按照參考文獻[6]設計鼠源抗體VH和VL基因特異性上下游通用引物,并送武漢金開瑞生物工程有限公司合成。取凍存的cDNA為模板,分別擴增抗體VH、VL基因,純化回收的VH、VL片段以1∶1混合,通過PCR拼接成scFv基因。PCR程序:95 ℃ 5 min;95 ℃ 30 s,70 ℃ 30 s,72 ℃ 1 min,共30個循環;72 ℃ 7 min。將拼接的scFv基因按1∶100稀釋作為模板,經PCR擴增目的片段scFv。PCR程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共30個循環;72 ℃ 7 min。PCR產物用10 g/L瓊脂糖凝膠電泳鑒定并純化回收目的片段。
1.2.4 N蛋白噬菌體單鏈抗體庫的構建 按照質粒提取試劑盒說明書提取載體,將載體用XbaI和EcoR I限制性內切酶進行酶切,酶切產物用試劑盒純化回收,將純化的scFv和酶切載體連接,構建scFv重組噬菌粒載體。然后將連接產物電轉進入感受態細胞[7],37 ℃作用1 h后取20 μL培養物10倍倍比稀釋,分別取10 μL滴涂在LB/Carb抗性平板37 ℃孵育過夜,計算庫容;剩余菌液則全部轉至2L 2YT/Carb/Kan培養基中,37 ℃擴大培養。然后將菌體離心充分沉淀,在上清中加入PEG8000/NaCl,12 000 g離心20 min使噬菌體顆粒沉淀,用PBT重懸沉淀并將噬菌體濃度調整至1×1013PFU/mL(OD268 nm=2);按1 mL/管分裝到1.5 mL離心管里,可直接用于噬菌體單鏈抗體庫的淘選,剩余部分凍存于-80 ℃待用。
1.2.5 N蛋白噬菌體單鏈抗體庫的鑒定 在LB/Carb平板上隨機挑取15個單克隆于LB/Carb液體培養基中,37 ℃、200 r/min培養3 h后,進行菌液PCR鑒定并計算陽性率。
1.2.6 N蛋白噬菌體單鏈抗體庫的富集淘選及特異性單鏈抗體篩選
1.2.6.1 N蛋白噬菌體單鏈抗體庫的富集淘選 以BCoV N蛋白為包被抗原,包被濃度為5 μg/mL,抗原蛋白包被孔和陰性對照孔各4個,每孔100 μL,陰性對照孔只加包被液,4 ℃過夜;加入200 μL封閉液,37 ℃封閉2 h;然后往4個陰性對照孔中各加入100 μL的噬菌體抗體庫,室溫下振蕩孵育1 h;將4個陰性對照孔中的噬菌體抗體庫分別吸取到4個抗原包被孔中,室溫下振蕩孵育2 h;PBST洗10次后,加入100 μL 100 mmol/L HCl,作用5 min,再加入1/8體積的1 mol/L Tris-HCl(pH=11),混勻,中和洗脫下來的噬菌體溶液;加入10倍體積的對數生長期的大腸桿菌,1 h后取10 μL進行滴度測定,剩余菌液用M13K07侵染擴增,第2天純化噬菌體,完成第1輪淘選;共重復4輪此淘選過程。
1.2.6.2 N蛋白特異性單鏈抗體的篩選 4輪淘選后,隨機挑取214個克隆,通過間接ELISA篩選陽性克隆株。以碳酸鹽緩沖液包被重組N蛋白,終質量濃度為250 ng/mL,37 ℃包被2 h;2%BSA封閉液,37 ℃封閉2 h;以噬菌體克隆培養上清液作為一抗,空載噬菌粒培養上清液作為陰性對照,37 ℃孵育1 h,用PBST洗板5次;以HRP標記的anti-M13單克隆抗體作為二抗,5%脫脂奶1∶15 000稀釋,37 ℃孵育1 h;PBST洗板5次;用新配置的TMB顯色液37 ℃避光顯色8 min,2 mol/L H2SO4終止反應,測定OD450 nm值,選取P/N較大的克隆株作為單鏈抗體的陽性克隆株。分別吸取50 μL陽性噬菌體單克隆上清液至1.5 mL EP管中,于沸水中煮10 min,以煮沸的樣品作為PCR的模板,使用scFv的上、下游引物,進行噬菌體上清液PCR鑒定,將擴增陽性的PCR產物進行測序。
1.2.6.3 ELISA法檢測噬菌體單鏈抗體結合活性 以BCoV N蛋白作為包被抗原,陽性噬菌體單鏈抗體上清液從原液開始,分別按 1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000進行稀釋,并作為一抗,共做6個梯度,空載噬菌體上清液作為陰性對照,應用間接ELISA抗體檢測技術檢測陽性噬菌體單鏈抗體結合活性,酶標儀讀取OD450 nm值并分析試驗數據。
2 結果
2.1 重組N蛋白的表達與純化 pET28a-N-BL21經IPTG誘導后,分別取菌液的上清和沉淀進行SDS-PAGE鑒定,結果顯示,重組菌表達蛋白條帶約在54 kDa處,與預期大小一致,且表達產物主要存在于上清中。經親和層析純化N蛋白的SDS-PAGE鑒定結果見圖1,純化后的目的條帶單一,純化效果良好。
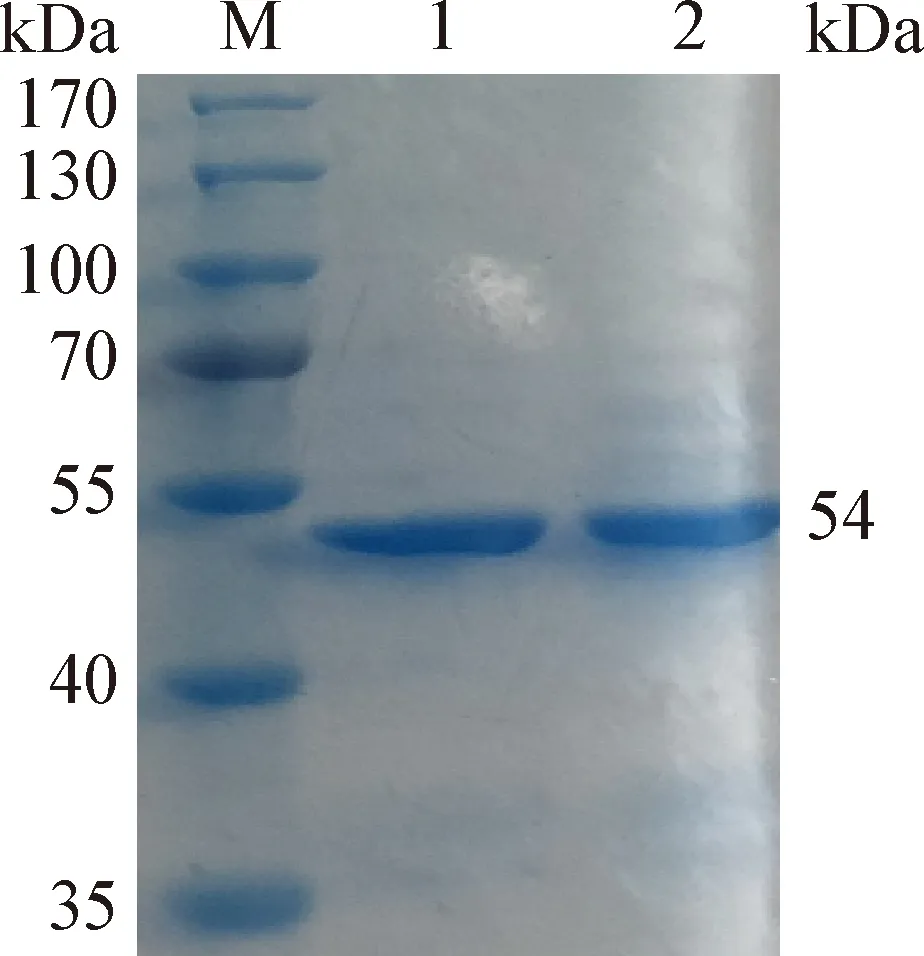
圖1 N蛋白的純化分析
2.2 VH、VL基因的擴增及scFv拼接 提取小鼠脾臟細胞總RNA,測定濃度為759 ng/μL。以反轉錄后的cDNA為模板擴增抗體可變區基因VH和VL,擴增的VH、VL基因大小均約為400 bp(圖2);拼接后的scFv基因片段大小約800 bp(圖3),與預期大小相符。

圖2 抗體可變區VH和VL基因的PCR擴增
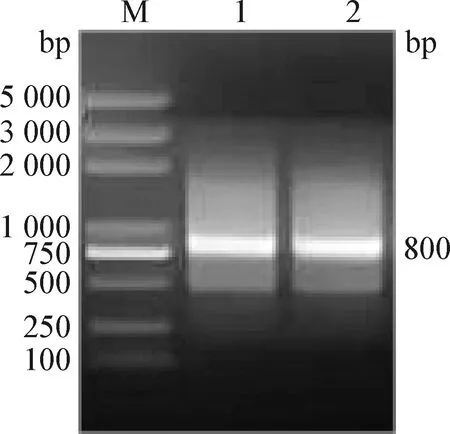
圖3 scFv基因的PCR擴增
2.3 N蛋白噬菌體單鏈抗體庫的構建及鑒定 將噬菌粒載體純化后用XbaI酶和EcoR I酶進行雙酶切鑒定。然后將純化的scFv基因片段和酶切后的載體進行連接,電轉入感受態細胞后,經10倍倍比梯度稀釋滴板,計算抗體庫的庫容為8×108PFU(圖4)。隨機挑取15個單克隆進行PCR鑒定,其中13個克隆可擴增出約800 bp大小的目的片段(圖5),陽性率為86.7%,表明抗體庫構建成功。

圖4 庫容測定
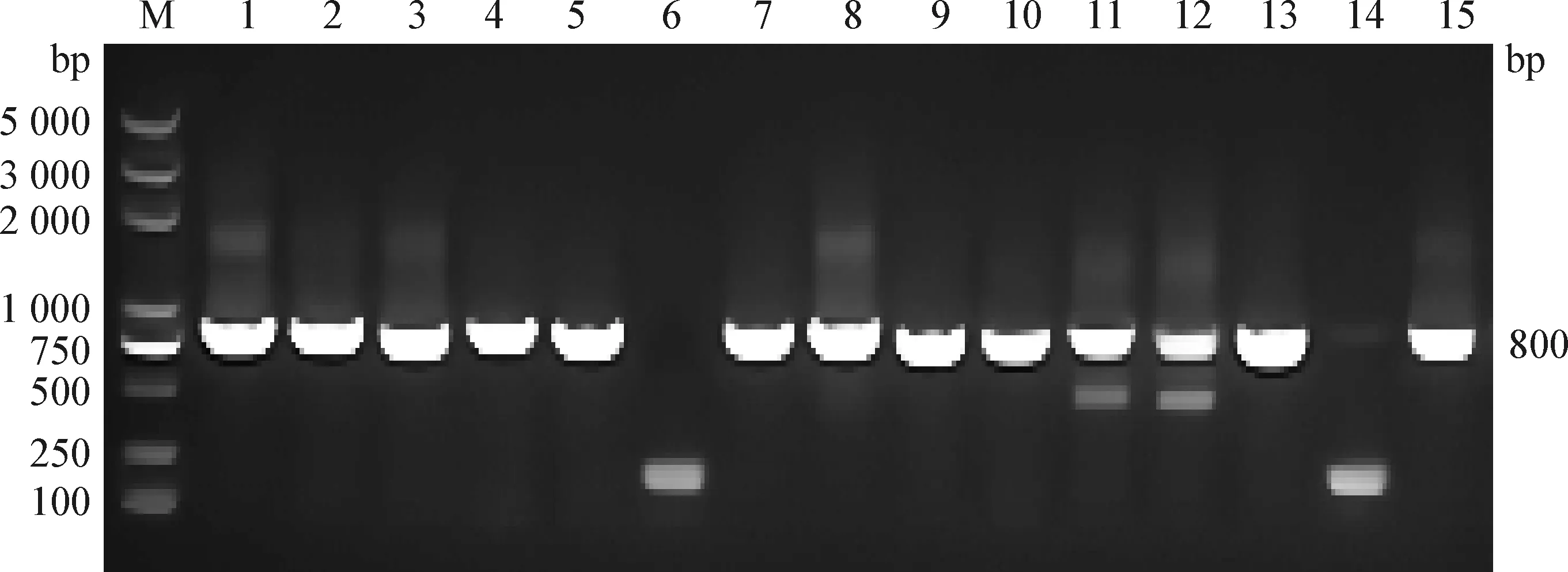
圖5 單鏈抗體庫的PCR鑒定
2.4 N蛋白噬菌體單鏈抗體庫的富集淘選及特異性單鏈抗體的篩選 以BCoV N蛋白作為包被抗原包被酶標板,經過4輪 “孵育—洗脫—擴增”淘選,結果如表1所示,N蛋白特異性噬菌體富集了164.7倍。將第4輪洗液涂板并隨機挑取214個克隆,經間接ELISA抗體檢測技術篩選針對N蛋白的陽性噬菌體克隆株。為篩選到結合活性更高的單鏈抗體,選取P/N≥4.5的克隆株作為單鏈抗體的陽性克隆株,用于后期鑒定和應用,結果共篩選獲得32株陽性值較高的噬菌體單鏈抗體(表2)。將這32株陽性噬菌體單鏈抗體進行PCR鑒定,結果顯示,32株陽性噬菌體單克隆全部正確擴增出約800 bp大小的片段。將PCR擴增陽性的產物進行測序,結果顯示,其中19株陽性噬菌體單鏈抗體基因序列正確。

表1 噬菌體抗體庫的富集

表2 ELISA篩選針對BCoV N蛋白的特異性噬菌體
2.5 噬菌體單鏈抗體結合活性的檢測 于19株基因序列正確的陽性噬菌體單鏈抗體中選取陽性值較高的5株陽性噬菌體單鏈抗體,通過間接ELISA檢測其噬菌體抗體結合活性,其中陽性噬菌體單鏈抗體scFv-154對N蛋白表現出較高的結合活性(圖6)。

圖6 5株陽性scFv結合活性的測定
3 討論
傳統的單克隆抗體(Monoclonal antibody,McAb)制備是通過動物免疫、細胞融合、單克隆細胞篩選和克隆、單個雜交瘤細胞群無性繁殖等過程,產生單一、特異性強的抗體。傳統方法可將雜交瘤細胞大規模培養提取單克隆抗體或通過小鼠腹腔接種制備相應的McAb,但生產規模和產量均受限制,且細胞保存條件要求苛刻。1990年,McCafferty等[8]成功地建立了噬菌體表面展示系統,通過將抗溶菌酶單鏈抗體基因克隆于絲狀噬菌體fd基因的下游,使scFv以融合蛋白形式展示于噬菌體表面,該技術的成功給抗體基因的篩選工作帶來了革命性的變革。
噬菌體抗體庫按基因來源分為免疫抗體庫和天然抗體庫,前者主要來源于免疫動物的淋巴細胞,其多樣性低,但抗原特異性和結合能力較強;后者則具有豐富的抗體多樣性,篩選獲得特定抗原結合力強的抗體較難[9]。與雜交瘤單克隆技術相比,經免疫動物獲得的噬菌體抗體庫技術,可模擬體內淋巴細胞產生抗體的過程,且不需復雜的細胞克隆過程,因此操作簡便、節省時間。
通常用于評價噬菌體抗體庫質量有2個關鍵指標:庫容量和抗體基因的多樣性,其中庫容量大小往往決定高親和力抗體的獲得機會[10-11]。本試驗以重組的BCoV N蛋白作為免疫原,構建了庫容為8×108PFU的鼠源抗BCoV N蛋白噬菌體單鏈抗體庫。當免疫庫的庫容達到106PFU時,即可以保證篩選獲得高親和力的抗體[12]。本試驗結果顯示,構建的抗體庫庫容和抗體多樣性良好,可以滿足一般抗原相關抗體篩選的要求。
本試驗以牛冠狀病毒重組蛋白N為抗原,通過固相包被抗原4輪淘選方式對抗體庫中特異性噬菌體抗體進行富集,獲得了32株與N蛋白特異性結合的噬菌體克隆株。其中陽性單鏈抗體scFv-154與N蛋白的結合活性較高,可用于后期鑒定和應用。本試驗結果為牛冠狀病毒N蛋白抗原表位鑒定,建立牛冠狀病毒檢測方法提供科學依據。

