金屬活動性順序的應用
代麗麗

金屬活動性順序是中考的熱點,要求同學們能通過金屬活動性順序對置換反應進行簡單判斷,靈活掌握金屬活動性順序的應用尤為重要。
題型一:利用實驗現象判斷金屬活動性順序
【解題策略】置換反應須符合“前置后,鹽必溶,鐵二價”原理,即金屬活動性順序在前的金屬單質能將后面的金屬從它的可溶性鹽溶液(或酸)中置換出來,鐵單質參與反應時,產物為+2價的亞鐵鹽。
例1 (2022·黑龍江·牡丹江)現有X、 Y、 Z三種金屬,如果把X和Y分別放入稀硫酸中,X溶解并產生氫氣,Y不反應;如果Y和Z分別放入硝酸銀溶液中,過一會兒,在Y表面有銀析出,而Z沒有變化。根據以上實驗事實,金屬活潑性由強到弱為()。
A. X > Y > Z? B. Z > X > Y? ? C. X > Z > Y? ? D. Y > X > Z
解析:把X和Y分別放入稀硫酸中,X溶解并產生氫氣,Y不反應,說明X在金屬活動性順序表中位于氫的前面,Y位于氫的后面,即金屬活動性:X > Y。把Y和Z分別放入硝酸銀溶液中,過一會兒,在Y表面有銀析出,而Z沒有變化,說明Y的金屬活動性比銀強,而Z的金屬活動性比銀弱,即金屬活動性:Y > Z。故三種金屬的活動性順序:X > Y > Z,故選A。答案:A。
題型二:利用圖象判斷金屬活動性順序
【解題策略】(1)審:看清橫、縱坐標代表的量。(2)理:利用質量守恒定律得出“價量比”公式,即氫氣的質量 = (金屬的化合價 ÷ 金屬元素的相對原子質量) × 參加反應的金屬的質量。(3)斷:判斷相關問題。
例2 (2022·山東·濟寧)相同質量的鎂、鐵、鋅三種金屬,分別與足量相同質量分數的稀硫酸充分反應,生成氫氣的質量與反應時間關系如圖1,分析圖象判斷,下列說法正確的是()。
A.金屬鋅的反應速率最大
B.金屬鋅的活動性最強
C.金屬鎂生成的氫氣質量最多
D.金屬鐵消耗稀硫酸的質量最多
解析:首先確定圖中橫、縱坐標,再結合“越陡越活潑”,判斷三種金屬的活動性順序:鎂 > 鋅 > 鐵,所以A和B都錯誤。通過觀察圖象可知鎂生成的氫氣質量最多,故鎂消耗硫酸的質量最多,所以C正確,D錯誤。答案:C。
題型三:利用實驗驗證金屬活動性順序
【解題策略】利用已知金屬活動性順序,結合實驗現象來驗證結論。
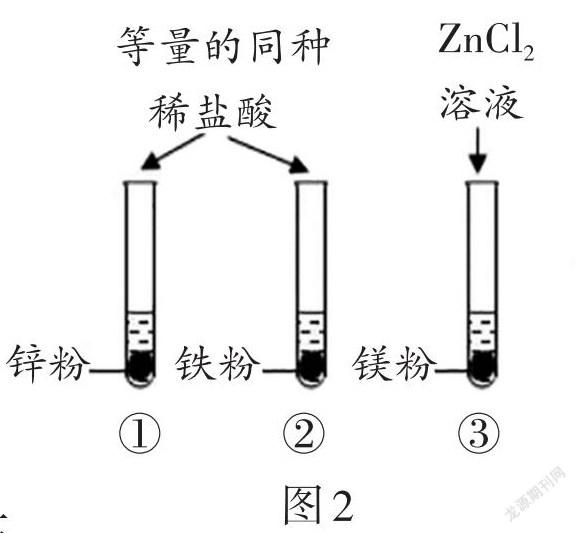
例3 (原創)為了驗證鎂、鋅、鐵三種金屬的金屬活動性強弱,某同學進行了如圖2實驗(金屬質量相同且顆粒大小相等),下列說法不正確的是()。
A.實驗①②可得金屬活動性:鋅 > 鐵
B.實驗③可得金屬活動性:鎂 > 鋅
C.實驗①②③可得金屬活動性:鎂 > 鋅 > 鐵
D.將實驗③溶液換成氯化鐵溶液也能完成本實驗驗證
解析:通過實驗①②可知,鋅粉與稀鹽酸反應產生氣泡的速率比鐵粉與稀鹽酸反應產生氣泡的速率快,說明金屬活動性:鋅 > 鐵,A正確。由實驗③可知,鎂粉能把氯化鋅溶液中的鋅置換出來,說明金屬活動性:鎂 > 鋅,B正確。結合實驗①②③可得金屬活動性:鎂 > 鋅 > 鐵,C正確。若將實驗③溶液換成氯化鐵溶液,只能證明金屬活動性:鎂 > 鐵,無法比較鎂與鋅的金屬活動性順序,D錯誤。答案:D。
題型四:利用金屬活動性順序判斷濾液和濾渣的成分
【解題策略】判斷濾液和濾渣的成分有“三慮”:“一慮”金屬和溶液是否反應;“二慮”反應的先后順序;“三慮”反應物是否過量。
例4 (2022·遼寧·遼陽 )將鋁絲浸入硫酸鎂和硫酸銅的混合溶液中,過一會兒取出,觀察到鋁絲表面有固體析出,溶液呈藍色。此時溶液中含有____________(填數字)種溶質。
解析:金屬活動性順序:鎂 > 鋁 > 銅,將鋁絲浸入硫酸鎂和硫酸銅的混合溶液中,鋁和硫酸銅反應生成硫酸鋁和銅,鋁和硫酸鎂不反應,過一會兒取出,觀察到鋁絲表面有固體析出,溶液呈藍色,說明硫酸銅沒有完全反應,此時溶液中含有硫酸鎂、硫酸鋁、硫酸銅3種溶質。答案:3。
(作者單位:遼寧省實驗中學分校)

