基于3D U-Net 模型實現T2WI 圖像中前列腺的區域分割及臨床驗證
劉想,高歌,韓超,朱麗娜,張耀峰,王祥鵬,張曉東,王霄英
(1.北京大學第一醫院醫學影像科,北京 100034;2.鄭州大學第一附屬醫院影像科,河南 鄭州 450052;3.北京賽邁特銳醫學科技有限公司,北京 100011)
多參數磁共振成像(Multiparametric MRI,mpMRI)是發現前列腺可疑病灶并進行定位、檢測的重要成像方式[1-2]。前列腺影像報告和數據系統(Prostate imaging and report data system,PI -RADS)v2.1 建議根據分帶解剖來進行病灶的定位。T2WI 上前列腺分帶解剖顯示清楚,因此臨床上常基于T2WI 來進行解剖定位[3]。
自2011 年Makni 等提出應用C-means 聚類方法進行前列腺的自動分割后[4],關于前列腺自動分割的方法和研究已有很多報道。尤其是近些年,隨著深度學習技術的發展,以U-Net 為代表的卷積神經網絡在前列腺分割中表現出色[5-7]。但目前這些研究僅實現了前列腺的腺體分割或簡單的區域分割(中央腺體+外周帶),并未滿足前列腺系統穿刺的6 分區定位標準及影像醫生對前列腺癌定位的分割精度要求。我科已實現在前列腺T2WI 上使用U-Net 模型進行前列腺的全腺體分割[8]并已證實基于該分割模型的腺體徑線測量植入結構化報告的可行性[9]。本研究在此基礎上進一步利用3D U-Net 模型進行精細的前列腺區域分割并利用臨床實際前列腺癌患者病例,驗證該模型是否可滿足臨床上影像醫生對癌灶的定位需求,以期為后續的前列腺癌自動檢出、定位奠定基礎。
1 資料與方法
本研究獲得了倫理審查委員會批準(批件號:[2021-060]),按照本單位人工智能(Artificial intelligence,AI)模型訓練規范執行研究方案。
1.1 用例定義
根據本單位AI 訓練管理方法,首先定義研發前列腺區域分割的用例。包括:前列腺區域分割AI 模型的ID、臨床問題、場景描述、模型在實際工作中的調用流程、模型輸入輸出數據結構等。AI 模型返回結果定義為:前列腺外周帶、移行帶、中央帶、前纖維基質帶及尿道的坐標,以及上述分割區域的體積等。AI 模型結果返回至前列腺mpMRI 結構化報告中。
1.2 一般資料
本研究收集數據包括用于模型訓練的數據集(數據集A)和用于臨床驗證的數據集(數據集B)(圖1)。從本院PACS 系統回顧性收集2019 年6月—2020 年1 月的302 例患者的前列腺mpMRI 圖像,納入標準為:①因前列腺特異性抗原(Prostate specific antigen,PSA)增高和(或)直腸指診懷疑為前列腺癌而行mpMRI 掃描;②掃描規范的T2WI 序列。按照排除標準:①前列腺癌根治術后或經尿道前列腺切除術后(n=4);②前列腺癌輔助治療后(n=5);③有明顯的運動偽影等(n=5),最終有288 例患者納入研究,用于模型訓練(數據集A),其中包括PI-RADS 評分≤3 分患者198例,≥4 分患者90 例。
回顧性收集2020 年2—5 月的經病理證實的35 例前列腺癌患者,排除5 例治療后患者,最終有30 例患者(共33 個前列腺癌灶)用于前列腺分割模型的臨床驗證(數據集B)。其中包括Gleason 評分3+3 分4例,3+4 分9例,4+3 分9例,4+4 分6例,5+5 分2 例。
1.3 掃描參數
根據前列腺mpMRI 掃描方案,所有患者的掃描序列均包括T1WI、T2WI、擴散加權成像及動態增強成像。掃描設備為3.0T Ingenia(Philips Healthcare,Best,the Netherlands)。其中,前列腺行軸位、矢狀位及冠狀位掃描的T2WI 參數為:重復時間(time of repetition,TR)=2 905 ms;回波時間(echo time)=90 ms;顯示野(FOV)=240×240 mm,矩陣=324×280,層厚=3 mm;無間距掃描;未壓脂。
1.4 分割模型訓練
將所有DICOM 格式的T2WI 圖像導入數據管理平臺并轉換為Nifty 格式。由一位低年資影像醫生(閱片經驗3年)使用ITK-SNAP軟件(Version 3.6.0,http://www.itksnap.org/)逐層標注前列腺T2WI上的外周帶、中央帶、移行帶、前纖維基質帶及尿道結構。由另一名具有15 年閱片經驗的前列腺影像專家進行審核。以手工標注的標簽作為評價模型分割性能的評價標準(圖2)。
使用本科室已建立的前列腺分割模型[8]分割整個前列腺,以減少周圍組織結構對前列腺區域分割的干擾。將288 例數據按照8∶1∶1 的比例隨機分為訓練集(n=231)、調優集(n=29)和測試集(n=28)。訓練集用于模型的訓練,通過對樣本數據的學習確定模型參數從而建立一種分類的方式;調優集用于對已訓練的模型進行參數調整即做模型的最終優化及確定;測試集則是對已訓練好的最終模型進行性能測試。利用3D U-Net 深度學習網絡[10]進行前列腺區域分割,訓練過程均在GPU NVIDIA Tesla P100 16G 上進行,軟件包括Python 3.6、Pytorch 0.4.Opencv、Numpy 和Simple ITK。使用Adam 作為訓練優化器。模型訓練時每批次輸入數據量(batch size)設定為10,學習率(learning rate)為0.0001,模型迭代次數為300 個周期(epoch)。模型訓練流程如圖3 所示。
1.5 分割模型評估
利用測試集數據對3D U-Net 模型的分割性能進行定量評估,評估指標包括基于重合度(overlapbased)的指標:Dice 相似系數(Dice similarity coefficient,DSC)、精確度(precision)、靈敏度(recall)[11];基于體積(volume-based)的指標:體積相似度(volumetric similarity,VS);以及基于空間距離(Spatial distance-based)的指標:Hausdorff 表面距離(Hausdorff surface distance,HSD)[12]。三者聯合使用可以從整體重疊程度、體積以及邊緣匹配程度多方面評估分割性能。應用最小體積包圍盒(minimum volume bounding box)算法[13]自動計算各結構的手工標注體積和模型預測體積,將兩者進行比較,評估模型測量前列腺各個分帶區域體積的效能。
1.6 模型臨床驗證
由一名低年資影像醫生對臨床驗證數據集中的30 例前列腺癌患者進行兩次閱片并記錄癌灶的位置。第一次閱片是在未進行前列腺分割的基礎上,在T2WI 圖像上記錄癌灶的位置。經過一個星期的洗脫期后,進行第二次閱片。第二次閱片是在模型對患者前列腺T2WI 進行分割的基礎上記錄癌灶的位置。以影像專家瀏覽mpMRI 各個序列的圖像后確定的癌灶位置為參考標準,評估低年資影像醫生兩次閱片的準確率。
1.7 統計分析
應用SPSS 23.0 軟件進行統計學分析。應用方差分析比較數據集A 中訓練集、調優集和測試集之間的年齡差異及PSA 水平,t 檢驗用于比較訓練集及測試集中各區域的DSC 及HSD 值。t 檢驗也用于比較數據集A 和數據集B 之間的年齡及PSA 水平。Bland-Altman 分析評價模型與參考標準對測量前列腺分帶區域體積的一致性。P<0.05 認為差異有統計學意義。
2 結果
2.1 數據分布
不同數據集的患者特征及分布如表1 所示,訓練集、調優集及測試集之間的患者年齡和PSA 水平均無顯著差異(P=0.170 和0.140)。數據集A 和數據集B 之間的患者年齡無顯著差異(P=0.542),但數據集B 的PSA 水平顯著高于數據集A(P=0.002)。
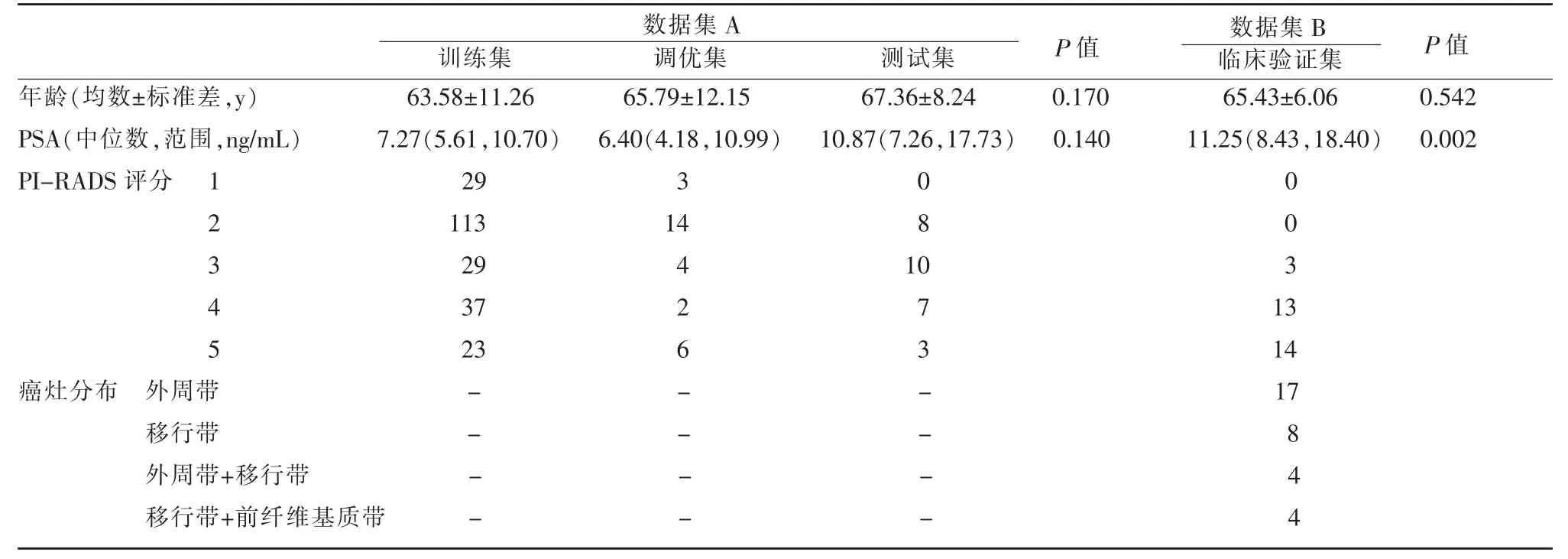
表1 患者臨床特征及分布
在數據集B 中的30 名前列腺癌患者中,共有33 個癌灶。其中17 個位于外周帶,8 個位于移行帶,4 個位于外周帶+移行帶中,4 個位于前纖維基質+移行帶中。
2.2 模型分割性能
以手工標注的前列腺各區域和尿道區域標簽為參考標準,評估測試集中模型的分割性能如表2 所示。在測試集中,模型對外周帶、移行帶和尿道區域的分割性能較好,其DSC 均大于0.70,精確度、靈敏度及VS 值也均在0.85 以上。中央帶和前纖維基質帶的DSC 值較低,分別為0.52±0.22 和0.63±0.22,且前纖維基質帶的HSD 也為各區域中最大((17.86±14.05)mm)。
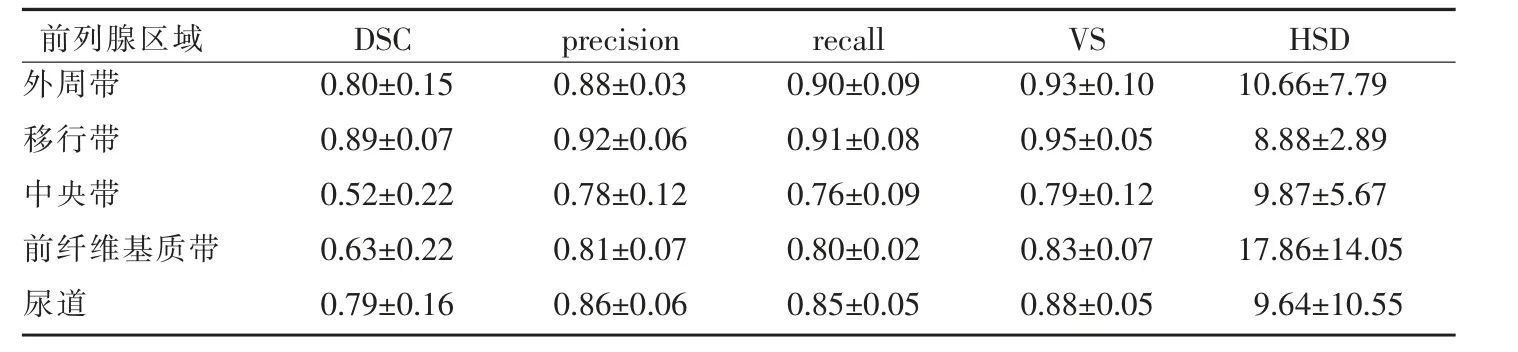
表2 模型對前列腺區域的分割性能
2.3 體積比較
測試集中手工標注及模型預測的前列腺各區域及尿道區域的體積如表3 所示。圖4 所示為測試集中兩者之間的Bland-Altman 一致性分析,模型預測與手工標注的各區域體積一致性較高,差值基本都位于95%一致范圍(limits of agreement,LoA)之內。
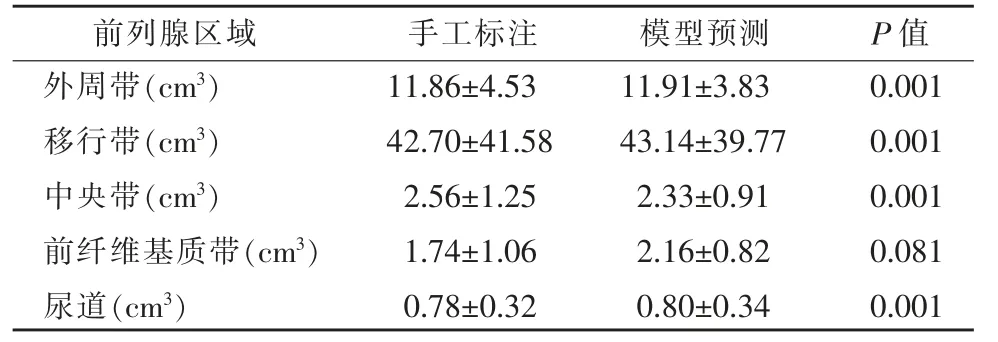
表3 前列腺區域分割體積
2.4 臨床驗證結果
以病灶為單位分析低年資影像醫生癌灶的檢出及定位準確性如表4 所示。在兩次閱片中,33 個病灶均被正確檢出,第一次閱片的定位準確率為(93.93%),其中1 處位于外周帶+移行帶的癌灶被定位為外周帶;1 處前纖維基質帶+移行帶的癌灶被定位為移行帶。第二次閱片的準確率為100%(33/33),所有被檢出的癌灶均被正確定位。
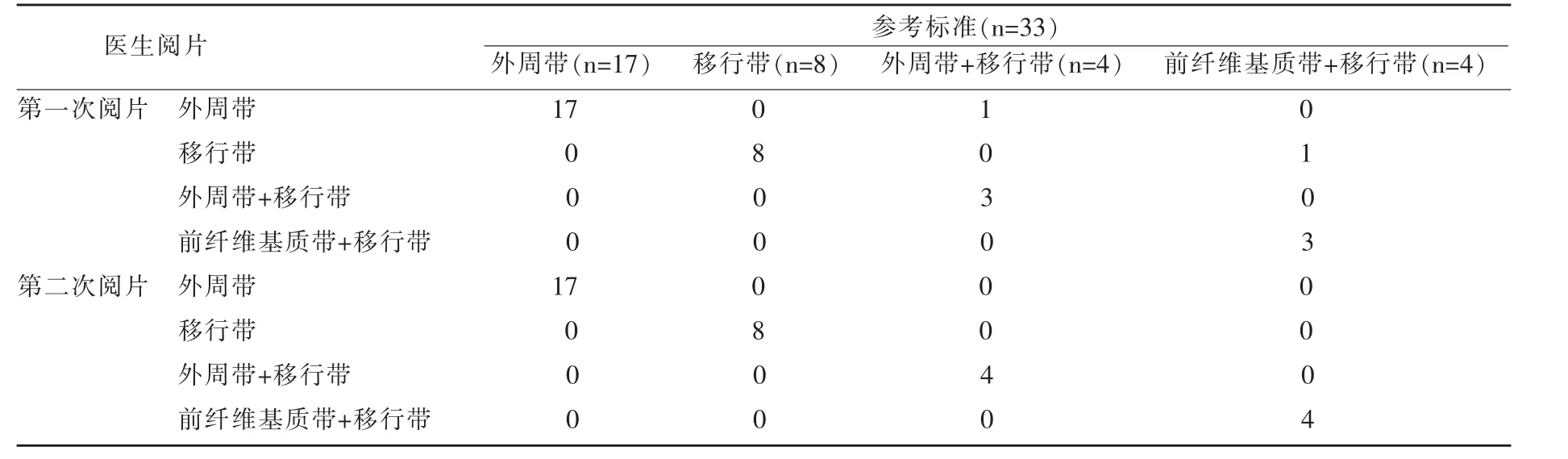
表4 影像醫生的兩次閱片結果
3 討論
前列腺mpMRI 檢查的主要任務是發現可疑癌灶并精確定位,以指導穿刺活檢。根據PI-RADS 2.1指標,前列腺病灶定位時先將腺體分為不同分帶,再按照上下關系、左右關系和前后關系將其細分為39個分區[3,14]。因此,mpMRI 診斷時識別腺體的分帶解剖是必需的。但是對于經驗較少的影像醫生,快速準確地對識別腺體分帶解剖存在一定的困難。在本研究中,我們應用3D U-Net 模型實現了前列腺分帶解剖的精細分割,并在臨床驗證數據集中證實了該模型輔助醫生對于前列腺癌灶定位的可行性。
T2WI 是前列腺癌mpMRI 檢查中用于癌灶定位的常規序列,目前基于U-Net 模型在T2WI 進行前列腺區域的自動分割已有較多報道。Nader等[7]通過建立Dense-2 U-net 模型將前列腺自動分割為中央腺體和外周帶,其DSC 值分別可達到0.89±0.02 和0.78±0.03。Carina等[15]應用2D U-Net 模型進行前列腺區域分割的DSC 值分別為0.79(中央腺體)和0.69(外周帶)。Renato等[16]比較了不同分割模型(UNet vs.ENet vs.ERFNet)對前列腺區域分割的效果,結果顯示ENet 模型對前列腺的分割效果最佳,其外周帶的DSC 可達到0.71±0.08,移行帶可達到0.87±0.05;U-Net 次之,其外周帶和移行帶的DSC分別為0.70±0.08,0.86±0.07。
與上述既往研究相比,本研究采用3D U-Net模型分割前列腺區域,結果顯示模型對T2WI 圖像中的前列腺區域分割性能較好,尤其是外周帶和移行帶,其在測試集中的DSC 可達0.80±0.15 和0.89±0.07。分析其原因,一方面可能是因為我們收集了更多的數據用于模型訓練(288 vs.Nader:141 vs.Carina:40 vs.Renato:204)。另一方面,我們對前列腺的區域分割是在前列腺腺體分割的基礎上進行的,這樣可減少背景的干擾,從而更高效地利用圖像信息。另外,本研究所用的3D U-Net 模型不僅可以提取到圖像層面內的空間信息,同時還能提取到層間特征信息。相比于2D U-Net 網絡能夠多增加一個維度的特征[17]。
在本研究中,為了更全面的對模型的分割性能進行評估,我們應用了包括基于重合度、基于體積和基于空間距離的三類分割評估指標。研究結果顯示,外周帶、移行帶及尿道區域的三類評估指標值均高于中央帶和前纖維基質帶,即模型對外周帶、移行帶及尿道區域具有較好的分割效果。分析其原因,我們認為可能是因為這三個區域相較于前纖維基質帶和中央帶而言體積更大且形態更為規則。
與既往的二分區(中央腺體+外周帶)分割研究不同[18-19],本研究對前列腺進行了更為精細的區域分割。按照前列腺的解剖分帶,我們將其分為四個腺體區域(外周帶、移行帶、中央帶、前纖維基質帶)和一個尿道區域。更為精細的分割可提供更為確切的定位信息。模型對于不同區域的分割性能稍有不同。模型對外周帶、移行帶及尿道的分割具有較好的表現,其DSC 值均在0.70 以上,中央帶及前纖維基質帶的效果則較差,分別為0.52 和0.63。其原因可能是,與外周帶及移行帶相比,中央帶及前纖維基質帶的體積較小,其在模型訓練過程中可用于學習的體素和圖像特征較少。且中央帶、前纖維基質帶和移行帶在T2WI 圖像上的信號特征相似,這三個區域的分割本身就存在一定的難度。雖然DSC 值低于0.70,但模型預測出的體積與手工標注一致性較高,考慮到分帶模型的目的是用于定位,仍可認為大致符合臨床要求。
為了進一步驗證分帶解剖分割模型是否可用于輔助醫生定位,我們在訓練模型之后,應用臨床實際前列腺癌患者數據對該分割模型進行了驗證。結果顯示以癌灶為單位分析,影像醫生在模型輔助時對癌灶定位準確率可達到100%,高于其醫生直接進行癌灶定位的準確率(93.93%)。因此,我們認為其可滿足臨床對前列腺癌的定位要求,并有望為后續進行前列腺癌的全自動檢出及定位奠定基礎。
本研究存在一定的局限性,首先,我們當前只是在單獨的非抑脂T2WI 序列上進行前列腺的區域分割,并未對其他如3D T2WI 圖像或多模態圖像(如增強期圖像和DWI 圖像)的前列腺分割性能進行研究。因此,在后續研究中,我們可考慮在現有模型中加入其他序列作為輸入,來訓練一個適用于多序列的前列腺分割模型。其次,本研究入組時排除了腺體結構被腫瘤明顯破壞的患者和因術后、治療后導致腺體結構不清晰的患者。該類患者的前列腺分帶解剖會有明顯變化,模型對上述情況是不適用的。因此本模型在實際臨床應用過程中有必要先進行圖像甄別,將明顯結構異常的數據自動過濾,才能保證分帶解剖分割模型的準確性。第三,當前用于模型訓練的數據為單一中心來源,在未來應擴大樣本量,加入多中心、多設備及多種臨床場景下的患者數據對模型進行迭代和優化,并統一標準建立訓練模型,將AI與人的主觀能動性有機結合,從而提高前列腺早期癌定位準確率。
總之,本研究基于3D U-Net 訓練的前列腺區域分割模型可滿足臨床對前列腺癌定位的需求,有利于引導穿刺活檢,同時也可作為后續前列腺癌全自動檢出的定位基礎。

