氨基葡萄糖產生菌的篩選鑒定及其發(fā)酵優(yōu)化
黃娟,蔡俊
(發(fā)酵工程教育部重點實驗室,工業(yè)微生物湖北省重點實驗室,工業(yè)發(fā)酵湖北省協(xié)同創(chuàng)新中心,湖北工業(yè)大學,湖北 武漢 430068)
氨基葡萄糖(glucosamine,GlcN)是由葡萄糖的一個羥基被氨基取代形成的一種重要的功能性單糖[1-4],其廣泛存在于細菌、酵母、絲狀真菌、植物和動物中[5]。作為生物體內多糖的重要單體之一,GlcN可有效治療關節(jié)炎,參與肝腎解毒和護肝[6-8],還能抗衰老、刺激嬰兒腸道內雙歧桿菌的生長、調節(jié)內分泌[9]。
目前國內外生產GlcN主要有由蝦蟹殼或者真菌菌絲體酸、酶解[10-14],工程菌發(fā)酵與真菌發(fā)酵這3種方法,但酸、酶解存在原料來源會引起過敏反應[15]以及酶成本高等問題。工程菌發(fā)酵產GlcN[16-19]已有大量研究,產量高且發(fā)酵周期短,在經濟上占有優(yōu)勢,但工程菌有著表達系統(tǒng)不穩(wěn)定,表達產物無活性、易被降解,食品市場難以接受等普遍性缺點。Hsieh等[5]比較發(fā)現(xiàn)野生菌株Aspergillus sp.BCRC 31742是產GlcN的最佳菌株,通過對該菌株發(fā)酵條件、菌絲體狀態(tài)以及刺激因子等多方面提高其生物量[20-21]或者利用生產檸檬酸的廢棄菌絲體[22]從而獲得菌絲體中GlcN的方法,對于不接受用工程菌產GlcN的醫(yī)藥、食品市場而言具有可行性,但從絲狀真菌菌絲體中提取GlcN仍存在純度低、酶成本高以及發(fā)酵周期長等問題。Papagianni等[23]研究發(fā)現(xiàn)黑曲霉產檸檬酸發(fā)酵早期的發(fā)酵液中存在GlcN,在絲狀真菌發(fā)酵初級階段,細胞內大量合成的GlcN會分泌到胞外,該現(xiàn)象為GlcN的生產提供了新思路。因此本文提出從絲狀真菌早期發(fā)酵液中提取獲得GlcN。
本研究從養(yǎng)蝦廠采集土壤樣品進行篩選分離,得到一株胞外GlcN含量為1.537 g/L的菌株,進行形態(tài)學觀察和分子學鑒定后確定為Aspergillus piperis,發(fā)酵12 h后發(fā)酵液中GlcN含量達到2.687 g/L,實現(xiàn)了GlcN胞外生產和積累。該策略解決了絲狀真菌發(fā)酵周期長、GlcN提取工藝中存在環(huán)境污染以及工程菌危害的問題,為綠色便捷獲得GlcN提供了理論依據。
1 材料與方法
1.1 材料與試劑
在湖北省潛江市小龍蝦養(yǎng)殖池中采集土樣。葡糖胺(分析純)、對二甲氨基苯甲醛(分析純):上海麥克林生化科技有限公司;D-氨基半乳糖鹽酸鹽(分析純):上海源葉生物科技有限公司;10×擴增緩沖液(10×PCR buffer,含 Mg2+)、脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP):美國賽默飛世爾科技公司(Thermo Fisher Scientific);引物 ITS1(10 μmol/L)、ITS4(10 μmol/L):南京金斯瑞生物科技股份有限公司;其他試劑均為國產分析純。
1.2 培養(yǎng)基的配制
牛肉膏蛋白胨培養(yǎng)基[24]:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、pH7.0。
高氏一號培養(yǎng)基[25]:可溶性淀粉20 g、KNO31 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g。用少量冷水將淀粉調成糊狀,倒入煮沸的水中,加入其他成分,溶化后補水至1 L。
馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養(yǎng)基[21]:土豆200 g、葡萄糖20 g。土豆去皮切塊煮沸0.5 h,然后用紗布過濾,再加葡萄糖并定容至1 L。
水瓊脂培養(yǎng)基平板[26]:瓊脂20 g、水1 L。
查氏培養(yǎng)基[27]:NaNO32 g、K2HPO41 g、KCl 0.5 g、MgSO40.5 g、FeSO40.01 g、蔗糖 30 g。
1.3 儀器與設備
SYNERGY2酶標儀:基因生物技術國際貿易(上海)有限公司;Veriti實時熒光定量聚合酶鏈式反應(polymerase chain reaction,PCR)儀:美國賽默飛世爾科技公司;沃特世2767-2545液質聯(lián)用儀(liquid chromatograph mass spectrometer,LC-MS):沃特世科技(上海)有限公司。
1.4 產GlcN菌株的分離篩選
1.4.1 菌株分離純化
取1 g土樣接入50 mL 0.9%NaCl溶液中并于搖床30℃,180 r/min培養(yǎng)2 h。將土樣液體進行稀釋,梯度稀釋至 10-9倍,取 200 μL 10-7、10-8、10-9倍的稀釋液涂布在牛肉膏蛋白胨、PDA及高氏培養(yǎng)基的平板上,分別置于37、30、30℃內培養(yǎng)。平板劃線分離直到劃分出單菌落。
1.4.2 產GlcN菌株初篩
將無菌濾紙貼在水瓊脂培養(yǎng)基平板上,純化后得到的菌株點種[28]在濾紙后培養(yǎng)1 d,將濾紙取出晾干進行茚三酮顯色[29]。觀察點樣點及其周圍有無紫紅色斑點出現(xiàn),將顯色菌株標記并進行菌株復篩。
1.4.3 產GlcN菌株復篩
將復篩的細菌活化后接入牛肉膏蛋白胨培養(yǎng)基,30℃、180 r/min培養(yǎng)16 h。然后按照接種量4%接入牛肉膏蛋白胨培養(yǎng)基,30℃、180r/min發(fā)酵培養(yǎng)24 h。復篩的真菌活化后接入PDA培養(yǎng)基,37℃、180 r/min培養(yǎng)20h后以接種量4%接入查氏培養(yǎng)基,于37℃、180r/min發(fā)酵48 h。用Elson-Morgon法與LC-MS聯(lián)用儀分別對初篩菌株的發(fā)酵液進行GlcN定量與定性分析。
Elson-Morgon法[30-31]:GlcN 與氨基半乳糖(galcosamine,GalN)兩種氨基己糖在100℃和25℃下經堿性乙酰化與對二甲氨基苯甲醛[p-(dimethylamino)-benzaldehyde,PDABA]反應后因乙酰化程度不同而導致生色原含量不同,通過標準曲線分別計算出樣品中總氨基己糖與GalN的含量,兩者差值即為樣品中GlcN的含量。
LC-MS聯(lián)用條件[32]:發(fā)酵液經0.22 μm微孔濾膜過濾。色譜條件為AtlantisT3,5 μm,100 ?(10 mm×150 mm),檢測器為Waters 2489 UV檢測器。流動相為乙腈-0.01%氨水溶液梯度洗脫,流速為8 mL/min,進樣量100 μL。質譜條件為電噴霧正離子化(electron spray ionization,ESI);特定離子(SIM)和質譜全掃檢測。溫度為600℃;錐孔電壓為25 V;掃描范圍為質荷比150~250。梯度洗脫條件見表1。
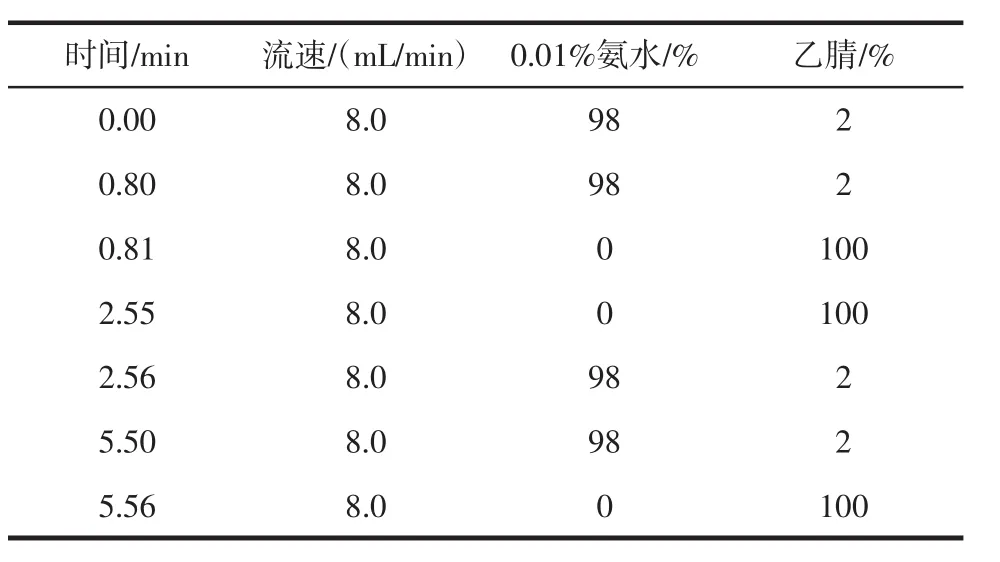
表1 梯度洗脫條件Table 1 The conditions of gradient elution
1.5 菌種鑒定
1.5.1 形態(tài)特征觀察
通過菌株分離純化確定曲霉11為產GlcN菌。將目的菌株在PDA固體培養(yǎng)基中進行稀釋涂布,30℃恒溫培養(yǎng)48 h,觀察并記錄其菌落特征。
1.5.2 分子學鑒定
將菌株接種于PDA液體培養(yǎng)基中,30℃恒溫培養(yǎng)24h后過濾收集菌體。根據Solarbio真菌基因組DNA提取試劑盒提取獲得曲霉11的全基因組。將提取的全基因組與南京金斯瑞生物科技股份有限公司合成的引物 ITS1:5’-TCCGTAGGTGAACCTGCGG-3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’進行PCR擴增。25 μL PCR 反應體系:DNA 模板 1 μL,10×擴增緩沖液(10×PCR buffer)2.5 μL,脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)1 μL,引物 ITS1、ITS4 各1 μL,rTaq 酶 0.5 μL,加超純水補至 25 μL。PCR 擴增條件為 98 ℃ 2 min,98 ℃ 10 s,58 ℃ 10 s,72 ℃ 10 s,循環(huán) 35次,72℃5min。將 3 μLPCR產物與3 μL10×上樣緩沖液混合,經0.8%瓊脂糖凝膠電泳進行檢測,并送至北京擎科生物有限公司進行測序。將測序結果在NCBI中用BLAST在線同源性查詢軟件與GenBank中已登錄的ITS區(qū)基因組進行同源性比較,用系統(tǒng)發(fā)生推斷軟件包MEGA5.1進行系統(tǒng)發(fā)育樹分析,并以Neighbor-Joinging法構建系統(tǒng)發(fā)育樹,確定該菌株的分類地位。
1.6 曲霉11生長曲線的繪制
曲霉11斜面經PDA液體培養(yǎng)基活化后以接種量4%接入50 mL的PDA液體培養(yǎng)基中,30℃、180 r/min培養(yǎng),周期取樣測干重。以培養(yǎng)時間(h)為橫坐標,干重(g)為縱坐標繪制曲霉11的生長曲線。
1.7 曲霉11發(fā)酵條件優(yōu)化
通過對產GlcN菌種的篩選確定曲霉11的發(fā)酵液中GlcN含量為1.537 g/L,對曲霉11的發(fā)酵條件即發(fā)酵周期、發(fā)酵pH值、搖床轉速、裝液量、發(fā)酵溫度及接種量等方面進行優(yōu)化以進一步提高發(fā)酵液中的GlcN含量并探究發(fā)酵優(yōu)化過程中菌體的干重與發(fā)酵液中GlcN含量的關系。
1.8 數據處理
取3次試驗數據的平均值并計算其誤差,用Origin 8.0軟件畫圖。
2 結果與分析
2.1 產GlcN菌株的分離篩選
2.1.1 菌株初篩結果
共分離得到菌種16株,其中在牛肉膏蛋白胨培養(yǎng)基篩得菌株4種,高氏培養(yǎng)基篩得4種,PDA培養(yǎng)基種篩得8種。采用茚三酮顯色法對分離得到的16株菌種進行產GlcN能力的初篩,結果見圖1。
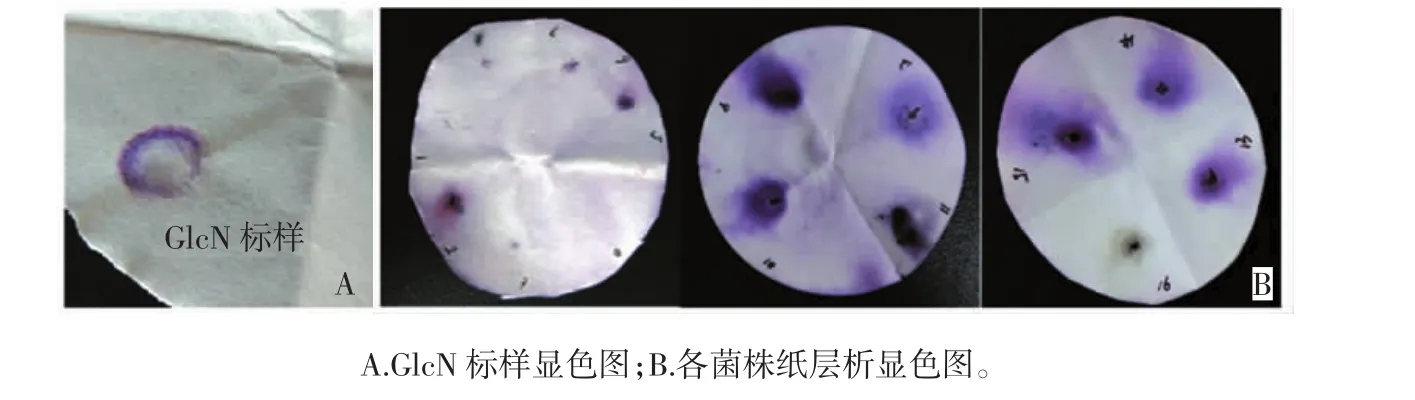
圖1 GlcN標樣顯色圖與各菌株紙層析顯色圖Fig.1 Color diagram of strains and GlcN standard sample
由圖1可知,共有10株菌種的周圍有紫紅色,這表明其產物能與茚三酮發(fā)生顏色反應。因此選擇這10株菌進行復篩實驗。
2.1.2 菌株復篩結果
氨基己糖在100℃與25℃反應下的標準曲線見圖2,根據標準曲線計算出各菌株胞外GlcN含量。
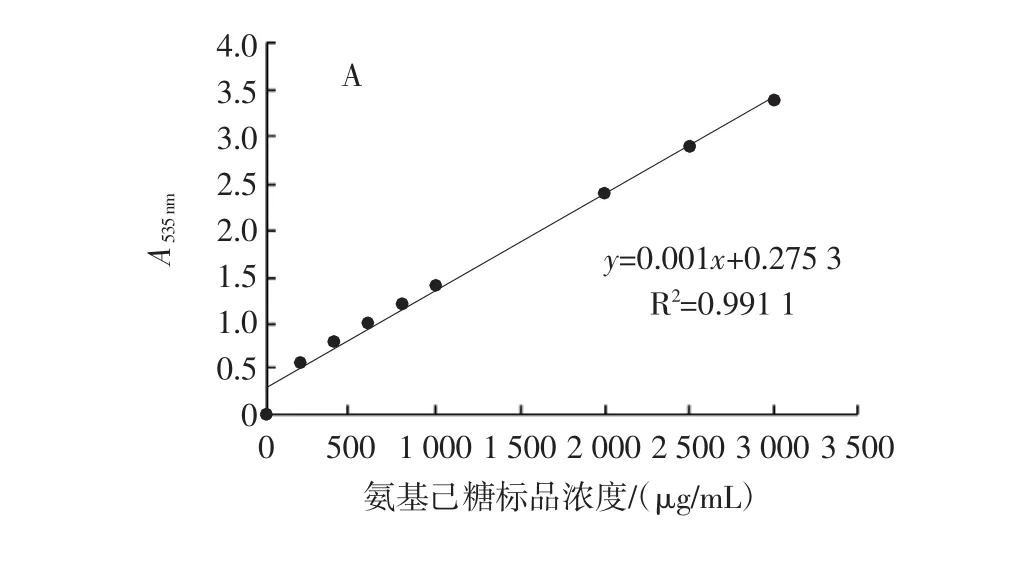
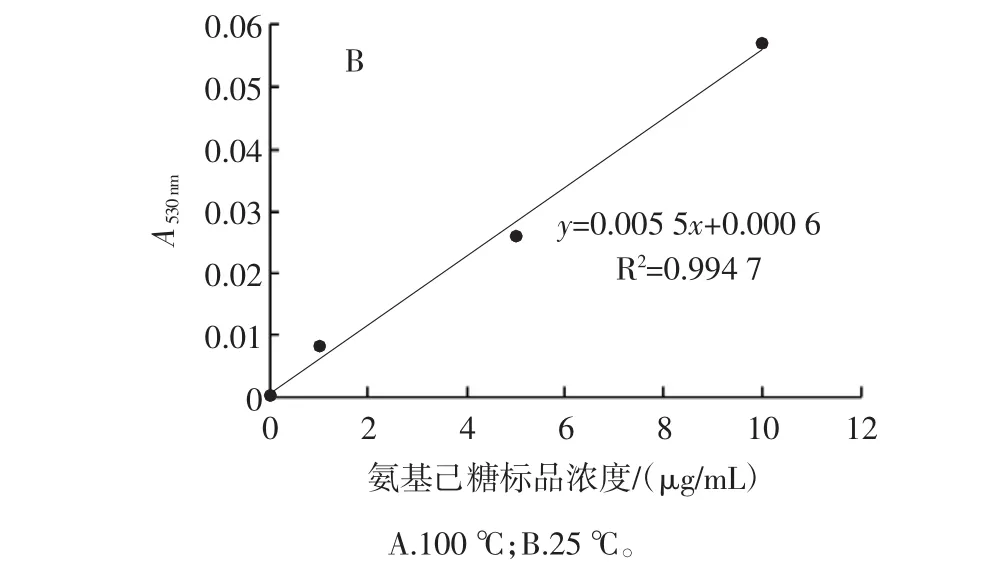
圖2 氨基己糖的標準曲線Fig.2 Standard curve of hexosamine
初篩菌株胞外GlcN產量見表2。
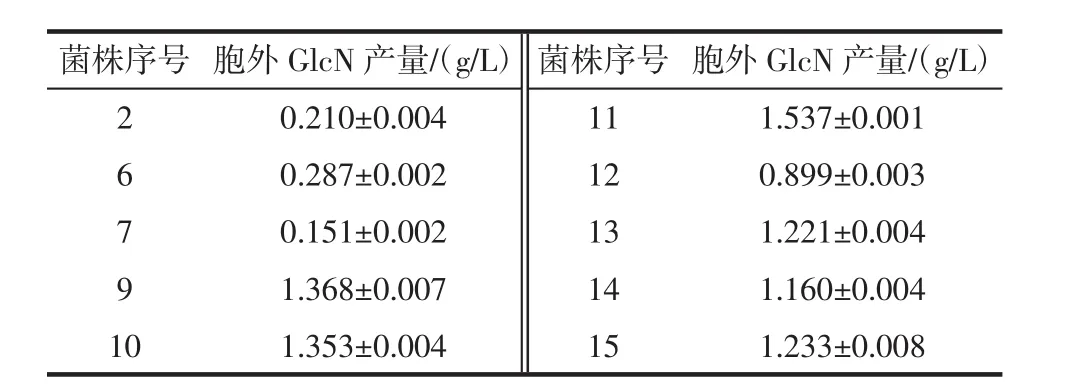
表2 初篩菌株胞外GlcN產量Table 2 Yield of extracellular GlcN in selected strains
由表2可知,曲霉11胞外GlcN含量最高,為1.537 g/L,對曲霉11的發(fā)酵液進行GlcN定性分析。
用LC-MS聯(lián)用儀對曲霉11的發(fā)酵液進行檢測,結果見圖3。
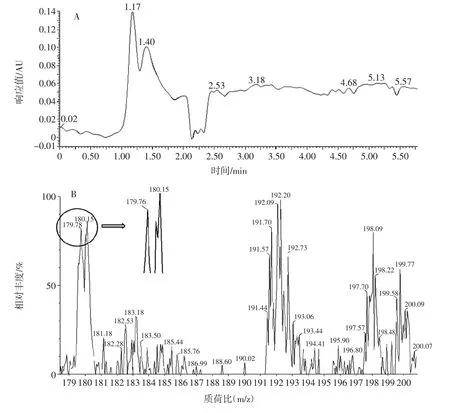
圖3 發(fā)酵液液相色譜-質譜圖Fig.3 Liquid chromatograph-mass spectrometer of fermented liquid
由圖3可知,SIR檢測出0.9 min~1.3 min內有質荷比為180的離子峰,減去H+的質量1,該時間段檢測物質與GlcN標品的分子量179相符,且該時間段質譜出峰時間與液相色譜出峰時間對應良好。
2.2 菌種鑒定結果
2.2.1 形態(tài)特征觀察
曲霉11菌落形態(tài)和顯微鏡下形態(tài)見圖4。
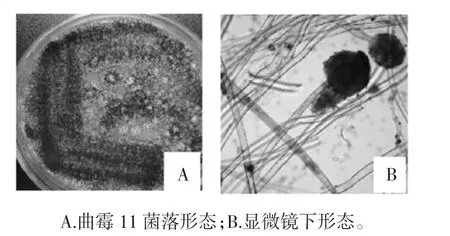
圖4 曲霉11形態(tài)Fig.4 Morphology of the strain 11
如圖4所示,曲霉11在PDA固體培養(yǎng)基上30℃培養(yǎng)48 h后,菌落開始為白色,菌落中央逐漸出現(xiàn)很淡的黃色,最后變?yōu)榇纸q狀黑色或黑褐色,背面淡黃色。曲霉11在顯微鏡下觀察菌體菌絲發(fā)達多分枝。分生孢子梗自基質中伸出,頂部形成黑褐色放射狀球形頂囊。
2.2.2 分子學鑒定
曲霉11的PCR電泳見圖5。
由圖5比對可得曲霉11的ITS區(qū)基因片段大致為600 bp。
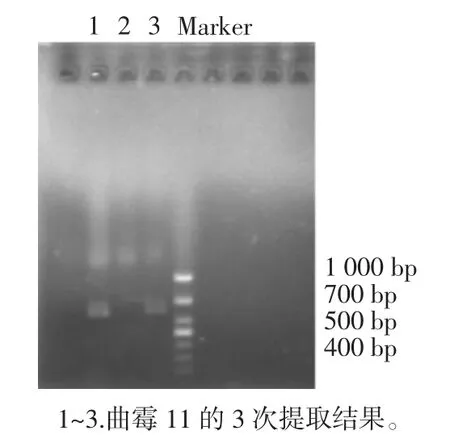
圖5 曲霉11的PCR電泳Fig.5 PCR electropherogram of strain 11
曲霉11的進化樹分析結果見圖6。
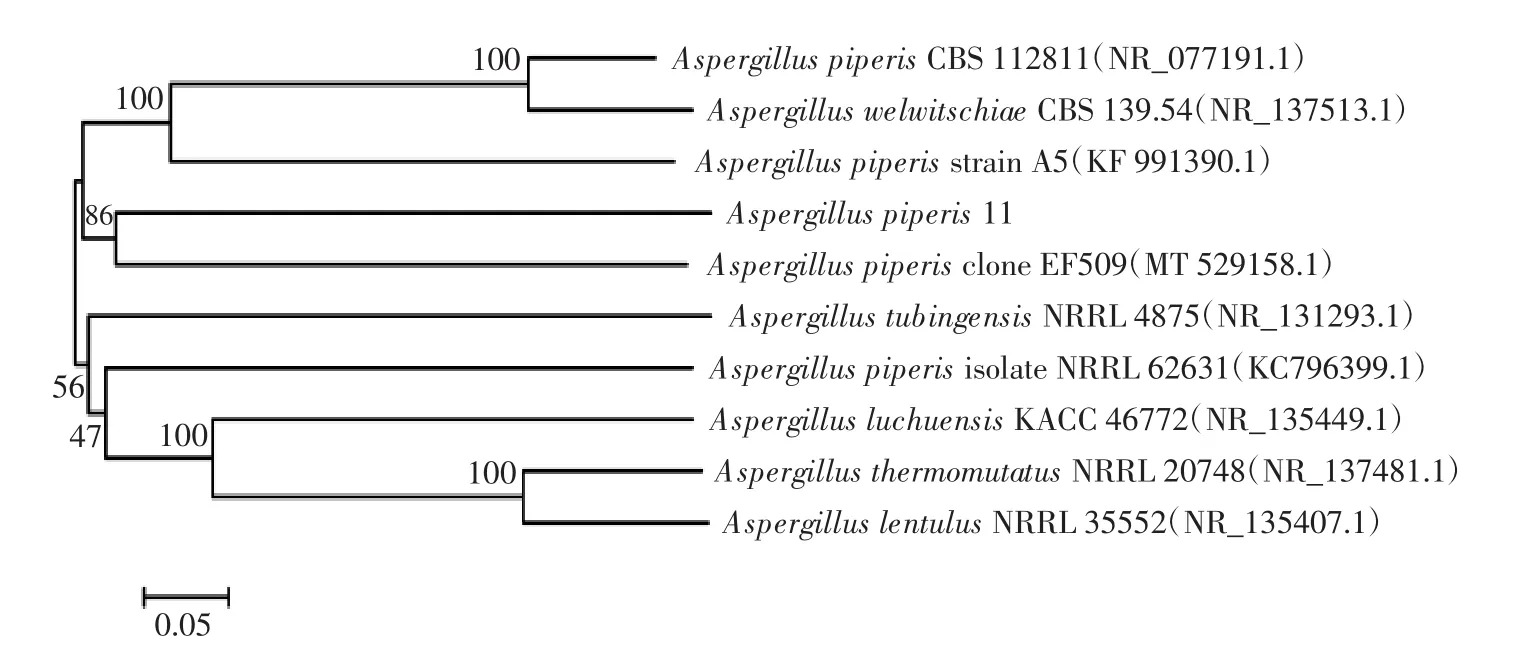
圖6 曲霉11的進化樹分析結果Fig.6 Phylogenetic tree of strain 11 based on ITS DNA sequences
由圖6可知,該菌株的ITS序列與Aspergillus piperis的基因序列同源性最高,為100%。結合該菌株的形態(tài)學特征和分子學鑒定結果,可初步判定該菌株為曲霉屬。
2.3 曲霉11生長曲線
曲霉11的生長曲線見圖7。
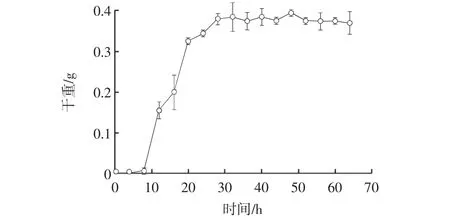
圖7 曲霉11的生長曲線Fig.7 The growth curve of Strain 11
如圖7所示,8 h~32 h為此菌株的對數生長期,選擇生長到第32小時的菌液做為種子轉接于發(fā)酵培養(yǎng)基。
2.4 曲霉11發(fā)酵條件與產GlcN含量的關系
發(fā)酵條件對曲霉11產氨基葡萄糖的影響見圖8。
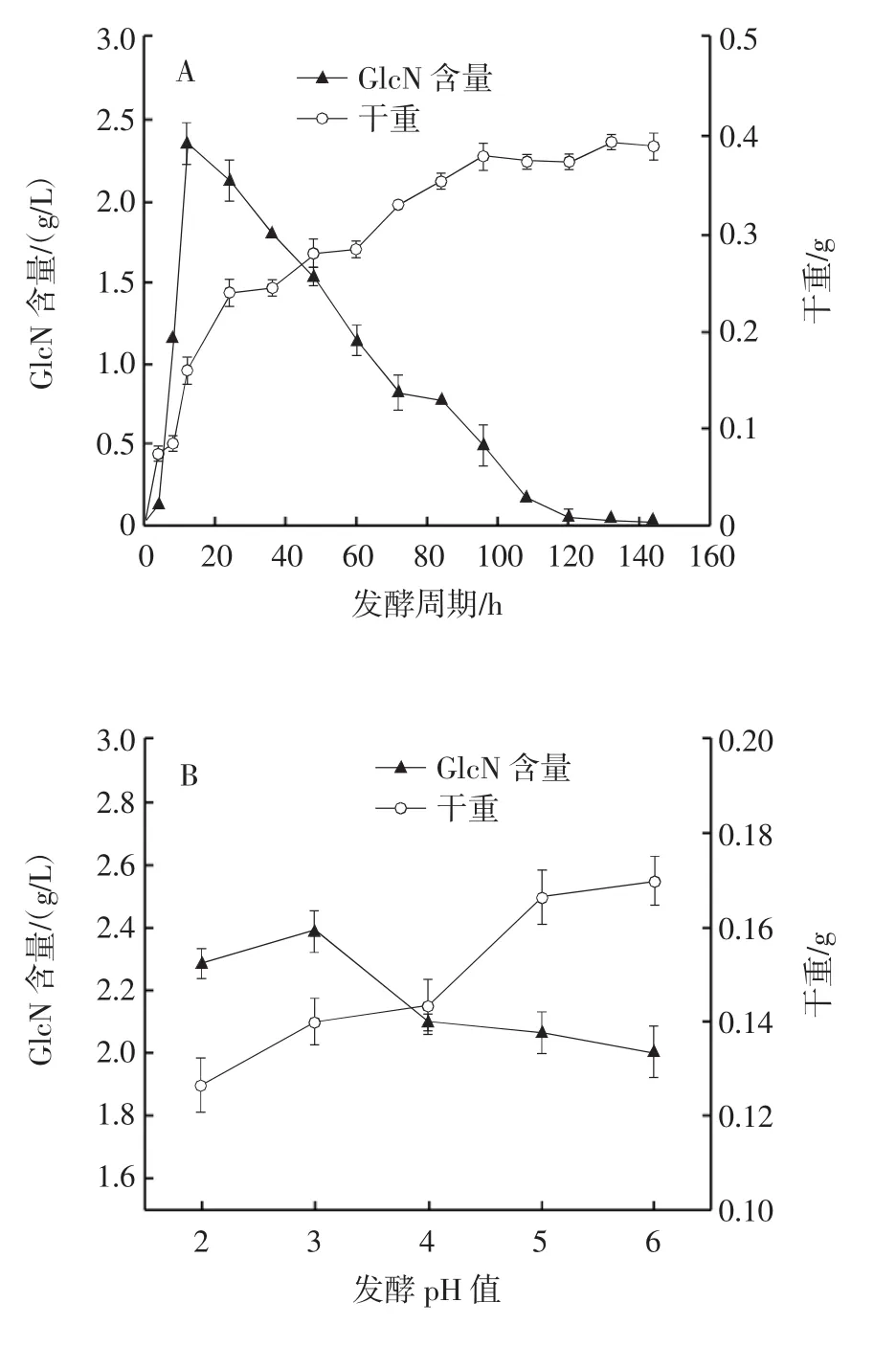
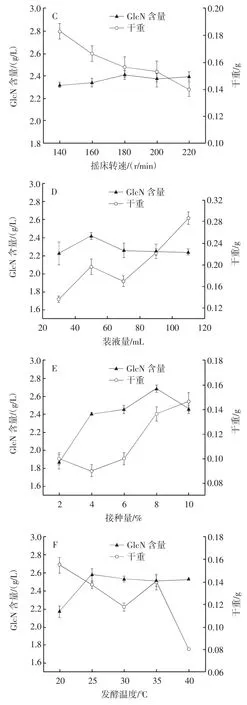
圖8 發(fā)酵條件對曲霉11產氨基葡萄糖的影響Fig.8 Effect of fermentation conditions on producing glucosamine by Aspergillus 11
由圖8A可知,發(fā)酵0~12 h時曲霉11發(fā)酵液中GlcN的含量急速增長,發(fā)酵12 h后GlcN含量迅速減少直至發(fā)酵72 h速度減緩。曲霉11的干重從8 h開始增長,到24 h后增長速度減緩直至96 h進入平穩(wěn)期。發(fā)酵過程中測得12 h時發(fā)酵液中GlcN含量最高,為2.362 g/L,此時干重為0.16 g,在此基礎上進一步優(yōu)化其他發(fā)酵條件。由圖8B、圖8C、圖8D、圖8E、圖8F可知,隨著發(fā)酵pH值、搖床轉速、裝液量、接種量、發(fā)酵溫度的增加,發(fā)酵液中GlcN的含量都先增后減,其中接種量對GlcN含量影響最明顯,搖床轉速幾乎無明顯影響,其他條件對GlcN含量影響較小。在優(yōu)化過程中,裝液量與發(fā)酵溫度對干重的影響比發(fā)酵pH值和搖床轉速對干重的影響要大。最終確定在發(fā)酵時間12 h、發(fā)酵 pH3.0、搖床轉速 180 r/min、裝液量 50 mL(250 mL)、發(fā)酵溫度25℃、接種量8%時,發(fā)酵液中GlcN的含量最高為2.687 g/L,干重為0.134 g。
發(fā)酵初期GlcN的大量合成導致干重的迅速增加,隨著發(fā)酵時間的延長、干重的增加,發(fā)酵液中GlcN含量逐漸下降。發(fā)酵pH值過低會影響菌株的生長狀態(tài)以及物質合成速度,當發(fā)酵pH值逐漸適于菌株生長時,菌株的干重會逐漸增大,合成的GlcN會大量應用于菌體生長。所以隨著發(fā)酵pH值的增加,發(fā)酵液中GlcN含量逐漸減少而干重增加。高轉速產生的剪切力、傳質速度、溶氧度和高溫等條件都會影響菌體的生長狀態(tài)以及代謝產物的合成與積累,甚至會導致菌體自溶,因此搖床轉速、裝液量以及發(fā)酵溫度會明顯影響干重,但幾乎不影響GlcN含量。干重與GlcN含量隨著接種量的增大而明顯增大,但接種量過大會導致GlcN含量的減少且干重增長速度減緩。
3 結論與展望
本文通過茚三酮顯色初篩以及Elson-Morgon、液質聯(lián)用的復篩試驗從土壤中分離篩選得到一株胞外產GlcN量為1.537g/L的曲霉11,對該菌株進行形態(tài)學觀察以及分子學鑒定,將其鑒定為Aspergillus piperis。通過測定曲霉11的生長曲線以及優(yōu)化曲霉11的發(fā)酵條件,最終使得曲霉11在發(fā)酵時間12 h、發(fā)酵pH3.0、搖床轉速180 r/min、發(fā)酵溫度25℃、接種量8%的條件下GlcN產量為2.687 g/L,是優(yōu)化前的1.75倍。
在曲霉11發(fā)酵初期,細胞內大量合成積累GlcN以用于曲霉11干重的增長,干重的增長相對于GlcN含量的增長具有滯后性而且干重的增長會導致GlcN胞外含量的減少。條件優(yōu)化時,發(fā)現(xiàn)在不利于菌體生長的條件(發(fā)酵pH值過低、發(fā)酵溫度較高)下,菌體的干重雖然較少但胞外GlcN含量并未減少。因此猜想胞外GlcN含量在不利于菌體生長的條件下也會有所提高。
本文根據黑曲霉產檸檬酸發(fā)酵早期的發(fā)酵液中存在GlcN這一現(xiàn)象,通過菌種篩選及GlcN的定量、定性試驗,實現(xiàn)了絲狀真菌胞外提取GlcN并通過發(fā)酵條件優(yōu)化提高了胞外GlcN產量。在優(yōu)化過程中提出了胞外GlcN含量會在不利于菌體生長的條件下有所提高這一新想法,因此后續(xù)可從GlcN合成途徑的強化、GlcN合成途徑支路的抑制、抑制細胞壁合成等不利于菌體生長的條件下進一步提高胞外GlcN的產量。

