MYB轉錄因子調控植物花青素生物合成研究進展
梁玉鐲, 陳新娜, 陳東亮, 王 森, 李彥慧, 黃叢林
(1.河北農業大學園林與旅游學院,河北保定 071000; 2.北京市農林科學院草業花卉與景觀生態研究所,北京 100097;3.北京市功能花卉工程技術研究中心,北京 100097)
花青素是一種類黃酮類水溶性天然色素,是植物呈現紅色、紫色及藍色等色彩的主要呈色色素[1-2]。除此之外,花青素還廣泛參與了植物抵御鹽[3]、干旱[4-5]、低溫[6-7]等非生物脅迫以及火疫病病菌(Erwiniaamylovora)[8]、黃萎病病菌(Verticilliumdahliae)[9]、蟲害[10]等生物脅迫的抗逆反應,因此花青素對于植物而言具有重要的生物學意義。對人而言,花青素也具有很高的利用價值,有抗氧化、增強血管彈性、預防癌癥、提高視力等多種功效,因此,植物花青素被廣泛用作醫藥、保健品、食品添加劑等。
目前,人們對植物花青素的生物合成途徑已經研究得比較清楚,涉及許多結構基因的表達,而這些基因又在不同層面受到不同基因的表達調控[11]。MYB是植物中最大的轉錄因子家族之一,廣泛參與植物的細胞形態建成、次生代謝物生物合成、分生組織形成、抵御生物及非生物脅迫等眾多生理生化進程[12]。大量研究發現,MYB類轉錄因子在植物花青素代謝中發揮著非常重要的調控作用,是目前已知的花青素生物合成途徑中最重要的調控因子。本文主要概述了植物花青素生物合成途徑,并對參與花青素生物合成途徑調控的MYB種類及其調控方式等進行了綜述,以期為進一步闡述植物花青素生物合成調控及花色形成機制奠定基礎。
1 植物花青素的生物合成
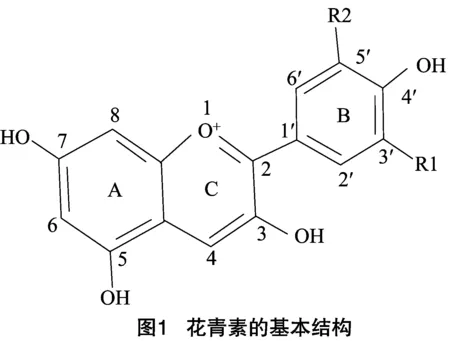
花青素是許多植物中最主要的呈色色素。目前已知的植物花青素有500多種,其基本結構由2個苯環(A—與B—)組成,并通過1個三碳的單位連接形成碳骨架C6—C3—C6(圖1)。自然界中天然的花青素主要包括天竺葵色素(pelargonidin)、矢車菊色素(cyanidin)和飛燕草色素(delphindin)三大類[13],這3種色素又經過糖基化、甲基化、酰基化等修飾,進一步形成各種結構更加穩定、顏色更加豐富的花色素苷。植物細胞中花色素苷的種類及含量共同決定了其呈現的顏色。
1.1 花青素的生物合成途徑
植物中花青素的生物合成通路已經被研究得比較清楚[14-15],主要分為3個階段(圖2)[16-20]。第1階段開始于苯丙氨酸,通過苯丙氨酸解氨酶(phenyl alanine ammonialyase,PAL)催化產生肉桂酸,再經肉桂酸羥化酶(cinnamic 4-hydroxy-lase,C4H)生成香豆酸,最后在4-香豆酰CoA連接酶(4-coumarate coenzyme A ligase,4CL)的作用下,香豆酸轉變為4-香豆酰-CoA,該階段是大多數次生代謝所共有的。第2階段是類黃酮代謝的重要反應,丙二酰-CoA和第1階段的產物4-香豆酰-CoA通過查爾酮合成酶(chalcone synthase,CHS)作用產生查爾酮,再經查爾酮異構酶(chalcone isomerase,CHI)的催化合成黃酮醇槲皮素(naringenin),然后黃烷酮-3-羥化酶(flavanon 3-hydroxylase,F3H)催化合成二氫黃酮醇(dihydrokaempferol,DHK)。DHK又可進一步分別被類黃酮-3′-羥化酶(flavonoid 3′-hydroxylase,F3′H)、類黃酮-3′,5′-羥化酶(flavonoid 3′5′-hydroxylase,F3′5′H)催化生成二氫槲皮素(dihydroquercetin,DHQ)、二氫楊梅素(dihydromyricetin,DHM)。在第3階段,DHK、DHM及DHQ在二氫黃酮醇4-還原酶(dihydroflavonol 4-reductase,DFR)、花青素合成酶(anthocyanidin aynthase,ANS)的依次催化下,分別形成天竺葵色素、飛燕草色素及矢車菊色素。然后在糖基轉移酶的作用下,形成天竺葵色素苷、飛燕草色素苷及矢車菊色素苷。矢車菊色素苷、飛燕草色素苷又經過不同程度的甲氧基化,進一步形成芍藥色素苷(peonidin)、矮牽牛色素苷(petunidin)和錦葵色素苷(malvidin)。自然界中游離的花青素并不穩定,需要經過糖基化、甲基化、酰基化等修飾形成各種花色素苷,才能穩定存在,同時使其具有更加豐富的顏色。
1.2 花青素合成途徑中的結構基因
目前,植物花青素生物合成的主要結構基因都已經被分離鑒定[14,17-18],其生物學功能也比較清楚[19]。CHS、CHI都是花青素合成途徑上游的關鍵酶,CHS催化查爾酮的形成,處于初生代謝和次生代謝的連接處,而CHI是查爾酮轉變為黃烷酮的關鍵酶,最早從法國豌豆(PisumsativumL.)中克隆獲得[20]。大量研究發現,CHS、CHI基因的表達水平與花青素含量呈正相關。例如,在擬南芥(ArabidopsisthalianaL.)tt4、tt5突變體中分別導入玉米(ZeamaysL.)CHS(C2)、CHI(CHI1)基因后,發現擬南芥突變體中花青素含量都顯著提高[21]。將小蒼蘭(Freesiahybrida)CHS1基因導入白花矮牽牛(Petuniahybrida)中,可以促進矮牽牛中花青素的合成,花色由白色轉變為粉色[22];而通過反義手段抑制CHS的表達會阻礙花青素的合成,使顏色褪去而呈白色[23-24]。Lim等將洋蔥(Alliumcepa)CHI導入番茄(Lycopersiconesculentum)中發現,番茄果皮中的花青素含量增加到原來的400倍, 果肉中的花青素含量也增加了260倍[25]。

F3H是催化4,5,7-三羥基黃烷酮產生花青素合成前體物質DHK的核心酶,F3′H、F3′5′H又分別催化DHK轉變為DHM、DHQ。DHK、DHQ、DHM則進一步在DFR、ANS等酶的催化下形成不同的花青素。因此,F3′H、F3′5′H往往被認為是決定花色的關鍵基因,如果其活性缺失,可能會導致花色無法形成紅色或藍色。月季(Rosachinensis)、香石竹(DianthuscaryophyllusL.)和菊花(Chrysanthemummorifolium)由于F3′5′H活性缺失,從而不能形成飛燕草色素,使其缺少藍色或紫色花[26];相反的,飛燕草色素含量比較高的大多數飛燕草屬植物的F3′5′H活性較高,花色多呈現為藍色或紫色,但因其不含F3′H而無法形成矢車菊色素,從而造成其缺失紅色或粉色花[27]。
DFR、ANS是DHK、DHM和DHQ分別形成天竺葵色素、飛燕草色素及矢車菊色素所共同需要的酶。DFR最初是從玉米、金魚草(AntirrhinummajusL.)中克隆出來的[28],后來又相繼從油菜(BrassicacampestrisL.)[29]、馬鈴薯(SolanumtuberosumL.)[30]等其他植物中分離出來,研究者逐漸明確了其在花青素合成中的作用,即催化DHK、DHM和DHQ形成無色的原花青素。無色的原花青素進一步由ANS催化轉化為有色的花青素,這是花青素生物合成途徑的第1個有色化合物,而ANS也被視為花青素合成途徑末端的核心酶。目前研究者已經從紫蘇(PerillafrutescensL.)[31]、桑椹(Fructusmori)[32]、夏堇(Toreniafournieri)[33]等多種植物中分離出了ANS類基因,它門對植物果實、葉片、花等顯現豐富顏色具有重要作用。研究發現,ANS僅在金鐘連翹(Forsythiaintermedia)的萼片中表達,在花瓣和花藥中不表達,使得花瓣中未產生花青素[34],而當龍膽(Gentianascabra)中ANS基因發生突變時,其花色褪變為白色[35]。
花青素雖然顯現出顏色,但是并不穩定。花青素形成后會進一步經過糖基化、甲基化、酰基化等修飾,形成結構更加穩定、顏色更加豐富的花色素苷。糖基化是花青素修飾中最常見的方式,可以增強花青素的穩定性與水溶性[36-37]。大部分植物花青素合成后的第1步是C3位經花青素3-O-葡萄糖基轉移酶(3GT)的催化進行糖基化[38],此外,一些植物的C5位、C7位也存在糖基化修飾,但一般C3位的糖基化優先于C5位的糖基化發生[39]。花青素分子上的羥基或糖苷基上的羧基又可以通過芳香酸或脂肪酸的作用發生酰基化,所以一般認為花青素酰基化修飾晚于糖基化修飾。酰基化修飾可以進一步增強花青素的水溶性,使花青素保持原有的顏色。此外,當發生芳香族酰基化修飾時,還會改變花青素的吸收波長,使其呈色向藍色增加的方向移動[40-41]。甲基化修飾可以穩定花青素的B環結構,通常發生在花色素分子的C3′、C5′位羥基上[41],由于花色素分子C3′、C5′位上的羥基被甲氧基替換,發生甲氧基化,可使花青素顯現紅色。通常甲基化修飾發生在糖基化修飾之后、酰基化修飾之前,但擬南芥中因為只有F3′H,使其只能合成矢車菊色素,所以不存在甲基化修飾。
2 植物花青素生物合成途徑中MYB的調控作用
花青素合成結構基因以直接參與的方式調控花青素的形成,而其表達又受到轉錄水平中轉錄因子的調控,大量研究發現,MYB轉錄因子是植物花青素合成結構基因中最重要的調控因子。MYB是高等植物中數量較大的基因家族之一[42],已在多種植物中被分離鑒定[43-44]。MYB轉錄因子含有2個保守區域,分別是N端的DNA結合結構域和C端的調控區域。N端的DNA結合結構域由不完整的重復片段R1、R2和R3(每個R序列由大約51~53個氨基酸組成)組成[45],根據結合域所包含的R片段的數量,MYB轉錄因子家族被分為R1-MYB、R2R3-MYB、R3-MYB和R4-MYB 4個亞家族[46]。R1-MYB類轉錄因子在植物對逆境的響應中發揮了重要作用[47-49],并且研究發現,R1-MYB類轉錄因子CCA1與擬南芥光信號傳導有關[48]。擬南芥、水稻(OryzasativaL.)等大部分植物中均含有5個R3-MYB轉錄因子[49-50],該蛋白主要廣泛參與植物細胞調控和細胞分化過程[51-52]。R4-MYB蛋白的含量較少,一般在植物中不含有或僅含有1個[53-55],目前對該蛋白的研究比較缺乏。
R2R3-MYB轉錄因子在MYB家族中的占比最高,有研究發現,在擬南芥已報道的近200個MYB轉錄因子中,R2R3-MYB類就有126個[53-54];在已報道的水稻近200個MYB中,R2R3-MYB 有109個[53],這類蛋白在N端含有2個MYB結構域(R2、R3),并廣泛參與植物次生代謝物的合成,應對各種脅迫的抗逆反應等過程[55]。R2R3-MYB類轉錄因子是目前已知的花青素生物合成途徑中最重要的調控因子,它通過調控花青素生物合成結構基因的表達,決定著花青素的種類及含量,最終影響花、果及葉片等的顏色。依據 R2R3-MYB 蛋白氨基酸序列的不同保守性,R2R3-MYB 家族又進一步被劃分為25個亞族[56],并且部分亞族已被證明與花青素生物合成密切相關。例如在模式植物擬南芥中,第5亞族AtMYB123參與了擬南芥種皮中原花青素的積累[57],第6亞族AtMYB75、AtMYB90、AtMYB113和AtMYB114調控著營養組織中花青素的合成[58],而第7亞族AtMYB11、AtMYB12和AtMYB111對擬南芥各器官中花青素的合成都有調控作用[59]。此外,第4亞族的大多數成員為擬南芥花青素合成途徑中的負調控因子[60]。
2.1 MYB正向調控花青素的合成
大部分參與花青素生物合成調控的MYB轉錄因子屬于R2R3-MYB類,并且大部分MYB對于花青素的生物合成起到促進作用。最早被報道的參與花青素合成調控的MYB類轉錄因子是調控玉米糊粉層的ZmC1,之后研究者又從玉米中分離出ZmC1的同源基因ZmPI,該基因在玉米的其他器官中調控著花青素的合成[61]。MYB轉錄因子是通過調節花青素合成途徑中結構基因的表達進而發揮作用的,幾乎所有植物器官中的花青素都受到MYB轉錄因子的正調控。番茄中AN1的過量表達會導致結構基因CHS、CHI與DFR的表達量上調,致使番茄果實中的花青素大量積累[62],而轉錄因子Rosea1會促進金魚草花瓣中結構基因F3H、DFR、ANS和UFGT的表達[63]。紫甘藍(BrassicaoleraceaL.)BoMYB2和紫色花椰菜(BrassicaoleraceaL.)Pr通過激活下游結構基因DFR、ANS與UFGT的表達量上調,決定著其葉片的著色[64-65],而甘薯(Ipomoeabatatas)塊莖中花青素的積累是通過IbMYB1調控CHS、CHI、F3H、DFR、ANS和UFGT的表達而獲得的[66]。
有研究發現,轉錄因子MYB在花青素合成調控中發揮作用時具有一定的組織特異性,在不同器官中發揮主導作用的MYB可能不同。紅色蝴蝶蘭(Phalaenopsisaphrodite)中3個R2R3-MYB轉錄因子PaMYB2、PaMYB11、PaMYB12分別正向調控花萼/花瓣、花萼/花瓣上的斑點及脈絡中花青素的積累[67]。MdMYB1、MdMYBA、MdMYB10與MYB110a是調控蘋果(Malusdomestica)各組織中花青素合成的關鍵正調控因子,其中MdMYB1、MdMYBA主要參與果皮中花青素的合成,而果實、葉片中的花青素合成受到MdMYB10的調控,果實外皮層組織中花青素的合成則與MYB110a的表達有關[68-69]。此外,研究者還從薔薇科(Rosaceae)其他植物中獲得MdMYB10的同源基因,如桃(Prunuspersica)的PpMYB10基因[70]、甜櫻桃(Prunusavium)的PavMYB10基因[71]、歐洲李(PrunusdomesticaL.)的PdmMYB10基因[72]、櫻桃李(Prunuscerasifera)的PcfMYB10基因[72]及梨(Pyrussorotina)的PyMYB10基因[73]等,這些MdMYB10的同源基因均通過誘導下游基因DFR的表達進而正調控果實中花青素的合成,推測MYB10可能是薔薇科植物果實呈色的關鍵調控因子。
MYB通過調節花青素合成結構基因的表達而發揮作用,但是不同MYB所調控的結構基因存在差異。如AtMYB11、AtMYB12和AtMYB111在擬南芥各組織花青素合成通路中調控結構基因CHS、CHI和F3H的表達,而DFR、ANS等結構基因的表達量則與PAP1、PAP2、AtMYB113和AtMYB114的表達量呈正相關[64-65]。在擬南芥種子中過量表達PAP1基因發現,DFR表達量大大增加,而CHS表達量卻沒有變化,表明PAP1主要調控花青素合成下游結構基因的表達[74],進而提高花青素含量,相似的情況也發生在玫瑰(Rosarugosa)[75]、油菜[76]中。
2.2 MYB負向調控花青素的合成
部分R2R3-MYB對于花青素的合成具有抑制作用,其特征是在蛋白羧基端存在1個阻遏結構域,會抑制花青素合成相關基因的轉錄,進而負調控花青素的合成。擬南芥R2R3-MYB第4亞族的AtMYB3、AtMYB4、AtMYB7及AtMYB32這4個成員均在花青素生物合成中發揮著負調控作用[66]。FaMYB1是草莓(Fragariaananassa)中已知的唯一的轉錄抑制因子,在煙草(NicotianatabacumL.)中過量表達FaMYB1會抑制花青素合成途徑中結構基因ANS、UFGT的表達[77],從而降低花瓣中花青素的含量。而金魚草中轉錄負調控因子AmMYB308是通過抑制花青素上游結構基因C4H的表達進而控制花青素的積累[78]。蘋果中MdMYB16、MdMYB17、MdMYB111和油桃(Prunuspersica)中PpMYB16、PpMYB111是高度同源的R2R3-MYB類轉錄因子,對花青素表現出明顯的抑制作用[70,79]。除此之外,在葡萄(VitisviniferaL.)[80]、藍莓(VacciniumuliginosumL.)[81]、楊樹(PopulusL.)[82]、苦蕎(FagopyrumtataricumL.)[83]等植物中也都發現了抑制花青素合成的R2R3-MYB轉錄因子。
除R2R3-MYB外,R3-MYB類蛋白也對花青素的合成起著抑制作用。與R2R3-MYB的抑制機制不同,R3-MYB主要通過與R2R3-MYB競爭MBW復合體,從而抑制R2R3-MYB對花青素合成的促進作用。比如,擬南芥中的R3-MYB轉錄因子CPC通過與花青素正調控因子PAP1/2競爭結合蛋白,從而抑制花青素結構基因DFR等的表達[84],TRY、ETC1對擬南芥中花青素的合成具有類似的抑制效應[85];番茄SlMYB3轉錄因子可以負向干擾MBW的形成,從而影響花青素合成[86]。蝴蝶蘭、百合(Liliumspp.)等花卉中也存在類似的花青素負調控因子[87-88]。
有研究發現,一些MYB轉錄因子發生突變也可能抑制花青素合成途徑。玉米中轉錄抑制因子ZmC1-I是由激活花青素合成的轉錄因子ZmC1發生突變而形成的,因ZmC1-I的轉錄激活區不完整,從而抑制花青素的積累[89]。有些MYB抑制因子還可以通過與激活因子競爭結合靶基因從而抑制花青素的合成。例如,擬南芥中轉錄負調控因子ICX1、PAP1等激活因子競爭結合CHS的啟動子序列,進而導致結構基因的表達受到抑制[90]。
除上述植物外,海棠(Maluschaenomeles)[91]、菊花[92]和萵苣(LactucasativaL.)[93]等植物中也存在對花青素合成途徑起負調控作用的轉錄因子。然而有趣的是,MYB在植物花青素合成過程中的作用并不是單一不變的,轉錄因子VcMYB-PA1對藍莓生長前期花青素的合成具有促進作用,而在果實成熟期卻會抑制花青素的積累[94],這也說明植物花青素生物合成及其調控網絡的復雜性。
2.3 MBW復合體調控花青素的合成
MYB、bHLH和WD40可以形成MBW三元復合體,調控植物花青素生物合成的機制存在于許多植物中,是許多植物花青素生物合成途徑中已知的重要的調控方式。苜蓿(Medicagotruncatula)中MYB蛋白MtPAR或者MtAP1與bHLH蛋白MtTT8和WD40蛋白MtWD40-1可以形成MBW復合體,從而激活下游結構基因ANS的表達[95],促進花青素合成。玉米ZmP1蛋白是通過與WD40類蛋白ZmPAC形成二元復合體來調節花青素苷合成結構基因DFR的表達[96],而ZmC1蛋白激活DFR的表達除需要ZmPAC外,還需要1個bHLH類蛋白ZmR或ZmB組成三元復合物[97],且三元復合物相比二元復合物多了1個激活UFGT表達的功能。研究發現,從紫粒小麥品種高原115(TriticumaestivumL.)中分離的R2R3-MYB轉錄因子TaMYB3-4A[98]、TaMYB3-4D[99]與ZmR共同在白色小麥胚芽瞬時表達時均能誘導花青素的合成,單獨表達時則不能發揮功能。不同的是,TaMYB3-4D只在高原115的胚芽鞘和種皮大量積累,而TaMYB3-4A同時還在莖、葉片等其他組織中進行表達。
大多數植物是通過形成三元復合體調控花青素合成途徑的,但組成復合物的3種轉錄因子以及復合物所調節的結構基因都是不確定的。擬南芥MYB轉錄因子TT2、PAP1或PAP2都需要與bHLH 轉錄因子TT8、EGL3和WD40轉錄因子TTG1結合形成三元復合體,從而促進花青素的合成,其中PAP1/PAP2-TT8-TTG1復合體調控花青素合成基因CHS和DFR的表達[100],而TT2-TT8-TTG1組成的復合體能夠與BAN啟動子結合,進而激活擬南芥種皮中花青素合成相關基因BAN的轉錄。此外,TT2、TT8共表達時也可以與BAN啟動子結合,但是復合物的活性與TTG1的表達有關[101]。在煙草中也發現三元復合物MrMYB1-MrbHLH1-MrWD40-1的表達比二元復合物MrMYB1-MrbHLH1更能顯著提高花青素的含量[102]。有研究發現,WD40本身不具有催化作用,但它可以介導MYB與bHLH之間的互作,增強MBW復合體的穩定性和活性[103]。
MBW復合體在花青素合成途徑中大部分具有轉錄激活功能,少數會抑制花青素合成基因的轉錄表達。甜櫻桃[104]、蘋果[77]中的MYB轉錄因子MYB10、MYB10.1均可以分別與bHLH轉錄因子bHLH3或bHLH33相互作用,從而參與花青素的合成,但僅存在PaMYB10-PabHLH33二元復合體時會抑制甜櫻桃花青素合成,其他復合體均可以誘導花青素合成下游結構基因的表達。此外,矮牽牛PhMYB27與bHLH轉錄因子AN1共表達時,也會抑制矮牽牛中花青素的積累[105]。
3 MYB及MBW上游調控因子
近年來的大量研究發現,花青素合成調控轉錄因子MYB及MBW復合體的形成受到MicroRNA(miRNA)以及RNA(siRNA)的調控。例如,miR858特異識別部分MYB轉錄因子基因,通過在轉錄后水平負調控其基因表達,從而調控花青素的生物合成[106],柿(Diospyroskaki)中miR858通過抑制靶基因DkMYB19或DkMYB20的表達進而抑制花青素的積累[107]。miR828也可以抑制PAP1、PAP2和MYB113等MYB類轉錄因子的表達,從而減少花青素的積累。然而有趣的是,PAP1/MYB75反過來又可以激活miR828的表達,miR828通過剪切TAS4產生更多siRNA,進而增強了對其靶基因的控制[100,108-109]。除此之外,其他miRNA也通過其靶基因間接參與對花青素的調控,例如Gou等研究發現,擬南芥中轉錄因子SPL9是miR156的靶基因,而SPL9的表達會降低MBW復合體的穩定性,從而導致花青素合成途徑受到抑制[110],而Chiou等也發現,miR827通過控制靶基因NLA的表達來影響花青素的合成[111]。
Gasciolli 等研究發現,花青素的合成還可能與siRNAs有關[112]。沉默大麗花(DahliapinnataCav.)中siRNA介導的CHS轉錄后基因,會使花色變成純白色[113],之后對雙色矮牽牛的研究發現,雙色性狀同樣是由CHS-A轉錄后的基因沉默造成的,因為發現在花瓣的2個不同顏色組織內均可以檢測到CHS-A前體mRNA,然而白色區域卻檢測不到mRNA,但存在siRNA[114]。雖然有研究發現,miRNA、siRNA參與花青素代謝途徑轉錄后水平的調控,但相關報道還是比較缺乏。
4 展望
植物花青素合成途徑是一個極其復雜且極具變化的過程,受到一系列結構基因及各種調節因子的作用或相互作用。近年來,關于花青素合成途徑的研究已經十分清晰,但花青素合成的調控機制還需要不斷研究和探索,以明確更多植物的各個組織中花青素合成調控因子的單獨作用和互作效應,從而充分發揮基因的調控作用。除此之外,花青素合成途徑還受到環境因子溫度、光照、激素等的影響,這使得花青素合成的調控機制變得更為復雜,因此,對于花青素合成的調控機制還有待更深入的探究。花青素的研究還應聯系實際,利用轉基因、沉默基因、基因突變等技術使調控基因可以定向表達,以提高植物的觀賞價值、改良蔬菜及果實的顏色和品質,創造出更大的價值。

