礦井通風系統改造
辛 兵
礦井通風系統改造
辛 兵
對大同煤礦集團大同地煤公司馬口煤礦礦井通風系統的技術改造進行了介紹。
礦井通風;通風系統;通風系統改造
1 礦井概況
馬口煤礦木代井位于大同市左云縣店灣鎮木代村,井田面積11.177 km2,批采侏羅紀3#、7#、10#、11-1#、11-2#、12#、13-2#共7層煤。礦井開拓方式為斜井、分水平盤區式開采。一水平3#、7#層已于1999年開采完畢,二水平11-1#層于2007年10月底開采完畢,并進行了永久封閉。現開采三水平13#層煤,有一個402生產盤區及131皮帶大巷、133材料大巷、135回風大巷3條開拓大巷。礦井歷年來鑒定為低瓦斯礦井。2006年礦井通風系統改造前瓦斯等級鑒定結果為:瓦斯絕對涌出量5.47 m3/min,相對涌出量 5.30 m3/t。
2 改造前礦井通風系統
改造前礦井采用中央邊界抽出式通風,共有3個井口,即主井、副井、7#層風井。其中主、副井進風,7#層風井回風。主井傾角-16°,斷面11 m2,斜長630 m;副井傾角-18°,斷面11 m2,斜長375 m;風井傾角-22°,斷面5.7 m2,斜長226 m。通風系統改造前礦井開采二水平11-1#層及三水平13#層,且全部集中在井田西翼開采,并通過一回風暗斜井與東翼7#層總回風巷連通進行回風(7#層只保留回風系統)。7#風井安裝2臺沈陽通風機廠生產的2K60-4-No18型軸流式主扇,1985年投入使用,1臺運行,1臺備用,電機功率均為180 kW,轉速734 r/min,反風方式為風機反轉反風。其中1#主扇于1997年7月經沈陽廠家技術改造,風葉角度40°,排風量為2 800 m3/min左右;2#主扇未改造,風葉角度25°,排風量為1 900 m3/min左右。
礦井通風系統改造前11-1#層共有15、16兩個生產盤區,每個盤區各布置1個刀柱炮采面,分別為15801回采、16806回采(11-1#層所有掘進工程已全部施工完畢,無掘進工作面);13#層則全部布置為掘進工程,有402一個生產盤區和131皮帶大巷、133材料大巷、135回風大巷3條開拓大巷。402盤區共布置 5個掘進工作面,分別為 402、402-1、402-2三條盤區巷掘進面和2201、5201兩條順槽巷掘進面。11-1#層所有開拓、盤區巷道均為雙巷布置,軌道巷進風,皮帶巷回風,無專用回風巷。由于11-1#層現采盤區巷道及開拓大巷兩側均已形成部分采空區(已回采完畢),故無法補掘回風巷,但新開拓的13#煤層均按三巷布置,有專用回風巷 (見圖1)。
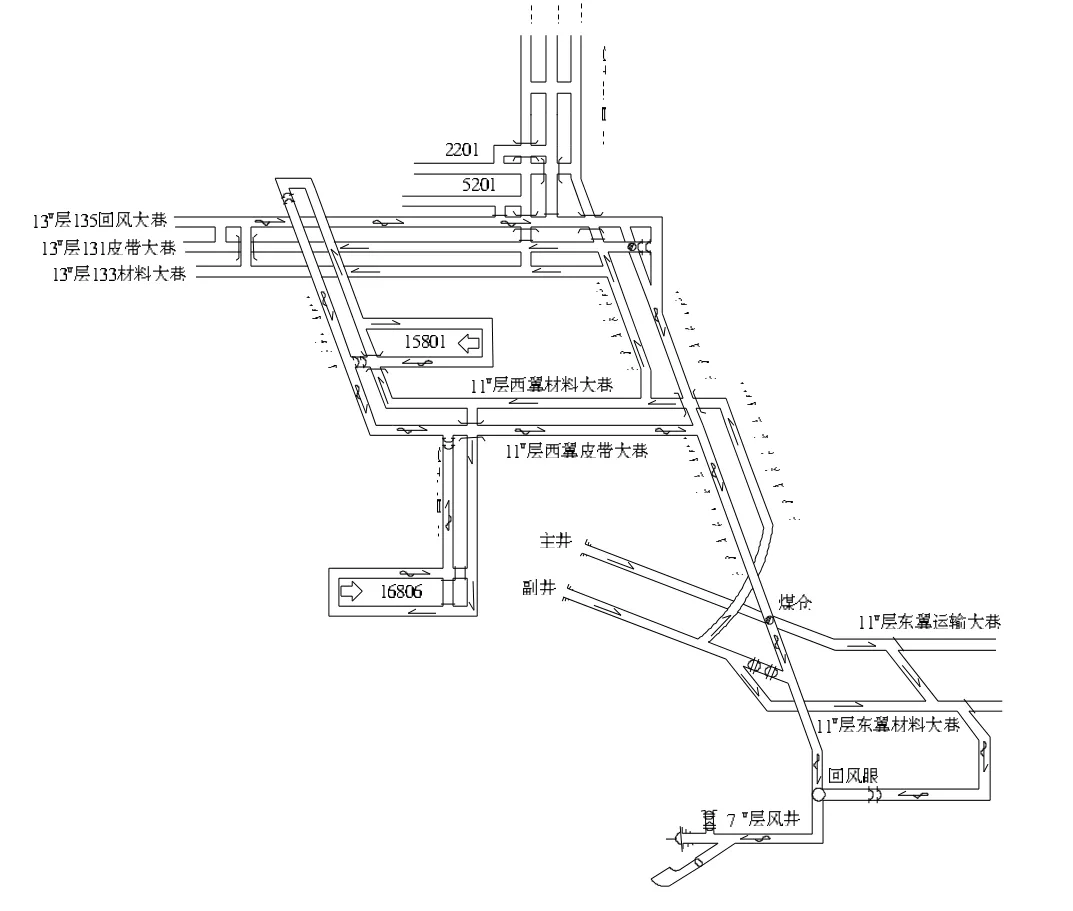
圖1 改造前礦井通風系統示意
3 改造前通風系統存在的問題
①礦井在開采11-1#和13#煤層時一直無水平獨立回風井,仍沿用東翼一水平7#層風井進行回風,通風路線長,通風阻力大(最大通風流程達7 km)。更為嚴重的是7#風井及7#層總回風大巷受南部已關閉的原左云縣店灣村1#井的火區威脅,2004年12月曾發生風井回風流中CO嚴重超限事故,后雖經1個半月的加固密閉、堵漏治理工作,使CO涌出得到了有效控制,但對火區未進行徹底治理,一旦發生火區氣體爆炸,將嚴重威脅木代井全礦井的安全。
②礦井生產主要集中在井田西翼。西翼11-1#層所有開拓、盤區巷道均為雙巷布置,為軌道巷進風,皮帶運輸巷回風,且無專用回風巷,而在皮帶回風巷設置調風設施難以合理有效地調控風量,致使各工作面配風比較困難,礦井通風系統不合理。
③由于礦井采掘嚴重失調,接替緊張,采掘工作面布署較多,而礦井主通風能力嚴重不足,存在超通風能力生產現象,嚴重影響著木代井的安全生產及正常采掘接替(礦井通風系統改造前,曾被迫將13#層402整個盤區停產封閉)。
④7#風井2臺主扇通風能力不匹配。由于2臺主扇通風能力不匹配,在日常生產工作中,木代井7#風井基本上一直運轉排風量較大的1#主扇,而2#主扇很少運轉,2臺主扇不能按期進行倒運行和檢修。
4 通風系統改造方案
由于木代井整個礦井通風系統存在著諸多不安全隱患,嚴重影響著礦井的安全生產,因此需盡快改造礦井通風系統。
2005年5月7日大同煤礦集團公司召開了關于對馬口煤礦木代井通風系統改造的專題會議,研究決定了礦井通風系統改造方案:從木代井11-1#層15盤區巷向北掘進,與東周窯二號井對掘貫通總回風大巷,將來利用東周窯二號井風井 (以下簡稱東二風井)作為木代井的回風井,徹底甩掉現使用的7#風井。預計共需掘進半煤巖巷道約950 m,斷面10 m2,并在東二風井口重新施工回風硐(原回風硐斷面小),新安裝2臺FBDCZNo20型對旋式主扇。
5 通風系統改造
2005年6月,馬口煤礦木代井開始從11-1#層15盤區軌道巷向北沿11-1#煤層掘進,與此同時,東周窯二號井開始沿11-1#煤層向南進行掘進,兩礦井于2005年12月19日順利實現對掘貫通木代井西翼總回風大巷。2006年3月至7月期間,先后完成了西翼總回風大巷噴漿、施工東二風井回風硐及安裝2臺FBDCZNo20型對旋軸流式主扇等工程;同時馬口煤礦做好木代井礦井通風系統調整改造的準備工作后,于7月31日新主扇投入運行。東二風井新主扇投入運行后,根據當時風量需求,將原7#層風井1#主扇轉速由734 r/min調小為435 r/min(采用變頻調控),排風量降為1 030 m3/min,負壓由原來的1 250 Pa降為530 Pa。
東二風井新主扇投入運行后,當時葉片角度為43°/35°,風井回風量為3 358 m3/min,主扇排風量為3 603 m3/min,負壓3 100 Pa,超出2 000 Pa的規定值。此時東二風井主扇通風能力仍不能滿足木代井西翼所有采掘工作面的所需風量,如靠繼續調大東二風井主扇葉片角度來增大風量,則主扇通風負壓會更高,主扇甚至會發生“喘振”現象,且增風效果不明顯。其主要原因是木代井井下部分進、回風大巷巷道斷面小,特別是11-1#層大部分巷道斷面小,存在超風速現象;其次是13#層通風路線長,因風流由11-1#層通過暗斜井進入13#層后再折返回11-1#層,然后回至東二風井,導致礦井通風阻力大,新主扇處于高負壓運行狀態,主扇每月電費消耗約9.1萬元 (見圖2)。
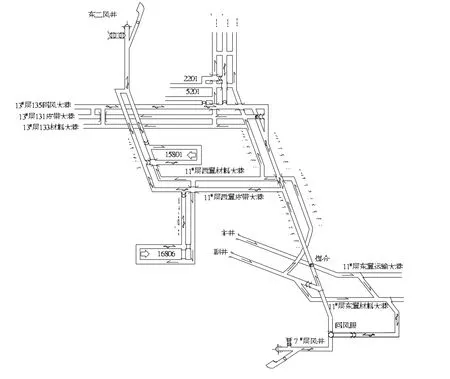
圖2 改造后礦井通風系統示意
為了解決木代井礦井通風阻力大、新主扇高負壓運行的問題,馬口煤礦又實施了通風降阻工程,一是從13#層135回風大巷至11-1#層15盤區軌道巷之間補掘了一回風暗斜井(斜長59 m,傾角25°),于2006年9月22日貫通,貫通后對木代井礦井通風系統又進行了重新調整。二是從11-1#層東翼向西翼補掘了西翼輔助運輸大巷(長度450 m,為進風巷),于11月5日實現貫通。貫通后降低了副井井底車場至西翼11-1#層之間的皮帶暗斜井和軌道暗斜井的風速,使巷道超風速的問題得到解決。之后于11月15日停轉了東翼7#層風井主扇,并對7#層總回風大巷及回風井筒進行了永久隔離封閉(見圖3)。
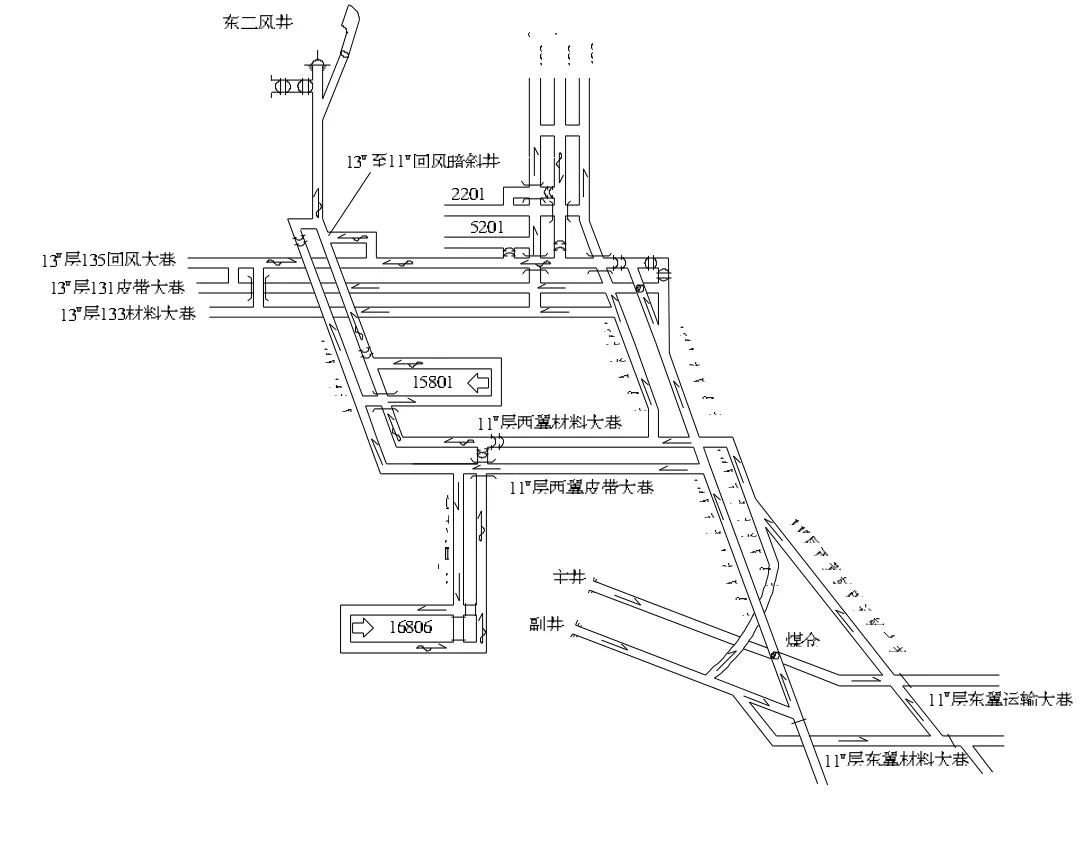
圖3 降阻后礦井通風示意
6 改造后的技術經濟效果分析
①礦井通風系統改造后,徹底甩掉了原使用的7#風井,避免了小窯火區威脅,使影響木代井安全生產的這一重大隱患得到排除。
②礦井通風系統改造后,使13#層通風路線大大縮短,礦井通風阻力降低,東二風井回風量增至4 478 m3/min,主扇排風量為4 612 m3/min,負壓降為1 950 Pa,達到了良好的降阻增風效果。由于礦井風量增加,使得13#層402盤區啟封恢復了生產,每月原煤產量可增加約1.6萬t。
③礦井通風系統改造后,所有區域均改為皮帶巷進風,11-1#層為軌道巷回風,13#層為專回巷回風,使礦井通風系統趨于合理。
④礦井通風系統改造后,東二風井新安裝的2臺FBDCZNo20型對旋軸流式主扇,1臺運行,1臺備用,電機功率均為185×2 kW,轉速960 r/min,風壓1 950 Pa,排風量4 612 m3/min,反風方式為風機反轉反風,2臺主扇通風能力相同,能夠實現按期倒運行和檢修;同時主扇每月電費消耗由降阻前的9.1萬元降至約6萬元,全年可節省電費消耗約37.2萬元。
7 結語
對木代井礦井通風系統的改造不僅有效緩解了木代井通風能力緊張的局面,而且改變了木代井礦井通風系統不合理的狀況,使長期影響木代井安全生產和制約礦井采掘接替正常生產的通風重大隱患得到了有效解決,提高了礦井抗災能力,為今后的安全發展奠定了堅實基礎,同時也產生了巨大的綜合經濟效益。
Renovation of Mine Ventilation System
Xin Bing
This article introduce the technological reformation of the mine ventilation system in Ma Kou Coal area,Datong Dimei Co.,Datong Coal Mine Group.
mine ventilation;ventilation system;ventilation system reformation
TD724
A
1000-4866(2010)01-0041-03
辛兵,男,1975年2月出生,1995年畢業于北京煤炭工業學校,現任大同煤礦集團大同地煤公司馬口煤礦通風副總工程師,助理工程師。
2009-10-22
2009-11-05

