Ki-67對晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的預測價值
韋奇秀,楊靜梅,田永華,黃林娜
卵巢癌是婦科常見惡性腫瘤,發病率僅次于乳腺癌、宮頸癌排名第三,并且全球卵巢癌發病率呈現逐年增加和年輕化趨勢。由于缺乏有效的早期診斷和治療方法,大多數卵巢癌患者確診時已處于晚期,治療效果差,5年生存率低[1],相關文獻報道,Ⅲ期卵巢癌患者5年總生存率低于45%,而Ⅳ期卵巢癌患者5年總生存率則低于15%[2]。目前腫瘤細胞減滅術是治療晚期卵巢癌最有效的手段,主要目的是盡最大努力切除原發灶和轉移灶,使殘余病灶直徑<2 cm,并且術后給予正規、足量的化療,以達到滿意的臨床療效。但即使實施滿意的腫瘤細胞減滅術和正規有效的化療,最終仍有很多卵巢癌患者會出現術后復發轉移,腫瘤惡性程度高、侵襲轉移能力強和化療耐藥是導致其術后5年復發轉移率高和總生存率低的重要原因[3-4]。因此臨床尋找用于預測晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的有效指標,對于指導術后治療和降低復發轉移率具有十分重要的意義。Ki-67是與惡性腫瘤細胞增殖相關的核抗原,高表達反映惡性腫瘤細胞增殖活性強和預后不佳。相關研究發現,Ki-67在卵巢癌中高表達,且其水平與淋巴結轉移和臨床分期密切相關[5]。本研究旨在探討Ki-67對晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的預測價值,現報告如下。
1 資料與方法
1.1研究對象 納入2016年1月—2017年1月在我院接受腫瘤細胞減滅術的109例晚期卵巢癌作為研究對象。納入標準:經術后病理檢查明確診斷為卵巢癌;在我院首次診斷,并接受腫瘤細胞減滅術;經術前影像學檢查和術后病理學檢查綜合評估臨床分期為Ⅲ~Ⅳ期。排除標準:伴有遠處臟器轉移者;術前接受放化療者;患嚴重心肺肝腎疾病無法耐受手術治療者。
1.2研究方法 病理標本采用免疫組織化學染色法檢測。石蠟塊標本連續切片,切片經多聚賴氨酸抗原修復,脫蠟,脫二甲苯,過氧化酶阻斷溶液室溫孵育,磷酸鹽緩沖液浸泡沖洗,然后置于枸櫞酸鹽緩沖液中修復。10%山羊血清封閉,室溫孵育,滴加Ki-67單抗(美國Santa Cruz公司)4 ℃過夜。滴加生物素標記二抗,再滴加辣根過氧化物酶標記鏈霉卵白素。DAB顯色,蘇木素復染,中性樹膠封片。檢測系統MaxVisionTM2及DAB購于福州邁新公司。細胞核中出現黃色沉淀記為Ki-67陽性表達細胞,40倍鏡下計數10個視野,Ki-67陽性細胞占細胞總數的百分數≥30%認為是Ki-67陽性表達。
收集患者年齡、體質量指數、病理分型、CA125、臨床分期、淋巴結轉移、腹膜轉移、脈管浸潤、分化程度及腫瘤大小等臨床病理資料。所有患者術后隨訪5年,隨訪終點為腫瘤復發轉移,記錄患者無病生存期,無病生存期指從手術日起至隨訪5年內腫瘤復發轉移的時間。

2 結果
2.1Ki-67陽性表達情況 109例根據術后免疫組織化學染色結果,分為Ki-67陽性組57例(52.3%)和Ki-67陰性組52例(47.7%)。
2.2臨床病理資料比較 2組癌抗原125(CA125)、臨床分期、淋巴結轉移、腹膜轉移、脈管浸潤、分化程度及腫瘤大小比較差異有統計學意義(P<0.05,P<0.01),見表1。

表1 晚期卵巢癌患者Ki-67表達與臨床病理特征的關系
2.3影響晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的單因素Cox回歸分析 以卵巢癌患者腫瘤細胞減滅術后復發轉移為因變量,以臨床病理指標為自變量,具體賦值:年齡,實際值;體質量指數,實際值;CA125,實際值;病理分型,漿液性癌=1,黏液性癌=2,透明細胞癌=3,其他=4;臨床分期:Ⅲ期=0,Ⅳ期=1;淋巴結轉移,否=0,是=1;腹膜轉移,否=0,是=1;脈管浸潤,否=0,是=1;分化程度,高中分化=0,低未分化=1;腫瘤大小,實際值;Ki-67表達,陰性=0,陽性=1。單因素Cox回歸分析結果顯示:CA125、臨床分期、腹膜轉移、脈管浸潤、分化程度及Ki-67表達與晚期卵巢癌患者腫瘤細胞減滅術后復發轉移存在一定相關性(P<0.05,P<0.01)。見表2。
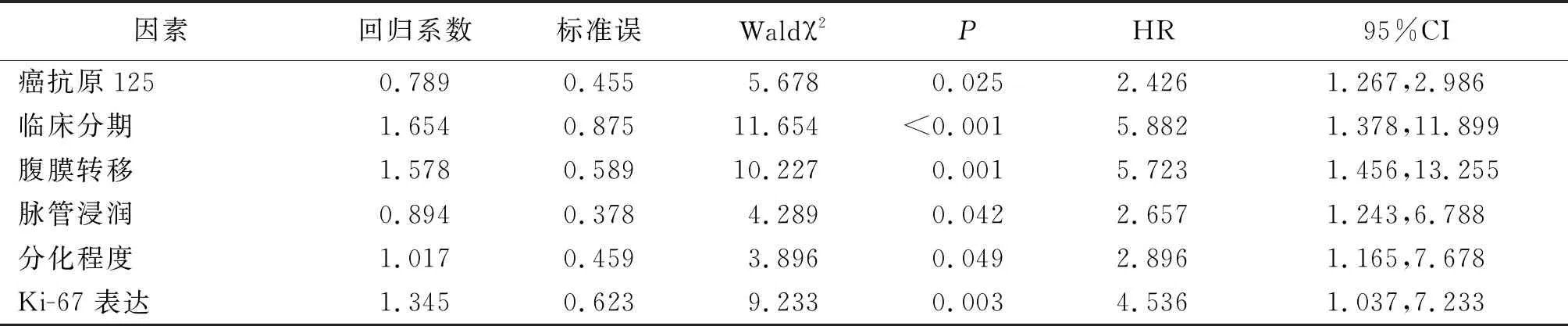
表2 影響晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的單因素Cox回歸分析
2.4影響晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的多因素Cox回歸分析 以患者術后復發轉移為因變量,納入單因素分析中有統計學意義的自變量行多因素Cox回歸分析,結果顯示:CA125、臨床分期、腹膜轉移及Ki-67表達為晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的獨立危險因素(P<0.05,P<0.01),其中Ki-67陽性表達患者腫瘤細胞減滅術后復發轉移的風險是Ki-67陰性表達患者的3.896倍。見表3。
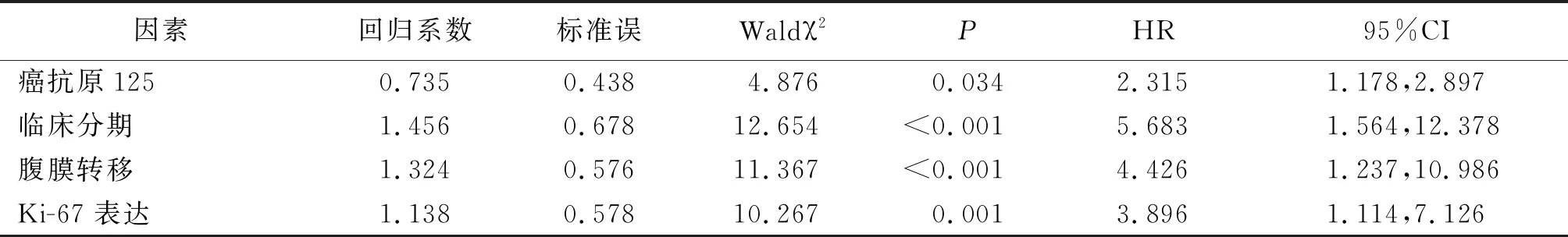
表3 影響晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的多因素Cox回歸分析
2.5Ki-67陽性和陰性組患者術后無病生存率比較 109例晚期卵巢癌術后1、3、5年無病生存率分別為62.3%、26.7%、17.5%;Ki-67陰性組術后1、3、5年無病生存率明顯高于Ki-67陽性組(84.3%、37.5%、37.5% vs 54.5%、22.3%、12.3%,P<0.01)。見圖1。
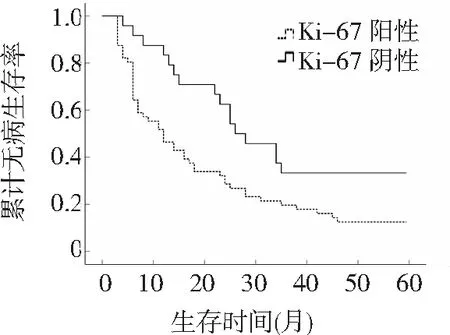
圖1 Ki-67陽性和陰性表達的晚期卵巢癌患者腫瘤細胞減滅術后5年無病生存率比較
2.6預測晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的決策曲線 以CA125、臨床分期、腹膜轉移及Ki-67表達預測晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的凈獲益為縱坐標,高風險閾值為橫坐標,對4個獨立預測指標進行決策曲線分析,結果顯示:在大多數合理閾值范圍內,4個獨立預測指標預測晚期卵巢癌患者腫瘤細胞減滅術后復發轉移均具有良好的凈獲益,并且聯合預測的總體凈獲益高于單一指標預測,見圖2。
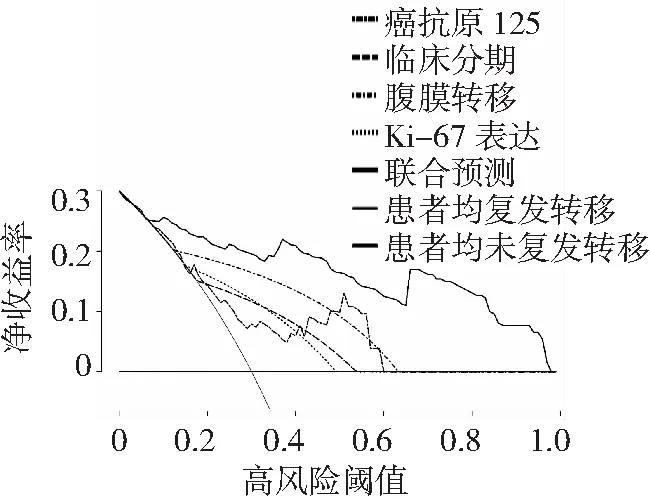
圖2 預測晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的決策曲線
3 討論
卵巢癌發病隱匿,多數患者確診時病情已發展至晚期,對于晚期卵巢癌患者給予腫瘤細胞減滅術聯合術后化療,可以有效抑制病情進展,甚至可以使腫瘤完全消失,但是仍有很多患者會出現術后復發轉移[6-9],因此對于晚期卵巢癌患者在實施腫瘤細胞減滅術聯合術后化療后,還應尋找準確有效的預后評估指標,用于指導術后治療,加強術后監測及早期發現復發征象,這是整個治療過程中極為重要的一環[10-12]。
Ki-67是一種與細胞增殖相關的核抗原,是反映惡性腫瘤細胞增殖活性和侵襲轉移能力的重要分子標志物,與惡性腫瘤增殖、分化、侵襲轉移及預后關系密切[13-15]。劉雪芬等[16]研究發現,Ki-67在上皮性卵巢癌中高表達,并且與卵巢癌增殖活性、淋巴結轉移及腹膜轉移密切相關,Ki-67增殖指數可作為卵巢癌術后淋巴結轉移和腹膜轉移發生可能性的預測分子。相關文獻證實,Ki-67陽性的乳腺癌患者臨床分期明顯高于Ki-67陰性患者,其術后復發轉移率也明顯高于Ki-67陰性患者[17-19]。而本研究也發現,晚期卵巢癌患者Ki-67表達狀態與患者血清CA125水平、臨床分期、腹膜轉移、脈管浸潤、分化程度及腫瘤大小存在一定相關性,提示Ki-67陽性表達的晚期卵巢癌患者本身具有較高的惡性程度和增殖活性,其術后復發轉移風險大,預后不佳,這也正好可以解釋我們多因素Cox回歸分析結果:CA125、臨床分期、腹膜轉移及Ki-67表達為晚期卵巢癌患者腫瘤細胞減滅術后復發轉移的獨立危險因素,其中Ki-67陽性表達患者腫瘤細胞減滅術后復發轉移的風險是Ki-67陰性表達患者的3.896倍。
此外,本研究生存曲線和決策曲線均提示,4個獨立預測指標用于預測晚期卵巢癌患者腫瘤細胞減滅術后復發轉移均具有良好的凈獲益和臨床價值,并且4個指標的聯合預測價值最高。提示Ki-67和CA125表達水平及臨床分期和腹膜轉移情況的評估有助于晚期卵巢癌術后復發轉移風險的早期預測,同時可能對指導卵巢癌預后的判斷甚至術后治療和隨訪起到非常重要的作用。

