血清堿性磷酸酶水平與冠心病PCI患者術后氯吡格雷療效和心血管事件風險的相關性
袁平年,王琦
1.西北大學附屬醫院·西安市第三醫院心血管內科,陜西 西安 710018;2.漢中市人民醫院心血管內科二病區,陜西 漢中 723000
經皮冠狀動脈介入術(percutaneous coronary intervention,PCI)是治療冠心病(coronary heart disease,CHD)的主要血運重建策略,術后常規使用氯吡格雷、阿司匹林雙聯抗血小板是PCI術后抗血栓的基石[1]。在冠心病PCI后,雖然替格瑞洛和普拉格雷優于氯吡格雷,但氯吡格雷因可降低大出血風險減輕經濟負擔等被廣泛使用。然而,氯吡格雷的藥效學作用受許多臨床因素和遺傳因素的影響,部分患者對氯吡格雷反應不佳,血栓事件的風險高于正常反應者。一項涉及8 582例冠狀動脈藥物洗脫支架患者的研究顯示,對氯吡格雷的低反應性與死亡和/或缺血性腦卒中的風險增加之間存在顯著相關性[2]。此外,ADAPT-DES研究確定了氯吡格雷低反應性與支架血栓形成和心肌梗死風險的增加密切相關[3],說明支架血栓形成是氯吡格雷療效及氯吡格雷治療后心血管風險發生的關鍵。因此,確定可以預測CHD患者預后的可靠生物標志物至關重要。
血清堿性磷酸酶(ALP)最初是肝功能的標志物,近年來被視為心血管疾病的替代標志物。一項前瞻性隊列研究的薈萃分析表明,在普通人群中,循環中的ALP水平與心血管疾病的風險呈正相關,并確定高ALP水平是動脈硬化和心血管疾病發生的獨立危險因素[4]。對于接受PCI治療的冠心病患者,高ALP水平者發生心血管死亡率和支架血栓形成的風險明顯高于ALP低者,這表明血清ALP是PCI術后支架內血栓形成的獨立預測因子[5]。由于支架內血栓受氯吡格雷療效的影響,因此筆者團隊推測血清ALP可能與冠心病PCI患者術后氯吡格雷療效和心血管事件風險相關。為證實這一推測,本研究分析了血清ALP水平與冠心病PCI患者術后氯吡格雷療效和心血管事件風險的相關性,現報道如下:
1 資料與方法
1.1 一般資料經西安市第三醫院和漢中市人民醫院倫理委員會批準,患者及家屬簽署知情同意書后,前瞻性選取2019年1月至2020年12月在西安市第三醫院和漢中市人民醫院接受PCI治療的149例CHD患者作為研究對象。納入標準:(1)符合《中國經皮冠狀動脈介入治療指南(2016)》[6]中關于冠心病診斷標準,經冠狀動脈造影檢查顯示心外膜下冠狀動脈直徑狹窄>50%,且存在典型心絞痛癥狀;(2)具有PCI治療適應證;(3)均為首次接受PCI治療。排除標準:(1)凝血功能異常;(2)甲狀旁腺功能亢進;(3)合并嚴重肝膽及骨骼疾病;(4)對本研究藥物過敏。所有患者均于PCI后行氯吡格雷治療。收集所有患者空腹肘靜脈血樣本測定ALP水平,將入院時血清ALP水平按照二分位數分組法分為高水平組60例和低水平組89例,評估所有患者采用氯吡格雷治療的效果。
1.2 研究方法
1.2 .1 治療方法所有患者均接受PCI手術,術前均予以降脂、降壓等常規治療,PCI術后給予300 mg氯吡格雷(Sanofi Winthrop Industrie;H20080268;75 mg/片)負荷劑量。
1.2 .2 資料收集詳細記錄患者臨床資料,包括年齡、性別、病程、體質量指數、吸煙史、冠心病家族史、入院時初步診斷(穩定心絞痛、不穩定性心絞痛、心肌梗死)、多支血管病變占比。
1.2 .3 實驗室檢查抽取入院時空腹肘靜脈血液樣本,以3 500 r/min離心15 min后分離血清,置于-70℃冰箱中待測,采用全自動生化免疫分析儀(Ci16200,Abbott,USA)測量血清ALP值水平;血胱抑素、血肌酐水平,并計算腎小球濾過率(eGFR),采用改良MDRD公式計算腎小球濾過率(eGFR);采用全自動乳膠增強免疫濁度測定儀(Cobas Integra)檢測高靈敏度C反應蛋白(hs-CRP);采用全自動血凝儀(STA-R)檢測纖維蛋白原(FIB)水平;采用全自動血細胞分析儀(Sysmex XS-1000i)測量白細胞(WBC)計數;采用雅培全自動生化分析儀(C16000)以酶比色法測量高、低密度脂蛋白膽固醇(HDL-C、LDL-C)、甘油三酯(TG)、總膽固醇(TC)水平。以上操作均嚴格按照說明書進行。
1.3 氯吡格雷療效判定[7]PCI后給予300 mg氯吡格雷后12~24 h內采集血液樣本,采用改良血栓彈力圖法通過花生四烯酸和二磷酸腺苷途徑檢測抗凝治療作用,以ADP誘導的最大振幅(MAADP)和血小板抑制率評估氯吡格雷療效,將血小板抑制率<50%、MAADP>47 mm定義為氯吡格雷低反應即無效,血小板抑制率≥50%、MAADP≤47 mm定義為有效。
1.4 隨訪以患者出院為研究起點,出院1年后通過電話、門診或住院方式隨訪,參照《現代心血管病學》[8]中擬定的標準,記錄所有患者隨訪期間血運重建、心源性死亡、心力衰竭、急性心肌梗死再發等主要心血管不良事件發生風險。
1.5 統計學方法應用SPSS22.0統計軟件分析數據。計數資料比較采用χ2檢驗,符合正態分布的連續計量變量以均數±標準差(±s)表示,組間比較采用t檢驗;采用多因素Logistic分析篩選影響因素,繪制Kaplan-Meier曲線分析心血管事件發生風險,比較采用Log-rank檢驗。設置檢驗水準α=0.05,以P<0.05表示差異有統計學意義。
2 結果
2.1 兩組患者的一般資料比較高水平組患者的hs-CRP、FIB、ALP水平明顯高于低水平組,差異具有統計學意義(P<0.05),其余資料比較差異無統計學意義(P>0.05),見表1。
表1 兩組患者的一般資料比較[±s,例(%)]
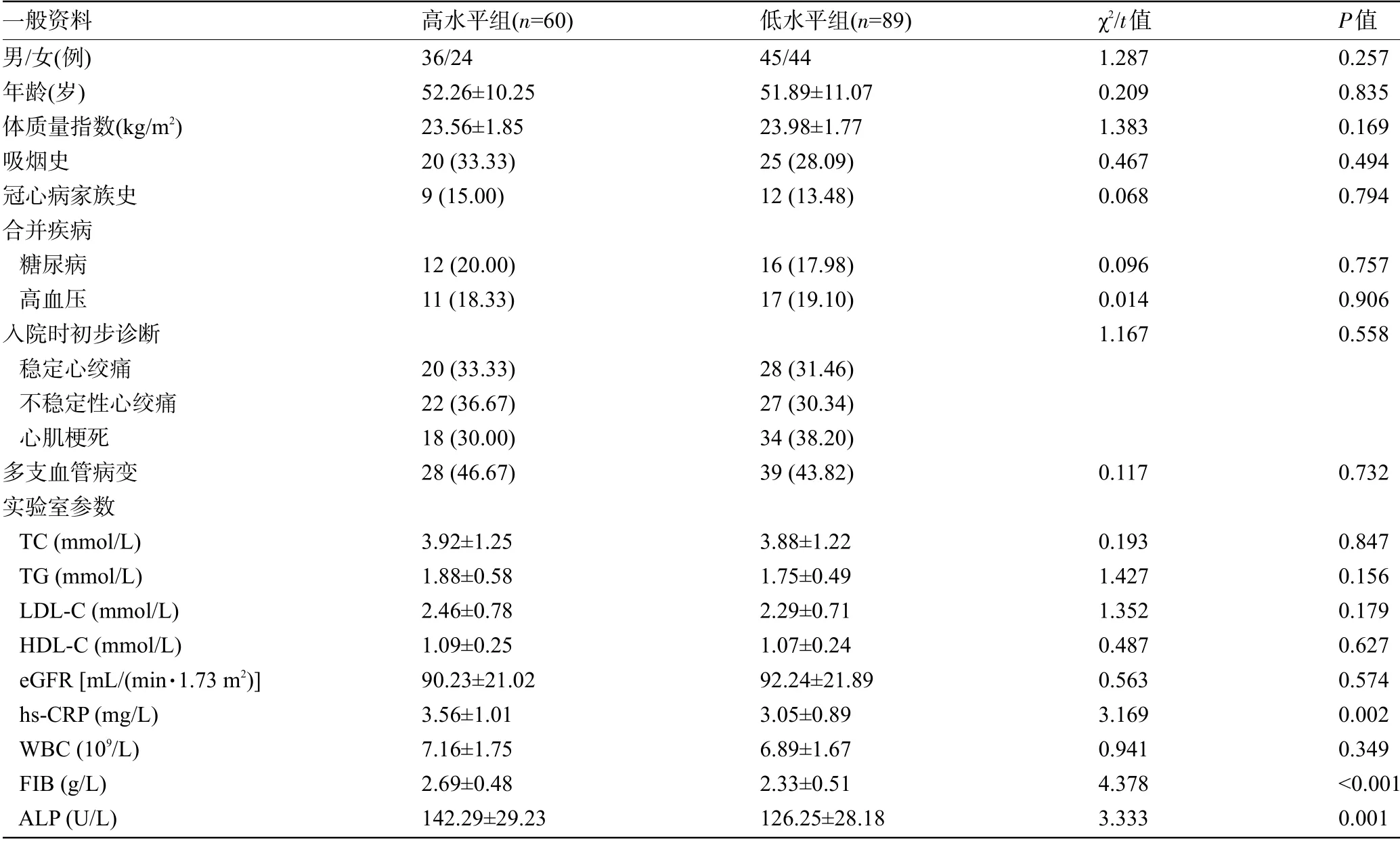
表1 兩組患者的一般資料比較[±s,例(%)]
一般資料男/女(例)年齡(歲)體質量指數(kg/m2)吸煙史冠心病家族史合并疾病糖尿病高血壓入院時初步診斷穩定心絞痛不穩定性心絞痛心肌梗死多支血管病變實驗室參數TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)eGFR[mL/(min·1.73 m2)]hs-CRP(mg/L)WBC(109/L)FIB(g/L)ALP(U/L)高水平組(n=60)36/24 52.26±10.25 23.56±1.85 20(33.33)9(15.00)12(20.00)11(18.33)20(33.33)22(36.67)18(30.00)28(46.67)3.92±1.25 1.88±0.58 2.46±0.78 1.09±0.25 90.23±21.02 3.56±1.01 7.16±1.75 2.69±0.48 142.29±29.23低水平組(n=89)45/44 51.89±11.07 23.98±1.77 25(28.09)12(13.48)16(17.98)17(19.10)28(31.46)27(30.34)34(38.20)39(43.82)3.88±1.22 1.75±0.49 2.29±0.71 1.07±0.24 92.24±21.89 3.05±0.89 6.89±1.67 2.33±0.51 126.25±28.18 χ2/t值1.287 0.209 1.383 0.467 0.068 0.096 0.014 1.167 0.117 0.193 1.427 1.352 0.487 0.563 3.169 0.941 4.378 3.333 P值0.257 0.835 0.169 0.494 0.794 0.757 0.906 0.558 0.732 0.847 0.156 0.179 0.627 0.574 0.002 0.349<0.001 0.001
2.2 兩組患者的氯吡格雷療效比較治療后,高水平組患者的氯吡格雷療效為68.33%,明顯低于低水平組的83.15%,差異有統計學意義(χ2=4.465,P<0.05)。
2.3 影響CHD患者PCI術后氯吡格雷療效的因素以氯吡格雷療效為因變量(有效=1,無效=0)進行多因素Logistic回歸分析,結果顯示:FIB(OR=4.198,95CI%:1.847~9.541)、ALP(OR=1.019,95CI%:1.004~1.034)、hs-CRP(OR=1.820,95CI%:1.151~2.879)水平是CHD患者PCI術后氯吡格雷療效的獨立危險因素(P<0.05),見表2。
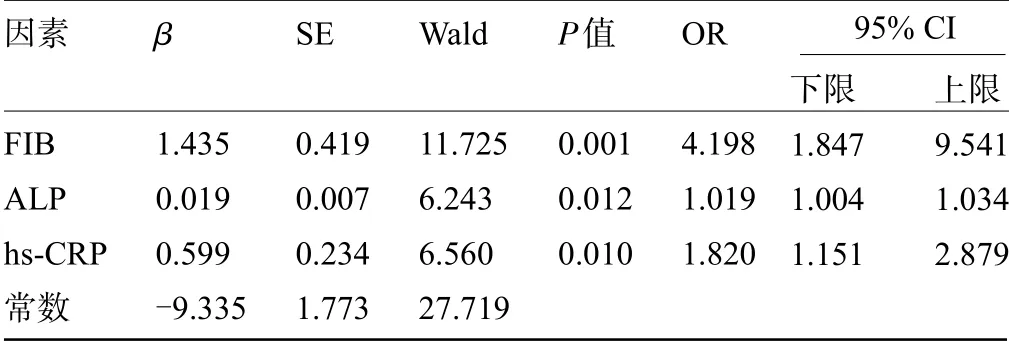
表2 CHD患者PCI術后氯吡格雷療效的多因素Logistic分析
2.4 心血管事件發生風險隨訪觀察1年,共4例失訪,最終145例納入研究(高水平組58例,低水平組87例),46例(31.72%)發生心血管不良事件,其中高水平組25例(43.10%)出現心血管不良事件(血運重建6例、心源性死亡1例、心力衰竭8例、急性心肌梗死再發10例),低水平組21例(24.14%)出現心血管不良事件(血運重建4例、心力衰竭9例、急性心肌梗死再發8例)。Kaplan-Meier曲線顯示,高水平組心血管事件發生風險顯著高于低水平組,差異具有統計學意義(Log-rank χ2=5.779,P=0.006<0.01),見圖1。
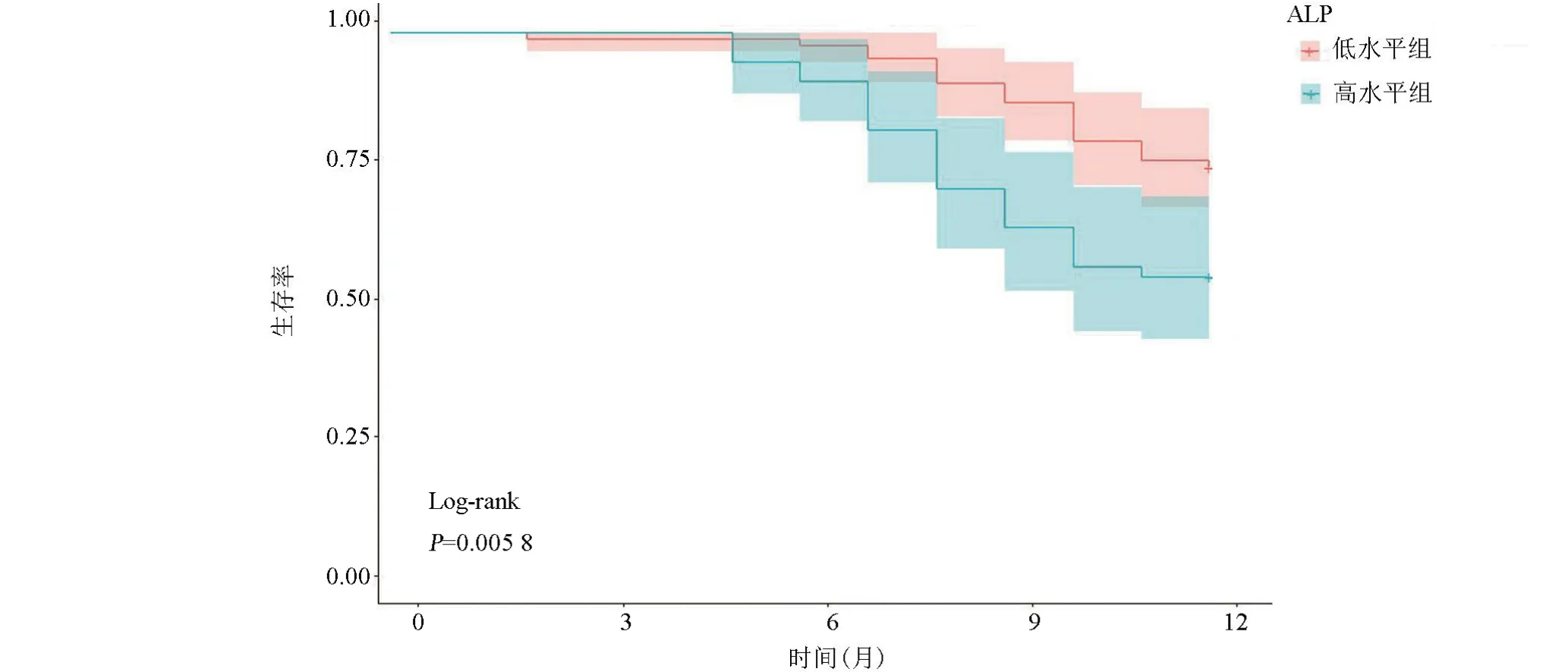
圖1 心血管事件發生風險Kaplan-Meier曲線
3 討論
CHD患者PCI術后即使使用阿司匹林和氯吡格雷雙聯抗血小板治療,仍有約20%會發生再缺血或栓塞事件,5%~35%在服用氯吡格雷后不能達到預期抗血小板效果。這可能是因為氯吡格雷反應性存在顯著個體差異,且這種個體差異與遺傳因素、代謝因素等有關。因此,氯吡格雷低反應性的基因多態性研究較為常見。但由于導致氯吡格雷低反應性因素較多,相關生物學標志物水平在預測氯吡格雷低反應性中也逐漸得到重視。在生物學標志物中,血管鈣化導致的支架內血栓形成被認為可能是影響氯吡格雷低反應性的重要原因之一[9]。而血管礦物代謝的標志物磷酸鹽是導致血管鈣化的關鍵,并認為其參與心血管不良事件的發生和發展,說明磷酸鹽可能與氯吡格雷低反應性及心血管事件發生有關。另外,ALP作為膜結合的金屬酶,在礦物質中起著重要作用,能催化有機焦磷酸鹽的水解,而有機焦磷酸鹽是血管鈣化的抑制劑。因此,ALP對血管疾病的影響不容忽視。
血管鈣化引起動脈粥樣硬化斑塊脆性增加,可導致粥樣硬化斑塊破裂、血栓形成。一項前瞻性研究顯示,術前血清高ALP水平是支架內血栓形成的獨立危險因素[10]。BARBARASH等[11]通過多層螺旋CT對冠狀動脈鈣化評估示血清ALP水平與冠狀動脈鈣化相關。此外,體外研究中,抑制ALP可以抑制血管平滑肌細胞的鈣化,說明ALP與血管鈣化及血栓間存在一定關系,這種關系可對血小板反應性產生一定影響[12]。由于ALP升高往往伴隨著肝源性炎癥介質的C反應蛋白升高,本研究在剔除肝臟疾病患者后發現,血清ALP水平升高與氯吡格雷反應性有關,提示高ALP水平可促進血栓形成進而導致氯吡格雷反應性低。另外,本研究顯示,FIB、hs-CRP水平是CHD患者PCI術后氯吡格雷療效的獨立危險因素。以下原因可以解釋本研究結果:(1)FIB可與活化的血小板相互作用,與血小板膜受體結合最終導致急性冠狀動脈血栓形成而影響氯吡格雷療效;(2)hs-CRP升高提示局部炎癥反應增強,激活血小板和纖維蛋白原招募到支架誘導的動脈壁直接損傷中,促進血栓形成而影響氯吡格雷反應性。
基于人群的前瞻性研究和最近的薈萃分析表明,ALP活性升高與心血管疾病或死亡呈正相關[13]。最近的一項分析顯示,基線ALP每增加一個標準差,腦血管疾病風險增加8%[14]。在CHD患者預后的研究中,OH等[15]評估了1 176例有心肌梗死病史的受試者中ALP與心血管轉歸之間的關系發現,ALP三分位受試者的全因死亡風險顯著增加43%。另外,YU等[16]評估了6 368例冠狀動脈支架置入術后的預后,證實了高ALP活性是預后獨立存在的危險因素,并認為更高的ALP活性與冠狀動脈造影鈣顯著相關,這為ALP通過血管鈣化介導其不良預后影響的假設提供了依據。本研究中Kaplan-Meier曲線顯示,高水平組心血管事件發生風險顯著高于低水平組,也說明ALP水平與CHD患者PCI術后心血管事件風險有關。筆者團隊認為在具有內側鈣化或晚期鈣化動脈粥樣硬化病變的血管中ALP水平上調與CHD患者PCI術后心血管事件風險發生風險有關。除此之外,ALP參與(或關聯)脂肪形成導致動脈粥樣硬化、代謝綜合征、磷酸鹽代謝、脂聯素等也可以解釋與ALP升高相關的心血管風險的機制。
綜上所述,ALP升高與CAD患者PCI術后氯吡格雷療效和心血管事件發生風險有關。但本研究具有一定局限性,首先,僅測量入院時基線ALP水平,未能進行動態分析;其次,未獲得血清甲狀旁腺激素及血清維生素D水平等數據,這可能會影響血清ALP水平,故仍需進一步研究彌補上述不足。

