用于卵母細胞玻璃化保存的微流控系統
張宇琪 喻梓瑄 周新麗
(上海理工大學生物系統熱科學研究所 上海 200093)
卵母細胞的玻璃化保存是輔助生殖的常用技術,可為由于年齡及醫療因素引起的卵巢功能衰退的女性保存生育能力[1-4],對珍貴瀕危物種保種擴繁也具有重要意義[5]。實現玻璃化保存通常需要在細胞內外加載高濃度的低溫保護劑[6],為減少高濃度的低溫保護劑對細胞造成的滲透損傷,需要采用分步法加載和去除低溫保護劑。目前,臨床上采用多步平衡法對卵母細胞進行低溫保護劑的加載和去除[7-8],雖在一定程度上減少了滲透損傷[9],但仍存在細胞外溶液滲透壓階梯狀突變,操作過程中極易造成細胞丟失等問題。此外,目前卵母細胞的玻璃化保存全部由人工操作,不僅對操作人員的技術要求較高,而且完成效率低。隨著保存需求的逐年增大,人工操作逐漸難以滿足保存需求,且人為因素存在一定的不確定性,所以開發卵母細胞自動玻璃化保存一體化裝置十分必要。
微流控芯片可對微量流體進行復雜、精確的操作,在單細胞分析、基因測序、蛋白質結晶等方面發揮獨特的作用[10]。近年來研究者們研發了微流控生物芯片用于生育力保存,包括配子與胚胎的篩選、體外培養、體外受精以及低溫保存等[11]。Y. S. Heo等[12]使用微流控芯片對卵母細胞進行低溫保護劑的加載,但該芯片有幾個不同的通道高度且需要氣動閥控制流體,制造工藝較為繁瑣。周新麗等[13-14]設計了一種在保護劑加載/去除過程中能使低溫保護劑濃度連續變化的微流控細胞處理芯片,操作時低溫保護劑經蛇形通道混合流入細胞操作腔,但細胞進出操作腔需通過使用口吸器人工控制,完成低溫保護劑加載后還需要將細胞從芯片中取出,再加載至載體上進行冷凍,增加了操作難度,不利于卵母細胞自動玻璃化保存的實現。以上兩種芯片均采用軟光刻法制作的PDMS芯片,需要經過光刻開模,倒膠成型、分層鍵合等步驟,工藝較為復雜,且制作成本較高。
目前,已有研究人員開發研制了幾款卵母細胞及胚胎自動玻璃化保存裝置。Liu Jun等[15]設計了胚胎自動玻璃化及復溫機器人,通過顯微鏡與相機定位胚胎位置,并通過機器人操作手進行胚胎玻璃化冷凍,但由于細胞在溶液中的位置無法固定,移動操作耗時較長,轉移過程還易出現細胞丟失問題。M. Dal Canto等[16]研發了一款自動玻璃化保存裝置,包含獨立的機器人移液處理單元,可以向冷凍載體Pod中分兩步加入并吸走低溫保護劑,但該裝置無法用于樣品復溫后的低溫保護劑去除操作,自動玻璃化保存流程不夠完整。現有的卵母細胞及胚胎自動玻璃化裝置多采用自動化機械手臂替代了分步法低溫保護劑加載與去除過程中的人工操作,但仍存在滲透壓突變以及細胞容易丟失的問題。采用微流控裝置對卵母細胞或胚胎進行保護劑加載和去除,并可用于后續自動玻璃化保存的裝置還未見報道。
本文設計制作了一個用于卵母細胞玻璃化保存的微流控系統,既實現了低溫保護劑的連續加載/去除,又為后續浸入液氮實現自動玻璃化保存做好準備。首先,采用CO2激光雕刻法制作了用于低溫保護劑連續加載/去除的微流控芯片,結合石英毛細管搭建微流控混合系統;然后,利用灰度值法與折光儀法,驗證微流控芯片的混合效率和濃度變化規律;最后,對比手動多步平衡法與微流體法加載/去除保護劑時卵母細胞的體積響應、存活率和后續發育率。本研究為基于微流控技術的卵母細胞與胚胎的自動玻璃化保存裝置的研發提供技術支撐。
1 材料與方法
1.1 材料與試劑
二甲基亞砜,乙二醇,蔗糖(美國Sigma-Aldrich公司);TCM199(美國Gibco公司 12340030);M2培養液,KSOM培養液(江蘇易核科學儀器有限公司);超凈工作臺(中國蘇凈集團安泰公司 Airtech);體視顯微鏡(日本MOTIC SMZ-168);高速工業相機(深圳市英視科技有限公司 OSG130-210UM);CO2培養箱(美國Forma Scientific公司 3111/3131);CO2激光雕刻機(美國 UNIVERSAL VLS2.30)。
1.2 主要溶液配置
所用溶液的濃度均指體積分數。基礎液BS:TCM199+20%FBS;平衡溶液ES: 7.5%EG+7.5%DMSO+基礎液;玻璃化溶液VS:15%EG+15%DMSO+0.5 mol/L蔗糖+基礎液;復溫溶液TS:1 mol/L蔗糖+基礎液;稀釋溶液DS:0.5 mol/L蔗糖+基礎液;透明質酸酶溶液:TCM199+0.1%透明質酸酶;孤雌激活溶液:M2培養液+5 μg/mL細胞松弛素B。
1.3 小鼠卵母細胞采集
每批取10只雌性小鼠腹腔注射孕馬血清促性腺激素(pregnant mare serum gonadotropin, PMSG) 10 IU,48 h后腹腔注射人絨毛膜促性腺激素(human chorionic gonadotrophin, HCG) 10 IU。在注射HCG后14~16 h內脫頸處死小鼠,剖開腹腔,取輸卵管部分,將輸卵管轉移至含有M2培養液的表面皿中,沖洗干凈。在體視顯微鏡操作臺上,找到輸卵管膨大部并用眼科針撕開,排出卵丘-卵母細胞復合物。再將卵母細胞團移至含透明質酸酶M2培養液中處理3~5 min反復吹打使卵丘細胞與卵母細胞分離獲得裸卵,洗滌3~5次后挑選形態正常卵母細胞移入事先制備好的M2培養液液滴中,放入培養箱備用。
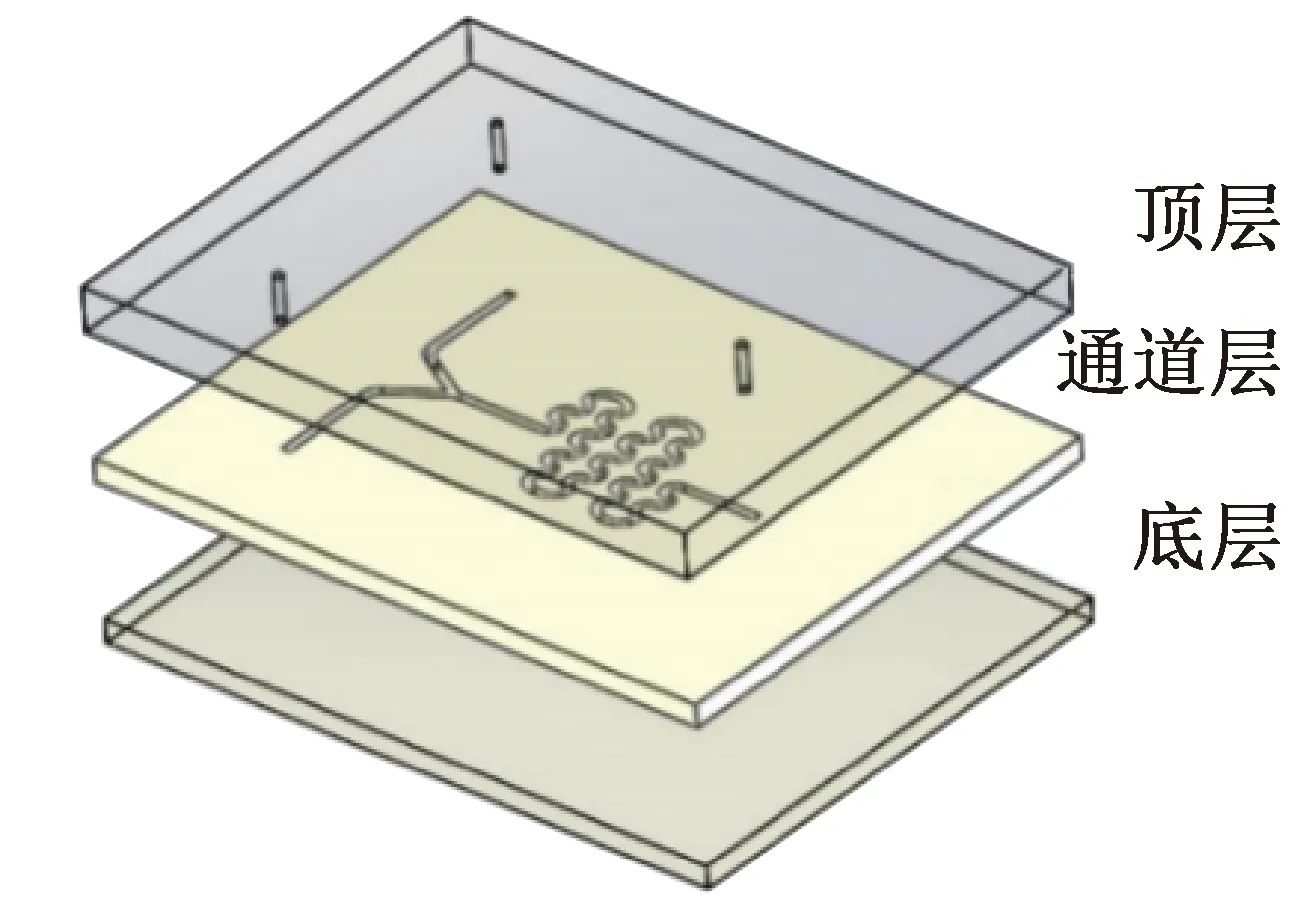
圖1 微流控芯片三層結構Fig.1 Structure of three layers of microfluidic chip
1.4 微流控混合系統的搭建
3、林地監測。監測結果表明,2012年庫區耕地4429997.22畝,2017年4377062.65畝,五年間林地面積減少52934.57畝。區域退耕還林政策的實施導致庫區內林地有所增加。林地減少的主要因素是建設占用和水庫淹沒。
2018年以來更是動作頻頻,夢妝入駐美國最大美妝零售商ULTA,悅詩風吟成功進軍日本,彩妝品牌赫妍與專業美發品牌AMOS PROFESSIONAL也成功登陸新加坡,蘭芝正式進駐澳大利亞所有絲芙蘭門店,而伊蒂之屋在進駐迪拜后,預計將進駐中東最大美妝市場——沙特阿拉伯。
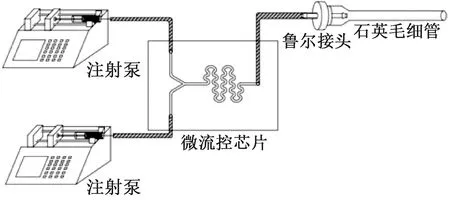
圖2 微流控混合系統連接示意圖Fig.2 Connection diagram of microfluidic mixing system
1.5 微流控混合系統的溶液混合
將玻璃化溶液(15%EG+15%DMSO+ 0.5 mol/L蔗糖+BS)和解凍溶液(1 mol/L蔗糖+ BS)用普通紅色染料染色,結合試劑反應法中的色彩分析方法定量分析微通道混合效果。微流控芯片置于光學顯微鏡載物臺上,將含染料的玻璃化溶液和基礎溶液各載入一支 1 mL的微量進樣針中,固定于一臺微注射泵上,設置注射流速為15 μL/min。運行載有基礎溶液的注射泵,排盡微通道內的空氣,啟動兩臺注射泵,待通道內流體穩定后,按圖3檢測點(A~G)設置,拍攝相應位置處微通道的圖像,每個檢測點拍攝10張圖像,使用3塊芯片重復實驗。拍攝結束后,更換芯片并換用含染料的去除溶液重復上述實驗。
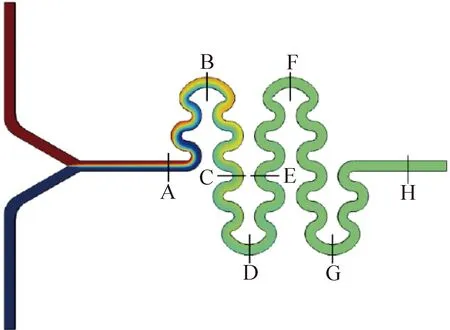
圖3 S型通道檢測點設置Fig.3 Detection point setting of S-type channel
1.6 低溫保護劑加載和去除
楊云等[14]對比了一步法、多步法和PDMS芯片加載低溫保護劑對豬MII期卵母細胞體積變化和后續發育的影響,結果表明,PDMS線性加載組的卵母細胞囊胚率(27.4%)顯著高于一步法組(8.3%)和多步法組(15.5%)。衣星越等[19]對比了一步法、兩步法和PDMS芯片去除低溫保護劑對豬MII期卵母細胞體積變化和后續發育的影響,微流控法去除低溫保護劑后,卵母細胞的存活率、體外發育情況等均優于分步去除方法。以上研究中所使用的芯片通道尺寸約為100 μm,采用軟光刻技術PDMS材料加工,工藝復雜,且卵母細胞位于芯片分析腔中,不能進行后續的玻璃化冷凍。而本研究改用寬度約200 μm的通道,采用CO2激光雕刻法對PMMA材質進行加工,工藝簡便且同樣能夠實現低溫保護劑濃度的線性變化。采用本系統的微流體法8 min組,卵母細胞的囊胚率(53.0%)與對照組無明顯差異,說明PMMA芯片加載和去除低溫保護劑可以有效減小卵母細胞的滲透損傷,且結合使用石英毛細管更有利于卵母細胞后續的玻璃化冷凍和復溫操作。
微流控法:將3~5枚卵母細胞固定在石英毛細管內,不銹鋼微絲從毛細管末端插入。將VS溶液與BS溶液各載入一支1 mL 的微量進樣針中分別固定在兩臺注射泵上,設置VS注射參數為0~30 μL/min,BS注射參數為30~0 μL/min,加載時間為8 min。在流速參數不變的情況下,設置加載和去除時間分別為6 min、10 min重復上述實驗。
1.7 圖像采集
在進行卵母細胞的低溫保護劑加載與去除的過程中,使用工業相機拍攝細胞在溶液中的體積動態變化過程,因細胞在高滲溶液中體積變化較為迅速,故設置相機拍攝參數為10 s拍攝1張圖片,以保證圖像信息的完整性。將卵母細胞假設為理想的球體,利用圖形處理軟件分析所拍攝圖像中每一枚卵母細胞的投影面積,根據球體與投影面積換算公式(1)計算得到卵母細胞的體積。
(1)
式中:V為卵母細胞體積,μm3;S為卵母細胞投影面積,μm2。
微通道內各處混合情況如圖4所示,在入口處低溫保護劑溶液已有少許擴散現象,而去除溶液無明顯擴散現象,但兩種溶液均在入口分層明顯。檢測點A能觀察到兩種溶液均有明顯的分層現象,而檢測點B分層現象已不顯著,在出口處已完全觀察不到分層現象。
1.8 卵母細胞存活率與發育率判斷
完成低溫保護劑的去除后將所有卵母細胞吹入M2培養液中,放入CO2培養箱中培養1 h后觀察細胞存活狀態。以透明帶完整無明顯變形且卵周間隙均勻,質膜完整,胞質無外流現象,胞質無皺縮、變暗或松散不均勻現象為存活標準。觀察結束后將細胞移入孤雌激活溶液中,并放入培養箱中激活處理5 min,然后用M2培養液清洗數次移入KSOM培養液液滴中培養。在激活后16~18 h內觀察判斷激活結果,若出現原核或發生卵裂則判定為激活成功,若質膜破裂皺縮則判定為死亡,若無明顯變化則判定為退化。在激活后的48 h觀察并計算卵裂率,挑選卵裂胚胎換液培養,第4天觀察發育情況并計算囊胚率。
1.9 數據分析
每組實驗重復3~5次,每組共處理 30枚卵母細胞。采用Origin 2021軟件中One way ANOVA、Tukey方差分析法進行數據分析,以P<0.05作為差異顯著評判標準。
蔡飛等[12-14]發現,在缺氧條件下,血府逐瘀湯含藥血清可以增加人微血管內皮株(HMEC-1)細胞活性,增加內皮細胞遷移、黏附和血管腔形成能力。在非缺氧條件下,血府逐瘀湯含藥血清可以促進血管數量的增加。同時不同濃度含藥血清均可影響堿性成纖維細胞生長因子(bFGF)的轉錄水平和濃度,通過對內皮細胞的多環節干預調節,促進血管新生。研究發現不同濃度含藥血清可以下調EphB4和EphrinB2基因表達,其促血管新生機制與EphB4/EphrinB2密切相關。
2 結果與分析
2.1 微通道混合效率與溶液濃度變化分析
來一場說走就走的旅行,不是任性,而是實屬無奈。原本手頭上的事情太多,十一長假也準備好好“奮斗”一番,誰想一通電話的相約,孩子歡呼雀躍吵著要走,如一枚石子驟然敲破平鏡的湖面。計劃亂了,但心之所動,已飄向了旅途的遠方。

圖4 通道內混合情況Fig.4 Mixing in the channel
多步平衡法與微流體法對卵母細胞進行低溫保護劑加載和去除過程中,卵母細胞的體積變化趨勢如圖7所示。由圖7可知,采用多步平衡法處理細胞時,細胞出現多次劇烈縮脹現象。細胞在分別浸入ES、VS、TS時最快收縮速率達0.834%、0.987%、0.855%V0/s,最小歸一化體積分別達到0.496 5、0.546 7、0.443 1。而使用微流體法加載和去除低溫保護劑時,可明顯觀察到體積變化更為平緩,整個過程的最大最小歸一化體積僅分別為1.118 4和0.903 8,接近初始體積。
在芯片頂層的溶液進出口處用外徑0.6 mm的鋼針和內徑0.5 mm的硅膠管連接,利用 UV光固膠固定和密封,避免溶液泄漏。微流控芯片溶液入口處的兩根硅膠管另一端各連接一臺微量注射泵。冷凍載體石英毛細管兩端均開口,其中一端為長1 cm、直徑2.8 mm的漏斗。魯爾接頭一端插入石英毛細管漏斗端,另一端通過硅膠管與微流控芯片相連微流控混合系統連接,如圖2所示。
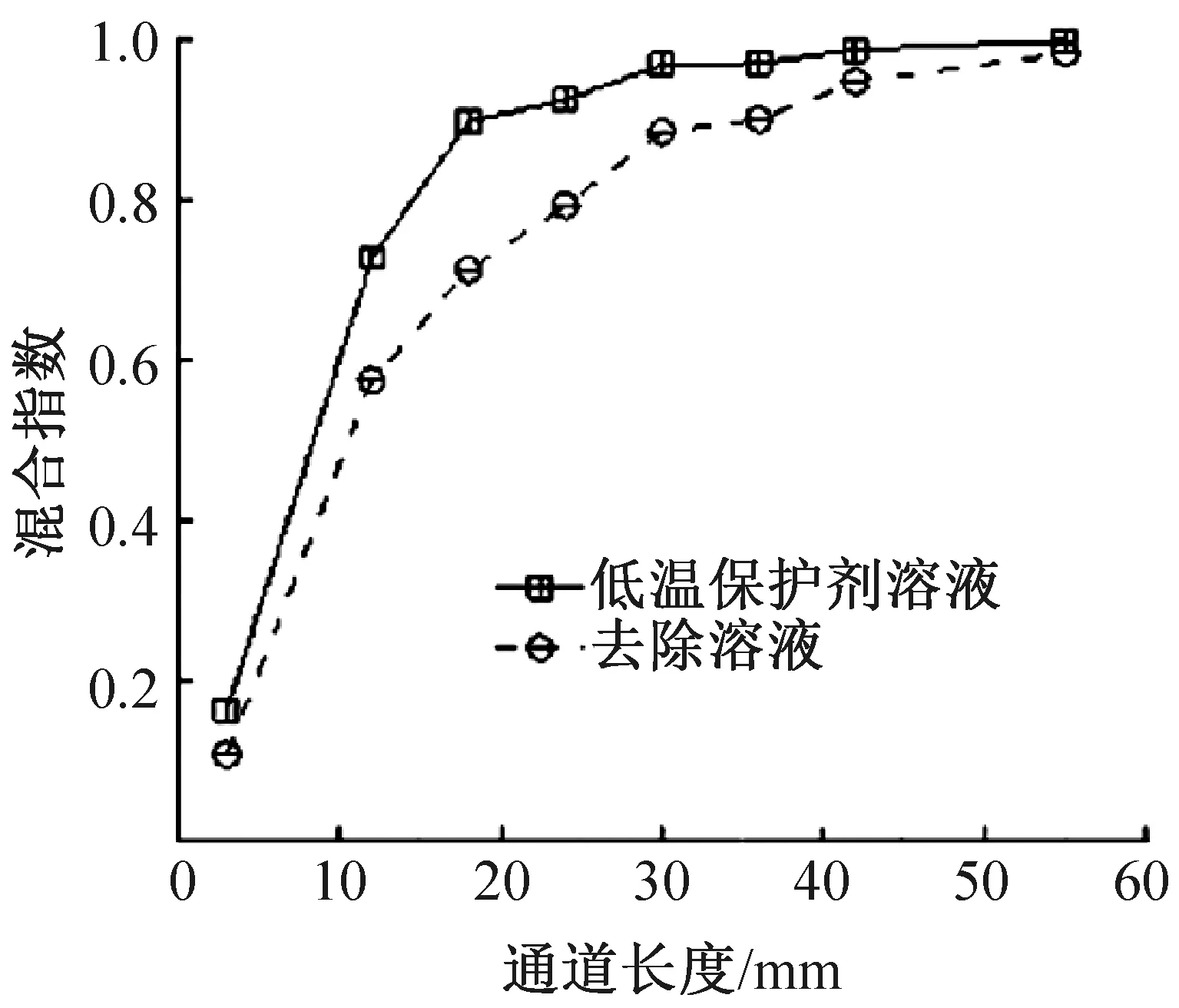
圖5 通道混合指數Fig.5 Mixing index of channel
采用折光法對比了低溫保護劑溶液和去除溶液在相同總流速、不同注射時間和流速比例下,芯片出口處溶液的濃度變化,如圖6所示。在保護劑加載時間為6、8、10 min時,溶液濃度的折光率均呈線性增長趨勢,混合溶液的初始折光率為1.335,最終折光率為1.415。隨著注射時間的延長,出口溶液折光率增長速率降低,均可在注射過程中實現濃度由基礎液至玻璃化溶液的線性轉變;在保護劑去除時間為6、8、10 min時,溶液濃度的折光率均呈線性降低趨勢,隨著注射時間的延長,混合溶液折光率降低速率減小,均實現了濃度由復溫溶液至基礎液的線性轉變。綜上說明,PMMA芯片可以實現在低溫保護劑溶液流速線性增大或去除溶液流速線性減小的情況下,混合溶液的濃度也隨之線性增大或減小。
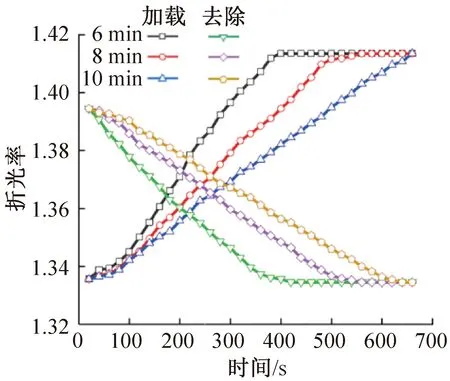
圖6 通道出口處溶液折光率Fig.6 Refractive index of the solution at the exit of the channel
2.2 微流控法與多步平衡法對比實驗研究
通過拍照并計算各檢測點的混合指數,定量分析PMMA芯片混合系統的混合效率,計算結果如圖5所示。混合過程中,低溫保護劑溶液在40 mm處的混合指數達到0.998 5;而去除溶液則在55 mm處混合指數才達到0.992 6。這是由于去除溶液中蔗糖含量較高,使溶液黏度增大,流動性降低,混合效率降低。計算結果說明低溫保護劑溶液和去除溶液均能在通道出口處完全混合,PMMA混合芯片符合溶液混合需求。
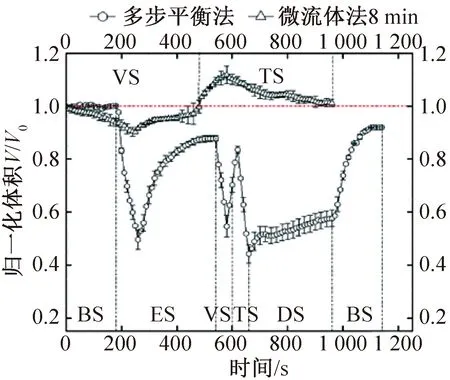
圖7 不同加載/去除方案卵母細胞體積變化Fig.7 Volume changes of oocytes in different loading/removal schemes
在使用微流體法處理細胞的整個過程中,卵母細胞雖有膨脹縮小現象,但一直保持著良好的球形度,不同于多步平衡法中,細胞出現不規則收縮。原因可能是多步平衡法中存在溶液混合不均勻或不完全的現象,使細胞周圍出現溶液濃度梯度,導致胞內水分優先從濃度更高的一側流出,形成坑狀變形,造成細胞的滲透損傷[17]。而微流體法可使細胞外溶液濃度逐漸且均勻地變化,從而降低細胞內外滲透壓差,使細胞形態均勻改變。Lai D.等[18]研究了卵母細胞玻璃化溶液的微流體法加載過程,結果表明,該方法使卵母細胞在低溫保護劑加載過程中保持較高的球形度,從而顯著降低卵母細胞膜損傷,增強其后續發育能力。綜上說明,微流控混合系統和毛細管載體的組合可使卵母細胞在保護劑加載和去除過程中做出體積響應,并能有效減小體積變化程度,減緩體積變化速率,最終減小滲透損傷。
表1所示為多步平衡法與微流體法加載和去除保護劑后卵母細胞存活率與發育率的結果,使用微流體法加載和去除保護劑后,卵母細胞的存活率(93.25%)顯著高于多步平衡法組(79.75%),與對照組(97.74%)無顯著性差異。微流體法組的卵裂率(77.12%)和囊胚率(53.00%)均高于多步平衡法組(58.74%、37.73%)。說明微流體法可有效減小卵母細胞低溫保護劑加載與去除過程的滲透損傷,提高低溫保護劑去除后的細胞存活率與發育率。
腦卒中在臨床中比較常見,有著較高的致殘率,如果沒有及時處理,會影響到患者的生活質量和水平。經過相關研究,患者在出現腦卒中之后,相關的中樞神經系統還具備一定的自然恢復功能,具備一定的神經功能。在康復治療中,需要恢復這些功能,同時利用加速腦側枝循環的構建,促進側腦組織或者病灶周圍組織的補償和重組[1] 。所以,使用有效治療方法和合理康復介入實際可以顯著恢復患者的神經功能,改善患者的生活自理能力。在臨床康復治療中,腦梗死患者一般在一周之內,少數的在兩天之內,腦出血的患者需要在兩周之內介入康復治療[2] 。
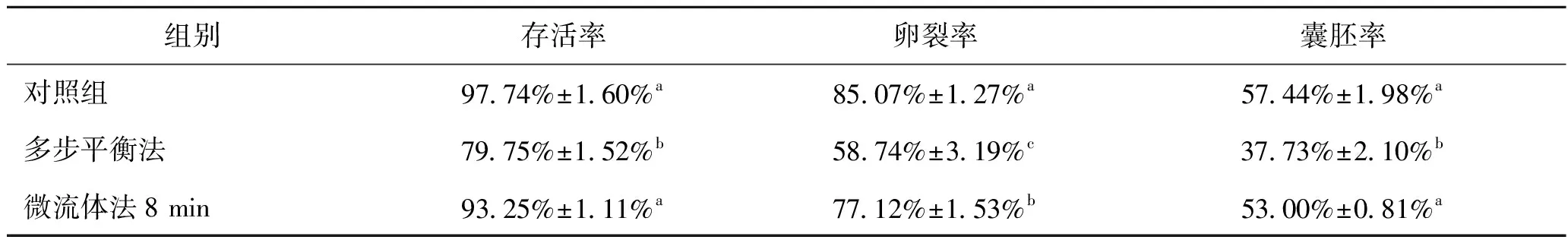
表1 多步平衡法與微流體法加載/去除方案對卵母細胞存活與發育的影響Tab.1 Effects of multi-step and microfluidic loading-removal method on oocyte survival and development rate
2.3 微流體法不同低溫保護劑加載/去除時間對卵母細胞的影響

圖8 微流體法不同注射時間卵母細胞體積變化Fig.8 Changes of oocyte volume at different injection times by microfluidic method
圖8所示為卵母細胞在使用微流體法進行低溫保護劑加載/去除時不同加載/去除時間的體積變化。由圖8可知,隨著加載/去除時間的增長,細胞體積變化程度顯著減小,且體積變化速率減緩,細胞在加載/去除時間均為6 min時,最大和最小歸一化體積分別達到1.221和0.839。10 min 時,細胞的最大和最小歸一化體積僅為1.041 3和0.928 5,相比于6 min 組和8 min 組,加載過程體積改變的程度可減小約8.95%、6.48%,去除過程體積改變程度可減小約17.97%、7.71%。說明注射時間延長可減緩胞外溶液濃度變化速率,縮小胞內外濃度差,從而使細胞體積變化趨于平緩,最后達到滲透平衡時體積也更接近初始體積。
色譜條件:Shimadzu-GL ODS-2色譜柱(250 mm×4.6 mm,5 μm);流動相為甲醇-水(75∶25);體積流量1.0 mL/min;檢測波長228 nm;進樣量20 μL,柱溫30 ℃。
表2所示為微流體法不同注射時間加載/去除保護劑后卵母細胞存活率與發育率的結果。由表2可知,微流控法8 min組的存活率(93.25%)顯著高于其余兩組。經化學激活培養后,微流控6 min組的卵裂率(67.17%)與10 min組(68.38%)之間無顯著性差異,但顯著低于8 min 組(77.12%)。對比培養4 d后的囊胚率可發現,6 min組的囊胚率(45.17%)與10 min 組(47.43%)無顯著性差異但卻低于8 min組(53.00%)。這可能是因為6 min組處理時間較短,相對于其余兩組胞外溶液濃度變化速率更快,細胞體積變化更為劇烈,所造成的滲透損傷也更大。而10 min組處理時間過長,雖在減小滲透損傷層面有一定優勢,但卻增大卵母細胞的毒性損傷,不利于其后期的生長與發育。因此,微流體法8 min組在溶液濃度變化速率和處理時間上具有一定優勢,可提高卵母細胞的玻璃化保存效果。
采用多步平衡法與微流控法分別對卵母細胞進行低溫保護劑的加載和去除。多步平衡法加載:將3~5枚卵母細胞移至基礎液中平衡3 min,轉至ES溶液中平衡6 min,再將細胞移至VS溶液中平衡1 min;多步平衡去除:將卵母細胞移至TS 溶液中平衡1 min,然后移至DS溶液中稀釋5 min,最后移至BS溶液中洗滌3 min。
鋼纖維混凝土的組成它包含了兩種部分,即纖維性材料、顆粒性材料混合而成的,在實踐過程中,鋼纖維混凝土中包含了鋼纖維,使得整體材料的就結構具備抗沖擊、抗折、抗疲勞等特點,與傳統的混泥土相比質量強度由于傳統混凝土材料,正是如此,在道路橋梁施工中該材料得到了廣泛的應用。
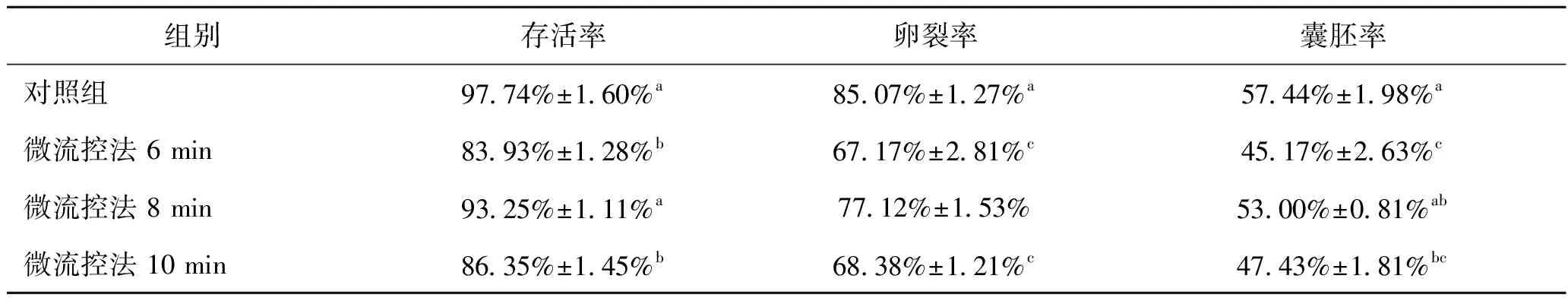
表2 微流體法不同注射時間對卵母細胞存活與發育的影響Tab.2 Effects of different injection time on oocyte survival and development rate in microfluidic method
3 總結與展望
本文設計制作了一種用于卵母細胞玻璃化保存的微流控系統,并從流體混合和細胞實驗層面對系統功能進行驗證,得到結論如下:
1)使用石英毛細管作為低溫保護劑加載/去除以及細胞冷凍載體,一體兩用簡化了原有的細胞進入及取出芯片的方式。
微流控通道結構包括頂層、通道層和底層,如圖1所示。流體混合通道為深0.5 mm、寬0.2 mm,總長度60 mm的S型通道。微流控芯片通過CO2激光雕刻法制作,選擇厚1 mm的聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)板材為頂層,0.5 mm PMMA板材為通道層和底層,且通道層板材雙面預先貼好光學級雙面膠,將板材放入雕刻機中分別雕刻出三層,再放入超聲波清洗機中清洗 20 min,取出烘干30 min,放入真空貼合機中常溫鍵合。
我認識遲羽那會兒她才十六歲,剛滿了最低年齡限制就跑去國外考了個PADI的探險潛水員證書。此后每次見她,她都會告訴我最近又玩了什么新項目:蹦極、滑板、雪板、賽車、空中沖浪……
2)使用CO2激光雕刻法批量制作PMMA芯片,簡化了芯片加工工藝,節省加工成本。灰度值法顯示兩種溶液均可在通道出口處完全混合均勻,低溫保護劑溶液所需混合長度為40 mm,去除溶液所需混合長度為55 mm,折光儀法測試保護劑溶液和去除溶液均可在通道內實現溶液濃度線性變化,所設計的 PMMA 混合系統可滿足實驗需求。
3)微流體法與多步平衡法相比體積變化速率可降至0.211 7%V0/s,并顯著提高卵母細胞的存活率與激活處理后的發育率。微流體法的3組中,8 min 組的存活率、卵裂率和囊胚率(93.25%、77.12%、53%)顯著高于其余2組,且存活率和囊胚率與對照組無顯著性差異。
微流體混合系統的使用優化了卵母細胞玻璃化保存步驟,為卵母細胞及胚胎的自動玻璃化保存及一體化裝置的研制提供了新思路。下一步將開發基于微流控技術的卵母細胞及胚胎自動玻璃化保存裝置,實現高自動化、標準化的卵母細胞及胚胎玻璃化保存。
本文受上海市促進市級醫院臨床技能與臨床創新能力三年行動計劃重大臨床研究項目(SHDC2020CR3077B)資助。(The project was supported by Clinical Research Plan of SHDC(No.SHDC2020CR3077B).)

