屏障環境中IVC小鼠飼養微環境控制方法研究
龔光彩 賀習之 陳盟君 陳 湘 彭 佩 余望貽
(1 湖南大學土木工程學院 長沙 410082;2 湖南中醫藥大學實驗動物中心 長沙 410208)
實驗動物作為生命科學研究必備的基本條件,對生物工程、生物醫學等領域均起到重要作用[1]。大部分實驗動物受室內環境因素變化影響較大,如室內氣流速度過大會增加實驗動物表面散熱量,而溫濕度、氨氣質量濃度等參數若不控制在相應適宜范圍內也會影響實驗動物的生長繁殖,因此必須控制實驗動物的飼養環境使環境因素對實驗的影響最小化[2-3]。實驗動物房作為實驗動物繁育、飼養、實驗的地點,其環境的控制不僅關系到實驗動物的福利及身心健康,更是保障實驗數據可靠性和可重復性的關鍵,對生命科學實驗研究的結果和水平具有深遠影響[4-7]。在新冠疫情期間,通過實驗動物對不同模式的生物體進行臨床前研究將為開發疫苗、測試治療藥物的安全性和有效性提供重要參考依據,為提高實驗精度,飼養環境控制的重要性尤為突出[8]。
我國SPF級(清潔實驗動物和無特定病原體)實驗小鼠普遍飼養在屏障環境下的獨立通風籠具(independent ventilation cage,IVC)中。IVC系統由控制主機、籠架、籠盒和獨立送排風系統組成,各獨立密閉籠盒自帶送排風接頭,獨立送排風系統將空氣過濾后分別送入籠盒中[4],從而為實驗動物提供相對密閉穩定的飼養環境。該系統具有避免盒與盒之間或動物與人之間的交叉污染、維護實驗動物福利、經濟節能等優勢[9-10]。
IVC系統將籠盒內環境與實驗室大環境即外環境隔離,其中與實驗動物的飼養質量關系更為密切的是貼近實驗動物周圍或實驗動物主要活動范圍內的環境,該環境可被理解為一種面向對象的目標微環境,也被稱為實驗動物飼養微環境[11]。微環境中各項重要指標的控制仍主要依賴于室內大環境和凈化空調系統的調節作用[12],而實際使用中,IVC凈化空調系統會同時對籠盒內環境和外環境進行調控[13-14]。因此,本文旨在針對IVC飼養微環境的控制方法進行研究以對現有實驗動物房凈化空調系統性能的提升提供思路。
為研究IVC飼養微環境的控制方法,國內外眾多學者從換氣次數、溫濕度、氨氣質量濃度、墊料種類等方面進行了大量研究[15-17]。已有研究多采用對籠內參數直接測量的方式,很少結合現場應用的籠盒采用針對內部飼養微環境的模擬和測試方法。現有主要測量方式如下:1)打開籠盒迅速將儀器放入籠盒內測量;2)檢測儀的檢測端口通過飲水瓶瓶嘴孔進入籠盒測量或提前在籠盒上開孔使檢測端口進入籠盒測量[12,18-19]。綜上可知,由于IVC飼養微環境的特殊性,難以在不破壞籠盒內流場并盡量減少對實驗動物干擾的情況下測量IVC飼養微環境內各參數的具體分布。此外,現有研究多為針對同一籠盒的不同指標進行測量,較少考慮同一系統中不同籠位對飼養微環境的影響。因此,本文針對上述問題,對湖南省某高校實驗動物中心一間SPF級實驗動物房實際飼養小鼠時的獨立通風籠盒內的飼養微環境特性進行模擬研究;并與實驗方法相結合,在輔助模型搭建和模型驗證外進一步研究飼養微環境與外環境的關系。
1 研究對象
1.1 實驗場地
本文以湖南省某高校實驗動物中心一間SPF級實驗動物房[SYXK(湘)2019-0009]為實驗場所。實驗動物房各項目參數如表1所示,平面布置如圖1所示。實驗動物房外環境采用吊頂中央送風底部四角回風的氣流組織形式,內部擺放4臺IVC籠架,每臺配置8×8個籠位。

表1 實驗動物房各項目參數Tab.1 Parameters of each item of laboratory animal room
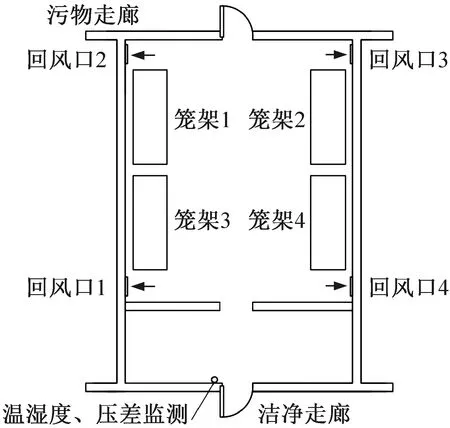
圖1 實驗動物房平面布置Fig.1 Arrangement of the laboratory animal room
1.2 IVC凈化空調系統
IVC凈化空調系統流程:室外空氣經凈化空調箱處理送入總風管后分成兩路,一路送入各實驗動物房外環境,一路增壓后送入IVC籠架的送風管,由籠盒蓋靜壓窗送至籠盒內;同理,籠盒內的排風和外環境排風經增壓后進入總排風管。IVC飼養間采用全膜終端式過濾,飼養間自帶的外環境溫濕度及壓差監控儀表布置于門口處。
1.3 實驗動物
實驗動物為購于湖南斯萊克景達實驗動物有限公司的SPF級KM雄性小鼠25只[SCXK(湘)2019-0004],體重為18~25 g。實驗小鼠養于5個IVC籠盒內,每籠5只,正常飼養喂水。另加一空態籠盒為空白對照組,除不飼養動物外與其他5個籠盒配置保持一致。6個籠盒全部放置于籠架4由下至上第五層的籠位中。
2 研究方法
2.1 飼養微環境的數值模擬方法
2.1.1 幾何模型建立
該籠盒模型以實驗動物房實際應用的FENGSHI GROUP的FS-003-1號小鼠籠盒為參考,尺寸為0.38 m×0.18 m×0.18 m(長×寬×高),實體主要由塑料底蓋、盒蓋、鋼絲網蓋及飲水瓶組成,采用上送上回的氣流組織形式。模型中不考慮飲水口的大小及不銹鋼網蓋對氣流阻攔作用,簡化模型如圖2所示。為建立小鼠模型,以KM小鼠為參考,根據體型特征和計算表面積建立了多種模型,兼顧網格質量及計算時間后最終采用的小鼠模型如圖3所示。
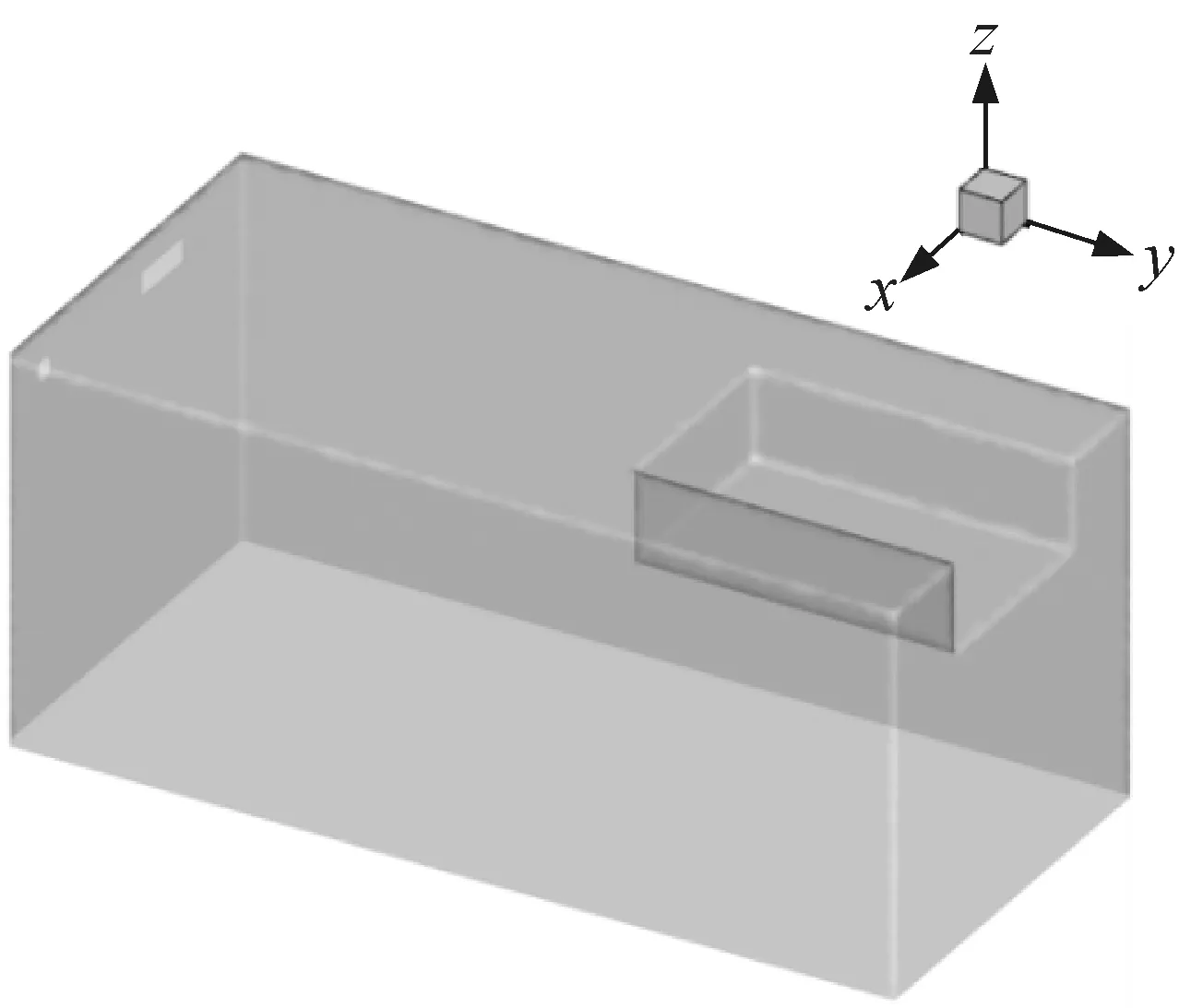
圖2 IVC籠盒簡化模型Fig.2 Simplified model of IVC
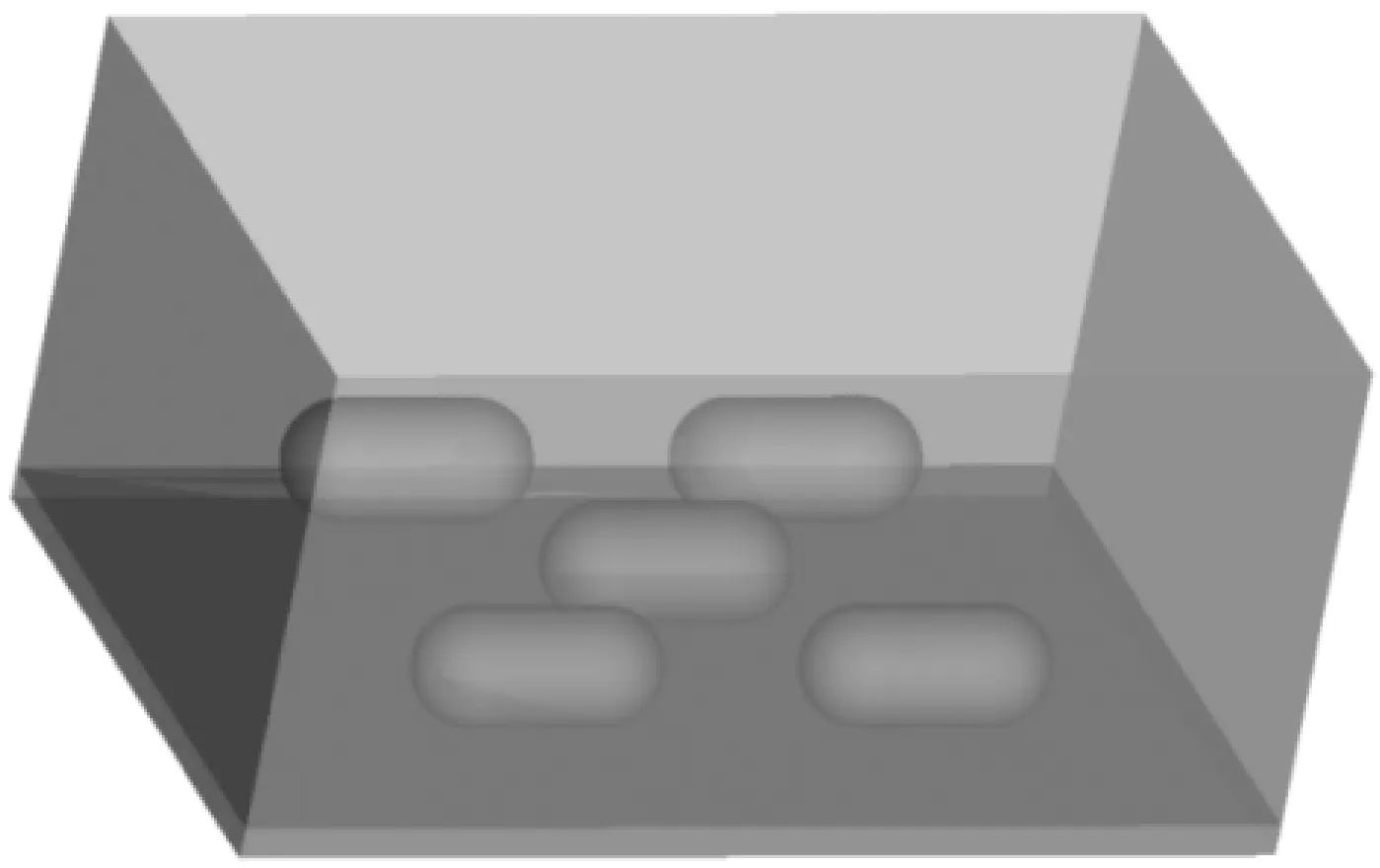
圖3 KM小鼠簡化模型Fig.3 Simplified model of KM mice
2.1.2 實驗室小鼠傳熱分析方法
實驗室小鼠與環境不斷進行能量交換以保證體內熱量的動態平衡。與人體散熱相似,小鼠主要散熱方式包括輻射散熱、對流散熱、蒸發散熱、排泄散熱。由于小鼠的排泄量較少,又因長期生活在鋪有厚墊料的籠盒內,小鼠體表可看作毛發和空氣,因此排泄散熱和輻射散熱可忽略。熱平衡方程如下[20]:
Q=Qc+Qe
(1)
式中:Q為全散熱量,W;Qc為對流散熱量,W;Qe為蒸發散熱量,W。
由于小鼠表面真實流態速度場復雜,模擬中簡化為平均散熱模型,由式(2)計算自然對流與受迫對流的綜合對流換熱表面傳熱系數hc(W/(m2·℃))[20]:
(2)
式中:hnc為自然對流換熱表面傳熱系數,W/(m2·℃);hfc為受迫對流換熱表面傳熱系數,W/(m2·℃)。根據GB 50447—2008《實驗動物設施建筑技術規范》[21]規定的動物實驗區環境指標范圍,一般情況下小鼠表面風速與環境的溫差分別小于0.2 m/s、15 ℃,宜采用Winslow和Rapp的經驗公式[20]。通過計算得到綜合對流換熱表面傳熱系數約為5.56 W/(m2·℃)。
對于蒸發散熱部分,小鼠無汗液蒸發散熱量,僅有呼吸散熱量,計算如下[22]:
Qe=0.017 3M(5.867-pa)+0.001 4M(34-ta)
(3)
式中:M為小鼠的代謝量,W,可與人體代謝量進行換算[21];pa為環境空氣中的水蒸氣分壓力,Pa;ta為小鼠附近空氣溫度,℃。
根據 Meeh-Ruhuer式計算小鼠的散熱體表面積[23]:
A=KW2/3/1 000
(4)
式中:A為體表面積,m2;K為常數,隨動物不同而不同;W為質量,g,小鼠的質量約為20 g[21]。通過計算得到小鼠的體表面積為0.006 9 m2。
2.1.3 飼養微環境模擬方法及邊界條件
本文采用RNGk-ε湍流模型進行模擬,SIMPLE壓力速度耦合算法求解。控制方程為連續性方程、動量守恒方程、能量守恒方程。以氨氣作為污染物,考慮氨氣密度與空氣的差異,豎向加速度設置為-9.8 m/s2。
通過前期調查與實驗測量,IVC籠盒的邊界條件設置如下:
1)籠盒換氣次數常用送風風速進行計算[24],因此用籠盒送風風速代表不同的換氣次數。經實驗測量籠架不同位置處送風風速的變化范圍在2.79~4.94 m/s之間,因此主要模擬了送風風速為2.79、4.94 m/s的籠盒狀態以對比不同換氣次數下的飼養微環境;出風口為自然邊界條件。
2)送風溫濕度根據測量結果設置為23 ℃、30%。
3)僅考慮籠盒內部的傳熱傳質,籠盒周圍壁面作為絕熱壁面處理。
4)小鼠散熱模型采用生物傳熱模型,表皮溫度為37 ℃且均勻散熱。
5)通過實際觀察,由于實驗期間墊料不進行更換,小鼠頻繁活動會使小鼠糞便充分混合于墊料中并使籠內各處墊料厚度趨于一致,因此把墊料面作為均勻穩定散氨源。
污染物邊界條件采取根據通風量和質量濃度推算源散發量的方法,全面通風換氣次數計算如下[25]:
(5)
式中:L為全面通風量,m3/s;KS為安全系數,通常取3~10,為討論最不利于氨氣稀釋排放的情況,本文取3;qm為氨氣散發量,mg/s;C0為送風空氣中氨氣質量濃度,mg/m3,因采用全新風,取0;C為穩定時室內氨氣質量濃度,mg/m3,根據美國國立圖書館提供的實驗數據,0.23 m×0.45 m×0.165 m(長×寬×高)的通風籠盒內飼養兩只小鼠,送風量為56 L/min,平衡后氨氣質量濃度維持在0.23 mg/m3[25]。通過計算得到每只小鼠的氨氣散發量為3.5×10-5mg/s,墊料面氨氣散發量為1.8×10-4mg/s。
2.1.4 網格劃分及網格無關性驗證
模擬采用ICEM軟件繪制模型和生成非結構化網格,用FLUENT軟件進行計算。為進行網格無關性驗證,正式計算前選擇903 658、1 275 275、1 734 664三種網格密度不同的網格試算,并在小鼠附近和籠盒上部設置不同監測點檢測風速,結果表明,903 658、1 275 275兩種網格試算后監測點風速最大相對誤差為7.63%,1 275 275和1 734 664兩種網格最大相對誤差為1.33%,計算結果接近,因此正式計算選擇的網格數為1 275 275。
2.2 飼養微環境的實驗測量方法
該實驗按照3R原則進行,經實驗動物中心倫理委員會審批[LLBH-202101050001]。對IVC飼養間的籠內送風風速、溫濕度環境特性以及氨氣質量濃度分布特性等參數進行實測。小鼠飼養前3天為適應性喂養,期間不進行實驗。
籠盒內外測點布置如圖4所示,由圖4可知,溫濕度和氨氣質量濃度的籠盒內測點位置選取在籠盒內上部空間以避免小鼠抓咬。籠盒外根據與籠具距離不同選擇兩組測點,設于籠盒外表面的測點為近處外環境測點,外環境4個回風口處測點為遠處外環境測點。實驗所用器材與測量方法如表2所示。
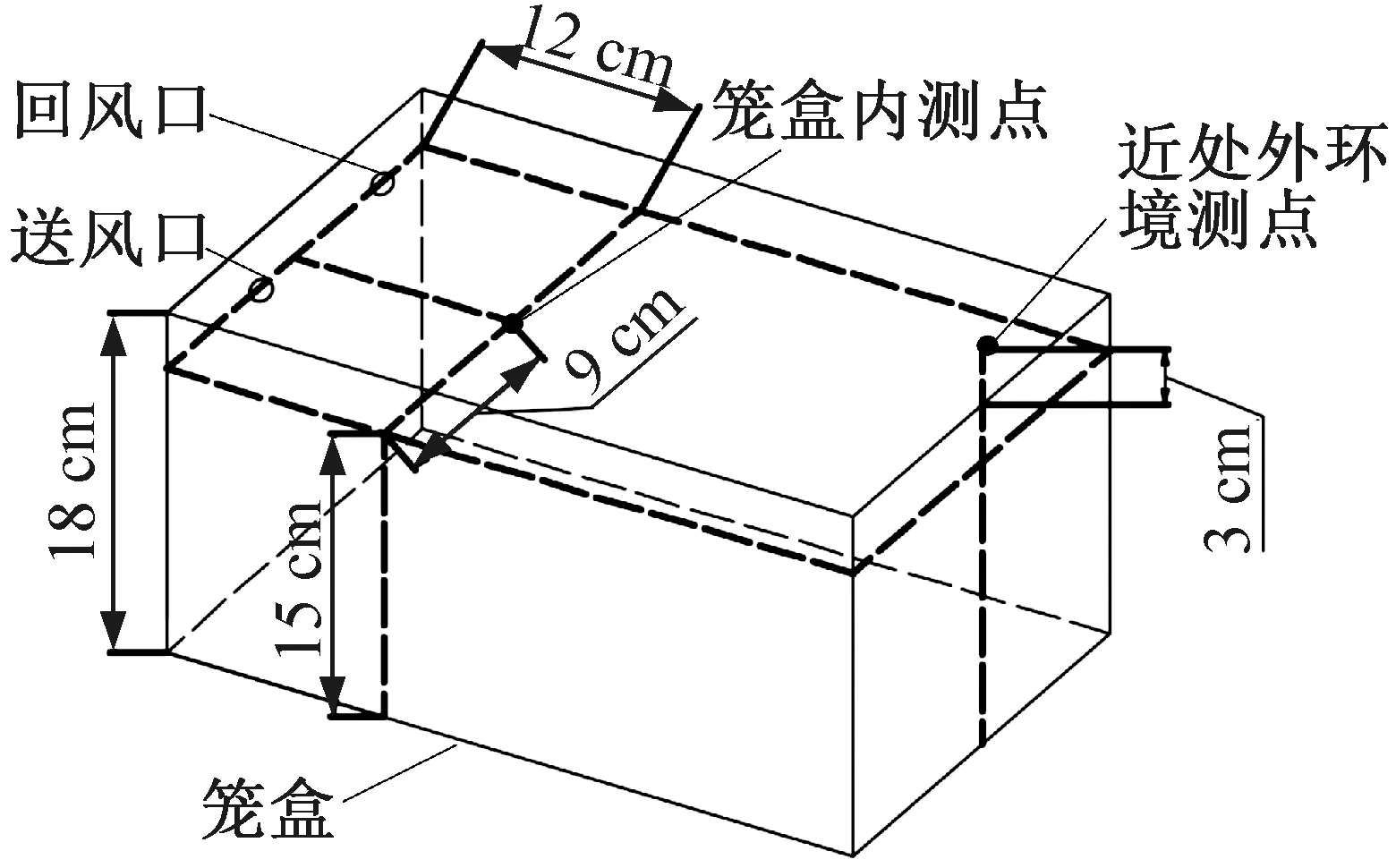
圖4 籠盒內外測點布置Fig.4 Layout of measuring points

表2 實驗儀器及測量方法Tab.2 Experimental instruments and measurement methods
3 結果與分析
3.1 模型驗證
為驗證模型有效性,以實驗中5個飼養小鼠的籠盒日平均送風風速為參考,利用所建模型對籠盒內溫度場進行模擬計算,并將籠盒內溫度測點的模擬數據與實驗值進行對比,對比結果如表3所示。誤差應是由籠盒壁面進行絕熱假設引起的,該模型滿足誤差要求,具有較好的適用性。在實際的實驗動物房運行維護中仍使用攝氏溫度進行調控,因此后續溫度模擬和實驗結果均換算為攝氏溫度表示。
為進一步驗證籠盒內飼養微環境溫度場分布模擬結果,利用紅外熱像儀拍攝小鼠在自由活動狀態下的熱成像圖,如圖5所示。送風風速為3.50 m/s,距離籠盒底部0.03 m處的模擬結果如圖6所示。由圖5、圖6可知,自由活動時小鼠的表面溫度約為37 ℃,小鼠附近即飼養微環境溫度約30.9 ℃,均與模擬結果接近。

表3 籠內測點模擬值與實測值對比Tab.3 Comparison of simulated and experimental values for temperature measuring points

圖5 小鼠自由活動時溫度分布Fig.5 Temperature distribution during free movement in mice
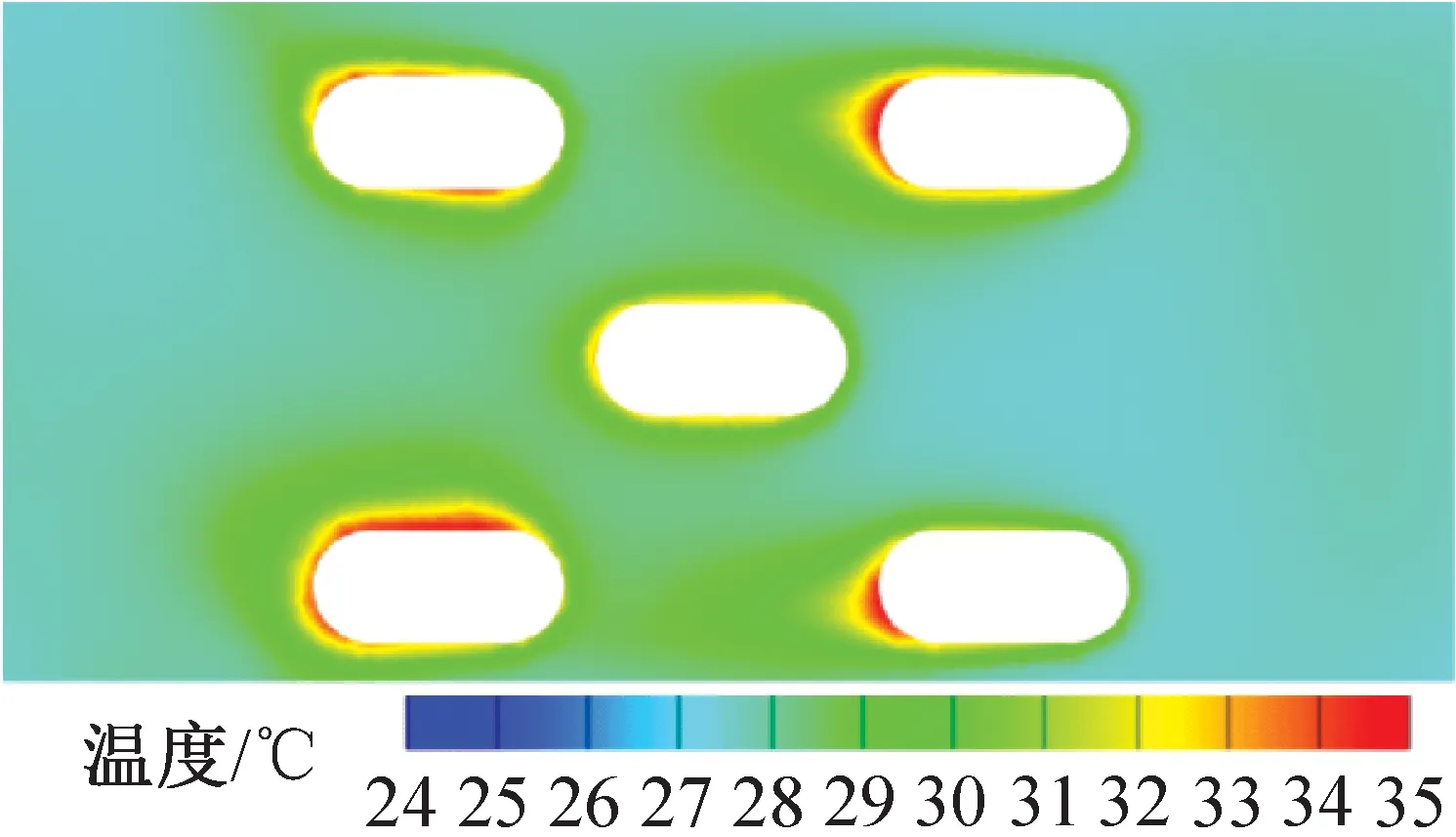
注:圖中空白處為KM小鼠截面(下同)。圖6 溫度分布云圖(z=0.03 m)Fig.6 Temperature distribution (z=0.03 m)
3.2 飼養微環境的風環境分析
3.2.1 飼養微環境的風環境模擬結果
IVC小鼠飼養微環境的風環境模擬結果如圖7和圖8所示。送風口側和回風口側的籠盒截面分別對應x=0.15 m、 0.03 m截面。由圖7、圖8可知,不同送風速度下主流區域的速度分布相似,籠盒下部的氣流漩渦碰到小鼠表面上移。送風風速為2.79 m/s(實測最小送風風速工況)和4.94 m/s(實測最大送風風速工況)時籠盒內的平均風速分別為0.14 m/s和0.24 m/s;送風風速為2.79 m/s時送風口截面和回風口截面的平均風速分別為0.28 m/s和0.11 m/s,相差60.7%;送風風速為4.94 m/s時送風口截面和回風口截面的平均風速分別為0.47 m/s和0.20 m/s,相差57.4%。位于送風口側的小鼠周圍氣流速度顯著高于回風口側的小鼠。
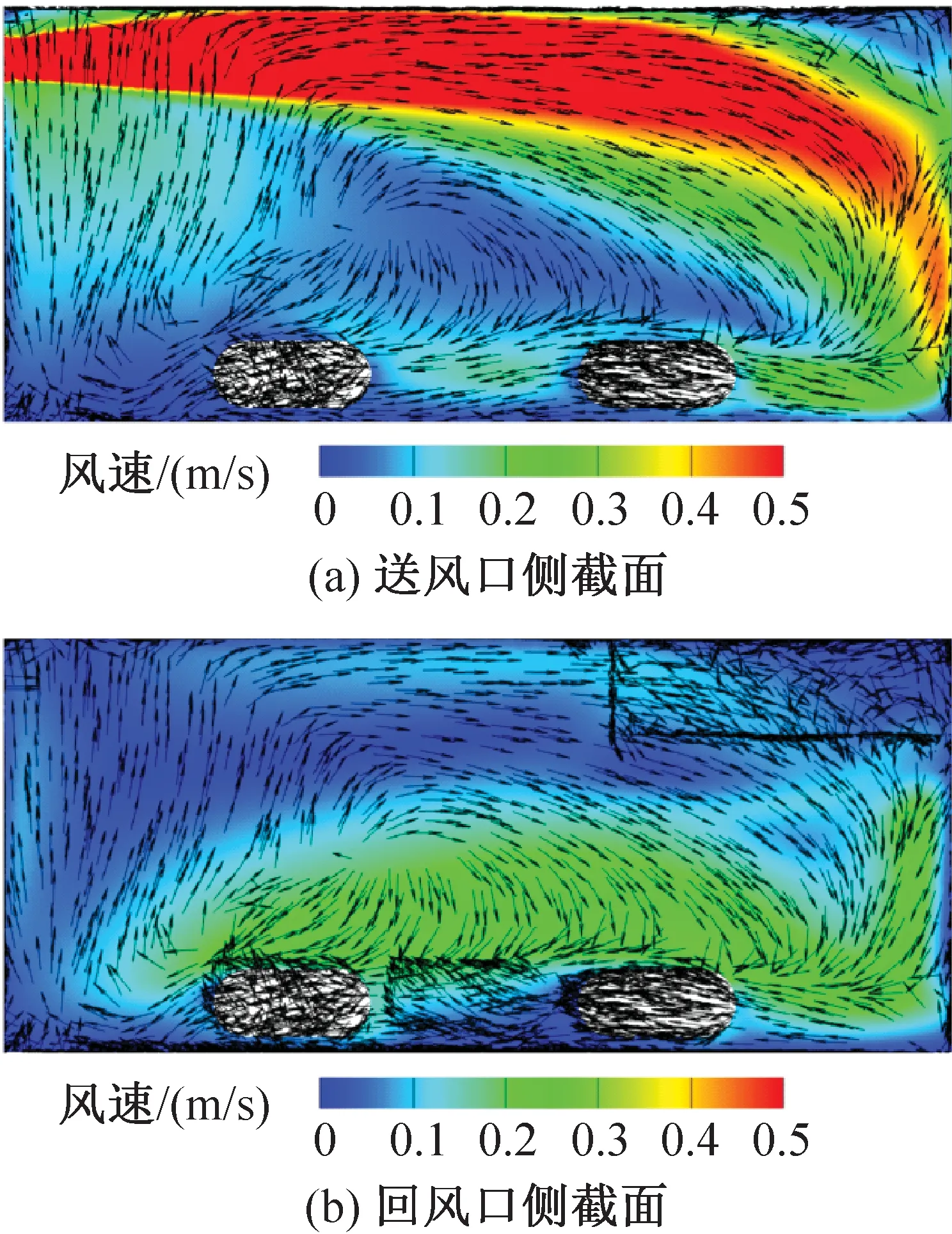
圖7 送風速度為2.79 m/s時籠盒內氣流速度云圖Fig.7 Velocity distribution at speed of 2.79 m/s
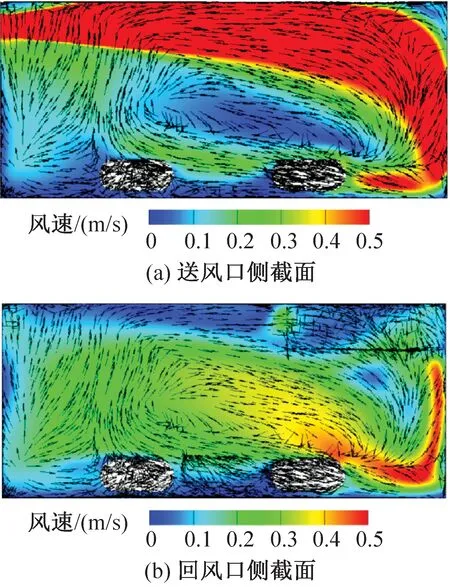
圖8 送風速度為4.94 m/s時籠盒內氣流速度云圖Fig.8 Velocity distribution at speed of 4.94 m/s
上送上回的氣流組織形式還易使籠盒上部及小鼠背部形成高風速區,當送風速度為4.94 m/s時,小鼠背部一側的部分風速達到0.3 m/s以上,已經超過標準規定的0.2 m/s。在實際的實驗觀察中,小鼠也更傾向于待在籠盒的前側,即風速較低的區域。
3.2.2 斜體飼養微環境的風環境實測結果
IVC系統各籠盒內飼養微環境送風風速如圖9所示,實驗期間送風風速總體變化范圍在2.79~4.94 m/s之間,籠盒日平均送風風速變化范圍在2.85~3.57 m/s之間。由于IVC凈化空調系統對飼養微環境和外環境分別加壓送風,微環境送風風速基本不受外環境支路波動影響,而受系統特性的影響較大。由圖9可知,隨著籠位垂直高度增加,籠盒的送風風速逐漸增大;籠架同一層內,與主風管距離不同的籠盒送風風速也存在差異,這與籠架送風管道的布置形式造成的垂直和水平氣力(水力)失調有關。飼養微環境的送風風速直接影響單個籠盒的送風風量或換氣次數,進而影響動物的健康和行為[26]。在實際應用中,定期將位于籠架不同高度處的籠盒調換位置,從消除風環境對實驗動物的影響的角度,該行為措施具有一定合理性。
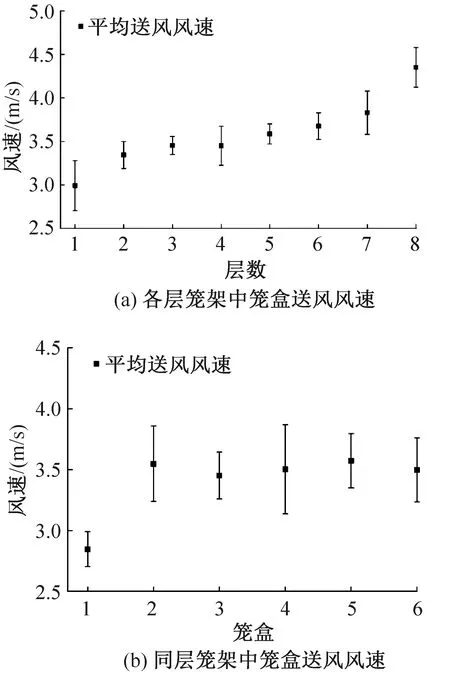
圖9 同一IVC系統中不同位置處籠盒送風風速Fig.9 Air supply speed of cage at different positions in the same IVC system
結合模擬與實驗結果,在設置IVC空調系統換氣次數時,應以所有籠盒中兩個空氣分布最不利處的情況為準,即因氣力(水力)不平衡造成的送風風速過大處和風速過小處,保證其維持最小換氣次數要求的同時兼顧籠內氣流組織分布。目前調節IVC籠具內送風風量主要是通過改變系統總風量或對同一IVC籠架的送風量[27],而缺少對各個籠盒的調控裝置。建議增設籠盒送風口的入口調節裝置以調節水力平衡、改善氣流組織,減小不同位置籠盒內飼養微環境的差異。
3.3 飼養微環境的熱環境分析
3.3.1 飼養微環境的熱環境模擬結果
圖10、圖11為兩種送風風速下的IVC飼養微環境的溫度分布模擬結果。送風速度為 2.79、4.94 m/s 時籠盒內平均溫度分別為 27.8、27.6 ℃。
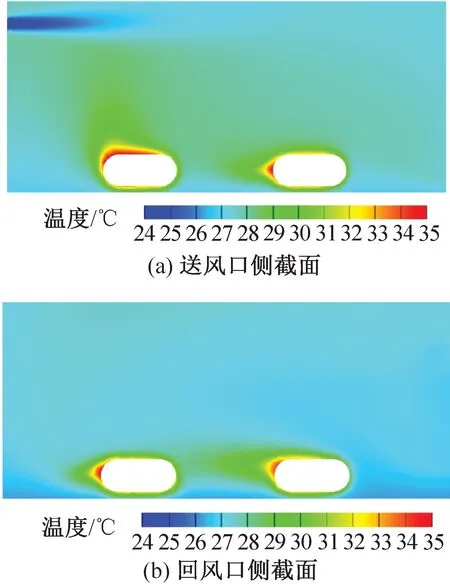
圖10 送風速度為2.79 m/s時籠盒溫度云圖Fig.10 Temperature distribution at speed of 2.79 m/s

圖11 送風速度為4.94 m/s時籠盒溫度云圖Fig.11 Temperature distribution at speed of 4.94 m/s
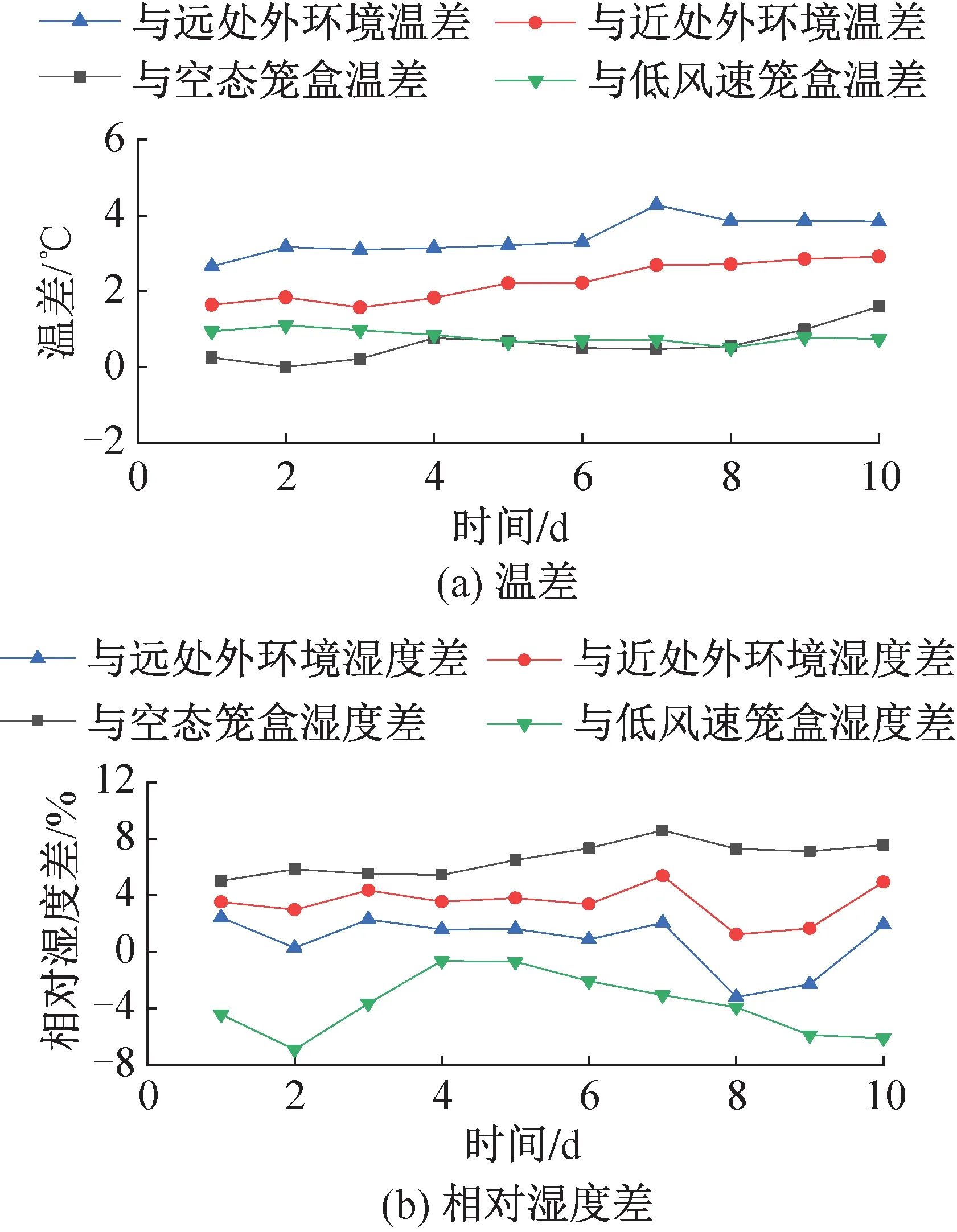
圖12 高風速籠盒內外溫濕度差變化特性Fig.12 Differences of temperature and relative humidity between microenvironment and macroenvironment at high air supply speed
結合氣流速度云圖可知,風速場對溫度場的分布影響較大,風速較大的區域溫度一般較低,渦漩處可能造成局部高溫,導致溫度分布不均。主流氣流碰撞到籠壁返回造成小鼠下側溫度較低,但實際籠盒底部粗糙的墊料能有效保溫并分散氣流,因此小鼠下側的溫度降低不顯著。
3.3.2 飼養微環境的熱環境實測結果
圖12、圖13所示為飼養實驗動物的5個籠盒中日均送風風速最高和最低的兩個籠盒(日均送風風速為3.57、2.85 m/s)分別與空態籠盒、近處外環境、遠處外環境和兩籠盒彼此之間的溫濕度差值隨時間的變化。籠盒外表面附近即籠盒近處外環境測點與回風口處即籠盒遠處外環境測點的平均溫度分別為23.7、22.5 ℃,實驗期間最高相對濕度分別為53.8%、57.1%。所有籠盒內部溫濕度最高可達到27.0 ℃、54.0%。雖然IVC空調系統對籠盒內的送風濕度僅為30%,但由于小鼠自身的散濕量和飲水瓶滴水蒸發,籠盒內濕度可以保持在40%~50%之間,符合規范要求。
實驗期間所有實驗籠盒內部與籠盒近處外環境的溫濕度差最高可達3.6 ℃、11.0%,飼養微環境與外環境差異顯著,且由圖12、圖13可知,離籠盒越遠,外環境與飼養微環境的溫度差越大,而濕環境差的變化則相反。但飼養間自帶儀表僅能檢測外環境固定測點的參數,不能反映實驗動物實際生活區域的飼養微環境狀況,也不能準確描述外環境參數分布。因此,從提高飼養微環境控制精度、保護實驗人員安全的角度出發,有必要對IVC系統外環境和飼養微環境提出更高的指標檢測要求。
實驗期間所有實驗籠盒內部與空態籠盒的溫濕度差最高可達2.7 ℃、18.0%,由圖12、圖13可知,由于風速引起的溫度差異與是否飼養小鼠引起的溫度差異接近,在實際應用中送風風速對飼養微環境的溫度分布影響可能與小鼠的影響相當,應給予充分考慮。
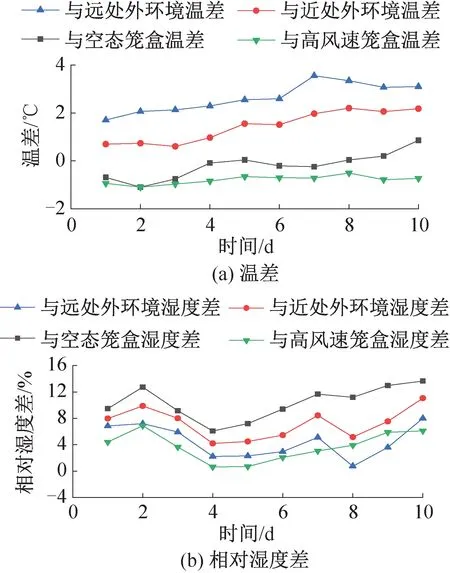
圖13 低風速籠盒內外溫濕度差變化特性Fig.13 Differences of temperature and relative humidity between microenvironment and macroenvironment at low air supply speed
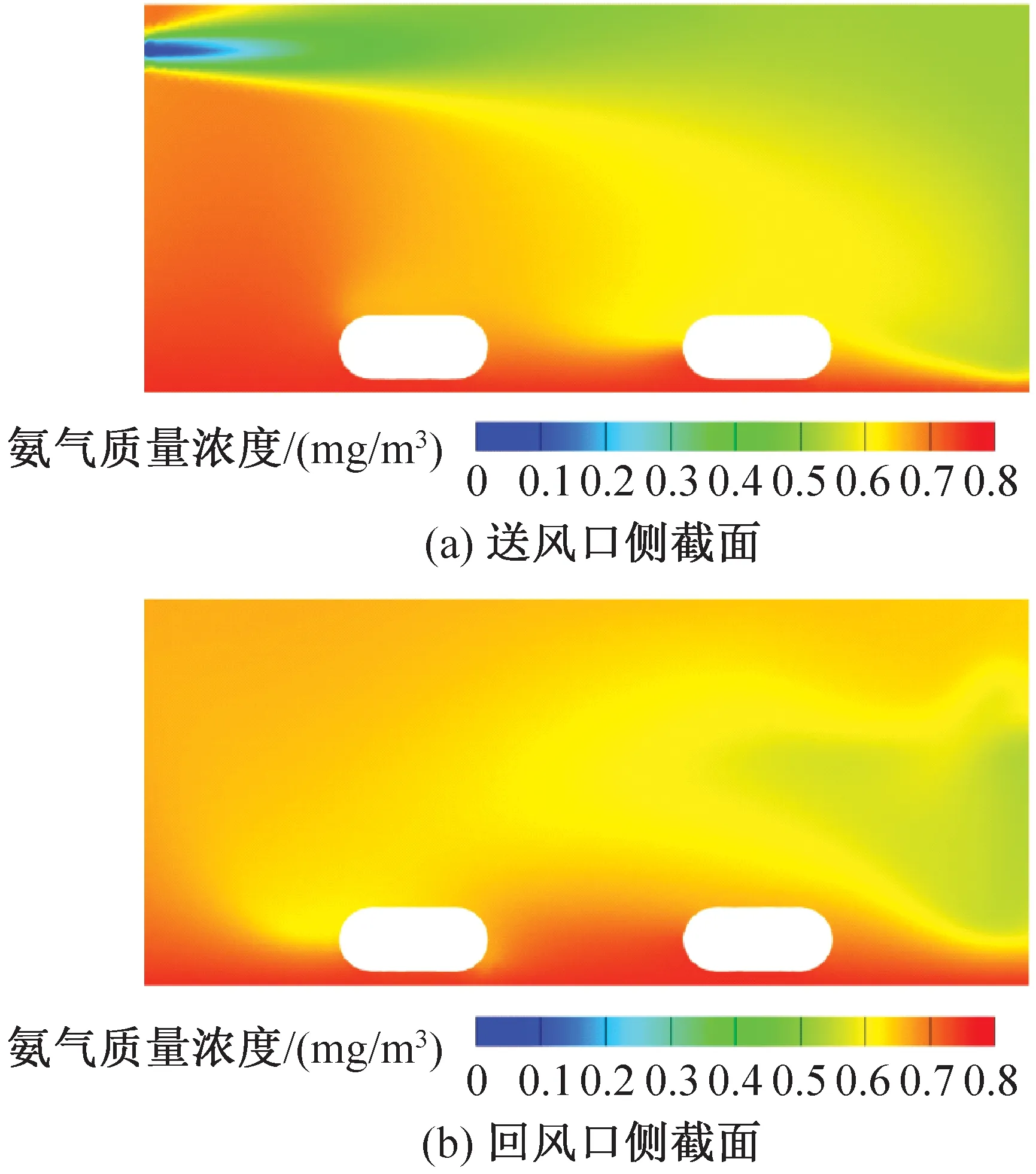
圖14 送風速度為2.79 m/s時籠盒氨氣質量濃度云圖Fig.14 Mass concentration distribution of ammonia in cage at speed of 2.79 m/s
3.4 飼養微環境的氨氣質量濃度分析
3.4.1 飼養微環境的氨氣濃度模擬結果
飼養微環境氨氣質量濃度模擬結果如圖14、圖15所示。由圖14、圖15可知,送風速度分別為2.79、4.94 m/s的籠盒內部平均氨氣質量濃度分別為0.63、0.60 mg/m3。送風風速較小時小鼠飼養微環境的氨氣質量濃度更高,送風風速越大越利于氨氣的稀釋和排放。目前的IVC系統滿足規范要求,處于最不利處即送風速度為2.79 m/s的籠盒中氨氣質量濃度仍在規定范圍之內。
氨氣由墊料面向外擴散,由于氣流漩渦和流向作用,小鼠飼養微環境中氨氣質量濃度較高,高濃度區主要集中于籠盒前側,即靠近送回風口一側。相比送風口側的小鼠,回風口側由于受主流氣流的影響較小,小鼠被較高的氨氣濃度包圍。結合溫度分布云圖和速度分布云圖可知,IVC籠盒內溫度場和氨氣質量濃度分布均受風環境影響,且二者有相對一致的分布規律,符合廣義雷諾比擬法則。因此在實際設計IVC凈化空調系統時應同時考慮多參數的相互影響,使最不利處籠盒飼養微環境指標符合要求,保證實驗動物福利。
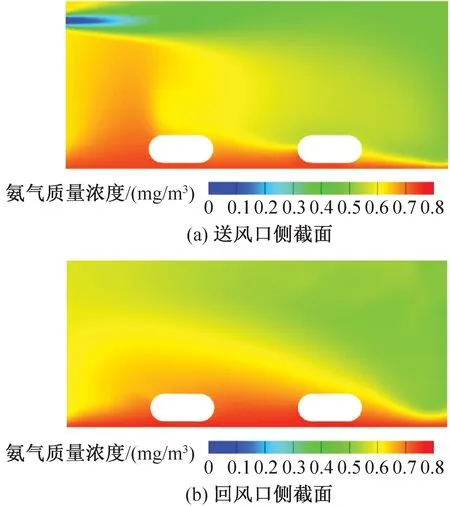
圖15 送風速度為4.94 m/s時籠盒氨氣質量濃度云圖Fig.15 Mass concentration distribution of ammonia in cage at speed of 4.94 m/s
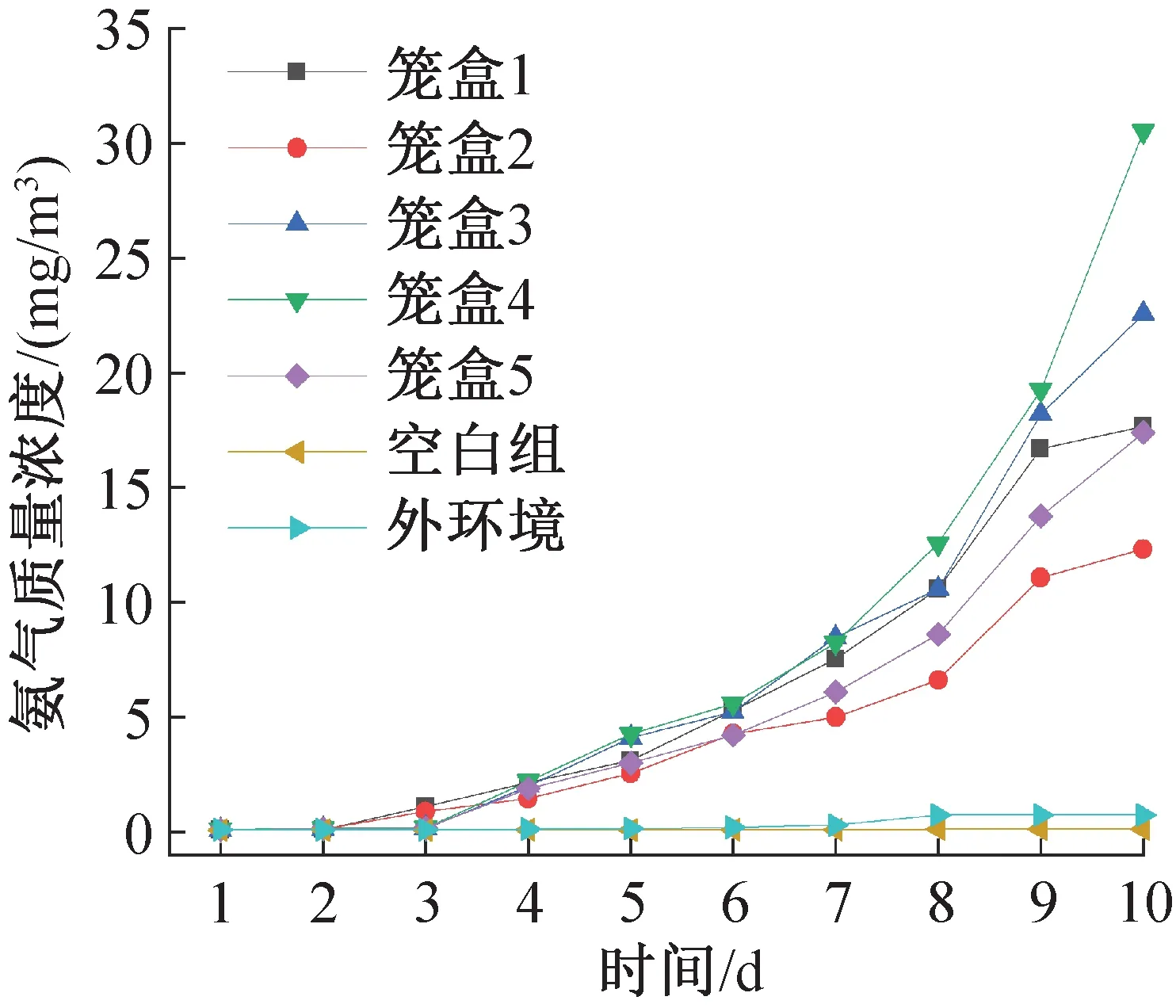
圖16 氨氣質量濃度隨時間的變化Fig.16 Variation of ammonia mass concentration with time
3.4.2 飼養微環境的氨氣質量濃度實測結果
圖16所示為連續10天測得的各實驗籠盒內部、空態籠盒及外環境的氨氣質量濃度隨飼養天數的變化。因組裝籠盒時氨氣從外環境進入籠盒以及籠盒存在一定泄漏,第一天籠盒內的氨氣質量濃度不為0。隨著天數的增加,由于籠盒的阻礙以及外環境的氣流組織擴散作用,外環境與空白籠盒的氨氣質量濃度值穩定在0.1 mg/m3以下。由于外環境會在更換飲水瓶或進行其他操作時與飼養微環境進行物質交換,外環境氨氣質量濃度會略高于空態籠盒。飼養微環境的氨氣質量濃度在第4天開始急劇升高,第9天時已有兩個籠盒內的氨氣質量濃度大于15 mg/m3,超過了規范規定的14 mg/m3限值,因此實際操作中規定的7天換一次籠盒與墊料是合理的。
4 結論
本文通過對湖南省某高校實驗動物中心一間SPF級實驗動物房的IVC小鼠飼養微環境(本文的飼養微環境即針對籠盒內部小鼠主要活動范圍)進行數值模擬分析和實驗測量,發現該實驗動物房籠盒內小鼠飼養微環境滿足規范要求,得到如下結論:
1)籠盒內小鼠飼養微環境的氣流組織分布有較大改進空間。位于送風口側飼養微環境氣流速度顯著高于回風口側;上送上回系統中部分籠盒內小鼠背部一側的風速可達0.3 m/s以上,易超過標準規定風速,不利于保證動物福利與安全。
2)對于IVC系統,飼養微環境受自身送風支路布置形式及氣力(水力)失調影響較大,位于同一籠架不同位置的籠盒內送風風速存在顯著差異,送風風速變化范圍在2.79~4.94 m/s之間。實際設計時應以最不利送風風速為基準,建議籠盒送風口的入口加上調節裝置,調節水力平衡并改善籠盒內飼養微環境的氣流組織,減小不同位置籠盒內飼養微環境差異。同時表明目前在實際應用中將位于籠架不同高度處的籠盒調換位置的措施是合理的。
3)IVC籠盒內溫度場和氨氣質量濃度分布均受風環境影響,且二者存在相對一致的分布規律,符合廣義雷諾比擬法則。實際設計IVC凈化空調系統時應同時考慮多參數的相互影響,使最不利處籠盒飼養微環境指標符合規范要求,保證實驗動物福利。
4)實驗室自帶檢測儀表僅能監測外環境局部狀況,從提高飼養微環境控制精度、保護實驗人員安全的角度出發,有必要對IVC系統外環境和飼養微環境提出更高的指標檢測要求。
本文受湖南省重點領域研發計劃(2020DK2003)和湖南省科技成果轉化及產業化計劃(2020GK2077)資助。(The project was supported by Research and Development Plan of Key Areas in Hunan Province(No. 2020DK2003)and Hunan Provincial Scientific and Technological Achievements Transformation and Industrialization Plan(No. 2020GK2077).)

