大腸桿菌醛醇脫氫酶的純化、分析及其在乙酰輔酶A測定中的應用
孫梅好, 劉 杰, 袁 熹, 蒲首丞, 鞏菊芳
(浙江師范大學 化學與生命科學學院,浙江 金華 321004)
從古細菌到哺乳動物,乙酰輔酶A(acetyl coenzyme A,Ac-CoA)在多種細胞過程中具有重要功能[1],作為一種中樞代謝中間體和第二信使,可調節細胞分解和合成代謝之間的平衡[2].乙酸是由單甲基和一個末端羧基組成的短鏈脂肪酸[3],屬于一元羧酸[4].乙酰輔酶A合成酶(acetyl-CoA synthetase,ACS)是具有一定底物特異性的大型酶超家族的成員,催化輔酶A與羧酸之間形成硫酯鍵,同時將ATP水解為AMP和焦磷酸鹽[5-6].ACS活性測定包括2種反應終止法:PPi[7]或14C標記Ac-CoA[8-10]的定量分析法,以及基于肌激酶、丙酮酸激酶和乳酸脫氫酶3種偶聯酶的AMP連續測定體系[7,11].目前尚缺乏直接連續測定Ac-CoA的反應體系.
醛醇脫氫酶(aldehyde/alcohol dehydrogenase,AdhE)是一種參與革蘭氏陰性細菌無氧代謝的雙功能酶[12].在許多乙醇發酵微生物中,乙醇生產的最后兩步是醛脫氫酶催化的Ac-CoA生成乙醛和醇脫氫酶催化乙醛生成乙醇.雖然許多醇脫氫酶可以催化醇脫氫反應,但能夠催化醛脫氫反應的唯一已知酶是AdhE,且該酶具有醛脫氫酶和醇脫氫酶雙結構域[13].AdhE氨基端的結構域與醛脫氫酶高度同源,而羧基端的結構域與Fe2+依賴的醇脫氫酶家族同源,其分別催化Ac-CoA生成乙醛、乙醛生成乙醇[14].該反應在發酵細菌的厭氧氧化還原平衡中具有關鍵性作用[15],對于細菌在厭氧狀態下生產乙醇極為重要[16].
AdhE直接催化Ac-CoA生成乙醇,且在此過程中消耗NADH(ε339=6.22 L·mmol-1·cm-1),使得以AdhE為偶聯酶直接連續測定Ac-CoA成為可能[17].本研究表達、純化了大腸桿菌AdhE,分析了其酶學動力學常數,并以AdhE為偶聯酶,對ACS酶活進行分析.結果表明,AdhE可以作為偶聯酶測定ACS酶活,并建立了直接連續測定Ac-CoA的反應體系.
1 材料與方法
1.1 菌株與載體
大腸桿菌DH5α及BL21(DE3),原核表達載體His9(源自pGEX-6P-1雙標簽表達載體,在PreScission Protease編碼區和BamH I識別位點之間加入NdeI識別位點,且融合蛋白GST的N端具有6×Histine)等,均保存于浙江師范大學化學與生命科學學院蛋白質結構與功能實驗室.
1.2 酶與生化試劑
ATP、輔酶A、還原型輔酶I(NADH)購自上海生工生物工程股份有限公司;鎳柱親和層析樹脂購自伯樂生命醫學公司;rTaq聚合酶、XhoI、BamH I、ScaI等購自寶日醫生物技術有限公司;無機焦磷酸酶(PPase)來自大腸桿菌的原核表達、純化[18];乙酰輔酶A合成酶購自湖北新德晟材料科技有限公司;其他常規生化試劑為國產分析純.
1.3 方 法
1.3.1AdhE基因克隆、表達與蛋白純化
參照細菌基因組提取試劑盒的使用說明,提取大腸桿菌DH5α基因組DNA.以所提取的基因組DNA為模板,利用PCR技術(AdhE-F:GGATCCATGGCTGTTACTAATGTCGCTGAAC;AdhE-R:CTCGAGTTAAGCGGATTTTTTCGCTTTTTTC)擴增AdhE基因.在AdhE基因的5′端和3′端分別添加限制性酶切位點BamH I和XhoI.所得PCR產物連接入表達載體His9,獲得載體His9-AdhE,經雙酶切驗證和測序驗證序列正確,通過熱激法轉化His9-AdhE載體入E.coliBL21(DE3)感受態細胞,獲得AdhE的表達菌株.將表達菌株接種到LB培養基中,培養至指數生長期(OD600=0.6),加0.5 mmol·L-1IPTG誘導蛋白表達(37 ℃,220 r/min,3 h);離心收集菌體,加入裂解液裂解45 min后,超聲波破碎菌體至澄清,高速離心后收集上清液.原核表達的AdhE氨基端有多聚組氨酸標簽,采用鎳柱親和層析法進行AdhE的分離純化[19].經咪唑梯度(25,50,100,150,250 mmol·L-1)洗脫得到AdhE,進一步透析并經Bradford法測定蛋白濃度后,存于-80 ℃保存備用.
1.3.2 醛醇脫氫酶(AdhE)活性測定
利用分光光度法(瓦里安UV 4000,安捷倫)測定AdhE酶活.因AdhE催化的2步反應中均有NADH參與,通過測定反應體系中NADH(ε339=6.22 L·mmol-1·cm-1)在適當條件下(pH、溫度)[20-21]光吸度的變化速率[22],可計算NADH的氧化速率,從而計算出AdhE的活性.AdhE的酶活測定體系為:1 μmol·L-1AdhE,1 mmol·L-1DTT,20 μmol·L-1FeSO4,100 mmol·L-1Tris-HCl(pH7.6),反應溫度為25 ℃.在測定酶的動力學常數時,改變其中一個底物濃度,固定另一個底物濃度為10倍Km[23].利用230 μmol·L-1Ac-CoA,分別以不同濃度的NADH(25,75,125,175,225,275,325,375和425 μmol·L-1)起始反應并測定NADH的氧化速率.利用0.4 mmol·L-1NADH,分別以不同濃度的Ac-CoA(5,20,40,80,120,160,200和230 μmol·L-1)起始反應并測定NADH的氧化速率.利用米氏方程進行數據擬合,分別獲得NADH和Ac-CoA的Km及Vmax.
1.3.3 乙酰輔酶A合成酶(ACS)活性測定
ACS催化乙酸與輔酶A合成Ac-CoA,Ac-CoA經由足量AdhE催化產生乙醇,同時氧化NADH.通過直接測量OD339隨時間的變化速率,可反映Ac-CoA合成速率,進而反映ACS的催化活性.ACS的酶活測定體系為:20 μmol·L-1AdhE,0.02 mmol·L-1ACS,5 μmol·L-1PPase,1 mmol·L-1DTT,20 μmol·L-1FeSO4,0.32 mmol·L-1CoA,0.4 mmol·L-1NADH,100 mmol·L-1Tris-HCl(pH7.6),反應溫度為35 ℃.根據前期預實驗得到的數據,利用1 mmol·L-1ATP與0.4 mmol·L-1MgCl2,分別以不同濃度的乙酸(0.2,0.5,0.8,1.0,1.5,2.0,2.5,3.5,4.5,5.3和7.0 mmol·L-1)起始反應并測定反應體系中NADH的氧化速率.利用7.0 mmol·L-1乙酸與適當濃度的MgCl2,分別以不同濃度的ATP(0.04,0.08,0.14,0.21,0.28,0.35,0.42,0.48,0.66,0.84,0.91和1.11 mmol·L-1)起始反應并測定NADH的氧化速率.利用米氏方程進行數據擬合,分別獲得乙酸和ATP的Km及Vmax.
2 結 果
2.1 大腸桿菌AdhE基因的克隆以及蛋白質的表達純化
AdhE基因的PCR擴增產物連接入載體His9(BamH I和XhoI),構建原核表達載體His9-AdhE.經雙酶切和瓊脂糖凝膠電泳驗證,各DNA片段大小與預期結果一致(AdhE基因為2 676 bp,His9載體為4 200 bp)(見圖1).AdhE基因序列進一步經過測序驗證,經大腸桿菌BL21(DE3)表達、親和層析純化獲得分子量為96 kD的AdhE(見圖2).
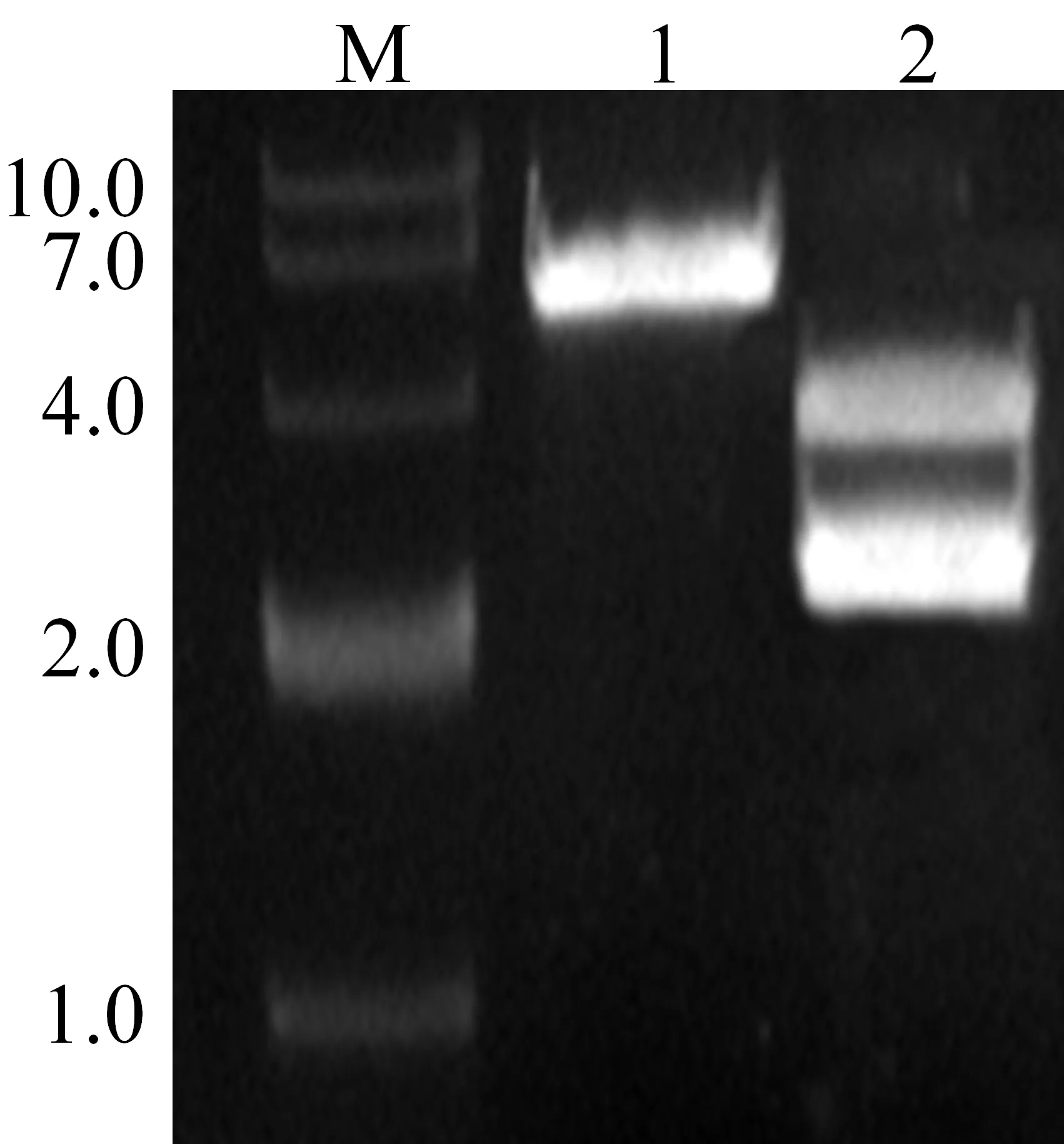
M:DNA分子量標準(kb);1:未經酶切的His 9-AdhE質粒; M:蛋白質分子量標準;1:誘導前菌體;2:誘導后菌體;2:雙酶切驗證各條帶 3:裂解后上清;4:純化后目的蛋白
2.2 AdhE的動力學常數測定
為了分析AdhE的酶學動力學常數,分別測定在不同NADH和Ac-CoA濃度條件下的反應速率,利用米氏方程進行擬合(見圖3),獲得由AdhE催化的依賴NADH的Ac-CoA還原反應kcat為13.8 min-1,NADH和Ac-CoA的Km值分別為(73.4±6.5)和(52.8±6.0) μmol·L-1(見表1).
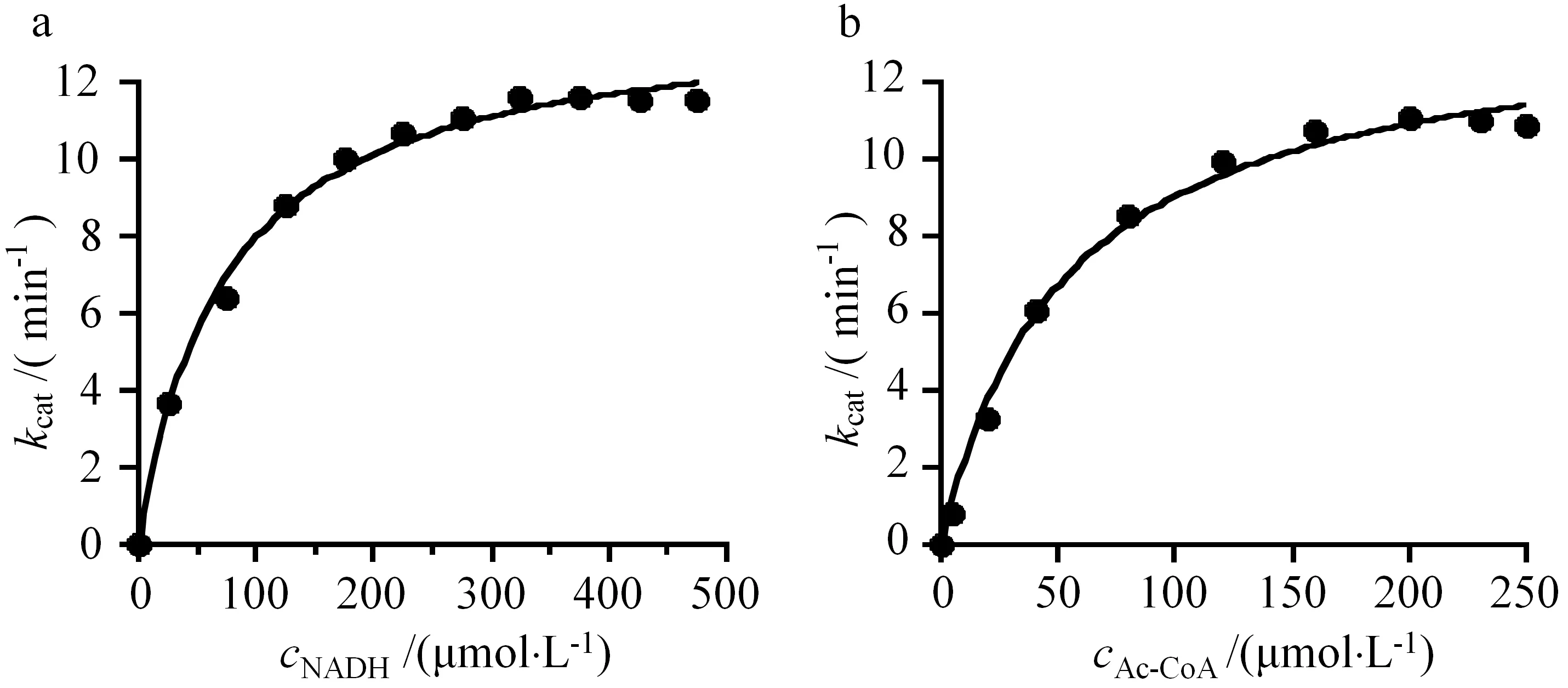
a:不同NADH底物濃度對反應速率的影響;b:不同Ac-CoA底物濃度對反應速率的影響

表1 AdhE的動力學常數
2.3 ACS的動力學常數測定
為了分析ACS的酶學動力學常數,以AdhE為偶聯酶,分別測定在不同乙酸和ATP濃度條件下的反應速率,利用米氏方程進行擬合(見圖4),獲得由ACS催化的Ac-CoA合成反應kcat為10.5 min-1,乙酸和ATP的Km值分別為(1.31±0.17) mmol·L-1和(150.1±14.70) μmol·L-1(見表2).
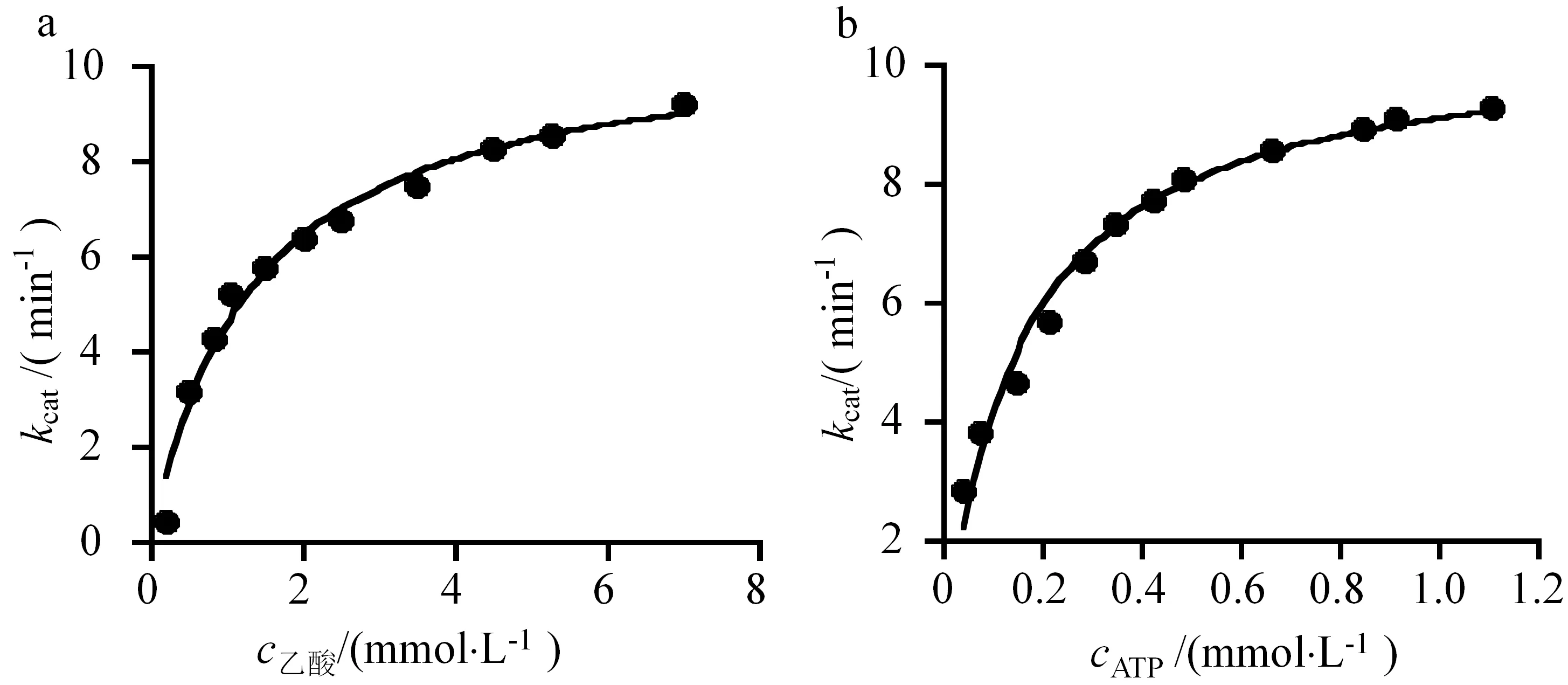
a:不同乙酸底物濃度對反應速率的影響;b:不同ATP底物濃度對反應速率的影響
3 討 論
AdhE具有醛脫氫酶和醇脫氫酶雙功能域,其醛脫氫酶結構域催化Ac-CoA還原生成乙醛,而醇脫氫酶結構域催化乙醛還原生成乙醇.本工作成功表達、純化了大腸桿菌AdhE,并分析了該酶在有氧狀態下的酶學活性為0.15 U/mg,此結果與文獻[14]等報道的大腸桿菌AdhE(0.08 U/mg)、Peng等[24]報道的嗜熱乙醇桿菌(Thermoanaerobacterethanolicus)AdhE(0.17 U/mg)及Chen等[25]報道的痢疾阿米巴(Entamoebahistolytica)AdhE(0.15 U/mg)的酶學活性一致.Membrillo-Hernandez等[14]報道大腸桿菌AdhE在無氧狀態下的酶活為有氧狀態下的10倍,而醛脫氫酶結構域內2個氨基酸殘基突變(A267T,E568K)顯著提高有氧狀態下的AdhE酶活.在氧氣存在條件下,醛脫氫酶結構域的酶活性降低成為限速步驟,致使整個AdhE的活性在有氧狀態下降低.此結果與Extance等[26]報道的嗜熱葡糖苷酶芽孢桿菌(Geobacillusthermoglucosidasius)AdhE的活性測定結果一致.醛醇脫氫酶在許多發酵細菌的厭氧氧化還原平衡中起關鍵作用,不同的發酵細菌由于不同的生命活動需要,其AdhE活性具有較大差別,并且同一種AdhE的活性在有氧與無氧狀態下也有較大差距,科學家們認為這是由細菌的代謝需求和長期進化所決定的[14,22,24-28].

表2 ACS的動力學常數
ACS活性的測定方法有2種終止法和1種連續測定法.基于偶聯酶的連續測定法作為酶活的測定方法被廣泛運用[29],ACS的連續測定需要肌激酶、丙酮酸激酶和乳酸脫氫酶3種偶聯酶測定AMP的產生速率,具有較大的延遲時間.基于AdhE的酶學特性,本研究通過偶聯酶法與分光光度法聯用成功連續測定ACS產物Ac-CoA的合成速率.
由于有氧條件下AdhE活性受到一定程度的抑制[30],導致酶活性較低,所以篩選、純化氧氣耐受AdhE,進一步優化基于大腸桿菌AdhE偶聯酶測定體系,將為產Ac-CoA的丙酮酸脫氫酶、脂肪酸β氧化酶系、硫解酶等多種酶活測定奠定基礎.

