酸棗葉縮合單寧的分離鑒定及其對黑色素生成的抑制機制
劉露露,張思瑾,秦少通,朱小菲,宋 巍,魏淑東
(1.長江大學生命科學學院,湖北荊州 434025;2.河南城建學院生命科學與工程學院,河南平頂山 467000)
酪氨酸酶是黑色素物質合成的關鍵限速酶,具有獨特的單酚酶和二酚酶雙重催化功能,它可以在氧氣存在的情況下將酪氨酸羥基化形成L-多巴,然后生成多巴醌,最終生成黑色素[1]。黑色素在體內的異常積累不僅會導致色斑等皮膚色素沉著性疾病的產生[2],而且在水果和蔬菜的儲存和運輸過程中,也會造成水果和蔬菜的褐變,降低它們的營養價值[3]。已有研究表明,以酪氨酸酶為靶標的抑制劑,通過抑制酪氨酸酶的活性,能有效降低生物體黑色素的含量[4]。近年來,對酪氨酸酶抑制劑的研究一直受到國內外的關注,人工合成的抑制劑如氫醌、曲酸等經研究發現對人體均有不同程度的毒副作用,刺激性大,在應用上受到諸多限制[5-6]。因此,尋找安全無毒、刺激性小以及療效顯著的天然酪氨酸酶抑制劑日益成為化妝品和食品行業的研究趨勢。
植物單寧是植物代謝過程中產生的一類次生物質,屬于天然有機化合物,廣泛存在于植物的葉、皮、果等部位[7]。根據化學結構的不同,植物單寧主要分為水解單寧和縮合單寧兩大類。前者主要是由棓酸或棓酸衍生的酚羧酸與多元醇通過酯鍵形成;后者又稱原花色素,主要是一類以黃烷-3-醇為基本結構單元通過C-C單鍵(B型連接)或C-C和C-O-C雙鍵(A型連接)縮合形成的寡聚物或多聚物[8]。
近年來,通過體外酪氨酸酶抑制實驗,發現魚尾葵果皮和果肉[9]、鱷梨果實[10]、高山榕葉[11]、茶樹葉[12]、銀合歡葉和果[13]等植物的縮合單寧均有明顯的酪氨酸酶抑制作用。花生衣縮合單寧提取物可以降低人體HMV-II黑色素瘤細胞中黑色素的生成[14]。楊梅葉中的縮合單寧能有效抑制小鼠B16黑色素瘤細胞的增殖和黑色素的生成[15]。但上述研究多集中于探討植物縮合單寧對酪氨酸酶的體外抑制情況,或簡單地分析植物縮合單寧對黑色素瘤細胞的增殖、黑色素含量等影響方面,而涉及植物縮合單寧對黑色素瘤細胞黑色素合成調控機理的研究還鮮有報道。
酸棗(Ziziphus jujubaMill. var.spinosa)是一種鼠李科棗屬的落葉灌木,多分布于我國華北地區,具有較高的營養和藥用價值,是我國傳統的中藥資源,具有極大的開發潛力及市場前景[16]。其中酸棗仁已被作為治療失眠的臨床藥材被廣泛使用,酸棗葉提取物也具有明顯的鎮靜安神作用[17]。目前酸棗葉中被鑒定的化合物主要是黃酮及皂苷類化合物,包括蘆丁、兒茶素、棓兒茶素、表兒茶酚、大棗皂苷等[18-19]。孫艷等[20-21]的研究表明,酸棗葉黃酮及皂苷均具有良好的抗氧化損傷的功效。然而,目前國內外針對酸棗葉中以兒茶素或棓兒茶素為結構單元構成的縮合單寧的研究尚未見報道。基于此,本文旨在提取分離酸棗葉縮合單寧,鑒定其結構特征,研究其對酪氨酸酶的抑制動力學和作用機理,并利用細胞生物學和分子生物學技術探討酸棗葉縮合單寧對小鼠黑色素瘤黑色素合成的影響和抑制機制,為酸棗葉資源在食品保鮮、美容醫藥等行業的利用提供理論基礎。
1 材料與方法
1.1 材料與儀器
蘑菇酪氨酸酶(3030 U/mg)、3,4-二羥基苯丙氨酸(L-多巴)、表兒茶素、棓兒茶素、芐硫醇、苯基硫脲、二甲基亞砜、Triton X-100 美國Sigma公司;L-酪氨酸、氯化銅、高碘酸鈉 上海生工生物工程有限公司;Invitrogen TRIzol 賽默飛世爾科技公司;SYBR Premix Ex Taq 寶日醫生物技術(北京)有限公司;乙腈 色譜純,上海邁瑞爾化學技術有限公司;甲醇、乙醇、丙酮、石油醚、乙酸乙酯、鹽酸、三氟乙酸等 分析純,國藥集團化學試劑有限公司;小鼠黑色素瘤細胞(B16F10) 廈門大學陳清西課題組饋贈;DMEM完全多糖培養基 江蘇凱基生物技術股份有限公司;胎牛血清 上海逍鵬生物科技有限公司;CCK-8 上海炎熙生物科技有限公司;酸棗幼葉
采自河南省平頂山市祥云公園。
18N/A冷凍干燥機 寧波新芝生物科技股份有限公司;N-1200BV-W旋轉蒸發儀 深圳市科力易翔儀器設備有限公司;Nanodrop 2000/2000 C紫外分光光度計、Varioskan LUX多功能酶標儀、II 3110型CO2培養箱 賽默飛世爾科技(中國)有限公司;Agilent 1200高效液相色譜儀 安捷倫科技有限公司;QTRAP3200離子阱質譜儀 SCIEX公司;F-4600熒光分光光度計 日立高新技術公司;Guava easyCyte流式細胞儀 密理博(中國)有限公司;BKE-1002HT小型超聲波清洗儀 杭州博可超聲波設備有限公司。
1.2 實驗方法
1.2.1 酸棗葉縮合單寧的提取與純化 酸棗幼葉經純水清潔干凈,冷凍干燥研磨粉碎,置于-20 ℃待用。酸棗葉縮合單寧的提取與純化參照Chen等[13]的方法,將樣品粉末與70%的丙酮水溶液以1:3的比例混合均勻,30 ℃ 40 kHz超聲提取3次,每次30 min,溶液進行真空抽濾除去殘渣,合并所有濾液后旋轉蒸發除去丙酮。將獲得的粗提液依次經石油醚、乙酸乙酯分別萃取3次,包含縮合單寧粗提物的水相部分經旋轉蒸發去有機溶劑后上Sephadex LH-
20(30×2.5 cm i.d.)凝膠柱,先用500 mL 50%甲醇水溶液作洗脫液去除糖類、氨基酸、非酚類苷等雜質,再用500 mL 70%丙酮水溶液洗脫并收集純化的單寧組分,并于38 ℃旋轉蒸發除去有機溶劑丙酮,水相冷凍干燥得到酸棗葉縮合單寧純化物樣品,純度約為98.9%。
1.2.2 酸棗葉縮合單寧結構特征的鑒定 參照Song等[22]的方法,運用硫醇降解結合高效液相色譜-電噴霧電離質譜(Thiolysis-HPLC-ESI-MS)鑒定酸棗葉縮合單寧的結構特征。首先在2 mL棕色瓶中依次加入250 μL含3.3% HCl的甲醇溶液、250 μL 10 mg/mL酸棗葉縮合單寧的甲醇溶液以及500 μL含5%芐硫醇的甲醇溶液,混勻后于40 ℃水浴30 min,然后冷卻至室溫,使用0.22 μm濾膜過濾后的芐硫醇解產物進行反相HPLC-ESI-MS分析。
采用的反相HPLC-ESI-MS條件如下:色譜儀Agilent 1200;質譜儀QTRAP 3200,負離子模式;色譜柱Hypersil ODS(5.0 μm,4.6 mm×250 mm);流動相:A為水(含0.5%三氟乙酸)、B為乙腈;梯度洗脫條件:0~45 min,12%~80% B;45~50 min,80%~12% B;檢測條件:DAD,280 nm;進樣量:20 μL;流速:l mL/min;柱溫:25 ℃。
1.2.3 酸棗葉縮合單寧對酪氨酸酶抑制作用的研究
1.2.3.1 酪氨酸酶單酚酶抑制活性的測定 參照Cui等[23]的方法,以L-酪氨酸為底物,在Na2HPO4-NaHPO4緩沖液(pH6.8)中,加入濃度為2 mmol/L的底物溶液、0.2 mg/mL的酪氨酸酶溶液及不同濃度的酸棗葉縮合單寧溶液,立即混合均勻,在30 ℃恒溫條件下檢測475 nm 處光密度值隨反應時間的增長曲線,由反應曲線直線部分的斜率計算出單酚酶的穩態活力。在此測活體系中,酪氨酸酶的終濃度為6.67 μg/mL。
1.2.3.2 酪氨酸酶二酚酶抑制活性的測定 參照Singh等[24]的方法,以L-多巴為底物,將不同濃度的酸棗葉縮合單寧溶液及0.1 mg/mL的酪氨酸酶溶液加入到底物濃度為0.5 mmol/L的Na2HPO4-NaHPO4緩沖液(pH6.8)溶液中,立即混合均勻,在30 ℃恒溫條件下檢測475 nm 處光密度值隨反應時間增長的直線,由直線的斜率計算出二酚酶的活力。在此測活體系中,酪氨酸酶的終濃度為3.33 μg/mL。
1.2.3.3 酪氨酸酶二酚酶抑制機理的判定 固定L-多巴的濃度,改變酪氨酸酶的加入量,測定不同濃度酸棗葉縮合單寧對酪氨酸酶催化L-多巴氧化活力的影響,以剩余酶活力對加入的酶量作圖,如果得到一組通過原點的直線,說明酸棗葉縮合單寧對酪氨酸酶二酚酶的抑制作用是可逆的,如果得到一組平行的直線,則說明抑制作用是不可逆的。
1.2.3.4 酪氨酸酶二酚酶抑制類型的判定 固定酪氨酸酶的濃度,改變L-多巴的加入量,測定不同濃度酸棗葉縮合單寧對酪氨酸酶催化L-多巴氧化活力的影響,利用Lineweaver-Burk雙倒數法,以底物濃度的倒數為X軸,反應速率的倒數為Y軸,來判定抑制劑的抑制類型。同時,計算出直線的斜率和Y軸的截距,并根據它們對酸棗葉縮合單寧濃度的二次作圖推測效應物對酪氨酸酶的抑制常數和對酶-底物絡合物的抑制常數。
1.2.4 無酶條件下多巴氧化檢測 L-多巴可被NaIO4氧化產生多巴醌,在475 nm處會產生特征吸收峰。參照Song等[22]的方法檢測無酪氨酸酶體系中,不同濃度的酸棗葉縮合單寧(0、200和400 μg/mL)抑制L-多巴氧化的效果。反應體系如表1所示,采用紫外可見分光光度計記錄多巴醌的產率,掃描波長段為240~800 nm。

表 1 無酶條件下L-多巴氧化反應體系Table 1 Oxidation reaction systems of L-3,4-dihydroxyphenylalanine without tyrosinase
1.2.5 熒光光譜檢測 參照Song等[25]的研究,采用熒光分光光度計研究酸棗葉縮合單寧對酪氨酸酶的熒光淬滅作用。將0.05 mL不同濃度的酸棗葉縮合單寧(0、50、100、150和200 μg/mL)加入終體積為0.35 mL的酪氨酸酶溶液(0.10 mg/mL)中,充分混勻,于30 ℃水浴中溫育1 min后,測定熒光光譜。熒光發射波長設定為290~500 nm,激發波長290 nm,激發和發射的狹縫寬度均設置為5 nm。
1.2.6 細胞培養 使用DMEM高糖培養基(含有10%的胎牛血清和1%的青霉素-鏈霉素溶液)在37 ℃、5% CO2環境中培養B16F10細胞,細胞長至對數生長期時,進行傳代及后續實驗。
1.2.7 B16F10細胞增殖抑制率的測定 參照楊安全等[26]的方法,將生長至對數期的B16F10細胞接種進96孔板中,37 ℃常規培養12 h后,更換為含不同藥物濃度的新培養液繼續培養24 h,每個濃度設置5個復孔,藥物處理24 h后,加入10 μL的CCK-8溶液,培養3 h后,在450 nm處測量每個孔的吸光值。

1.2.8 B16F10細胞酪氨酸酶活性的測定 參照Chatatikun等[27]的方法,收集B16F10細胞沉淀,加入含有1% Triton X-100的磷酸緩沖液,超聲后在4 ℃下抽提1 h。4 ℃12000 g離心20 min,所收集的上清,即為B16F10細胞中的酪氨酸酶粗提液。將20 μL不同濃度的酸棗葉縮合單寧溶液、130 μL恒溫30 ℃的L-多巴溶液、30 μL B16F10細胞中的酪氨酸酶粗提液加入96孔酶標板中,混合均勻后,30 ℃反應30 min。最后每孔加入6 μL苯基硫脲的飽和溶液。測定475 nm處的OD值,每一濃度設3個復孔,取平均值。細胞內相對酶活力的計算公式如下:

1.2.9 B16F10細胞相對黑色素含量的測定 參照Nikomatsu等[28]的方法,將B16F10細胞接種在10 cm培養板中,常規培養12 h后換為含有不同濃度酸棗葉縮合單寧的培養液,繼續培養24 h,pH7.2的磷酸緩沖液洗滌3次,加入1.0 mL含10% DMSO的濃度為1.0 mol/L NaOH溶液,80 ℃水浴孵育2 h,1000 g離心10 min,取上清液分別測定570和405 nm處的吸光度值。相對黑色素含量的計算公式為:
1.2.10 實時定量熒光PCR檢測 參考Song等[25]的方法,根據GenBank中小鼠酪氨酸酶基因(Tyrosinase, TYR)、酪氨酸酶相關蛋白-1(Tyrosinase related protein 1, TRP-l)基因及小眼畸形相關轉錄因子基因(Microphthalmia-associated transcription factor, MITF)的序列,利用Oligo 7軟件設計引物,并在NCBI軟件中檢測其特異性,由上海生工股份有限公司合成,引物具體序列如表2所示。采用異硫氰酸胍-苯酚法抽提B16F10細胞中總RNA,將總RNA反轉錄成cDNA。在PCR體系中加入SYBR熒光染料,實時監測反應進程。使用β-肌動蛋白(β-actin)基因作為內參,檢測酸棗葉縮合單寧處理后B16F10細胞內TYR、TRP-l及MITF等基因的相對表達。
1.3 數據處理
實驗結果以平均值±標準差(n=3)的形式表示,采用SPSS 19.0統計軟件進行數據分析,使用Sigma Plot 12.0進行繪圖。
2 結果與分析
2.1 Thiolysis-HPLC-ESI-MS分析
圖1為酸棗葉縮合單寧硫醇降解產物的反相HPLC色譜圖。通過與標樣的保留時間及其質譜數據進行比對,可以確定峰1和2分別為棓兒茶素(m/z 305)和表兒茶素(m/z 289),為酸棗葉縮合單寧的末端單元。另外,質譜數據顯示峰3和4的分子離子[M - H]-分別為m/z 427和411。參考Chen等[13]的研究,可以認定它們為(表)棓兒茶素芐硫醚衍生物和(表)兒茶素芐硫醚衍生物,為酸棗葉縮合單寧的延伸單元。由于缺乏相應的降解產物標準品,僅僅根據這些質譜數據難以確定它們的立體化學結構。峰5和6則為過量的芐硫醇和硫醇降解副產物。結果表明,酸棗葉縮合單寧主要是由(表)兒茶素構成的原花青素類型,同時還伴有由(表)棓兒茶素構成的原翠雀素類型。

表 2 黑色素生成相關基因的引物序列Table 2 Primer sequences of melanogenesis-related genes

圖 1 酸棗葉縮合單寧硫醇降解后的反相HPLC色譜圖Fig.1 Reversed-phase HPLC chromatogram of condensed tannins from Z. jujuba leaves after thiolytic degradation
2.2 酸棗葉縮合單寧對酪氨酸酶單酚酶的抑制效果
通過L-酪氨酸的氧化反應測定酸棗葉縮合單寧對酪氨酸酶單酚酶的影響。該反應有一個明顯的滯后期,反應速率在滯后期過后快速增大,隨著反應進行,逐漸趨于平緩。將產物生成的曲線延長至X軸,延長曲線的斜率即為反應的穩態斜率。如圖2所示,隨著酸棗葉縮合單寧濃度的增加,300 s反應時間內生成產物的量逐漸降低,穩態酶活力逐漸下降。從圖2B中可以看出,當棗葉縮合單寧濃度為266.67 μg/mL時,相較于縮合單寧濃度為0 μg/mL時,相對穩態酶活力從100%降低了48.33%。由此可見,酸棗葉縮合單寧能夠通過降低單酚酶的穩態酶活性抑制酪氨酸酶的活性。據Chai等[29]的報道,推測酸棗葉縮合單寧對酪氨酸酶的抑制活性依賴于其含有酚羥基的基本結構單元,其與L-酪氨酸結構相似,因此酸棗葉縮合單寧可以與底物競爭酶的結合位點,阻礙L-酪氨酸的羥基化進程,從而抑制酪氨酸酶的催化活性。

圖 2 酸棗葉縮合單寧對酪氨酸酶單酚酶的抑制作用Fig.2 Inhibitory effect of condensed tannins from Z. jujuba leaves on monophenolase of tyrosinase
2.3 酸棗葉縮合單寧對酪氨酸酶二酚酶的抑制效果、機理及類型
如圖3A所示,隨著酸棗葉縮合單寧濃度的增加,二酚酶的活性呈劑量依賴性下降的趨勢。根據酸棗葉縮合單寧濃度曲線,測定導致酪氨酸酶二酚酶活性下降一半時的抑制劑濃度IC50的值為24.28±1.61 μg/mL。相比于常用的美白化妝品添加劑熊果苷(IC50=2.97 mg/mL)及甘草提取物(IC50=2.94 mg/mL)[30],酸棗葉縮合單寧對酪氨酸酶的抑制作用更強,具有較高的開發潛力。另外,表3還列出了酸棗葉縮合單寧與其它縮合單寧對酪氨酶抑制效果的比較。從中可以看出,酸棗葉縮合單寧具有更強的酪氨酸酶抑制活性,這可能與其結構單元組成相關。從結構層面上比較,苯環上含有酚羥基的量從高到低依次為:(表)棓兒茶素>(表)兒茶素>(表)阿福豆素。酸棗葉縮合單寧結構單元中由于(表)棓兒茶素含量較高,酚羥基含量也更多,因此抑酶效果更強[31]。

圖 3 酸棗葉縮合單寧對酪氨酸酶二酚酶的抑制作用Fig.3 Inhibitory effect of condensed tannins from Z. jujuba leaves on diphenolase of tyrosinase
以酸棗葉縮合單寧為效應物,固定底物濃度,改變酶的添加量,進一步研究酸棗葉縮合單寧對二酚酶的抑制機理。如圖3B所示,酶濃度相同時,隨著酸棗葉縮合單寧濃度的增大,酶活力逐漸下降。以不同縮合單寧濃度下的剩余酶活力相對于酶濃度作圖,得到了一組穿過原點的直線。這些直線的斜率隨著抑制劑濃度的增加而減小,說明酸棗葉縮合單寧對酪氨酸酶的抑制作用是可逆的,抑制劑并沒有減少有效的酶量,而是通過降低酶的催化效率達到抑制酶活性的效果。
采用Lineweaver-Burk作圖法判定酸棗葉縮合單寧對酪氨酸酶二酚酶的抑制類型。如圖3C所示,1/V對1/[S]作圖得到一組相交于第二象限的直線。根據已有報道[33-34]可知,酸棗葉縮合單寧是酪氨酸酶二酚酶的混合型抑制劑,該抑制劑不僅能與游離酶結合,也與酶-底物復合物結合。酸棗葉縮合單寧對酪氨酸酶的抑制常數KI和對酶-底物復合物的抑制常數KIS分別為25.10和60.82 μg/mL。KI值低于KIS值,說明酸棗葉縮合單寧與游離酶的親和力強于和酶-底物復合物的親和力[10]。通過與不同化合物的比較可以看出(表3),大部分縮合單寧及黃酮類化合物對酪氨酸酶的抑制類型多為混合型,而熊果苷、紫紅素等單體化合物的抑制類型多為單一的競爭型。Chen等[32]認為,當抑制劑結構組成單一時,可能會產生競爭性抑制;而縮合單寧這種由黃烷-3-醇為基本結構單元構成的多聚物,往往會產生混合型抑制類型。綜上所述,酸棗葉縮合單寧是一個高效的、可逆的混合型酪氨酸酶抑制劑。
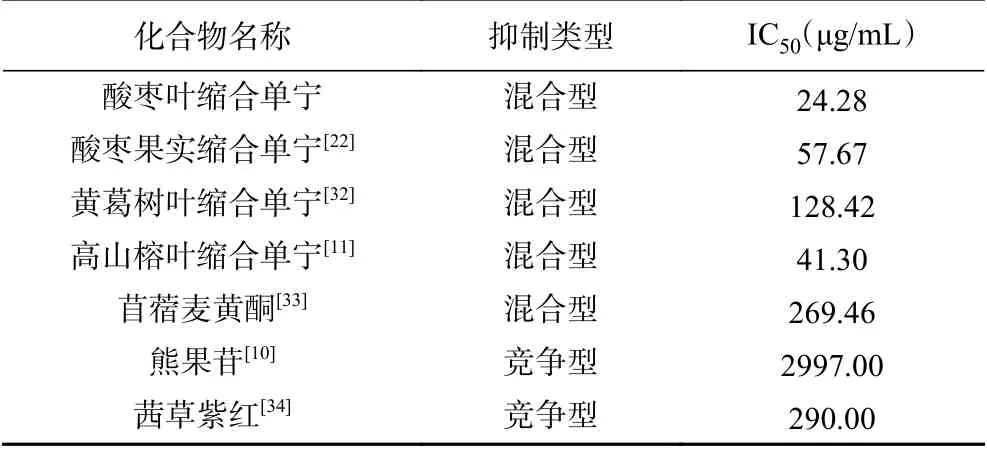
表 3 不同化合物對酪氨酸酶抑制效果及抑制類型的比較Table 3 Comparison of the inhibitory effect and type of different compounds on tyrosinase
2.4 酸棗葉縮合單寧對高碘酸鈉氧化L-多巴反應的影響
L-多巴可被氧化生成多巴醌,多巴醌經過分子內環化可生成無色多巴色素,進而被另一分子的多巴醌氧化生成多巴色素,最終產生黑色素[35]。為了闡述酸棗葉縮合單寧對酪氨酸酶的抑制機制,采用強氧化劑高碘酸鈉氧化L-多巴,檢測L-多巴在不同濃度酸棗葉縮合單寧存在時的的反應情況。如圖4所示,前三組反應中不加入高碘酸鈉,發現L-多巴不能被氧化;后三組反應體系中加入高碘酸鈉時,L-多巴被氧化為多巴醌,進而生成多巴色素,因此在475 nm出現多巴色素的特征吸收峰。隨著酸棗葉縮合單寧的加入,特征峰的吸光值明顯降低,表明酸棗葉縮合單寧可以抑制高碘酸鈉的氧化能力。酪氨酸酶催化L-多巴生成多巴醌的過程是一個氧化的過程,而酸棗葉縮合單寧可以通過抑制L-多巴的氧化進而抑制酪氨酸酶的活性。

圖 4 酸棗葉縮合單寧對L-多巴氧化的紫外可見光譜的影響Fig.4 Effect of condensed tannins from Z. jujuba leaves on UV-vis spectra for the oxidation of L-3,4-dihydroxyphenylalanine
2.5 熒光猝滅法分析酸棗葉縮合單寧對酪氨酸酶的作用機理
酪氨酸酶具有色氨酸、酪氨酸、苯丙氨酸等氨基酸殘基,可以激發內源性熒光[25]。根據這一特性,采用熒光淬滅實驗來探究酪氨酸酶和酸棗葉縮合單寧的相互作用。酪氨酸酶的熒光發射光譜如圖5所示,隨著酸棗葉縮合單寧濃度的增大,激發的熒光強度也逐漸降低,且特征峰也產生輕微藍移。由此證明酸棗葉縮合單寧不僅能與酪氨酸酶結合,淬滅其固有的熒光,而且影響了發生熒光淬滅的氨基酸殘基的疏水性環境。

圖 5 酸棗葉縮合單寧對酪氨酸酶熒光光譜的影響Fig.5 Effect of condensed tannins from Z. jujuba leaves on fluorescence spectrum of tyrosinase
2.6 酸棗葉縮合單寧對B16F10細胞增殖的影響
已有報道表明,植物縮合單寧對B16F10細胞的增殖具有明顯的抑制效果[25]。本研究以酸棗葉縮合單寧為效應物,研究B16F10細胞在不同濃度效應物作用下抑制率的變化。如圖6所示,酸棗葉縮合單寧濃度由0 μg/mL增加至350 μg/mL的過程中,細胞活性的抑制率由13.44%迅速增加至58.45%,而繼續增大濃度后,抑制率增加的速度明顯減緩。
2.7 酸棗葉縮合單寧對B16F10細胞酪氨酸酶活力和黑色素生成量的影響
由圖7可知,酸棗葉縮合單寧能明顯抑制B16F10細胞酪氨酸酶活性和黑色素生成;當酸棗葉縮合單寧濃度由0 μg/mL增加至200 μg/mL時,B16F10細胞內相對酪氨酸酶的活性由100%降低至66.81%,而黑色素相對生成量也降低了28.35%,且抑制效果都呈現出一定的劑量依賴性。結果表明,B16F10細胞酪氨酸酶與蘑菇酪氨酸酶的活性都可被酸棗葉縮合單寧抑制,但抑制效果與細胞外酶活檢測相比偏弱,這可能是由于B1F10細胞酪氨酸酶與蘑菇酪氨酸酶活性中心的結構差異及酶活測定方法不同導致[15]。

圖 6 酸棗葉縮合單寧對B16F10細胞增殖的抑制作用Fig.6 Inhibitory effect of condensed tannins from Z. jujuba leaves on the proliferation of B16F10 cells

圖 7 酸棗葉縮合單寧對B16F10細胞酪氨酸酶活性(A)和黑色素生成量(B)的影響Fig.7 Effect of condensed tannins from Z. jujuba leaves on the activity of tyrosinase(A) and the formation of melanin (B)in B16F10 cells
2.8 酸棗葉縮合單寧對B16F10細胞黑色素生成相關基因表達的影響
具有螺旋-環-螺旋-亮氨酸拉鏈結構的MITF可以通過調節TYR和TRP-1的表達來調控黑色素細胞的增殖分化及黑色素的合成過程[36]。B16F10細胞能在酪氨酸酶家族的調控下,經由黑色素生成相關基因MITF、TYR、TRP-1的介導,產生大量黑色素。本研究以酸棗葉縮合單寧為效應物,探究不同濃度效應物對B16F10細胞內TYR、TRP-1、MITF的mRNA表達量的影響。如圖8所示,與對照組相比(0 μg/mL),200 μg/mL的酸棗葉縮合單寧處理B16F10細胞后,TYR、TRP-1、MITF基因的相對表達量分別降低了65%、38%和83%。結果表明,酸棗葉縮合單寧可通過抑制B16F10細胞內黑色素生成相關基因的表達來調控黑色素的合成。

圖 8 酸棗葉縮合單寧對B16F10細胞黑色素生成相關基因表達的影響Fig.8 Effect of condensed tannins from Z. jujuba leaves on the melanogenesis-related gene expression in B16F10 cells
3 結論
綜上所述,酸棗葉縮合單寧主要是由(表)兒茶素構成的原花青素類型,同時伴有由(表)棓兒茶素構成的原翠雀素類型。酸棗葉縮合單寧可有效抑制酪氨酸酶單酚酶和二酚酶的活性,是二酚酶的可逆混合型抑制劑。酸棗葉縮合單寧可能通過抑制B16F10細胞的增殖、降低細胞內的氨酸酶活性以及黑色素合成相關基因的表達水平來調控細胞中黑色素生成量。實驗結果表明酸棗葉縮合單寧具有開發為酪氨酸酶抑制劑的潛力,為后期酸棗葉資源的綜合利用提供了實驗依據和理論基礎。

